Экология, 2021, № 3, стр. 234-240
Цианобактерии как источник питания беспозвоночных: результаты модельного эксперимента
Н. А. Березина a, *, А. В. Тиунов b, С. М. Цуриков b, С. А. Курбатова c, Л. Г. Корнева c, О. С. Макарова c, С. Н. Быкова c
a Зоологический институт РАН
199034 Санкт-Петербург, Университетская наб., 1, Россия
b Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
c Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 Ярославская обл, п/о Борок, Россия
* E-mail: nadezhda.berezina@zin.ru
Поступила в редакцию 12.08.2020
После доработки 15.10.2020
Принята к публикации 21.10.2020
Аннотация
Массовое развитие цианобактерий в водоемах считается одной из глобальных экологических проблем. До сих пор роль этих прокариот в трофической сети водоемов не ясна. Нами было выполнено экспериментальное исследование трофических связей беспозвоночных в период массового развития цианобактерий Aphanizomenon flos-aquae. Ключевые звенья трофической сети: планктон, микроперифитон, детрит и бентосные беспозвоночные, были собраны для изотопного анализа углерода (δ15C) и азота (δ15N) после 20-суточного экспонирования мезокосмов, имитирующих условия прибрежного биотопа Рыбинского водохранилища при отсутствии цианобактерий (вариант I) и их высоком обилии (вариант II). Выявлены статистически значимые различия величин δ15N ракообразных Cladocera, Copepoda, Asellus aquaticus и Gmelinoides fasciatus и личинок поденок между вариантами: в присутствии цианобактерий эти величины были на 1–4 ‰ ниже, чем при их отсутствии. Индуцированные цианобактериями сдвиги в величине δ15N консументов свидетельствует об ассимиляции диазотрофного азота и включении питательных веществ цианобактерий в пищевые цепи.
Цианобактерии и микроводоросли, будучи основными первичными продуцентами органического вещества в водных экосистемах, являются базовым звеном в пищевых цепях самых различных консументов – от простейших до высших звеньев. Известно, что цианобактерии при летнем дефиците азота в водоеме способны фиксировать атмосферный азот (N2) и таким образом создавать богатый азотом трофический ресурс, повышая продуктивность экосистемы. Цианобактерии содержат большое количество пигментов, липидов, белков, витаминов и минералов [1]. Вместе с тем цианобактерии рассматривают как нежелательный компонент водных экосистем из-за возможного токсического действия выделяемых ими вторичных метаболитов на жизнедеятельность других организмов [2].
Долгое время считалось, что цианобактерии представляют низкую пищевую ценность для зоопланктона и зообентоса и не потребляют их [3]. Позже было показано [4, 5], что некоторые виды планктонных рачков и донных моллюсков потребляют цианобактерии. До сих пор вопрос о возможном питании беспозвоночных цианобактериями остается спорным.
В последние два десятилетия доля цианобактерий возросла во многих водохранилищах и водоемах бассейна р. Волги, и в частности в Рыбинском водохранилище [6], но роль разных видов цианобактерий в трофической сети остается неясной. Целью настоящей работы стало экспериментальное исследование трофических связей массовых видов беспозвоночных в прибрежном сообществе Рыбинского водохранилища и, в частности, оценка значимости массового вида цианобактерий Aphanizomenon flos-aquae в качестве пищевого источника для различных консументов. Поскольку бактерии этого вида фиксируют атмосферный азот, соотношение изотопов азота 15N/14N (величина δ15N) у них ближе к атмосферному значению 0‰, чем величины δ15N у видов, которые не способны фиксировать N2 [7]. По данным [8], величины δ15N у A. flos-aquae варьировали от −1 до −2‰, что во время массового развития цианобактерий приводило к снижению содержания 15N в теле питающихся ими беспозвоночных.
Основываясь на этих данных, мы сочли возможным использовать особенности изотопного состава диазотрофных цианобактерий для оценки их участия в трофических сетях. Соотношение изотопов углерода и азота в тканях гидробионтов является интегральной характеристикой состава их пищи и отражает итог потребления ими тех или иных трофических ресурсов. Мы предполагали, что при массовом развитии A. flos-aquae величина δ15N в тканях беспозвоночных-консументов из Рыбинского водохранилища должна снижаться. Для проверки этой гипотезы методом анализа изотопного состава углерода и азота в тканях были исследованы трофические связи планктонных и бентосных беспозвоночных и их пищевых ресурсов (фитопланктона, перифитона и детрита) в искусственно созданных экосистемах (мезокосмах) двух типов – с присутствием и отсутствием A. flos-aquae.
МАТЕРИАЛ И МЕТОДЫ
Описание эксперимента. Исследование проводили на базе стационара экспериментальных работ ИБВВ РАН (п. Борок). Мезокосмы создавали в пластиковых рыбоводных лотках (100 × 100 × 40 см), установленных в бетонный бассейн с водой. Лотки заполняли фильтрованной через сито с ячеей 63 мкм природной водой и в них имитировали летние условия мелководной зоны Рыбинского водохранилища (р. Волга): вариант I – без цианобактерий, вариант II – с добавлением массы цианобактерий. Каждый из двух вариантов мезокосмов был создан в трех идентичных повторах. Лотки изолировали сеткой от попадания животных из воздуха и бассейна. Характеристики мезокосмов приведены в табл. 1.
Таблица 1.
Физико-химические характеристики и биомассы водных организмов в двух вариантах эксперимента
| Показатель | Вариант | |
|---|---|---|
| I | II | |
| рН | 8.51 ± 0.20 | 8.59 ± 0.11 |
| О2, мг/л | 7.34 ± 0.47 | 7.57 ± 0.36 |
| Na+, мг/л | 5.0 ± 0.3 | 5.2 ± 0.1 |
| K+, мг/л | 2.3 ± 0.1 | 2.3 ± 0.1 |
| Ntot, мг/л | 1.03 ± 0.14 | 1.01 ± 0.1 |
| N-NO3, мкг/л | 7.6 ± 2.6 | 6.8 ± 1.9 |
| Ptot, мкг/л | 54.4 ± 2.6 | 58.8 ± 3.2 |
| P-P${\text{O}}_{4}^{3}$, мкг/л | 30.3 ± 1.4 | 33.8 ± 1.6 |
| Фитопланктон, мг/л | 0.22 ± 0.06 | 1.38 ± 0.31* |
| Зоопланктон, мг/л | 4.06 ± 0.87 | 6.75 ± 1.8* |
| Перифитон, мг/дм2 | 18.30 ± 5.90 | 17.50 ± 4.40 |
Природный фитопланктон попадал в вариант I вместе с добавленной речной водой. В мезокосмы варианта II были дополнительно внесены цианобактерии, которые на момент проведения эксперимента вызывали “цветение” воды в Рыбинском водохранилище (58°02′ с.ш., 38°14′ в.д.). Планктонной сетью с размером ячеи 63 мкм 200 л воды концентрировали до объема 1 л и вносили в мезокосмы варианта II. Фитопланктон в мезокосмах варианта I состоял главным образом из зеленых водорослей Tetrasporidium sp., Closterium moniliferum и Oocystis solitaria, на долю которых приходилось до 93% общей биомассы, а в варианте II 90% биомассы фитопланктона составляли цианобактерии A. flos-aquae.
В обоих вариантах в микроперифитоне по биомассе доминировали зеленые водоросли Protoderma viride и Coleochaete scutala, реже встречались виды родов Stigeoclonium и Spirogyra. В микроперифитоне мезокосмов варианта II отмечены цианобактерии Aphanizomenon sp.
Рачковый планктон собирали в искусственных прудах и равномерно распределяли по опытным лоткам, формируя зоопланктонное сообщество начальной численностью 150 экз/л (Cladocera : Copepoda ~ 1 : 1). По массе доминировал крупный рачок-фильтратор Daphnia longispina.
Бентосных беспозвоночных из водохранилища вносили в каждый лоток в равном количестве, соответствующем природной плотности. Среди них были двустворчатые Unio pictorum (длина раковины 70–89 мм, 13 экз/м2) и брюхоногие Lymnaea stagnalis (17–21 мм, 10 экз/м2) моллюски, поденки Cloen dipterum (длина тела 5–6 мм, 20 экз/м2), изоподы Asellus aquaticus (5–7 мм, 40 экз/м2) и амфиподы Gmelinoides fasciatus (7–12 мм, 50 экз/м2). В лотки добавляли чистые камни в качестве субстрата для микроперифитона.
Мезокосмы экспонировали 20 дней – с 19.07.2018 г. по 08.08.2018 г.
Отбор проб. По окончании эксперимента все звенья трофической сети: сестон (фитопланктон и взвешенные органические частицы), микроперифитон, детрит (осажденный сестон), зоопланктон и бентосные беспозвоночные – были собраны для анализа стабильных изотопов азота и углерода. Для оценки размерных характеристик и интенсивности роста дафний в обоих вариантах их отлавливали на 0, 5, 10, 15 и 20-е сутки.
Сестон отбирали из каждого лотка батометром в поверхностном слое воды в утренние часы. Детрит собирали на дне в седиментационные ловушки, перифитон – с поверхности камней, смывая его чистой дистиллированной водой. Планктонных рачков отлавливали планктонной сетью с размером ячеи 63 мкм и в лаборатории их разделяли на фракции крупных (в основном дафнии D. longispina) и мелких (в основном копеподы Cyclops sp.) организмов. Сестон, перифитон, детрит и зоопланктон осаждали на фильтры Whatman GF.
Макробеспозвоночных отлавливали сачком и тщательно промывали дистиллированной водой от эпибионтов и грязи. В течение 4 ч их содержали в чистой воде, чтобы обеспечить эвакуацию кишечника перед анализом. Ткани мускула ноги использовали для анализа изотопного состава у моллюсков и тело целиком – у остальных беспозвоночных. В случае мелких организмов (ракообразные, поденки) в каждой пробе для анализа были совмещены несколько особей одного вида беспозвоночных.
Изотопный анализ углерода и азота. Все образцы (по 4‒12 проб для каждого источника) были высушены в термостате при температуре 55°С до постоянной массы. Используя весы Mettler Toledo MX5 (точность ±1 мкг), были сделаны навески тканей по 200‒400 мкг для животных и 1000–1200 мкг для растений и детрита. Навески помещали в оловянные капсулы.
Определение изотопного состава проводили в Центре коллективного пользования ИПЭЭ РАН (г. Москва) на комплексе, состоящем из изотопного масс-спектрометра Thermo Delta V Plus (Thermo Scientific, USA) и элементарного анализатора (Thermo Flash EA 1112).
Изотопный состав азота и углерода выражали в тысячных долях отклонения от международного стандарта (δX, ‰): δXобразец = [(Rобразец – ‒ Rстандарт)/Rстандарт] ×1000, где Х – углерод (C) или азот (N), R – атомное отношение тяжелого и легкого изотопа C или N в анализируемом образце и стандарте. Для азота стандартом служит N2 атмосферного воздуха, для углерода – “венский” эквивалент белемнита PeeDee формации (VPDB).
Величины δ13C и δ15N представлены в виде арифметических средних со стандартными ошибками. Сравнение средних величин между вариантами эксперимента проводили с помощью непараметрического U-критерия Манна-Уитни с использованием статистического пакета “Statistica 8.0”.
РЕЗУЛЬТАТЫ
Величины δ13С планктона и бентоса в мезокосмах вариантов I и II варьировали в пределах от −30.9 до −23.8 и от −31.4 до −23.7‰ соответственно. В обоих вариантах наибольшие величины δ1ЗС получены для брюхоногих моллюсков L. stagnalis (рис. 1), а наименьшие – для двустворчатых моллюсков U. pictorum. Последние были наиболее близки к величинам δ13С детрита: −30.4 (I) и −30.9 ‰ (II). Величины δ1ЗС у этих моллюсков были статистически значимо ниже, чем у ракообразных и личинок поденок (р < 0.001). Различия в величинах δ1ЗС между брюхоногими моллюсками и другими консументами (кроме бентосных рачков G. fasciatus) были статистически значимыми (р < < 0.05).
Рис. 1.
Значения δ1ЗС и δ15N в мезокосмах вариантов I (а) и II (б).
Обозначения: Sest – сестон, Detr – детрит, Peri – микроперифитон, Clad – крупный зоопланктон (в основном дафнии Daphnia longispina), Cope – мелкий зоопланктон (веслоногие рачки), Ephe – личинки поденок Cloen dipterum, Gast – моллюски-гастроподы Lymnaea stagnalis, Amph – амфиподы Gmelinoides fasciatus, Isop – изоподы Asellus aquaticus, Biva – двустворчатые моллюски Unio pictorum.
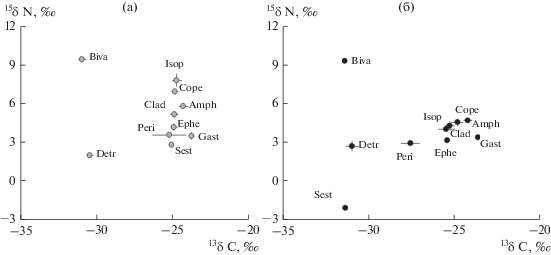
Между вариантами I и II были выявлены статистически значимые различия в величинах δ13С сестона, состоящего из планктона (I – зеленые водоросли или II – цианобактерии) и органического вещества в виде частиц (см. рис. 1, табл. 2). Различия в средних значениях δ13С консументов между вариантами статистически не подтверждались, но в присутствии цианобактерий у всех они были немного ниже, чем в варианте I.
Таблица 2.
Cредниe величины δ1ЗС и δ15N источников и консументов и результаты анализа различий между вариантами I и II по критерию Манна-Уитни (средние со значимыми различиями выделены полужирным шрифтом)
| Группа | δ1ЗС | δ15N | ||||
|---|---|---|---|---|---|---|
| I | II | p | I | II | p | |
| Сестон | −25.1 ± 0.1 | −31.4 ± 0.1 | <0.001 | 2.8 ± 0.0 | –2.1 ± 0.1 | <0.001 |
| Перифитон | −25.2 ± 1.1 | −27.6 ± 0.6 | >0.05 | 3.6 ± 0.2 | 2.9 ± 0.2 | 0.04 |
| Детрит | −30.4 ± 0.2 | −30.9 ± 0.4 | >0.05 | 2.0 ± 0.1 | 2.7 ± 0.4 | >0.05 |
| Copepoda | −24.9 ± 0.2 | −24.9 ± 0.3 | >0.05 | 6.9 ± 0.2 | 4.6 ± 0.3 | <0.001 |
| Cladocera | −24.9 ± 0.3 | −25.5 ± 0.5 | >0.05 | 5.2 ± 0.2 | 4.0 ± 0.1 | 0.02 |
| Amphipoda | −24.3 ± 0.3 | −24.3 ± 0.2 | >0.05 | 5.8 ± 0.1 | 4.7 ± 0.2 | <0.001 |
| Isopoda | −24.7 ± 0.3 | −25.3 ± 0.3 | >0.05 | 7.8 ± 0.5 | 4.2 ± 0.4 | 0.001 |
| Ephemeroptera | −24.9 ± 0.2 | −25.4 ± 0.1 | >0.05 | 4.2 ± 0.3 | 3.2 ± 0.2 | 0.02 |
| Gastropoda | −23.8 ± 0.2 | −23.7 ± 0.1 | >0.05 | 3.5 ± 0.3 | 3.4 ± 0.2 | >0.05 |
| Bivalvia | −30.9 ± 0.3 | −31.4 ± 0.1 | >0.05 | 9.4 ± 0.1 | 9.3 ± 0.1 | >0.05 |
Величины δ15N в варианте I варьировали в пределах от 2.1 до 9.6‰. Средняя величина δ15N сестона составила 2.81 ± 0.03‰. Величины δ15N у моллюсков U. pictorum (9.43 ± 0.11‰) были статистически значимо выше, чем у всех остальных консументов (p < 0.001). Различия в величинах δ15N не выявлены между рачками A. aquaticus (7.79 ± 0.49‰) и Cyclopoida (6.94 ± 0.21‰), D. longispina (5.16 ± 0.21‰) и G. fasciatus (5.82 ± ± 0.15‰), а также между личинками поденок Cloen dipterum (4.17 ± 0.27‰) и брюхоногих моллюсков L. stagnalis (3.62 ± 0.30‰).
В варианте II величины δ15N были распределены существенно иным образом. Величина δ15N фитопланктона, представленного преимущественно цианобактериями, составила −2.08 ± 0.15‰. Изотопный состав азота детрита, а также тканей моллюсков U. pictorum и L. stagnalis незначительно изменился по сравнению с вариантом I (р > 0.05). У всех остальных консументов, а также у микроперифитона величины δ15N снизились, одновременно уменьшились и различия величины δ15N консументов (см. рис. 1, табл. 2).
Рост кладоцер D. longispina в мезокосмах варианта II шел активнее, чем в варианте I. Так, в варианте II средний размер этих рачков был 1.35 мм на 10-е сутки эксперимента, а в варианте I даже на 15-е сутки размер дафний не превышал 1.32 мм. В среднем в варианте II биомасса зоопланктона (5 измерений за весь период) была выше, чем в варианте I (см. табл. 1, p < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Изотопный анализ первичных звеньев трофической сети показал, что азотфиксирующие цианобактерии значительно снизили значения δ13С и δ15N сестона: от −25.08 и 2.81‰ в варианте I до −31.35 и −2.08‰ в варианте II. Некоторое снижение δ13С и δ15N выявлено в варианте II и для перифитона (δ13С от −25.2 до −27.6‰; δ15N от 3.6 до 2.9‰), который, помимо зеленых водорослей, состоял из цианобактерий.
Соотношение изотопов первичных источников углерода варьировало в пределах, характерных для водорослей планктона и перифитона [9]. В обоих вариантах продуценты могли использовать не только углерод, растворенный в воде, но и атмосферный СО2 (δ13С = −8 ‰), потребляя его в разном количестве, соответствующем их специфическим уровням фотосинтеза и роста [10]. Различия в видовом составе, скорости роста продуцентов и уровне потребления ими СО2 обусловили разницу в величинах δ13С сестона между вариантами.
Статистически значимые различия в величинах δ15N между одними и теми же компонентами пищевой сети в вариантах I и II были обнаружены для сестона, микроперифитона, личинок поденок, планктонных (Cladocera, Copepoda) и бентосных ракообразных: они были на 1–4‰ ниже в мезокосмах варианта II, чем варианта I. Доминирующие в планктоне дафнии и веслоногие ракообразные, в основном растительноядные, потребляли зеленые водоросли фитопланктона в варианте I. О включения азота цианобактерий в цепи этих планктонных консументов в варианте II свидетельствуют значительно сниженные величины δ15N (см. табл. 2).
В варианте без влияния цианобактерий величины δ15N консументов статистически значимо снижалась от изопод A. aquaticus и Cyclopoida к D. longispina и G. fasciatus и далее к личинкам поденок C. dipterum и брюхоногим моллюскам L. stagnalis. Вероятно, узкоспециализированных растительноядных поденок C. dipterum и брюхоногих моллюсков L. stagnalis, у которых выявлены минимальные величины δ15N, можно считать первичными (или базовыми) консументами, а их значения δ15N характеризуют границу перехода с первого на второй трофический уровень.
Различия в средних значениях δ15N между детритоядными рачками G. fasciatus и детритом составляли 3.8 ‰. Сходные величины трофического фракционирования Δ15N получены и для бентосных рачков А. aquaticus и микроперифитона (4.2‰), а также рачков зоопланктона и сестона/фитопланктона (2.4–4.1‰). Разница в изотопном составе углерода и азота между консументами и их потенциальными источниками пищи вполне ожидаема, поскольку при переходе на каждый последующий трофический уровень δ1ЗС и δ15N увеличиваются. В работе [11] было принято, что эта величина колеблется от 0.1 до 1‰ для Δ13С и от 3 до 4‰ для Δ15N. В целом полученные нами величины трофического фактора согласуются с общепринятыми значениями [11]. Однако для водных беспозвоночных, которые относятся к детритоядным и всеядным консументам, т.е. используют в рационе множество пищевых источников, величина трофического фракционирования Δ13С или Δ15N может существенно варьировать [12] и быть как выше, так и ниже общепринятых значений [11]. Например, в озере Байкал величина Δ15N брюхоногих моллюсков по отношению к их пищевым объектам (планктонным водорослям) была ниже одного трофического уровня (3–4‰), варьируя от 1.1 до 2.3‰, что подтверждает смешанный характер питания этих моллюсков и ассимиляцию ими среди прочих и азотфиксирующих бактерий [5].
Полученные нами относительно высокие величины δ15N (9.3‒9.4‰) U. pictorum в целом согласуются с величинами δ15N двустворчатых моллюсков – 8.6‒10.2‰ [13], и в частности для U. pictorum (около 8‰) в эстуарии р. Невы [14]. Известно, что виды рода Unio питаются разнохарактерно, предпочитая детрит (мелкие растения и органические частицы сестона) и водоросли из перифитона [15]. При этом величины Δ15N между U. pictorum и их потенциальными источниками (сестоном и детритом) намного превышали известные величины [11], что может быть связано с их относительно крупными размерами и низким уровнем обмена по сравнению с остальными изученными консументами.
Хотя часть продукции сестона в мезокосмах варианта II поступала в детрит благодаря фильтрации крупными моллюсками U. pictorum, за время эксперимента (20 дней) моллюски не успевали поменять изотопный состав так, чтобы он соответствовал “пище”, представленной в мезокосмах. Поэтому различия в величинах δ15N двустворчатых и брюхоногих моллюсков между вариантами эксперимента были малы и статистически не подтверждались. В работе [16] индуцированные цианобактериями сдвиги в величинах δ13C и δ15N были четко отслежены в зоопланктоне (Leptodora), а моллюски, как и в нашем случае, показали слабые реакции.
Изотопный состав углерода и азота исследованных консументов отражает не только разницу в их питании. Он формируется и под влиянием других факторов, включая временную задержку оборота изотопов между пищей и потребителем [11]. Согласно линейной модели [17], время достижения “изотопного равновесия” с пищей для конкретного вида можно прогнозировать с учетом размеров организма, используя уравнение: Ln (период полувыведения элемента, сут) = 0.23 Ln (масса тела, г) + 3.25. Исходя из данной модели и размера тела изученных бентосных ракообразных и личинок поденок, период полувыведения элементов из их тканей можно оценить в 10–12 сут. Этот период был коротким и для планктонных рачков в отличие от таких крупных и долгоживущих консументов, как двустворчатые и брюхоногие моллюски. Последние характеризовались длительным периодом оборота элементов (время полувыведения порядка 30–50 сут). Видимо, поэтому в нашем коротком эксперименте не выявлены связи между изотопным составом источников пищи и моллюсками, которые сохранили исходный изотопный состав.
В целом влияние цианобактерий на значения δ15N у консументов может быть результатом прямого потребления ими цианобактерий. В ряде исследований [4, 18] показано, что некоторые планктонные рачки активно питаются цианобактериями. Более активный рост дафний в мезокосмах варианта II, чем варианта I, указывает на наличие благоприятных трофических условий в присутствии цианобактерий. В ряде исследований (например, в оз. Эрио, [19]) были обнаружены значимые положительные связи между концентрацией цианобактерий и биомассой растительноядных таксонов зоопланктона (в том числе Daphnia spp.).
Поступление азота цианобактерий в трофическую сеть происходит не только через их прямое потребление, но и через утилизацию другими продуцентами доступного азота, выходящего из отмирающих бактериальных клеток, или вторичного потребления фиксированного азота через микробные пищевые сети [20]. Важную роль при этом играют гетеротрофные микроорганизмы и так называемая “микробная петля”, что показано в ряде работ по динамике пищевых цепей в различных водоемах [21, 22].
Возможное непрямое потребление углерода цианобактерий беспозвоночными подтверждается лишь небольшой разницей величин δ13С у консументов между вариантами эксперимента, несмотря на статистически значимую разницу величин δ13С сестона между вариантами (см. табл. 2). Вопрос о переносе углерода цианобактерий в пищевой цепи требует дальнейших исследований. Можно предположить , что ассимилированный цианобактериями углерод в большой степени теряется в быстрых циклах микробной петли, не доходя до беспозвоночных. Кроме того, у моллюсков и амфипод основная доля углерода (но не азота) накапливается в экзоскелетах (хитине, арагоните, кальците), оборот этого элемента в которых еще медленнее, чем в мягких тканях.
Проведенный анализ выявил тесные трофические связи между беспозвоночными Рыбинского водохранилища и цианобактериями A. flos-aquae. Индуцированные A. flos-aquae сдвиги в величинах δ15N консументов свидетельствует об ассимиляции ими диазотрофного азота и включении питательных веществ цианобактерий в пищевые цепи. Особенно четко это показано на примере короткоцикловых беспозвоночных (ракообразных и личинок насекомых) с относительно быстрым оборотом элементов в тканях.
Несмотря на то, что ранее указывалось на ряд отрицательных последствий массового развития цианобактерий для некоторых беспозвоночных Рыбинского водохранилища [6, 23], наше исследование характеризует их как ценный пищевой ресурс, который может эффективно использоваться разными консументами. В дальнейшем было бы актуально проследить перемещение питательных веществ от цианобактерий внутри трофической сети водохранилища к ее более высоким звеньям (рыбам) и, в частности, оценить роль питательных веществ цианобактерий в формировании рыбопродуктивности этой экосистемы.
Работа выполнена в рамках госбюджетных тем Министерства науки и высшего образования Российской Федерации: AAAA-A19-11902066900091-0 (Н.А. Березина), AAAA-A18-118042490059-5 (А.В. Тиунов, С.М. Цуриков), AAAA-A18-118012690101-2 (С.А. Курбатова, С.Н. Быкова), АААА-А18-118012690096-1 (Л.Г. Корнева, О.С. Макарова). Авторы благодарят И.Ю. Ершова за помощь в проведении эксперимента, В.Б. Вербицкого и А.Н. Шарова (ИБВВ РАН) – за ценные советы и обсуждение.
Список литературы
Kay R.A., Barton L.L. Microalgae as food and supplement // Crit. Rev. Food Sci. Nutr. 1991. V. 30. P. 555–573. https://doi.org/10.1080/10408399109527556
DeMott W.R., Zhang Q.X., Carmichael W.W. Effects of toxic cyanobacteria and purified toxins on the survival and feeding of a copepod and three species of Daphnia // Limnol. Oceanogr. 1991. V. 36. P. 1346–1357. https://doi.org/10.4319/ lo.1991.36.7.1346
Schmidt K., Jonasdottir S. Nutritional quality of two cyanobacteria: How rich is “poor” food? // Marine Ecology Progress Ser. 1997. V. 151. P. 1–10. https://doi.org/10.3354/meps151001
Mohamed Z.A., Bakr A.A., Ghramh H.A. Grazing of the copepod Cyclops vicinus on toxic Microcystis aeruginosa: potential for controlling cyanobacterial blooms and transfer of toxins // Oceanol. Hydrobiol. Stud. 2018. V. 47. № 3. P. 296–302. https://doi.org/10.1515/ohs-2018-0028
Sitnikova T., Kiyashko S.I., Maximova N. et al. Resource partitioning in endemic species of Baikal gastropods indicated by gut contents, stable isotopes and radular morphology // Hydrobiologia. 2012. V. 682. P. 75–90. https://doi.org/10.1007/s10750-011-0685-5
Korneva L.G., Lazareva V.I., Mineeva N.M. et al. The state and dynamics of biological communities in the Rybinsk Reservoir under climate changes // J. Sib. Fed. Univ. Biol. 2019. V. 12. № 2. P. 160–179. https://doi.org/10.17516/1997-1389-0037
Mayer B., Wassenaar L.I. Isotopic characterization of nitrate sources and transformations in Lake Winnipeg and its contributing rivers, Manitoba, Canada // J. Great Lakes Res. 2012. V. 38. P. 135–146. https://doi.org/10.1016/j.jglr.2012.02.004
Karlson A.M.L., Duberg J., Motwani N.H. et al. Nitrogen fixation by cyanobacteria stimulates production in Baltic food webs // AMBIO. 2015. V. 44. Suppl. 3. P. 413–426. https://doi.org/10.1007/s13280-015-0660-x
Kiyashko S.I., Richard P., Chandler T. et al. Stable carbon isotope ratios differentiate autotrophs supporting animal diversity in Lake Baikal // Comptes rendus de L’Academy des Science. Paris. Sciences de la Vie. 1998. V. 321. P. 509–516.
Finlay J.C., Kendall C. Stable Isotope tracing of temporal and spatial variability in organic matter sources to freshwater ecosystems // Stable isotopes in ecology and environmental science/ Michener R., Lajtha K. Eds. Oxford: Blackwell Publishing Ltd., 2007. P. 283–333.
Post D.M. Using stable isotopes to estimate trophic position: models, methods and assumptions // Ecology. 2002. V. 83. P. 703–718. https://doi.org/10.1890/0012-9658(2002)083[0703: USITET]2.0.CO;2
Dionne K., Dufresne F., Nozais C. Variation in δ13C and δ15N trophic enrichment factors among Hyalella azteca amphipods from different lakes // Hydrobiologia. 2016. V. 781. P. 217–230. https://doi.org/10.1007/s10750-016-2846-z
Горбатенко К.М., Кияшко С.И., Лаженцев А.Е. и др. Трофические отношения и бенто-пелагические связи на западнокамчатском шельфе по данным анализа содержимого желудков и стабильных изотопов 13С и 15N // Известия ТИНРО. 2013. Т. 175. С. 3–25.
Berezina N., Razinkovas-Baziukas A., Tiunov A. Non-indigenous amphipods and mysids in coastal food webs of eastern Baltic Sea estuaries // J. Mar. Biol. Assoc. UK. 2017. V. 97. № 3. P. 581–590. https://doi.org/10.1017/S0025315416000643
Makhutova O.N., Protasov A.A., Gladyshev M.I. et al. Feeding spectra of bivalve mollusks Unio and Dreissena from Kanevskoe Reservoir, Ukraine: are they food competitors or not? // Zool. Stud. 2013. V. 52. 56. https://doi.org/10.1186/1810-522X-52-56
Lesutienė J., Bukaveckas P.A., Gasiūnaitė Z.R. et al. Tracing the isotopic signal of a cyanobacteria bloom through the food web of a Baltic Sea coastal lagoon // Estuar. Coast. Shelf Sci. 2014. V. 138. P. 47–56. https://doi.org/10.1016/j.ecss.2013.12.017
Vander Zanden M.J., Clayton M.K., Moody E.K. et al. Stable isotope turnover and half-life in animal tissues: A Literature Synthesis // PLoS ONE. 2015. V. 10. № 1. e0116182. https://doi.org/10.1371/journal.pone.0116182
Oberhaus L., Gelinas M., Pinel-Alloul B. et al. Grazing of two toxic Planktothrix species by Daphnia pulicaria: potential for bloom control and transfer of microcystins // J. Plankton Res. 2007. V. 29. P. 827–838. https://doi.org/10.1093/plankt/fbm062
Briland R.D., Stone J.P., Manubolu M. et al. Cyanobacterial blooms modify food web structure and interactions in western Lake Erie // Harmful Algae. 2020. V. 92. 101586.https://doi.org/10.1016/j.hal.2019.03.004
Motwani N.H., Duberg J., Svedén J.B. et al. Grazing on cyanobacteria and transfer of diazotrophic nitrogen to zooplankton in the Baltic Sea // Limnol. Oceanogr. 2018. V. 63. P. 672–686. https://doi.org/10.1002/lno.10659
Копылов А.И., Лазарева В.И., Пырина И.Л. и др. Микробная петля в планктонной трофической сети крупного равнинного водохранилища // Успехи современной биологии. 2010. Т. 130. № 6. С. 544–556.
Бульон В.В. Структура и функция микробиальной “петли” в планктоне озерных экосистем // Биология внутренних вод. 2002. № 2. С. 5–14.
Verbitsky V.B., Kurbatova S.A., Berezina N.A. et al. Responses of aquatic organisms to cyanobacteria and elodea in microcosms // Doklady Biological Sciences. 2019. V. 488. № 1. P. 136–140. https://doi.org/10.1134/ S0012496619050028
Дополнительные материалы отсутствуют.


