Экология, 2021, № 3, стр. 193-204
Экосистемный обмен диоксида углерода и влаги в сосняке бруснично-лишайниковом восточно-европейской средней тайги
С. В. Загирова a, *, О. А. Михайлов a
a Институт биологии Коми НЦ УрО РАН
167982 Сыктывкар, ул. Коммунистическая, 28, Россия
* E-mail: zagirova@ib.komisc.ru
Поступила в редакцию 09.06.2020
После доработки 20.11.2020
Принята к публикации 26.11.2020
Аннотация
Для определения экосистемного обмена диоксида углерода в сосняке бруснично-лишайниковом выполнен анализ 8790 измерений по методу микровихревых пульсаций в летне-осенний период. Годовой цикл потоков диоксида углерода между лесом и атмосферой восстановлен с использованием регрессионных уравнений. Суммарные значения нетто-обмена диоксида углерода, гросс-фотосинтеза и экосистемного дыхания соснового насаждения соответствовали −103, −407 и 304 г С м–2 год–1. Суммарная эвапотранспирация в июне–сентябре составила 98 мм, а эффективность использования воды на гросс-фотосинтез менялась в пределах 2–3 г С кг–1 Н2О. Установлена тесная связь среднесуточных значений гросс-фотосинтеза и суммарного испарения влаги над лесным пологом. Экосистемный обмен диоксида углерода и эвапотранспирация в сосняке бруснично-лишайниковом значительно ниже, чем в ельнике восточно-европейской тайги, что подтверждает гипотезу о влиянии структуры лесного покрова на характеристики энерго-массообмена в приземном слое атмосферы.
Россия остается регионом мира, где потепление климата в последние десятилетия существенно превышает среднее глобальное изменение температуры [1]. Повышение температуры и увеличение продолжительности вегетационного периода положительно повлияли на сток углерода и продукцию фитомассы в большей части бореальных лесов России [2]. По мнению некоторых авторов [3], увеличение глобальной нетто-продукции наземных экосистем (NEP) вызвано возросшей концентрацией СО2 в атмосфере, а увеличение температуры в регионах с холодным климатом усиливало этот эффект. В условиях современного климата бореальные леса вносят значительный вклад в связывание атмосферного СО2, однако климатические события в текущем столетии могут превратить их в источник парниковых газов, в первую очередь в зоне распространения многолетней мерзлоты [4].
Прогнозные оценки функционального состояния лесов основываются на выявлении ключевых факторов, контролирующих экосистемный обмен вещества и энергии. В последние десятилетия в исследованиях энерго-массообмена локальных экосистем, прежде всего за рубежом, широкое применение нашел метод микровихревых пульсаций [5]. С помощью этого метода установлено, что реакция обмена СО2 в лесных насаждениях на повышение температуры зависит от водного баланса [6, 7]. При дефиците влаги в приземной атмосфере и экстремально высокой температуре в летний период снижаются фотосинтетический сток углерода [8, 9] и эффективность использования света на фотосинтез [10]. Компиляция результатов долговременных измерений методом микровихревых пульсаций показала, что суммарный нетто-обмен диоксида углерода в хвойных лесах бореальной зоны варьирует от –206 до 95 г C м–2 год–1 [11]. Пространственная вариабельность обмена СО2 может быть обусловлена климатом, экологическими факторами, а также структурой и состоянием фитоценозов.
На Европейском Северо-Востоке России в растительном покрове преобладают еловые и сосновые фитоценозы [12], которые характеризуются невысокой эффективностью использования солнечной радиации на создание продукции [13] и низкой продуктивностью транспирации [14]. Применение метода микровихревых пульсаций позволило выявить суточную и сезонную динамики нетто-обмена СО2 и эвапотранспирации в ельнике среднетаежной подзоны при разных погодных условиях в период вегетации [9]. В сосновых фитоценозах Европейского Северо-Востока России подобные исследования ранее не проводили.
Цель настоящей работы состояла в оценке экосистемного обмена СО2 и влаги в сосняке бруснично-лишайниковом восточно-европейской средней тайги по результатам измерений методом микровихревых пульсаций. В задачи исследований входило: 1) установить суточный и сезонный ход обмена СО2 и влаги между сосновым лесом и приземной атмосферой в летне-осенний период; 2) выявить связь гросс-фотосинтеза (Pgross) с основными экологическими факторами и эвапотранспирацией (ET); 3) оценить годовой баланс нетто-обмена СО2 (NEE) экосистемы соснового леса. Предполагалось, что в сосняке бруснично-лишайниковом с невысоким индексом листовой поверхности, сформированном на относительно сухих и бедных песчаных почвах, обмен СО2 и влаги будет заметно ниже, чем в ранее исследованном еловом насаждении средней тайги.
МАТЕРИАЛ И МЕТОДЫ
Исследования проводили на территории Якшинского участкового лесничества Печоро-Илычского заповедника (61°49′ с.ш., 56°52′ в.д., Республика Коми), который находится в 120 км от районного центра пос. Троицко-Печорск. На этом участке заповедника преобладают равнинные ландшафты с господством сосновых лесов и сфагновых болот, среди сосняков преобладают лишайниковые и брусничные типы [15]. Среднегодовая температура составляет −0.8°С, средняя многолетняя температура января −17.9°С, июля +16.3°С, продолжительность безморозного периода – 83 дня. За год выпадает 627 мм осадков, большая их часть приходится на лето и начало осени.
В сосняке бруснично-лишайниковом древостой образован Pinus sylvestris L. в возрасте 70–320 лет, средняя высота – 14 м, запас древесины –177 м3 га–1 [12]. В напочвенном покрове доминируют кустарнички рода Vaccinium и лишайники рода Cladina. Сосняки лишайниковой группы типов леса в равнинных ландшафтах заповедника сформированы на бедных по минералогическому составу подзолах иллювиально-железистых со средней мощностью подстилки и низким содержанием гумуса (0.3–0.4%) [16]. В процессе развития они неоднократно подвергались действию пожаров. Индекс поверхности листьев древостоя (LAI), измеренный с помощью LAI-2200C plant canopy analyzer (Li-Cor, USA) на высоте 1.3 м от поверхности земли в период максимального облиствления, соответствовал 1.5.
Система для измерений вертикальных потоков СО2 (${{F}_{{{\text{C}}{{{\text{O}}}_{2}}}}}$) и скорости теплообмена по методу микровихревых пульсаций включала ультразвуковой анемометр (Wind Master, Gill Instruments Ltd., США) и инфракрасный газоанализатор закрытого типа (EC-100, Campbell Scientific Inc., США). Оборудование установлено в июне 2013 г. на вышке высотой 22 м от поверхности земли. Одновременно регистрировали интенсивность фотосинтетически активной радиации (ФАР), температуру воздуха (Та), дефицит упругости водяного пара в атмосферном воздухе (ДУВП) над пологом, температуру (Тп) и объемное содержание влаги (ОВ) в почве. Для заполнения пропусков в микроклиматических измерениях использовали данные логгеров Hobo (Onset, США), установленных на вышке в 2012 г.
Нами использованы результаты измерений вертикальных потоков парниковых газов по методу микровихревых пульсаций с 26 июня по 31 декабря 2013 г. Данные регистрировали с частотой 20 Гц, их обработку производили в программном обеспечении LoggerNet (Campbell Scientific Inc., США) в соответствии с общепринятым методом статистического анализа [17]. Качество полученных средних значений 30-мин измерений оценивали с учетом стабильности атмосферных условий, выражающемся в отношении показателя шероховатости подстилающей поверхности Монина-Обухова (z/L) и футрпринта (dfetch70) к динамической скорости ветра (u*) в момент измерения. При очень стабильных (z/L > 1) и очень нестабильных (z/L < −5) атмосферных условиях наблюдали критическое значение u* < < 0.2 м с–1. Чаще всего это происходило в ночной период при низкой турбулентности в приземном слое атмосферы, поэтому такие данные исключали из дальнейшей обработки. Для статистического анализа выбрано 8790 измерений (97% от всего набора первичных данных). Единичные пропуски в суточных измерениях (до 2 ч) заполняли линейной аппроксимацией по методике [18].
Поток воздуха, который использовался системой для расчета потока СО2, формировался на расстоянии до 500 м от вышки в зависимости от скорости ветра над пологом леса. Рассчитанный вертикальный поток диоксида углерода ${{F}_{{{\text{C}}{{{\text{O}}}_{2}}}}}$ эквивалентен нетто-обмену СО2 (NEE), который представляет собой сумму двух разнонаправленных процессов – гросс-фотосинтеза (Pgross) и дыхания экосистемы (Reco) [19]:
В уравнении баланса NEE имеет положительный знак, если Reco превышает Pgross, и отрицательный – если Pgross превышает Reco. Направленность потока СО2 из атмосферы в экосистему соответствует NEE cо знаком “–”, а со знаком “+” – от поверхности растительного покрова в атмосферу.В ночное время (ФАР < 20 мкмоль м–2 с–1) фотосинтез приравнивался к нулю, а NEE соответствовал Reco. Дыхание экосистемы в дневные часы рассчитывали по уравнению зависимости NEE от Та в ночное время:
Верификация этой модели по эмпирическим данным ночного дыхания в период с 26 июня по 31 декабря показала удовлетворительный результат (r2 = 0.7). Стандартная ошибка оценки регрессионной модели составила 0.0157 (р < 0.00000); Pgross соответствовал разности между измеренной величиной NEE и смоделированным экосистемным дыханием.
Эвапотранспирацию (ET), или суммарное испарение, в июне-сентябре рассчитывали на основании регистрируемых системой затрат тепла на испарение воды (LE):
где λ – скрытая теплота парообразования (2.45 МДж/кг).Эффективность использования влаги на гросс-фотосинтез определяли как отношение Pgross/ET [7].
Суммарный поток СО2 и эвапотранспирация за определенный промежуток времени соответствовали интегралу значений с 30-мин шагом измерений. Нормальность распределения NEE и ET оценивали по критерию Колмогорова–Смирнова. Для выявления зависимости обмена СО2 от факторов окружающей среды (ФАР, температуры и влажности воздуха, температуры и объемного содержания влаги в почве) использовали корреляцию Пирсона и регрессионный анализ в программном пакете Statistica 10.
РЕЗУЛЬТАТЫ
Метеорологические условия. В районе проведения исследований в летний период 2013 г. сохранялась умеренно-теплая погода, среднемесячные температуры превышали на 1–2°С средние многолетние значения за предыдущие пять лет (табл. 1). В сентябре–октябре погода была прохладнее, а в ноябре–декабре теплее, чем в 2008–2012 гг. Минимальная температура воздуха (−30°С) отмечена в декабре. В летние месяцы наблюдался незначительный дефицит осадков – с 1 июня по 31 декабря 2013 г. их сумма составила 426 мм. Снежный покров сформировался в середине октября.
Таблица 1.
Температура воздуха и сумма осадков в период наблюдений*
| Месяц | Средняя температура, °С | Сумма осадков, мм мес–1 | ||
|---|---|---|---|---|
| 2013 г. | 2008–2012 гг. | 2013 г. | 2008–2012 гг. | |
| Июнь | 15.5 | 14.1 | 42 | 57 |
| Июль | 19.1 | 17.1 | 49 | 71 |
| Август | 14.4 | 12.5 | 65 | 92 |
| Сентябрь | 6.4 | 8.1 | 63 | 88 |
| Октябрь | –0.9 | 2.3 | 86 | 58 |
| Ноябрь | –1.6 | –5.8 | 69 | 66 |
| Декабрь | –10.9 | –15.5 | 53 | 36 |
* Для метеостанции Троицко-Печорск по данным [20].
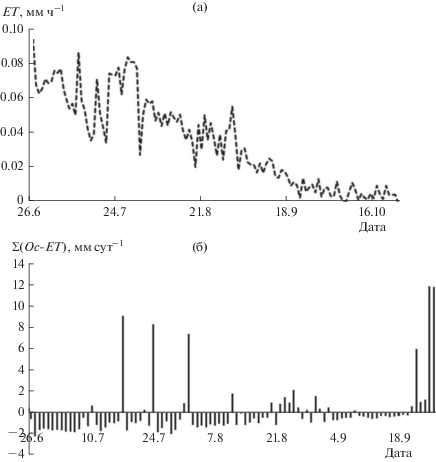
Температура воздуха над древесным пологом соснового леса в некоторые дни июля повышалась в дневные часы до 30°С. Первые ночные заморозки наблюдали в конце сентября (рис. 1). Аномально теплая погода с температурой до 8°С установилась в начале ноября. В июне–начале июля среднее за сутки значение ФАР, поступающей к земной поверхности, составило 640 мкмоль м–2 с–1, к концу сентября снизилось в 2 раза, в октябре оно не превышало 200 мкмоль м–2 с–1, а в ноябре–декабре – 30 мкмоль м–2 с–1. Альбедо соснового леса в летний период варьировало в пределах 0.15–0.25 и увеличилось до 0.3 в октябре после формирования снежного покрова (см. рис. 1). Кратковременное снижение альбедо отмечено в ноябре при аномально высокой температуре воздуха днем (до 8°С), что могло быть вызвано исчезновением снега с крон деревьев. Среднесуточное значение дефицита упругости водяного пара в атмосферном воздухе над пологом древостоя в июне–июле составило 0.4–1.6 кПа, однако в некоторые дни июля в дневные часы оно превышало 2.5 кПа. В августе–сентябре ДУВП постепенно снижался, достигнув нулевого значения в октябре (см. рис. 1).
Рис. 1.
Сезонный ход среднесуточных значений Ta (а, 1), Тп (а, 2), суммы осадков (б), ФАР (в), альбедо (г), ДУВП (д) на высоте 22 м и ОВ почвы (е) на глубине 20 см в сосняке бруснично-лишайниковом.
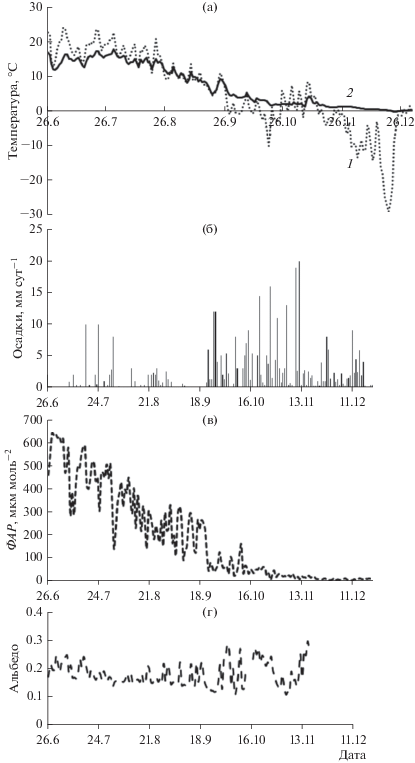
Рис. 1.
Окончание.
Температура верхнего горизонта почвы на глубине 20 см от поверхности в сосновом лесу следовала за изменением температуры воздуха – ее максимум наблюдали в конце июля, а минимум – в декабре (см. рис. 1). Минимальное объемное содержание влаги в верхних горизонтах почвы отмечено в середине июля, а максимальное – в ноябре. Увеличение ОВ в 3 раза регистрировали в начале августа после выпадения обильных осадков (Ос).
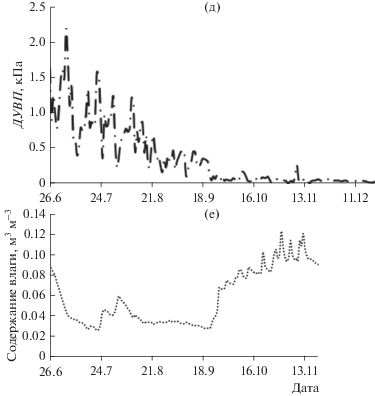
Обмен СО2 между лесом и приземной атмосферой в июне–декабре. Нетто-обмен СО2 постепенно снижался в летне-осенний период. В начале наблюдений скорость экосистемного обмена СО2 соснового леса в дневные часы достигала −0.6 мг СО2 м–2 с–1 и снизилась в 2 раза к концу августа. Максимальное среднесуточное значение NEE составило −0.14 мг СО2 м–2 с–1 (рис. 2). Осенний переход леса от стока к источнику СО2 регистрировали в конце сентября, когда среднее за день значение ФАР не превышало 200 мкмоль м–2 с–1, а температура воздуха приближалась к нулю. В целом суточный баланс NEE в августе составил около 40%, в сентябре – 20% июльских значений (табл. 2). С октября по декабрь сосновый лес являлся источником СО2 для приземной атмосферы.
Рис. 2.
Сезонный ход среднесуточных значений потоков NEE (1), Reco (2) и Pgross (3) в экосистеме соснового леса в период наблюдений.
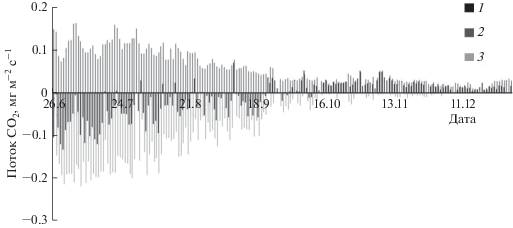
Таблица 2.
Суточный ход обмена СО2 (г СО2 м–2 сут–1) и эвапотранспирация (мм Н2О сут–1) в сосняке в июне–октябре 2013 г.
| Период | NEE | Reco | Pgross | ET |
|---|---|---|---|---|
| 26–30 июня | –7.2 | 6.8 | –13.9 | 1.8 |
| 1–15 июля | –6.9 | 7.9 | –14.8 | 1.6 |
| 16–31 июля | –3.9 | 8.5 | –12.4 | 1.4 |
| 1–15 августа | –2.8 | 6.9 | –9.7 | 1.2 |
| 16–31 августа | –1.5 | 5.8 | –7.3 | 0.9 |
| 1–15 сентября | –1.3 | 4.6 | –5.9 | 0.5 |
| 16–30 сентября | –0.2 | 3.5 | –3.7 | 0.2 |
| 1–15 октября | +2.5 | 2.5 | 0 | 0 |
В июле при благоприятных погодных условиях суточный ход NEE соответствовал изменению ФАР, его максимум отмечен в дневные часы (с 11.00 до 14.00). Экосистемное дыхание снижалось ночью, усиливалось в течение дня, достигая максимума в вечерние часы (рис. 3). Нарушение обычного суточного хода NEE наблюдали при дневной температуре воздуха >25°С и дефиците упругости водяного пара >2 кПа, в результате чего сосновый лес после полудня становился источником СО2.
Рис. 3.
Суточный ход NEE (1) и Reco (2) в сосновом насаждении в малооблачную погоду при разном сочетании ФАР (3), Та (4) и ДУВП (5): а – 15.07.2013; б – 21.07.2013.
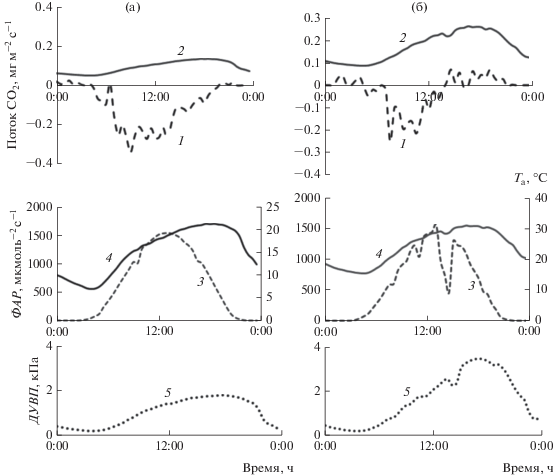
Максимальные значения экосистемного дыхания соснового леса, смоделированного по изменению температуры воздуха, отмечены в июне–июле (см. рис. 2, табл. 2). В последующем дыхание снижалось, а в октябре–декабре варьировало в пределах 0.02–0.05 мг СО2 м–2 с–1. Всплеск дыхания произошел в ноябре при кратковременном повышении температуры воздуха.
Максимальные значения гросс-фотосинтеза в сосновом насаждении отмечены в июне–июле, в период с наиболее благопроятными свето-температурными условиями для ассимиляции СО2 (см. рис. 2, табл. 2). В последующем Pgross снижался, достигнув нулевых значений в начале октября. С гросс-фотосинтезом связаны нетто-обмен СО2 и экосистемное дыхание (рис. 4). В свою очередь Pgross в сосновом насаждении достоверно зависел от факторов окружающей среды (табл. 3): наиболее высокий коэффициент корреляции Pgross выявлен с ФАР и Та, самый низкий – с объемным содержанием влаги в почве. С температурой воздуха коррелировали температура почвы и дефицит влажности воздуха.
Рис. 4.
Зависимость среднесуточных значений NEE (а), Reco (б) и ET (в) от гросс-фотосинтеза в сосняке бруснично-лишайниковом в июне–сентябре 2013 г.

Таблица 3.
Корреляционная матрица среднесуточных значений в июне–сентябре (n = 91, p < 0.05)
| Показатель | P*gross | ФАР | Та | Тп | VPD | ОВ |
|---|---|---|---|---|---|---|
| Pgross | 1 | |||||
| ФАР | −0.76 | 1 | ||||
| Та | −0.75 | 0.59 | 1 | |||
| Тп | −0.70 | 0.47 | 0.95 | 1 | ||
| ДВП | −0.70 | 0.46 | 0.94 | 0.98 | 1 | |
| ОВ | −0.25 | 0.20 | 0.10 | 0.10 | 0.10 | 1 |
Моделирование годичного цикла нетто-обмена СО2. Восстановление годичного цикла нетто-обмена СО2 в сосновом насаждении выполнено с использованием моделей гросс-фотосинтеза и экосистемного дыхания. Для моделирования Pgross в качестве независимых переменных использованы среднесуточные значения ФАР и Та. Методом подбора выбрано уравнение линейной регрессии Pgross, которое давало наибольший коэффициент детерминации для этих переменных (R2 = 0.95, F(2, 91) = 844, p < 0.01):
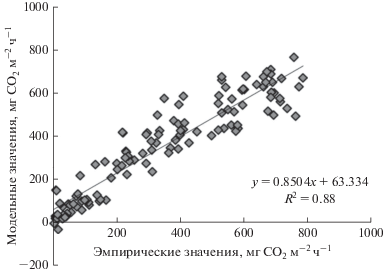
Скорость обмена выражали в мг СО2 м–2 ч–1. Верификация модели гросс-фотосинтеза показала удовлетворительный результат сходимости с данными, полученными в июне–сентябре (рис. 5). Найденное уравнение использовали для оценки мгновенных величин Pgross в годичном цикле. Мгновенные значения Reco рассчитывали по уравнению (2), а NEE – по уравнению (1).
Рис. 5.
Корреляция модельных и эмпирических среднесуточных значений гросс-фотосинтеза (−Pgross) в сосняке бруснично-лишайниковом в июне–сентябре 2013 г.
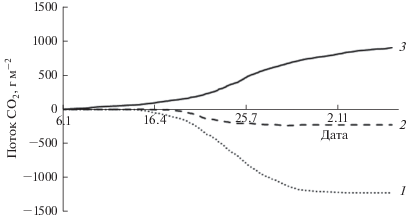
В соответствии с модельными данными гросс-фотосинтез в сосновом насаждении весной начинался в апреле при отрицательных температурах воздуха. В этот период скорость Pgross в среднем за сутки не превышала −200 мг СО2 м–2 ч–1, в мае увеличилась в два раза, достигнув максимума в июле (рис. 6). Среднесуточные значения NEE в середине апреля составляли около –50 мг СО2 м–2 ч–1, повышались в мае и в первой половине июня достигали –240 мг СО2 м–2 ч–1. В последующем постепенное снижение NEE сопровождалось усилением экосистемного дыхания. В соответствии с моделью фотосинтетический сток углерода прекратился в октябре при отрицательных температурах воздуха, что соответствовало результатам инструментальных измерений обмена СО2. Однако гросс-фотосинтез отмечен в ноябре при положительных среднесуточных температурах. В целом за год суммарный Pgross соснового насаждения составил −1222 г СО2 м–2 год–1, Reco и NEE – 913 и −309 г СО2 м–2 год–1 соответственно (рис. 7).
Рис. 6.
Годовой цикл ФАР (а, 1), Та (а, 2) и модельных значений Pgross (б, 3) Reco (б, 4), NEE (б, 5) в сосновом насаждении в 2013 г.
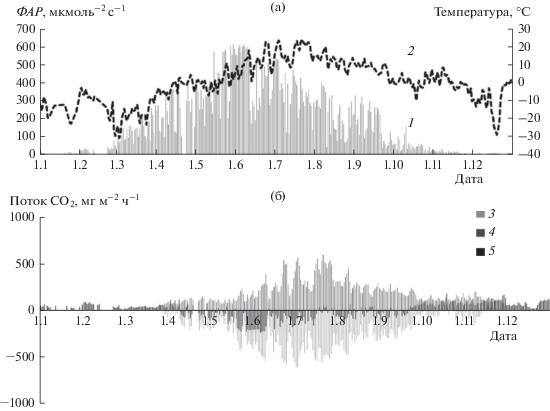
Рис. 7.
Кумулятивные значения Pgross (1), NEE (2) и Reco (3) в сосняке бруснично-лишайниковом в 2013 г.
Эвапотранспирация, или суммарное испарение воды с подстилающей поверхности, представляет собой сумму двух основных процессов – физического испарения и транспирации растений. В июне–августе среднесуточное значение ЕТ в сосняке составило 0.06 ± 0.02 мм ч–1. Наиболее высокая скорость эвапотранспирации отмечена в июне–июле, в последующем она снижалась и достигала нулевых значений в октябре (рис. 8). Летом снижение ET наблюдали также в пасмурные дни при ФАР < 300 мкмоль м–2 с–1. Установлена тесная связь среднесуточных значений ET и Pgross (см. рис. 4). Суммарная за сутки эвапотранспирация в конце августа составила около 50%, а в сентябре – 30% июльских значений (см. табл. 2). В теплый период года суммарное испарение влаги превышало сумму осадков – разница между ними достигала 2 мм сут–1, за исключением нескольких дней с обильными дождями (см. рис. 8). За период наблюдений с 26 июня по 30 сентября кумулятивное значение ЕТ в сосняке составило 98.4 мм, а эффективность использования воды на фотосинтез варьировала в пределах 2–3 г С кг–1 Н2О. Отсутствие данных теплообмена с 1 января по 25 июня 2013 г. не позволило оценить годичный цикл эвапотранспирации соснового леса.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В сосняке бруснично-лишайниковом среднесуточная скорость нетто-обмена СО2 в июне–июле достигала –0.14 мг СО2 м–2 с–1, что значительно меньше результатов, полученных в сосновых лесах Сибири (–0.35 мг СО2 м–2 с–1, [21]) и Финляндии (–0.66 мг СО2 м–2 с–1, [22]), а также в темнохвойных насаждениях бореальной зоны (–0.57 мг СО2 м–2 с–1, [23]; –0.44 мг СО2 м–2 с–1, [24]; –0.6 мг СО2 м–2 с–1, [9]). В исследованном нами сосняке баланс NEE составил –309 г СО2 м–2 год–1 (или –103 г С м–2 год–1), в то время как в сосняке лишайниковом Сибири среднее значение NEE за три года измерений соответствовало –156 г С м–2 год–1 [21]. В разных типах хвойных лесов бореальной зоны баланс экосистемного обмена СО2 варьирует от –206 до 95 г C м–2 год–1 [11]. При этом межгодовая вариабельность NEE может быть обусловлена разной чувствительностью гросс-фотосинтеза и дыхания к изменению факторов среды. Тесная связь среднесуточных NEE и Pgross в экосистеме соснового леса указывает на то, что фотосинтез определяет баланс нетто-обмена СО2.
Фотосинтетическое связывание атмосферного углерода в экосистеме леса зависит от поступающей солнечной радиации. В исследованном нами сосняке бруснично-лишайниковом гросс-фотосинтез тесно связан с ФАР и температурой воздуха. Восстановленный по этим переменным годичный цикл гросс-фотосинтеза начинался в апреле при отрицательных среднесуточных температурах и ФАР > 400 мкмоль м–2 с–1. Некоторые авторы [23, 25, 26] предполагают, что при отсутствии транспирационного потока влаги ранней весной хвойные растения в процессе фотосинтеза могут использовать воду, запасенную в стволах деревьев. О возможности фотосинтеза в хвойных фитоценозах в апреле свидетельствуют также суточные колебания концентрации СО2 в приземном слое атмосферы над лесами Центральной Сибири [27].
Суммарный гросс-фотосинтез в сосновом насаждении, рассчитанный по ФАР и температуре воздуха, составил –1222 г СО2 м–2 год–1 (или 407 г С м–2 год–1). Одним из важнейших предикторов пространственной вариабельности гросс-фотосинтеза и нетто-обмена СО2 в бореальных экосистемах является LAI [28]. Возможно, поэтому в исследованном сосняке бруснично-лишайниковом с низким LAI фотосинтетический сток углерода меньше, чем в еловом насаждении средней тайги [9]. Кроме того, сосняк отличался от ельника повышенным альбедо и соответственно имел более низкий радиационный баланс, что также могло повлиять на экосистемный обмен СО2 и эвапотранспирацию.
Экосистемное дыхание лесного насаждения является результирующей дыхания двух компонетов – автотрофов и гетеротрофов, и его доля может превышать 50% гросс-фотосинтеза [22, 29]. В сосняке бруснично-лишайниковом Reco составило 913 г СО2 м–2 год–1, или 304 г С м–2 год–1, что заметно меньше результатов, полученных в темнохвойных насаждениях средней тайги [9, 24]. Это может быть обусловлено продуктивностью насаждения, сформированного на бедных песчаных почвах. Отношение экосистемного дыхания к гросс-фотосинтезу в июне–августе соответствовало 0.5–0.7, в сентябре достигало 0.9. Увеличение Reco/Pgross в осений период обусловлено более быстрым снижением скорости фотосинтеза по сравнению с экосистемным дыханием (см. табл. 2) вследствие повышения облачности, снижения поступления ФАР и температуры воздуха. Согласно исследованиям других авторов [10], в лесных экосистемах при теплой погоде весной среднее значение Reco/Pgross за период вегетации составляло 0.74–0.81, а в годы с низкими температурами повышалось до 0.96. В целом в лесах северного полушария среднее значение отношения Reco/Pgross соответствует 0.84–0.85 [6, 29].
В дыхании лесной экосистемы доля гетеротрофного (почвенного) дыхания может составлять более 50% [30]. В Центральной Сибири экосистемное дыхание сосняка лишайникового достигало 1240 г СО2 м–2 сезон–1 [21], а почвенная эмиссия в сосновых насаждениях в разные годы варьировала в пределах 300–800 г СО2 м–2 сезон–1 [31]. При этом авторы отмечали повышение чувствительности дыхания почвы к температуре в засушливые годы. В сосняке бруснично-лишайниковом восточно-европейской тайги при среднесуточной температуре воздуха 10–15°С дыхание почвы в разные годы составляло более 5 г СО2 м–2 сут–1 [32], что превышает 50% суточного экосистемного дыхания, полученного нами для этого же типа леса в июле–августе (см. табл. 2).
Тесная связь эвапотранспирации с гросс-фотосинтезом в сосняке бруснично-лишайниковом (r = 0.7) указывает на способность растений регулировать оптимальное соотношение фотосинтеза и транспирации при разных погодных условиях [33, 34]. Этим же обусловлено относительное постоянство эффективности использования воды на фотосинтез в бореальных лесах [7]. Известно, что транспирация в темнохвойных насаждениях достигает 80%, а в сосняках – 60% суммарного испарения [13]. В теплый период года суммарное испарение с наземных экосистем не всегда зависит от суммы выпавших осадков [7], однако влажность воздуха в приземной атмосфере и эвапотранспирация связаны между собой [35]. В исследованном нами сосняке бруснично-лишайниковом значения ЕТ заметно меньше, чем в ельнике среднетаежной подзоны [9], что могло быть обусловлено низкими LAI древостоя (1.5) и запасом почвенной влаги (0.04–0.06 м3 м–3). Эффективность использования воды на фотосинтез в сосняке составила в среднем 2–3 г С кг–1 Н2О, что согласуется со значением продуктивности транспирации древостоев хвойных фитоценозов, рассчитанным весовым методом [14].
ЗАКЛЮЧЕНИЕ
Применение метода микровихревых пульсаций и эмпирических моделей позволило определить годовой цикл вертикальных потоков СО2 и эвапотранспирации над пологом соснового насаждения. Результаты проведенных исследований согласуются с мнением других авторов о влиянии наземных экосистем на суточные и сезонные колебания концентрации газов в приземном слое атмосферы. Сосняк бруснично-лишайниковый восточно-европейской средней тайги характеризовался невысокой скоростью экосистемного обмена диоксида углерода и эвапотранспирации. Согласно модельной оценке, суммарный гросс-фотосинтез и нетто-обмен СО2 составили соответственно ‒1222 и −309 г СО2 м–2 год–1, что соответствует −407 и −103 г С м–2 год–1. Выявлена тесная зависимость между нетто-обменом СО2 и гросс-фотосинтезом в теплый период года. Максимальные значения эвапотранспирации отмечены в июне–июле: эффективность использования воды на фотосинтез составила 2–3 г С кг–1 Н2О. Различие скорости вертикальных потоков СО2 и эвапотранспирации между еловым и сосновым насаждениями восточно-европейской средней тайге подтверждает гипотезу о влиянии структурной организации лесного покрова на энерго-массообмен в приземном слое атмосферы.
Работа подготовлена в рамках государственного задания Института биологии Коми научного центра УрО РАН по теме “Пространственно-временная динамика структуры и продуктивности фитоценозов лесных и болотных экосистем на Европейском Северо-Востоке России” (АААА-А17-117122090014-8).
Авторы заявляют об отсутствии конфликта интересов. В настоящей работе не содержатся какие либо исследования с участием людей и животных в качестве объектов.
Список литературы
Второй оценочный доклад Росгидромета об изменениях климата и их последствиях на территории Российской Федерации. М.: Росгидромет, 2014. 58 с.
Lapenis A., Shvidenko A., Shepaschenko D. et al. Acclimation of Russian forests to recent changes in climate // Global Change Biology. 2005. V. 11. P. 2090–2102.
Fernández-Martínez M., Sardans J., Chevallier J. et al. Global trends in carbon sinks and their relationships with CO2 and temperature // Nature Climate Change. 2019. V. 9. P. 73–79. https://doi.org/10.1038/s41558-018-0367-7
Gauthier S., Bernier P., Kuuluvainen T. et al. Boreal forest health and global change // Science. 2015. V. 349. P. 819–822.
Alekseychik P., Lappalainen H., Petäjä T. et al. Ground-based station network in Arctic and Subarctic Eurasia: an overview // Geography. Environment. Sustainability. 2016. V. 9. № 2. P. 75–81. https://doi.org/10.15356/2071-9388_02v09_2016_06
Low B.E., Falge E., Gu L. et al. Environmental controls over carbon dioxide and water vapor exchange of terrestrial vegetation // Agriculture and Forest Meteorology. 2002. V. 113. P. 97–120.
Brummer Ch., Black T., Jassal R. et al. How climate and vegetation type influence evapotranspiration and water use efficiency in Canadian forest, peatland and grassland ecosystems // Agricultural and Forest Meteorology. 2012. V. 153. P. 14–30. https://doi.org/10.1016/j.agrformet.2011.04.008
Замолодчиков Д.Г., Гитарский М.Л., Шилкин А.В. и др. Мониторинг циклов диоксида углерода и водяного пара на полигоне “Лог таёжный” (Валдайский национальный парк) // Фундаментальная и прикладная климатология. 2017. Т. 1. С. 54–68.
Zagirova S.V., Mikhailov O.A., Elsakov V.V. Carbon dioxide and water exchange between spruce forest and atmosphere in spring-summer under different weather conditions // Contemporary Problems Ecology. 2019. V. 12. P. 45–58.
Barr A., Black T., Hogg E. et al. Climatic controls on the carbon and water balances of a boreal aspen forests, 1994–2003 // Global Change Biology. 2007. V. 13. P. 561–576. https://doi.org/10.1111.j.1365-2486.2006.01220
Baldocchi D., Chu H., Reichstein M. Inter-annual variability of net and gross ecosystem carbon fluxes: A review // Agricultural and Forest Meteorology. 2018. V. 249. P. 520–533. https://doi.org/10.1016/j.agrformet.2017.05.015
Углерод в лесных и болотных экосистемах особо охраняемых природных территорий Республики Коми. Сыктывкар: Институт биологии Коми НЦ УрО РАН, 2014. 202 с.
Галенко Э.П. Фитоклимат и энергетические факторы продуктивности хвойного леса Европейского Севера. Л.: Наука, 1983. 129 с.
Сенькина С.Н. Связь влагообмена с продукцией фитомассы древесного и травяно-кустарничкового ярусов в ельниках черничных средней подзоны тайги // Растительные ресурсы. 2014. Т. 50. С. 25–30.
Закономерности полувековой динамики биоты девственной тайги Северного Предуралья. Сыктывкар, 2000. 206 с.
Почвы и почвенный покров Печоро-Илычского заповедника (Северный Урал). Сыктывкар: Институт биологии Коми НЦ УрО РАН, 2013. 328 с.
Vickers D., Mahrt L. Quality control and flux sampling problems for tower and aircraft data // J. of Atmospheric and Oceanic Technology. 1997. V. 14. P. 512–526.
Falg E., Baldocchi D., Olson R. et al. Gap filling strategies for defensible annual sums of net ecosystems exchange // Agricultural and Forest Meteorology. 2001. V.107. P. 43–69.
Greco S., Baldocchi D. Seasonal variations of CO2 and water vapor exchange rates over a temperate deciduous forest // Global Change Biology. 1996. V. 2. P. 183–197.
Novakovskiy A.B., Elsakov V.V. Hydrometeorological database (HMDB) for practical research in ecology // Data Science J. 2014. V. 13. P. 57–63. https://doi.org/10.2481/dsj.IFPDA-10
Чебакова Н.М., Выгодская Н.Н., Арнет А. и др. Энерго-массообмен и продуктивность основных экосистем Сибири (по результатам измерений методом турбулентных пульсаций). 2. Углеродный обмен и продуктивность // Изв. РАН. Сер биологич. 2014. № 1. С. 65–75. https://doi.org/10.7868/S0002332914010044
Kolari P., Pumpanen J., Rannik U. et al. Carbon balance of different aged Scots pine forest in Southern Finland // Global Change Biology. 2004. V. 10. P. 1106–1119.
Hollinger D.Y., Goltz S.M., Davidson E.A. et al. Seasonal patterns and environmental control of carbon dioxide and water vapor exchange in an ecotonal boreal forest // Global Change Biology. 1999. V. 5. P. 891–902.
Röser C., Montagnani L., Schulze E.-D. et al. Net CO2 exchange rates in three different succession stages of “dark taiga” of central Siberia // Tellus. 2002. № 54. P. 642–654.
Suni T., Berninger F., Vesala T. et al. Air temperature triggers the recovery of evergreen boreal forest photosynthesis in spring // Global Change Biology. 2003. № 9. P. 1410–1426.
Arneth A., Veenendaal E.M., Best C. et al. Water use strategies and ecosystem-atmosphere exchange of CO2 in two highly seasonal environments // Biogeosciences. 2006. V. 3. P. 421–437.
Тимохина А.В., Прокушкин А.С., Онучин А.А. и др. Динамика приземной концентрации СО2 в среднетаёжной подзоне Приенисейской Сибири // Экология. 2015. № 2. С.110–119. https://doi.org/10.7868/S0367059715020122
Ueyama M., Iwata H., Harazono Y. et al. Growthing season and spatial variations of carbon fluxes of Arctic and boreal ecosystems in Alaska (USA) // Ecological Applications. 2013. V. 23. P. 1798–1816.
Chen Z., Guirui Y., Zhu X. et al. Covariation between gross primary production and ecosystem respiration across space and the underlying mechanisms: A global synthesis // Agricultural and Forest Meteorology. 2015. V. 203. P. 180–190. https://doi.org/10.1016/j.agrformet.2015.01.012
Law B.E., Ryan M.G., Anthoni P.M. Seasonal and annual respiration of a ponderosa pine ecosystem // Global Change Biology. 1999. V. 5. P. 169–182.
Махныкина А.В., Прокушкин А.С., Меняйло О.В. и др. Влияние климатических факторов на эмиссию СО2 из почв в среднетаежных лесах Центральной Сибири: эмиссия как функция температуры и влажности // Экология. 2020. № 1. С. 51–61. https://doi.org/10.31857/S0367059720010060
Осипов А.Ф. Влияние межгодовых различий метеорологических характеристик вегетационного периода на эмиссию СО2 с поверхности почвы среднетаежного сосняка бруснично-лишайникового (Республика Коми) // Почвоведение. 2018. № 12. С. 1455–1463.
McCaughey J.H., Pejam M.R., Arain M.A., Cameron D.A. Carbon dioxide and energy fluxes from a boreal mixedwood forest ecosystem in Ontario, Canada // Agricultural and Forest Meteorology. 2006. V. 140. P. 79–96.
Amiro B.D., Barr A.G., Black T.A. et al. Carbon, energy and water fluxes at mature and disturbed forest sites, Saskatchewan, Canada // Agricultural and Forest Meteorology. 2006. V. 136. P. 237–251. https://doi.org/10.1016/j.agrformet.2004.11.012
Kasurinen V., Alfredsen K., Kolari P. et al. Latent heat exchange in the boreal and arctic biomes // Global Change Biology. 2014. V. 20. P. 3439–3456. https://doi.org/10.1111/gcb.12640
Дополнительные материалы отсутствуют.