Экология, 2021, № 5, стр. 363-371
Распределение трахеид по размеру люмена в годичных кольцах на разной высоте ствола у лиственницы в мерзлотных условиях. Суховершинность
Д. А. Машуков a, *, А. В. Бенькова a, В. Е. Бенькова a, А. В. Шашкин a, А. С. Прокушкин a
a Институт леса им. В.Н. Сукачева СО РАН
660036 Россия, Академгородок, 50/28, Красноярск
* E-mail: mashukov.da@ksc.krasn.ru
Поступила в редакцию 19.02.2021
После доработки 12.04.2021
Принята к публикации 20.04.2021
Аннотация
В северо-таежных лиственничниках Сибири на многолетней мерзлоте широко распространено явление суховершинности. Для выявления факторов, вызывающих усыхание верхушек, нами было проведено исследование строения водопроводящей системы в стволах суховершинных и здоровых деревьев лиственницы Гмелина (Larix gmelinii (Rupr.) Rupr.). Анализ распределений ранних (водопроводящих) трахеид по радиальным размерам люменов на разной высоте в стволах показал, что у всех исследованных деревьев – здоровых и суховершинных – радиальный размер люменов большинства трахеид уменьшается с высотой в стволе; у суховершинных деревьев этот показатель достоверно меньше, чем у здоровых, на всех уровнях высоты. Полученные результаты подтверждают следующую гипотезу: деревья многолетнемерзлой зоны могут испытывать водный дефицит, являющийся причиной усыхания верхушек у более чувствительных к нему деревьев. Высокая неоднородность гидротермических почвенных условий рассматривается как основной фактор, обусловивший дифференциацию деревьев по «чувствительности» к водному дефициту.
На фоне текущего потепления климата, провоцирующего увеличение частоты экстремальных природных явлений, полное или частичное усыхание и гибель деревьев в хвойных древостоях получили повсеместное распространение [1–3 и др.]. Причину этого исследователи видят в частых засухах, при которых у деревьев происходит нарушение водного баланса, что может привести к обезвоживанию органов и тканей выше критических [4].
В северо-таежных древостоях из лиственницы Гмелина (Larix gmelinii (Rupr.) Rupr.), типичных для севера Средней Сибири, суховершинность – довольно распространенное, но слабо изученное явление. Вопросы о том, каковы причины усыхания верхушек у деревьев на многолетней мерзлоте, во всех ли случаях усыхание является предвестником гибели всего дерева и многие другие, до настоящего времени не получили ответа. Между тем упомянутые древостои имеют запасы древесины от 15–40 до 80–120 м3/га [5] и играют существенную роль в поддержании баланса углерода на планете [6].
Результаты работ [2–4, 7] свидетельствуют о том, что суховершинность в этих лиственничниках можно связать с водным дефицитом. Количество доступной для растений влаги в сезонно-талом слое зависит от многих факторов, в том числе и от состояния древостоя [8], и структуры живого напочвенного покрова [9]. При текущем потеплении в высоких широтах деградация многолетней мерзлоты сопровождается специфическими изменениями гидротермических свойств почв. С увеличением мощности сезонно-талого слоя количество доступной для деревьев почвенной влаги в хорошо дренированных местообитаниях уменьшается [10]. На выровненных участках деревья испытывают гипоксию из-за образования карстовых озер и переувлажнения деятельного слоя [11–13]. В том и другом случае ингибируется рост и уменьшается продуктивность древостоев. Негативное влияние на рост может оказывать быстрая гибель тонких корней лиственницы, высоко чувствительных даже к кратковременным засухам [14], что существенно снижает способность дерева поглощать воду из почвы. Таким образом, изменения гидротермических свойств многолетнемерзлых почв при текущем потеплении вполне могут приводить к появлению и обострению уже имеющегося водного дефицита. Результаты дендроклиматических исследований динамики содержания стабильных изотопов углерода в годичных кольцах лиственницы Гмелина из криолитозоны показали, что деревья в последние десятилетия действительно испытывают все возрастающий дефицит доступной влаги [15].
В предыдущих работах в качестве косвенного показателя того, что лиственница Гмелина в северо-таежных древостоях в течение сезона роста испытывает водный дефицит, нами использовались данные радиального прироста [16] и средние ксилотомические характеристики годичных колец (радиальный размер люмена и толщина клеточной стенки трахеид) [17]. Цель настоящего исследования — подтвердить тот факт, что суховершинность в этих древостоях является проявлением водного дефицита. В задачи работы входило проведение сравнительного анализа распределений трахеид по радиальным размерам люменов на разной высоте стволов в направлении от комля к верхушке, что косвенно характеризует гидравлическую архитектуру любого дерева [18].
МАТЕРИАЛ И МЕТОДЫ
Исследования проводили вблизи пос. Тура, на базе Эвенкийского опорного экспедиционного пункта Института леса СО РАН (64°19′23″ с.ш., 100°13′28″ в.д.). Климат района резко континентальный. По данным метеостанции “Тура” за 1934–2009 гг., средняя температура января –36.0°С, июля +16.5°С, среднегодовая температура –9.0°С, среднегодовое количество осадков 366 мм. Вегетационный сезон длится 70–80 дней. Период без заморозков на почве составляет всего 53–56 дней, или около 70% от длительности вегетационного сезона. Снежный покров мощностью до 40–50 см сохраняется в среднем 207 дней [5].
Данная работа, являющаяся продолжением наших ранее проведенных исследований [16, 17, 19], выполнена на той же пробной площади (ПП), заложенной в лиственничном древостое багульниково-бруснично-голубичном лишайниково-зеленомошном. Древостой сформировался после сильного низового пожара 1899 г. (датировка пожара А.А. Кнорре [20]) на мерзлотных почвах склона северной экспозиции с уклоном 7°–8°. Около 60% деревьев были суховершинными. Признаки присутствия деревоповреждающих насекомых при экспертных обследованиях не были обнаружены. Густота древостоя составляла 4075 дер/га, полнота 0.43, запас 41.7 м3/га, бонитет Vб. На конец июля 2009 г. деревья с сухими верхушками были заметно мельче соседних здоровых одновозрастных деревьев. Средние значения диаметра на высоте груди у первых были на 27% меньше (47.4 и 65.2 мм соответственно), высоты – на 26% меньше (7.36 и 8.29 м), протяженности кроны – на 14.6% меньше (3.79 и 4.44 м). Более полная характеристика древостоя была дана в работе [19].
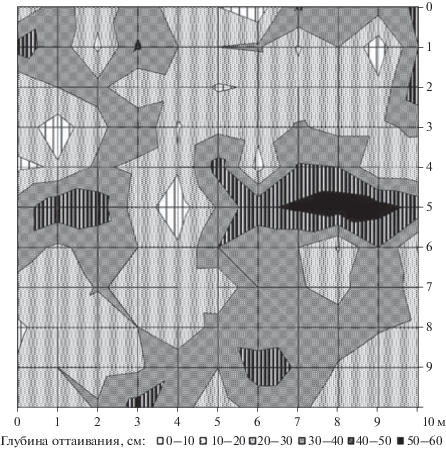
Почвы – криогидроморфные криоземы гомогенные [21] – имеют среднесуглинистый гранулометрический состав (доля физической глины 41%). Характерны повышенная влажность и надмерзлотный сток воды. Толщина мохово-лишайникового покрова 7–15 см, мощность органического горизонта 11–25 см [19]; глубина корнеобитаемого слоя не превышает 25 см [22]. В течение всего вегетационного периода почва имеет довольно низкую температуру. На конец июля почва на глубине 10 см прогревается всего до 6.5°С при объемной влажности 40% [16]. Для ПП характерна высокая пространственная мозаичность мохово-лишайникового покрова, а вместе с ней высокая пространственная мозаичность гидротермических свойств многолетнемерзлых почв [9] и высокая пространственная неоднородность глубины оттаивания (рис. 1), которая по многолетним наблюдениям в среднем составляет 42 ± 10 см в буграх мерзлотного пучения и 6 ± 6 см в западинах.
Рис. 1.
Картосхема глубин оттаивания на участке пробной площади размером 10 × 10 м на конец июля 2004 г.
Для ксилотомических исследований были отобраны спилы с пяти суховершинных и пяти здоровых деревьев из тех, что участвовали в дендроэкологическом анализе, проведенном ранее [16, 17, 19]. У одних деревьев спилы были взяты в 2009 г., у других – в 2013 г. Спилы брали на 1/4, 1/2, 3/4 высоты в стволе и у верхушки, на 20–30 см ниже апекса, а у суховершинных деревьев, кроме того, на 1–3 см ниже границы между живой частью, внешне не имевшей визуально диагностируемых признаков отмирания, и отмершей (в связи с прекращением камбиальной активности) частью, где эти признаки были четко выраженными. Со спилов на санном микротоме были изготовлены поперечные срезы толщиной 15–20 мкм, а из них временные микропрепараты. Для их окрашивания использовали сафранин [23]. Препараты включали примерно 20 последних годичных колец.
Из ксилотомических элементов был выбран люмен трахеид, размер которого определяет эффективность восходящего сокодвижения в стволах деревьев. Измерения радиальных размеров люменов проводились по 2–5 рядам трахеид в десяти годичных кольцах, сформировавшихся в период 2000–2009 г., на установке компьютерного анализа изображений Axio Imager MAT, Version 04.14.2005 (Karl Zeis Light AGMicroscopy). Выбор нижней границы временного периода обусловлен следующим. Проведенное ранее качественно-ксилотомическое исследование [17] показало, что со второй половины ХХ в. в годичных кольцах на верхних уровнях высоты стволов суховершинных деревьев на исследуемой пробной площади появились модификации анатомического строения, наиболее четко выраженные у верхушки. Нарушилась рядность трахеид в годичных кольцах, поздние трахеиды сформировались со сравнительно тонкими стенками, так что в последних кольцах вблизи коры позднюю зону, как и сами годичные кольца, было трудно, а иногда и невозможно различить (пример на рис. 2б, в). Модификации появились у деревьев не в один и тот же год, но с 2000 г. они уже имели четко выраженный характер у всех исследованных суховершинных деревьев.
Рис. 2.
Ксилотомическое строение у верхушки ствола здорового (а) и суховершинных деревьев 1-й (б) и 2-й (в) групп (поперечные срезы ×200; стрелками отмечена граница годичного кольца 2001 г.).

Для построения “высотных” рядов распределений данные измерений радиальных размеров люменов трахеид, сформированных в 2000–2009 гг. на каждом уровне высоты в стволе каждого дерева, не усредняли — их число было взято за 100%. В этом пуле данных группировку радиальных размеров люменов проводили по ступеням с шагом в 5 мкм (D = 0–5, 5–10,…, 45–50 мкм). Было определено число люменов в каждой ступени и вычислены их процентные доли (N, %), а по ним построены эмпирические распределения трахеид по радиальным размерам люменов на каждом из четырех уровней высоты в стволе.
При построении распределений для здоровых и суховершинных деревьев было измерено от 170 до 380 клеток на 1/4 высоты в стволе, от 160 до 280 клеток – на 1/2 высоты, от 135 до 325 клеток – на 3/4 высоты и от 55 до 425 клеток – у верхушки. Высотный ряд для каждого дерева составлялся из 4 распределений, располагавшихся последовательно снизу вверх (термин “высотный ряд распределений” введен для краткости изложения по аналогии с соответствующим термином в лесной таксации [24]). Сравнительный анализ высотных рядов проводился по характеристикам максимумов (или вершин) распределений, составляющих эти ряды, – Nmax и Dmax, где Nmax – максимальная частота встречаемости трахеид с радиальными размерами люменов Dmax в древесине, сформированной в 2000–2009 гг. Анализировали изменение Nmax и Dmax с высотой в стволе каждого дерева, взятого для исследования.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Эмпирические высотные ряды распределений трахеид по радиальным размерам люменов, построенные для здоровых и суховершинных деревьев лиственницы, имеют определенное сходство и различия. Высотные ряды распределений, построенные для здоровых деревьев, схожи между собой. На рис. 3а приведен типичный высотный ряд для здорового дерева. Распределения на всех уровнях высоты в стволе имеют два максимума (две вершины): правый и левый. Положение левого максимума не меняется с высотой в стволе и соответствует очень малым размерам люменов из диапазона 0–5 мкм; положение правого максимума, соответствующее более крупным люменам, сдвигается по оси абсцисс в сторону меньших размеров люменов при увеличении высоты в стволе. Высотные ряды распределений для суховершинных деревьев менее сходны между собой и по схожести условно разделены на две группы. К 1-й группе отнесли ряды, распределения в которых на всех уровнях высоты в стволах имеют два максимума. Положение максимумов на оси абсцисс в связи с высотой в стволе изменяется аналогично здоровым деревьям (см. рис. 3б). Ряды распределений во 2-й группе отличаются тем, что распределения под усохшей верхушкой имеют один максимум, тогда как на 1/4, 1/2 и 3/4 высоты в стволе – два (см. рис. 3в). Соответственно суховершинные деревья условно были разделены на 1-ю и 2-ю группы.
Рис. 3.
Эмпирические распределения трахеид по радиальным размерам люмена на 1/4, 1/2, 3/4 высоты в стволе и вблизи верхушки у типичных представителей здоровых (а) и суховершинных деревьев 1-й (б) и 2-й (в) групп лиственницы Гмелина на многолетнемерзлых почвах склона северной экспозиции. По оси абсцисс – радиальные размеры люменов D (мкм) по ступеням с шагом в 5 мкм; по оси ординат — доля люменов N (%) в каждой ступени; Nmax (%) – максимальная частота встречаемости трахеид с радиальными размерами люменов Dmax (мкм).
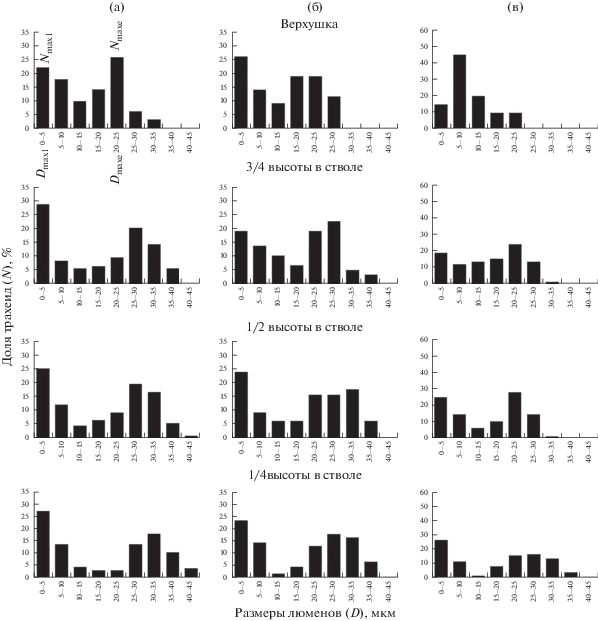
Эмпирические распределения с двумя максимумами можно представить двумя перекрывающимися распределениями. Визуально (судя по графикам на рис. 3) они легко разделяются. Мы предполагаем, что их можно рассматривать как два отдельных распределения: левое характеризует степень участия трахеид с мелкими люменами в формировании поздней зоны в годичных кольцах, а правое – степень участия трахеид со сравнительно крупными люменами в формировании ранней зоны. Результаты ксилотомического исследования (см. рис. 2) показали, что в годичных кольцах здоровых и суховершинных деревьев 1-й группы на всех уровнях высоты в стволах (пример верхушки на рис. 2, фото а и б), а также у деревьев 2-й группы на 1/4, 1/2 и 3/4 высоты в стволе (фото не приведено) четко выделяется граница между ранней и поздней древесиной. По трахеидам ранней зоны (ранним трахеидам) главным образом осуществляется сокодвижение от корней к кроне, в то время как участие трахеид поздней зоны (поздних трахеид) в водопроведении очень мало [25].
Ряды распределений трахеид по радиальным размерам люменов у здоровых и суховершинных деревьев 1-й группы. Распределения люменов поздних трахеид (левые распределения) имеют только правое крыло (см. рис. 3а, б). С увеличением высоты в стволе дерева значение максимума распределения (Nmaxl, %) уменьшается, но положение максимума на оси абсцисс (Dmaxl, мкм) остается в диапазоне размеров люменов 0–5 мкм. Достоверность того, что значения Nmaxl убывают в связи с увеличением высоты в стволе, установлена при сравнении средних по деревьям Nmaxl на 1/4 высоты в стволе и у верхушки с использованием t-теста при Р ≥ 0.95. По нашим данным, убывающий тренд можно описать уравнениями: для здоровых деревьев – Nmaxl = –10.2x + 34.0, для суховершинных 1-й группы – Nmaxl = –6.5x + 30.2 (х – уровень высоты в стволе).
Распределения люменов ранних трахеид (правые распределения, см. рис. 3а, б) относительно симметричны, имеют вершину и оба крыла. С увеличением уровня высоты в стволе дерева значение максимума правого распределения (Nmaxe, %) увеличивается, а соответствующий этому значению размер люменов (Dmaxe, мкм) уменьшается. Так, например, у здорового дерева (см. рис. 3а) на 1/4 высоты ствола Nmaxe = 15% и Dmaxe = 40–45 мкм, а у верхушки Nmaxe = 21% и Dmaxe = 30–35 мкм. У суховершинного дерева на 1/4 высоты ствола Nmaxe = 16% и Dmaxe = 25–30 мкм, а у верхушки Nmaxe = 25% и Dmaxe = 15–20 мкм. Достоверность возрастающего тренда Nmaxe и убывающего тренда Dmaxe при увеличении высоты в стволе установлена t-тестом при Р ≥ 0.95. Тренды можно описать линейными уравнениями: для здоровых деревьев – Nmaxe = 11.5x + 11.9, Dmaxe = –12.7х + 39.2; для суховершинных 1-й группы – Nmaxe = 7.1x + 14.8, Dmaxe = –8.9x + 31.9, где х – уровень высоты в стволе.
Линейные аппроксимации характеристик правых распределений Nmaxe и Dmaxe по здоровым и суховершинным деревьям 1-й группы представлены на рис. 4. Четко видно, что на всех уровнях высоты в стволе средние значения Dmaxe у суховершинных деревьев меньше, чем у здоровых (кривые 4 и 3 соответственно), в то же время средние Nmaxe у тех и других не различаются (кривые 2 и 1). Достоверность различий средних установлена t-тестом при Р ≥ 0.95.
Рис. 4.
Характеристики максимумов Nmax (1, 2) и Dmax (3, 4) в высотных рядах распределений ранних трахеид по радиальным размерам люменов: линейные аппроксимации 1, 4 – для здоровых деревьев, 2, 3 – для суховершинных деревьев 1-й и 2-й групп, за исключением верхушки.
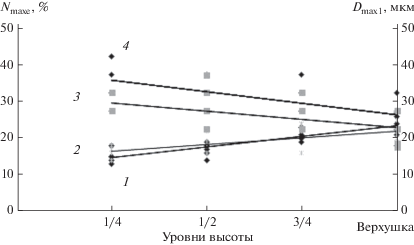
Ряды распределений трахеид по радиальным размерам люменов у суховершинных деревьев 2-й группы. Распределения с двумя максимумами на 1/4, 1/2 и 3/4 высоты в стволе мы рассматриваем аналогично предыдущим случаям как два перекрывающихся распределения: поздних трахеид с мелкими люменами и ранних трахеид со сравнительно крупными люменами (см. рис. 3в). Тенденции изменения характеристик максимумов распределений поздних (Nmaxl, Dmaxl) и ранних (Nmaxe и Dmaxe) трахеид с высотой в стволе схожи с таковыми для здоровых и суховершинных деревьев 1-й группы. С увеличением высоты в стволе Nmaxl убывает (значения Dmaxl остаются в диапазоне 0‒5 мкм), Nmaxe возрастает и Dmaxe убывает. Характеристики максимумов распределений на всех уровнях высоты в стволе, за исключением верхушки у деревьев 2-й группы, входят в диапазон соответствующих значений, полученных для деревьев 1-й группы. Например, у дерева из 2-й группы (см. рис. 3в) на 1/4 высоты ствола Nmaxe = 17% и Dmaxe = 25–30 мкм, а на 3/4 высоты – Nmaxe = 25% и Dmaxe = 20–25 мкм. У дерева из первой группы (см. рис. 3б) на 1/4 высоты ствола Nmaxe = 16% и Dmaxe = 25–30 мкм, а на 3/4 высоты – Nmaxe = 24% и Dmaxe = 20–25 мкм. Очевидно, что тренды средних по деревьям значений Nmaxl, Nmaxe и Dmaxe, установленные для суховершинных деревьев 1-й группы и описанные линейными уравнениями, справедливы и для деревьев 2-й группы, исключая верхушку (см. рис. 4, кривые 2 и 3).
Единственный максимум в распределениях трахеид по размерам люменов вблизи верхушки у деревьев 2-й группы (см. рис. 3в, верхний график) может свидетельствовать о том, что трахеиды не разделяются на ранние и поздние по размерам люменов. Качественно-ксилотомические исследования подтвердили, что граница между ранней и поздней зонами в годичных кольцах отсутствует (пример на рис. 2в). Трахеиды у верхушки довольно мелкие (рис. 3в, верхний график), с люменами менее 25 мкм (тогда как на 3/4 высоты в стволе у этих же деревьев трахеиды с размерами люменов 25–35 мкм составляют около 16%). С учетом того, что они участвовали в процессе водопроведения (образцы были взяты с живой части), характеристики максимума их распределений Nmaxe и Dmaxе сравнивали с таковыми, полученными из распределений ранних (водопроводящих) трахеид. По нашим данным, у деревьев 2-й группы в распределениях вблизи сухой верхушки Dmaxe значительно меньше, а Nmaxe больше по сравнению с таковыми на более низких уровнях высоты (различие более чем в 2 раза). Так, у дерева вблизи верхушек Nmaxe = 45% и Dmaxе = 5–10 мкм, в то время как на 3/4 высоты в стволе Nmaxe = 23% и Dmaxе = = 20–25 мкм.
Таким образом, характеристики максимумов распределений трахеид у верхушки деревьев 2-й группы не “вписываются” в линейную связь, установленную для них по распределениям на 1/4, 1/2 и 3/4 высоты в стволе (см. рис. 4), однако находятся в согласии с утверждением, сформулированным выше для здоровых и суховершинных деревьев 1-й группы: радиальные размеры люменов трахеид уменьшаются с увеличением высоты в стволе. Следует заметить, что тенденция к уменьшению размеров люменов трахеид в направлении от комля к верхушке, выявленная K. Саньо в 1872 г. ([26], цит. по [27]), подтверждена на множестве представителей хвойных и лиственных видов (обзор приведен в [27]). Характеристики максимума распределений под усохшими верхушками у деревьев 1-й и 2-й групп также существенно различаются: у деревьев 1-й группы Nmaxe = 19–25% и Dmaxе = 15–20 мкм, а у 2-й – Nmaxe= 45–53% и Dmaxе = 5–10 мкм. Очевидно, что эффективность водопроведения трахеид со сравнительно мелкими люменами у деревьев 2-й группы должна быть существенно меньше, чем у деревьев 1-й группы. Действительно, проводимость трахеиды, по закону Пуазейля, пропорциональна четвертой степени радиального размера люмена [25]. Тем не менее усыхание верхушек произошло и у тех, и у других, очевидно, из-за недостаточного количества воды, транспортируемой к верхушкам. В то же время определенная часть деревьев в древостое (именуемых в тексте “здоровыми”) испытывает водный дефицит не так остро. Эти деревья с живыми верхушками имеют сравнительно крупные трахеиды, более эффективные для транспортировки воды.
Различие микроусловий произрастания индивидуальных деревьев рассматривается нами (согласно с результатами работ [10, 13, 28]) как основной фактор, обусловивший дифференциацию деревьев по реакции на водный дефицит. Действительно, пробная площадь характеризуется высокой пространственной мозаичностью глубины оттаивания (см. рис. 1) и соответственно высокой пространственной неоднородностью гидротермических свойств деятельного слоя почвы. Из исследованных деревьев суховершинные 2-й группы оказались наиболее чувствительными. Дефицит доступной почвенной влаги обусловил формирование мелких трахеид, малоэффективных для водопроведения (низкий тургор [29, 30]), имеющих относительно тонкие клеточные стенки (субстратное голодание [31]). Дендроклиматический анализ, проведенный нами ранее [16, 19] с использованием скользящих корреляционных климатических функций отклика радиального прироста, выявил, что острый водный дефицит деревья лиственницы на склоне северной экспозиции, вероятнее всего, испытывают в период с конца мая до двадцатых чисел июня.
ЗАКЛЮЧЕНИЕ
Исследование высотных рядов распределений ранних (водопроводящих) трахеид по радиальным размерам люменов, которые были сформированы в стволах деревьев лиственницы Гмелина в 2000–2009 гг., показало следующее: у всех исследованных деревьев — здоровых и суховершинных 1-й и 2-й групп – радиальный размер люменов трахеид, составляющих большинство, уменьшается с увеличением высоты в стволе; у суховершинных деревьев 1-й и 2-й групп радиальный размер люменов трахеид, составляющих большинство, достоверно меньше, чем у здоровых деревьев, на всех исследованных уровнях высоты в стволе (на 1/4, 1/2 и 3/4 высоты и у верхушки).
Результаты исследования находятся в согласии с гипотезой, высказанной ранее: деревья в лиственничном древостое на многолетнемерзлых почвах испытывают водный дефицит в разной степени. У более «чувствительных» к этому фактору деревьев произошло усыхание верхушек. Среди суховершинных деревьев выделяются экземпляры, у которых древесина ствола вблизи верхушки, судя по распределению трахеид по размерам люменов и особенностям ксилотомической структуры годичных колец, неэффективно выполняет водопроводящую функцию. Высокая неоднородность гидротермических почвенных условий произрастания деревьев рассматривается как основной фактор, обусловивший дифференциацию деревьев по реакции на водный дефицит.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Шиятов С.Г. Динамика древесной и кустарниковой растительности в горах Полярного Урала под влиянием современных изменений климата. Екатеринбург: УрО РАН, 2009. 216 с.
Kharuk V.I., Im S.T., Dvinskaya M.L., Ranson K.J. Climate-induced mountain tree-line evolution in southern Siberia // Scandinavian J. of Forest Res. 2010. V. 25 (5). P. 446–454.
Allen C.D., Macalady A.K., Chenchouni H. et al. A global overview of drought and heat-induced tree mortality reveals emerging climate change risks for forests // Forest Ecology and Management. 2010. V. 259. P. 660–684.
Anderegg W.R.L., Flint A., Huang C.-Y. et al. Tree mortality predicted from drought-induced vascular damage // Nature Geoscience. 2015. № 8. P. 367–371.
Прокушкин С.Г., Абаимов А.П., Прокушкин А.С. Структурно-функциональные особенности лиственницы Гмелина в криолитозоне Центральной Эвенкии. Красноярск: ИЛ СО РАН “ДарМа-печать”, 2008. 161 с.
Prokushkin A.S., Shibata H., Prokushkin S.G. et al. Dissolved organic carbon in coniferous forests of Central Siberia // Eurasian J. For. Res. 2001. V. 2. P. 45–58.
Gaylord M.L., Kolb T.E., McDowell N.G. Mechanisms of pinion pine mortality after severe drought: a retrospective study of mature trees // Tree Physiol. 2015. V. 35. P. 806–816.
Поздняков Л.К. Лес на вечной мерзлоте. Новосибирск: Наука, 1983. 96 с.
Зырянова О.А., Абаимов А.П., Бугаенко Т.Н. Оценка видового разнообразия и структуры лиственничных ассоциаций криолитозоны Сибири // Биоразнообразие и динамика экосистем: информационные технологии и моделирование. Новосибирск: Наука, 2006. С. 495–504.
Patankar R., Quinton W.L., Hayashi M., Baltzer J.L. Sap flow responses to seasonal thaw and permafrost degradation in a subarctic boreal peatland // Trees. Struct. Funct. 2015. № 29. P. 129–142.
Николаев А.Н., Федоров П.П., Десяткин А.Р. Влияние гидродинамического режима мерзлотных почв на радиальный прирост лиственницы и сосны в Центральной Якутии // Сибирский экологич. журн. 2011. № 2. С. 189–201.
Kramer P.J., Boyer J.S. Water relations of plants and soils. San Diego: Academic Press, 1995. 495 p.
Iijima Y., Ohta T., Kotani A. et al. Sap flow changes in relation to permafrost degradation under increasing precipitation in an eastern Siberian larch forest // Ecohydrology. 2014. № 7. P. 177–187.
Chenlemuge T., Hertel D., Dulamsuren C. et al. Extremely low fine root biomass in Larix sibirica forests at the southern drought limit of the boreal forest // Flora Morphol. Distrib. Funct. Ecol. Plants. 2013. № 208. P. 488–496.
Sidorova O.V., Siegwolf R.T.W., Saurer M. et al. Do centennial tree-ring and stable isotope trends of Larix gmelinii (Rupr.) Rupr. indicate increasing water shortage in the Siberian north? // Oecologia. 2009. № 161. P. 825–835.
Машуков Д.А., Бенькова А.В., Бенькова В.Е. и др. Значение экспозиции склонов для роста лиственницы Гмелина в мерзлотных условиях Средней Сибири. II. Особенности радиального роста на разной высоте стволов // Сибирский лесной журн. 2018. № 3. С. 9–18.
Машуков Д.А., Бенькова А.В., Бенькова В.Е. и др. Радиальный прирост и анатомическая структура древесины стволов здоровых и суховершинных деревьев лиственницы на многолетней мерзлоте // Лесоведение. 2020. № 6. С. 1–10.
Tyree M., Ewers F. The hydraulic architecture of trees and other woody plants // New Phytologist. 1991. № 119. P. 345–360.
Бенькова А.В., Машуков Д.А., Бенькова В.Е. и др. Значение экспозиции склонов для роста лиственницы Гмелина в мерзлотных условиях Средней Сибири. I. Различия в динамике радиального прироста деревьев на склонах северной и южной экспозиции // Сибирский лесной журн. 2015. № 4. С. 18–29.
Knorre A.A., Kirdyanov A.V., Prokushkin A.S. et al. Tree ring-based reconstruction of the long-term influence of wildfires on permafrost active layer dynamics in Central Siberia // Science of The Total Environment. 2019. V. 652. P. 314–319.
Ершов Ю.И. Теоретические проблемы лесного почвообразования. Новосибирск: Наука, 2015. 319 с.
Kajimoto T. Root system development of larch trees growing on Siberian Permafrost // Permafrost ecosystem: Siberian larch forest, ecological studies / Osawa A., Zyryanova O.A., Matsuura Y., Kajimoto T., Wein R.W. Eds. Dordrecht: Springer, 2010. V. 209. P. 303–330.
Фурст Г.Г. Методы анатомо-гистохимического исследования растительных тканей. М.: Наука, 1979. 156 с.
Моисеев В.С. Таксация молодняков. Л.: ЛТА, 1971. 344 с.
Zimmermann M.H. Transport in the xylem // Trees: Structure and function. Zimmermann M.H., Brown C.L. Eds. New York: Springer Verlag, 1971. P. 169–216.
Sanio K. Ueber die Grosse der Holzzelen bei gemeinen Kiefer (Pinus sylvestris) // Jahrbücher für Wissenschaftliche Botanik. 1872. № 8. S. 401–420.
Olson M.E., Anfodillo T., Sean M. et al. Tip-to-base xylem conduit widening as an adaptation: causes, consequences, and empirical priorities // New Phytologist. 2021. V. 229. P. 1877–1893.
McDowell N.G., Pockman W.T., Allen C.D. et al. Mechanisms of plant survival and mortality during drought: why do some plants survive while others succumb to drought? // New Phytologist. 2008. V. 178. P. 719–739.
Lockhart J.A. An analysis of irreversible plant cell elongation // J. of Theoretical Biology. 1965. № 8. P. 264–275.
Coussement J.R., Villers S.L.Y., Nelissen H. et al. Turgor-time controls grass leaf elongation rate and duration under drought stress // Plant Cell Environ. Accepted Author Manuscript. 2020. https://doi.org/10.1111/pce.13989
Woodruff D.R., Meinzer F.C., Lachenbruch B., Johnson D.M. Coordination of leaf structure and gas exchange along a height gradient in a tall conifer // Tree Physiology. 2009. V. 29. P. 261–272.
Дополнительные материалы отсутствуют.


