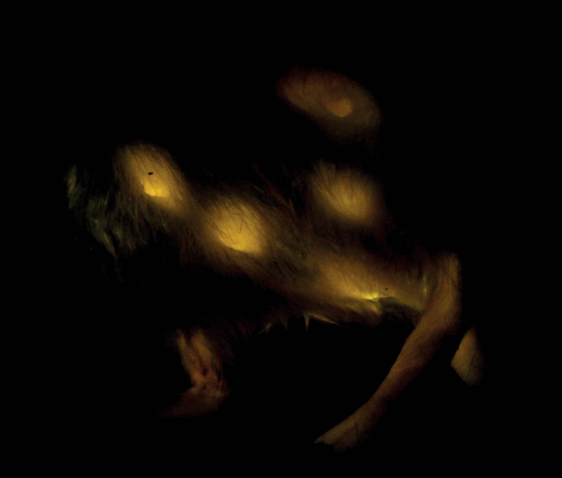Экология, 2022, № 2, стр. 153-158
Способ выявления точного места рождения мелких млекопитающих в исследованиях с применением группового мечения родамином
Е. Б. Григоркина a, *, Г. В. Оленев a, О. В. Толкачев a
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: grigorkina@ipae.uran.ru
Поступила в редакцию 30.04.2021
После доработки 02.07.2021
Принята к публикации 23.07.2021
- EDN: JBALYD
- DOI: 10.31857/S036705972201005X
Дисперсия (расселение, переселение) обеспечивает существование метапопуляций, связность видового населения на больших территориях и определяет устойчивость популяций в сильно фрагментированных ландшафтах [1]. Мелкие млекопитающие обычно используются в качестве тест-объектов в исследованиях, проводимых в зонах естественных геохимических аномалий или техногенного загрязнения [2–11]. Учет последствий дисперсии в данной группе видов необходим для корректной оценки аккумуляции поллютантов и биологических эффектов. К наиболее эффективным методам получения данных о передвижениях животных относится групповое мечение родамином B (RB). В организме млекопитающих маркер встраивается в кератинсодержащие структуры – шерсть, когти, вибриссы [12]. При этом формируется системная (фиксированная в ткани) метка, которая легко обнаруживается по характерной флуоресценции при осмотре животного [13, 14]. У грызунов и землероек маркер сохраняется длительное время, часто пожизненно [13].
В полевых исследованиях место рождения животных с меткой обычно остается неизвестным. Можно констатировать факт перемещения меченых животных или, напротив, их оседлость. При этом резиденты могут включать зверьков как родившихся на участке мечения, так и вселившихся извне. Мигрантами, отловленными на удалении от места мечения, могут быть не только животные, родившиеся на площадке, но и транзиенты, посетившие еe лишь один раз, например в ходе расселения. На лабораторных мышах показано [13], что RB может передаваться детенышам с материнским молоком. В полевых исследованиях на площадках мечения мы многократно отмечали флуоресценцию в сосках кормящих самок (рис. 1).
Выявление особей с молочной меткой в зонах локального техногенного загрязнения позволит сформировать пул зверьков с точно известным местом рождения. Это полезно как для калибровки методик, так и для проверки гипотез, подразумевающих длительное воздействие на особей факторов, связанных с определенной территорией. Цель настоящей работы – проверка возможности выявления мелких млекопитающих, меченых RB через материнское молоко в природных условиях.
Исследования проведены в зоне Восточно-Уральского радиоактивного следа (ВУРС) (Челябинская обл., Южный Урал). Растительность района типична для лесостепной зоны, характеризуется чередованием лугово-степных пространств, березовых, березово-осиновых колков, сосновых лесов.
Мечение RB выполнено в мае 2019 г. на участке площадью 1 га в периферийной части зоны ВУРСа (55°46′282″ с.ш., 60°53′673″ в.д.) [15, 16]. Приманку с RB готовили на основе овсяных хлопьев согласно [13]. Приманку (5 кг) равномерно распределили на площади 1 га, помещая куски в естественные укрытия для более длительного сохранения и доступности животным. Три контрольных отлова – в июле (43 дня после мечения), августе (78 дней) и сентябре (129 дней), проведены на четырех участках, включая площадку мечения. Места отловов выбирали с учетом имеющихся в районе исследований элементов ландшафта – озер, которые канализируют передвижения животных, что повышает шансы поимки зверьков с меткой на больших расстояниях. Отловы проведены методом безвозвратного изъятия с помощью крючковых давилок с деревянным основанием.
На каждой площадке на сутки методом ловушко-линий устанавливали по 40–60 ловушек с интервалом 10 м. Продолжительность отлова обусловлена унифицированной в наших исследованиях многолетней схемой работы [15, 16]. Объем промыслового усилия составил 950 ловушко-суток. У животных определяли вид, пол, вес, принадлежность к функциональной группировке (перезимовавшие, сеголетки) и репродуктивный статус по комплексу признаков. Эти данные использовали для определения возраста особей. При возрастной диагностике мышей дополнительно учитывали одонтологические признаки [17]. RB-метку выявляли по желтой флуоресценции при осмотре всей поверхности тела зверьков согласно [13, 14]. Привлечены также материалы, полученные нами в исследованиях с использованием группового мечения на территории г. Екатеринбурга и Ильменского заповедника (Челябинская обл., Южный Урал).
Для дифференциации пути поступления RB мы использовали особенности локализации метки в теле зверьков. У грызунов, получивших RB с кормом, метка на шкуре обычно проявляется в случайных местах и занимает менее 50% поверхности тела [13]. В вибриссах метка также проявляется частично [14]. Эти паттерны обусловлены особенностями роста кожных дериватов у грызунов, а также тем, что RB встраивается только в те кератиновые структуры, которые растут во время поступления маркера в организм [12, 18, 19]. У лабораторных мышей известны “волны роста” волос, которые перемещаются по телу [20]. У диких грызунов мы тоже обнаруживаем метку на фронте роста волос, хотя чаще расположение флуоресцирующих участков случайно (рис. 2).
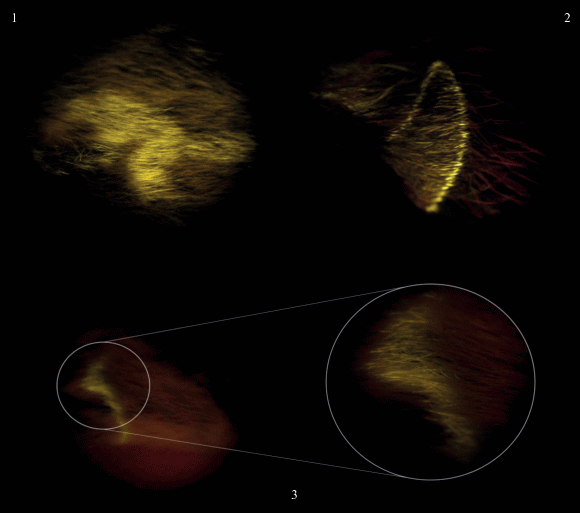
Рис. 2.
Примеры проявления системной метки (желтое свечение) при поступлении маркера с приманкой. Случайное расположение: 1 – в области груди и живота половозрелой самки Myodes glareolus Schreber, 1780; 2 – на ушной раковине неполовозрелой самки M. glareolus; 3 – метка на фронте роста волос на вентральной стороне тела (грудь, живот) перезимовавшей самки S. uralensis.
В жизни грызунов есть только один период, когда все дериваты кожи растут интенсивно и одновременно – вскоре после рождения и до формирования шерстного покрова. При этом у лабораторных мышей, получивших RB с молоком, метка проявляется по всему шерстному покрову, во всех вибриссах и когтях. У диких видов метка не видна в интенсивно окрашенных частях шкуры (спина, бока) и поэтому обнаруживается только на вентральной стороне тела. В дальнейшем метка фрагментируется и постепенно пропадает по мере замены старых волос. У лабораторных мышей молочная метка сохранялась не менее 4 мес., однако к концу этого срока ее уже нельзя было отличить от метки, полученной с приманкой, так как она оставалась в виде отдельных небольших фрагментов. Первоначально молочная метка видна в одинаковой секции каждой из вибрисс (проксимальная, средняя или дистальная), которые имеют разную длину. Положение метки в волосе зависит от того, на какой фазе роста он находился в момент поступления RB в организм. Метка в вибриссах сохраняется до 2 мес. [13, 21], затем они отрастают и поочередно заменяются новыми.
Таким образом, молочная R-B-метка должна проявляться у диких грызунов до двухмесячного возраста на всей или почти всей вентральной поверхности тела. Кроме того, флуоресценция должна быть во всех или нескольких вибриссах, проявляясь в одной и той же секции каждого волоса. У более взрослых животных можно ожидать выявления молочной метки только в виде флуоресценции на большей части вентральной поверхности тела, но не в вибриссах. Очевидно, на определенном этапе уже невозможно будет понять, была ли получена метка с молоком или приманкой.
У бурозубок метка проявляется иначе, чем у грызунов. Нередко у зверьков, отловленных на площадке мечения, RB обнаруживается в вибриссах и когтях, но полностью отсутствует в шерсти. Если системная метка проявляется на шерсти, то чаще всего на всей вентральной поверхности тела (рис. 3). Метку на фронте роста волос у землероек мы никогда не наблюдали. На данном этапе целесообразно причислять к меченым через молоко только тех особей, у которых одновременно присутствует метка на всей вентральной поверхности тела и в одинаковой секции всех вибрисс.
Рис. 3.
Сравнение вида вентральной стороны тела сеголеток Sorex araneus Linnaeus, 1758 без метки (слева) и с системной меткой по всей вентральной стороне тела (справа).

В ходе исследования было отловлено 131 животное, из них 109 – грызуны, 22 – бурозубки. В разные сроки на разных участках были обнаружены неполовозрелые сеголетки S. uralensis, Apodemus agrarius (Pallas, 1771) и S. araneus с молочной меткой (табл. 1), доля которых равна 12.5% (4 из 32 меченых). Возраст мышей соответствует 1.5–2 мес. В отличие от грызунов бурозубки появляются в уловах только после полного формирования особи. Невозможно отличить землеройку, только что вышедшую из гнезда, от особи в возрасте нескольких месяцев (до конца лета). Вес зверьков меняется день ото дня [22], но тенденции к его изменению с возрастом у сеголеток S. araneus не наблюдали [23], поэтому определить возраст по весу животного практически невозможно.
Таблица 1.
Характеристики животных, получивших RB-метку с молоком
| Вид | Дата отлова, срок с начала мечения, дни |
Дистанция от площадки мечения, м | Локализация метки | Пол | Вес тела, г; тимуса, мг |
Показатели генеративного состояния (описание матки, вес семенника, мг) |
|---|---|---|---|---|---|---|
| A. agrarius | 03.07.19, 43 | Участок мечения | Яркая системная метка на большей части живота, дистальные (концевые) части всех вибрисс | ♀ | 12.0; 20.0 | Матка нитевидная |
| S. araneus | 03.07.19, 43 | 9300 | Яркая системная метка по всей вентральной стороне тела, когти, дистальные части всех вибрисс | ♂ | 7.0 – |
2.0 |
| S. uralensis | 07.08.19, 78 | 9300 | Слабая системная метка на большей части живота, в средней части большинства вибрисс | ♀ | 13.0; 22 |
Матка нитевидная |
| A. agrarius | 27.09.19, 129 | 1500 | Слабая системная метка на большей части живота | ♀ | 13.0 16 |
Матка нитевидная |
Молочная метка была расположена на всей или большей части вентральной поверхности тела у всех зверьков. Спустя 43 дня после мечения она была более яркой, чем через 78 и 129 дней. Вероятно, это вызвано снижением количества приманки, пригодной для поедания, что должно приводить к уменьшению средних получаемых доз RB. Обычно приманка остается съедобной до двух недель, но при раскладывании в естественные укрытия, как в нашем исследовании, может сохраняться значительно дольше. Это объясняет, почему у лесной мыши, отловленной через 78 дней после начала экспонирования приманки, обнаружена метка в вибриссах. У трех зверьков RB-метка зарегистрирована во всех вибриссах, при этом она располагалась в одинаковых секциях всех волос у каждой особи.
Таким образом, нам удалось выявить четыре зверька трех видов, объединенных общим местом рождения и, как минимум, первых двух недель жизни – на участке мечения площадью 1 га на периферии зоны ВУРСа. Одно животное стало здесь же резидентом, а три других переселились на 1.5 и 9.3 км. Мы предполагали, что RB может проникать через плацентарный барьер (чисто гипотетически) или что самка, съев приманку с RB, могла покинуть площадку и, родив на новом месте, начала кормить детенышей молоком с маркером, пока он циркулирует в крови (1–2 сут). Но поскольку детеныши рождаются голыми, размер метки в этом случае не может превышать размер волосяного фолликула. Поэтому после отрастания волос мы могли бы увидеть в каждом из них метку размером менее 1 мм. У мелких млекопитающих детеныши начинают обрастать мехом спустя примерно неделю после рождения, когда несвязанный RB уже был бы гарантированно выведен из организма. В действительности у всех зверьков с молочной меткой наблюдалось сплошное светящееся поле на вентральной стороне тела (см. рис. 3). При этом волосы часто флуоресцируют целиком, что указывает на поступление маркера в организм в период их интенсивного роста. Следовательно, молодых животных (S. uralensis, A. agrarius, S. araneus), получивших RB с молоком, можно рассматривать как нерезидентов, самостоятельно переместившихся на выявленные дистанции.
Полученные результаты принципиально важны, хотя ограничены небольшим количеством особей с молочной меткой и спецификой объектов. Описанный способ выявления места рождения животных полезен при изучении отдаленных последствий радиационного и других токсических воздействий. В биоиндикационных исследованиях важно знать, в течение какого времени, а также на какой стадии онтогенеза особь находилась под воздействием поллютантов, что определяет чувствительность организма к интоксикации (повреждению). Предлагаемый метод позволит выявлять мелких млекопитающих, родившихся на определенной территории и подвергшихся изучаемому воздействию на ранних (наиболее уязвимых) стадиях онтогенеза.
Работа выполнена в рамках государственного задания Института экологии растений и животных УрО РАН, а также частично поддержана РФФИ (проект № 20-04-00164).
Авторы заявляют об отсутствии конфликта интересов и подтверждают, что в работе с животными соблюдались общепринятые этические нормы.
Список литературы
Hansk I., Gilpin M. Metapopulation dynamics: brief history and conceptual domain // Biological J. of the Linnean Society. 1991. V. 42. P. 3–16. https://doi.org/10.1111/j.1095-8312.1991.tb00548.x
Theodarakis C.W., Bickham J.W., Lamb T. et al. Integration of genotoxicity and population genetic analyses in kangaroo rats (Dipodomys merriami) exposed to radionuclide contamination at the Nevada Test Site, USA // Environ. Toxicol. and Chem. 2001. V. 20. № 2. P. 317–326.
Гилева Э.А., Большаков В.Н., Ялковская Л.Э. Межвидовые различия по реакции генома грызунов из природных популяций на хроническое облучение // Докл. РАН. 2002. Т. 387. № 3. С. 418–421.
Ryabokon N.I., Goncharova R.I. Transgenerational accumulation of radiation damage in small mammals chronically exposed to Chernobyl fallout // Radiat. Environ. Biophys. 2006. V. 45. P. 167–177.
Байтимирова Е.А., Мамина В.П., Жигальский О.А. Размножение европейской рыжей полевки (Myodes glareolus: Rodentia) в условиях естественных геохимических аномалий // Журн. общ. биол. 2010. Т. 71. № 2. С. 176–186.
Воробейчик Е.Л., Нестеркова Д.В. Техногенная граница распространения крота в районе воздействия медеплавильного завода: смещение в период сокращения выбросов // Экология. 2015. № 4. С. 308–312.
Ракитин С.Б., Григоркина Е.Б., Оленев Г.В. Анализ микросателлитной ДНК у грызунов из зоны Восточно-Уральского радиоактивного следа и сопредельных территорий // Генетика. 2016. Т. 52. № 4. С. 453–460.
Васильев А.Г., Васильева И.А., Шкурихин А.О. Геометрическая морфометрия: от теории к практике. М.: КМК, 2018. 471 с.
Bashlykova L., Rascosha O., Starobor N. Induction of abnormal sperm heads in small mammals under chronic ionizing radiation // Turk. J. Zool. 2019. V. 43. P. 540–544. https://doi.org/10.3906/zoo-1903-6
Orekhova N.A. Hepatic effects of low-dose rate radiation in natural mouse populations (Apodemus uralensis and Apodemus agrarius): comparative interspecific analysis // Int. J. of Radiation Biology. 2020. V. 96. № 8. P. 1038–1050. https://doi.org/10.1080/09553002.2020.1770362
Мухачева С.В. Многолетняя динамика сообществ мелких млекопитающих в период снижения выбросов медеплавильного завода. 1. Состав, обилие и разнообразие // Экология. 2021. № 1. С. 66–76. [Mukhacheva S.V. Long-term dynamics of small mammal communities in the period of reduction of copper smelter emissions: 1. Composition, abundance, and diversity // Russ. J. of Ecol. 2021. V. 52. № 1. P. 84–93.]
Fisher P. Review of using Rhodamine B as a marker for wildlife studies // Wildl. Soc. Bull. 1999. V. 27. P. 318–329.
Толкачёв О.В., Беспамятных Е.Н. Новый метод детекции родаминовой метки и возможности его применения в зоологических исследованиях // Журнал СФУ. Биология. 2018. Т. 12. № 4. С. 352–365.
Tolkachev O. A new baiting scheme and simple method of rhodamine B detection could improve biomarking of small mammals // European Journal of Wildlife Research. 2019. V. 65. № 10. https://doi.org/10.1007/s10344-018-1243-5
Григоркина Е.Б., Оленев Г.В. Миграции грызунов в зоне влияния Восточно-Уральского радиоактивного следа (радиобиологический аспект) // Радиац. биология. Радиоэкология. 2013. Т. 53. № 1. С. 76–83.
Grigorkina E.B., Olenev G.V. Migrations of rodents in the zone of local radioactive contamination at different phases of population dynamics and their consequences // Biol. Bull. 2018. V. 45. № 1. P. 110–118.
Колчева Н.Е. Стертость зубов как критерий возраста малой лесной мыши при анализе возрастной структуры популяций // Вестник ОГУ. Спецвыпуск. 2009. С. 77–80.
Spurr E.B. Rhodamine B as a systemic hair marker for assessment of bait acceptance by stoats (Mustela erminea) // New Zealand J. of Zoology. 2002. V. 29. P. 187–194. https://doi.org/10.1080/03014223.2002.9518302
Weerakoon M.K., Price C.J., Banks P.B. Hair type, intake, and detection method influence Rhodamine B detectability // J. Wildl. Manag. 2013. V. 77. P. 306–312.
Müller-Röver S., Handjiski B., van der Veen C. et al. A comprehensive guide for the accurate classification of murine hair follicles in distinct hair cycle stages // J. of Investigative Dermatology. 2001. V. 117. № 1. P. 3–15.
Jacob J., Jons D.A. Retention of the bait marker Rhodamine B in wild house mice // Wildl. Res. 2002. V. 29. P. 159–164.
Pucek Z. Seasonal and age changes in the weight of internal organs of shrews // Acta Theriologica. 1965. V. 10. № 26. P. 369–438.
Shchipanov N.A., Zima J., Churchfield S. Introducing the Common Shrew // Shrews, Chromosomes and Speciation (Cambridge Studies in Morphology and Molecules: New Paradigms in Evolutionary Bio). Eds. Searle J., Polly P., Zima J. Cambridge: Cambridge University Press, 2019. P. 19–67. https://doi.org/10.1017/9780511895531
Дополнительные материалы отсутствуют.