Электрохимия, 2019, T. 55, № 1, стр. 125-128
Электрохимическое аминирование. Селективная функционализация пара- и орто-анизидинов в водных растворах серной кислотыЮ. А. Лисицын, А. В. Сухов
Ю. А. Лисицын a, *, А. В. Сухов a
a Химический институт им. А.М. Бутлерова Казанского (Приволжского) федерального университета
420008 Казань, ул. Кремлевская, 18, Россия
* E-mail: Yuri.Lisitsyn@kpfu.ru
Поступила в редакцию 14.12.2017
После доработки 30.05.2018
Принята к публикации 25.07.2018
Аннотация
В водных растворах 4–14 М серной кислоты изучены процессы электрохимического аминирования пара- и орто-анизидинов с помощью гидроксиламина и медиаторной системы Ti(IV)/Ti(III). Функционализация пара-анизидина приводит к образованию 4-метокси-1,3- и 4-метокси-1,2-фенилендиаминов с выходами по току соответственно до 64.3 и 0.56%. При аминировании орто-анизидина 4-метокси-1,3-фенилендиамин является единственным продуктом замещения, его выход по току достигает 61%. В условиях, благоприятных для синтеза 4-метокси-1,3-фенилендиамина из анизидинов, наблюдается полная конверсия гидроксиламина, и выходы диаминосоединения по току соответствуют выходам по источнику аминорадикалов.
ВВЕДЕНИЕ
В водных растворах H2SO4 электрохимическое аминирование анизола с помощью гидроксиламина и медиаторной системы Ti(IV)/Ti(III) дает в качестве основного конечного продукта 4-метокси-1,3-фенилендиамин, образующийся преимущественно из связанных в ионные пары с гидросульфат-ионами катионов пара- и орто-анизидинов [1]. С учетом данных, полученных в работе [1], с целью оценки перспектив селективного синтеза 4-метокси-1,3-фенилендиамина непосредственно из вышеупомянутых анизидинов в настоящей работе изучены процессы их функционализации в водных растворах 4–14 М H2SO4
МЕТОДИКА ЭКСПЕРИМЕНТА
Аминирование изомерных анизидинов выполняли в стеклянной электрохимической ячейке, снабженной обратным холодильником и рубашкой для термостатирования. Конструкция нашей ячейки [2] с разделенными керамической диафрагмой катодным и анодным пространствами давала возможность использовать и платиновый (8.2 см2), и ртутный (11.0 см2) катоды при постоянстве площади последнего в условиях эксперимента.
Католит объемом 25 мл содержал водный раствор H2SO4 требуемой концентрации, 0.1 М Ti(IV), 0.2 М NH2OH и 0.2 М пара- или орто-анизидина. Перед электролизом католит, перемешиваемый при помощи магнитной мешалки IKA RET basic safety control (IKA-Werke GmbH & Co. KG, Германия), в течение 30 мин дезаэрировали потоком аргона, пропущенным предварительно через склянку Дрекселя с водным раствором серной кислоты исследуемой концентрации. В процессе электролиза аргон пропускали над католитом.
В большинстве случаев функционализацию изомерных анизидинов осуществляли при скорости вращения магнита мешалки (v) 1200 об/мин. Плотность тока, задаваемая посредством потенциостата-гальваностата Autolab PGSTAT 302N (Metrohm, Нидерланды) или IPC-Pro MF (Вольта, Россия), составляла –2 мА/см2. Для получения воспроизводимых значений потенциалов платиновый электрод перед электролизом промывали ацетоном и водой и подвергали катодно-анодной поляризации в водном растворе H2SO4 исследуемой концентрации при силе тока ±0.5 А [1, 2]. Изменение катодного потенциала в течение электролиза контролировали относительно хлоридсеребряного электрода. Анодом служил электрод из платинированной платины, анолитом – водный раствор H2SO4, имеющий концентрацию кислоты католита.
По окончании электролиза католит разбавляли водой до концентрации H2SO4 1–1.5 М, подщелачивали, охлаждая, до слабокислой реакции насыщенным водным раствором NaOH и нейтрализовали NaHCO3. Аминосоединения экстрагировали хлороформом [3].
Для анализа аминов использовали хроматограф Хроматэк-Кристалл 5000.2 (Хроматэк, Россия) с ионизационно-пламенным детектором. Температура капиллярных колонок CP-Sil 8 CB и BPX35 (60 м × 0.25 мм × 0.25 мкм) составляла 160°C, давление гелия, газа-носителя, – 200 кПа.
В работе использовали 15%-ный раствор сернокислого титана(IV) в водной 4 М H2SO4 (ч. д. а.); сернокислую соль гидроксиламина (Acros, 99%), перекристаллизованную из воды; H2SO4 (х. ч.); NaOH (ч. д. а.); NaHCO3 (х. ч.); перегнанный хлороформ (х. ч.); орто-анизидин (Lancaster, 98%), очищенный перегонкой в вакууме над KOH (Acros, for analysis, 85%); сублимированные пара-анизидин (Lancaster, 99%), а также 4-метокси-1,3-фенилендиамин и 4-метокси-1,2-фенилендиамин, полученные нейтрализацией соответственно сернокислой (Aldrich, 98%) и солянокислой (Lancaster, 98%) солей; ртуть (Р0), очищенную обработкой кислородом воздуха в 10%-ном водном растворе перегнанной HNO3 (х. ч.); бидистиллированную воду.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Поскольку при аминировании анизола больший вклад в образование 4-метокси-1,3-фенилендиамина вносит пара-анизидин [1], первой была изучена система Ti(IV)–NH2OH–п-CH3OC6H4NH2. За основу эксперимента были взяты условия, использованные в работе [1], концентрации гидроксиламина и анизидина были эквимолярными. В наиболее кислых растворах, в которых возможно окисление ртути титаном(IV) [2], использовали платиновый катод. Для предотвращения реакции электрохимического восстановления ионов гидроксония на поверхности платинового электрода [1] и, следовательно, более корректной оценки влияния концентрации серной кислоты на эффективность процесса аминирования ароматического субстрата [на выход по току (ВТ) продуктов замещения] электролизы с использованием двух катодов проводили, как правило, при повышенной температуре (40°С). Количество электричества, пропускаемое через электролит, составляло 482.4 Кл и соответствовало полной теоретической конверсии источника аминорадикалов из расчета потребления одного электрона на его молекулу.
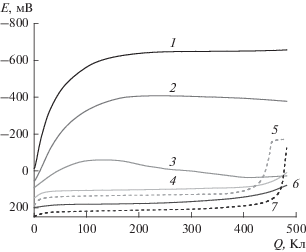
В водном растворе 4 М H2SO4 функционализация пара-анизидина дает только один продукт, 4‑метокси-1,3-фенилендиамин. То есть атаке аминокатион-радикалов подвергаются ионные пары $п {\text{ - C}}{{{\text{H}}}_{{\text{3}}}}{\text{O}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{NH}}_{{\text{3}}}^{ + },$ ${\text{HSO}}_{{\text{4}}}^{ - },$ в которых реакционная способность ароматического кольца и региоселективность замещения определяются главным образом метоксигруппой (влияние аммониевой группы в значительной степени нивелировано гидросульфат-ионом, за исключением эффекта поля). В соответствии с данными [1] повышение концентрации кислоты в католите приводит к возрастанию ВТ 4-метокси-1,3-фенилендиамина (рис. 1а) и появлению незначительных количеств 4-метокси-1,2-фенилендиамина (рис. 1б), образующегося из ассоциатов, включающих молекулу пара-анизидина и гидросульфат-ион. Выходы по току 4-метокси-1,3-фенилендиамина, наблюдаемые в растворах 4–6 М кислоты, существенно ниже выходов, которые можно было бы ожидать на основании результатов работы [1]; в 6 М H2SO4, например, ВТ диамина, составляющий 9.0%, немногим больше выхода, полученного при аминировании анизола [1]. Невысокая эффективность функционализации пара-анизидина в этих условиях связана с интенсивным протеканием на ртутном катоде параллельного восстановлению Ti(IV) процесса каталитического выделения водорода [4], обусловленного наличием ионов пара-анизидиния, а затем, по-видимому, и появлением дикатионов изомерных метоксифенилендиаминов, разряжающихся легче ионов гидроксония. Рост кислотности католита сопровождается изменением состава комплексов Ti(IV) [5] и смещением потенциалов их восстановления в область более положительных значений [5, 6], вследствие чего скорость процесса каталитического выделения H2 падает. Если в 4 М H2SO4 появление водорода визуально фиксируется примерно через 30 мин после начала электролиза (рис. 2, Q ≈ 40 Кл), к концу электролиза поверхность католита покрыта слоем обильной пены, то в 6 М растворе – более чем через час. Газовыделение и пенообразование в последнем случае менее интенсивные. В 8 М H2SO4 выделение H2 визуально уже не наблюдается, однако вид кулонопотенциограммы (рис. 2, кривая 3) еще не позволяет полностью исключить протекание в данных условиях электрокаталитического процесса.
Рис. 1.
Влияние концентрации серной кислоты на выходы по току 4-метокси-1,3-фенилендиамина (а) и 4-метокси-1,2-фенилендиамина (б) при непрямом катодном аминировании орто- (1) и пара-анизидинов (2–5) на ртутном (1, 2, 4) и платиновом (3, 5) катодах при 40°С (сTi(IV) = 0.1 М, ${{с }_{{{\text{N}}{{{\text{H}}}_{{\text{2}}}}{\text{OH}}}}} = 0.2\,{\text{М ,}}$ ${{с }_{{{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{O}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{N}}{{{\text{H}}}_{{\text{2}}}}}}} = 0.2\,{\text{М ,}}$ i = –2 мА/см2, Q = 482.4 Кл, SHg = 11.0 см2, SPt = 8.2 см2, v = 1200 об/мин).

Рис. 2.
Изменение потенциала ртутного (1–4, 6) и платинового (5, 7) катодов при электролизе системы Ti(IV)–NH2OH–п-CH3OC6H4NH2 в водных растворах при концентрации: 4 (1), 6 (2), 8 (3), 10 (4), 11 (5), 12 (6) и 14 М H2SO4 (7) при 40°С.
При 40°С наиболее высокие выходы по току как 4-метокси-1,3-фенилендиамина (64.3–63.9%), так и 4-метокси-1,2-фенилендиамина (до 0.50%) регистрируются в растворах 10–12 М H2SO4 (рис. 1). Уменьшение общей эффективности электрохимического процесса в более кислых средах обусловлено, по-видимому, протонированием ассоциатов $п {\text{ - C}}{{{\text{H}}}_{{\text{3}}}}{\text{O}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{N}}{{{\text{H}}}_{{\text{2}}}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{SO}}_{{\text{4}}}^{ - },$ протонированием ионных пар и ионов анизидиния по атому кислорода, а затем и проявлением процесса сульфирования ароматического субстрата. На сульфирование пара-анизидина указывает тот факт, что с повышением концентрации серной кислоты снижается общий выход изомерных метоксифенилендиаминов по субстрату при увеличении его конверсии. В растворе 10 М H2SO4 общий выход диаминосоединений и конверсия пара-анизидина составляют соответственно 98.7 и 65.7%, тогда как в 14 М H2SO4 – 85.4 и 70.8%.
Как и в случае аминирования анизола [1], изменение температуры эксперимента при использовании ртутного катода слабо отражается на ВТ 4-метокси-1,3-фенилендиамина (рис. 1а). Выход же 4-метокси-1,2-фенилендиамина с повышением температуры и скорости перемешивания католита падает (рис. 1б), что хорошо согласуется с образованием данного продукта из частиц $п {\text{ - C}}{{{\text{H}}}_{{\text{3}}}}{\text{O}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{N}}{{{\text{H}}}_{{\text{2}}}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{SO}}_{{\text{4}}}^{ - },$ водородная связь в которых слабее электростатического взаимодействия в ионных парах. Отметим, что при v, равной 1700 об/мин, общий выход изомерных метоксифенилендиаминов по пара-анизидину является практически количественным (99.6%).
Принимая во внимание результаты аминирования пара-анизидина и анизола [1], электролизы системы Ti(IV)–NH2OH–о-CH3OC6H4NH2 ограничили растворами 8–12 М кислоты. Функционализация орто-анизидина приводит к образованию единственного продукта замещения, 4-метокси-1,3-фенилендиамина, что свидетельствует о нахождении субстрата в данных средах только в виде катионов, связанных и несвязанных в ионные пары. Несколько неожиданный факт отсутствия даже незначительных количеств 2-метокси-1,3-фенилендиамина может быть следствием стерических ограничений в катионе, обусловленных строением метоксигруппы и взаимодействием ее атома кислорода с положительно заряженными компонентами католита.
В условиях отсутствия процесса электрокаталитического выделения водорода выходы по току 4-метокси-1,3-фенилендиамина, регистрируемые при аминировании орто-анизидина, несколько меньше выходов, полученных при функционализации пара-анизидина. В растворах 10–12 М серной кислоты выходы составляют 61.0–60.2% (рис. 1а). Эксперименты, выполненные в 10 М H2SO4, показали, что изменение температуры от 20 до 60°С практически не влияет на ВТ диамина, наблюдается лишь некоторое снижение его выхода по орто-анизидину, со 100 до 98.8%, связанное, по-видимому, с сульфированием ароматического субстрата.
По окончании процесса аминирования пара-анизидина в 9–14 М H2SO4 католиты имели черно-коричневый цвет, переходящий в фиолетовый при разбавлении водой. В ходе электролизов системы Ti(IV)–NH2OH–о-CH3OC6H4NH2 в растворах 8–12 М кислоты электролиты приобретали устойчивый фиолетовый цвет. Исчезновение окраски проб католитов, характерной для водных растворов Ti(III) [7], при добавлении к ним сернокислого гидроксиламина свидетельствует о полной конверсии источника аминорадикалов в процессах аминирования пара- и орто-анизидинов. Следовательно, значения ВТ изомерных метоксифенилендиаминов в данных экспериментах соответствуют выходам по NH2OH.
Аминирование анизидинов протекает по цепному механизму [Ti(III) генерируется не только на катоде, но и в объеме католита при окислении соответствующих метоксидиаминоциклогексадиенильных радикалов титаном(IV)], и для восстановления гидроксиламина требуется количество электричества меньшее 482.4 Кл. Поэтому в средах с концентрацией кислоты более 8 М после полной выработки гидроксиламина и восстановления большей части Ti(IV) до Ti(III) на катоде начинает протекать процесс электрохимического восстановления ионов гидроксония, вследствие чего потенциал электрода смещается в сторону более отрицательных значений (рис. 2).
ЗАКЛЮЧЕНИЕ
Таким образом, электрохимическое аминирование пара- и орто-анизидинов в водных растворах серной кислоты дает с неплохими выходами по току 4-метокси-1,3-фенилендиамин в качестве соответственно основного и единственного продукта. Наибольшая эффективность замещения, превышающая для обоих субстратов 60%, наблюдается в 10 М H2SO4. При функционализации пара-анизидина в данном католите повышение температуры эксперимента с 25 до 60°С приводит к возрастанию массовой доли 4-метокси-1,3-фенилендиамина с 99.1% до 99.6%. Аминирование орто-анизидина не требует использования повышенных температур и может проводиться при 20°С.
Список литературы
Лисицын, Ю.А., Сухов, А.В. Электрохимическое аминирование. Селективное введение двух аминогрупп в ароматическое кольцо. Журн. общ. химии. 2017. Т. 87. С. 20. [Lisitsyn, Yu.A. and Sukhov, A.V., Electrochemical Amination. Selective Introduction of Two Amino Groups into an Aromatic Ring, Russ. J. Gen. Chem., 2017, vol. 87, p. 16.]
Лисицын, Ю.А., Каргин, Ю.М. Электрохимическое аминирование. II. Влияние кислотности электролита. Журн. общ. химии. 1993. Т. 63. С. 1312. [Lisitsyn, Yu.A. and Kargin, Yu.M., Electrochemical amination. II. Effect of electrolyte acidity, Russ. J. Gen. Chem., 1993, vol. 63, p. 917.]
Коренман, И.М. Константы распределения органических веществ между двумя жидкими фазами. Вып. 1. Горький: Изд-во Горьк. гос. ун-та, 1975. С. 21–28. [Korenman, I.M., The distribution constants of organic compounds between two liquid phases (in Russian), no. 1, Gor’ki: Gor’ki state univ., 1975. P. 21–28.]
Дамаскин, Б.Б., Некрасов, Л.Н., Петрий, О.А., Подловченко, Б.И., Стенина, Е.В., Федорович, Н.В. Электродные процессы в растворах органических соединений, М.: Изд-во Моск. ун-та, 1985. С. 258. [Damaskin, B.B., Nekrasov, L.N., Petriy, O.A., Podlovchenko, B.I., Stenina, E.V., and Fedorovich, N.V., Electrode processes in solutions of organic compounds (in Russian), Moscow: Publishing house of the Moscow univ., 1985, p. 258.]
Лисицын, Ю.А., Бусыгина, Н.В., Зявкина, Ю.И., Штырлин, В.Г. Электрохимическое аминирование. Медиаторная система Ti(IV)/Ti(III) в водных растворах серной кислоты. Электрохимия. 2010. Т. 46. С. 544. [Lisitsyn, Yu.A., Busygina, N.V., Zyavkina, Yu.I., and Shtyrlin, V.G., Electrochemical amination. Ti(IV)/Ti(III) mediator system in aqueous solutions of sulfuric acid, Russ. J. Electrochem, 2010, vol. 46, p. 512.]
Fatouros, N., Krulic, D., Larabi, N. Electrochemical kinetics of the Ti(IV)/Ti(III) couple in sulfuric acid, J. Electroanal. Chem., 2004, vol. 568, p. 55.
Реми, Г. Курс неорганической химии. Т. 2. М.: Мир, 1974. С. 69–70. [Remy, H., Lehrbuch der Anorganischen Chemie, Band II, Leipzig: Akademische Verlagsgesellschaft Geest & Portig K.-C., 1961. 1023 p.]
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия


