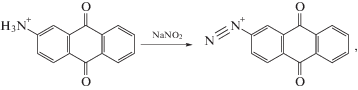Электрохимия, 2019, T. 55, № 12, стр. 1560-1568
Исследование реакции электровосстановления кислорода на тонкопленочном модифицированном антрахиноном углерод/полимерном композите в щелочном растворе
М. Ю. Чайка a, В. В. Волков b, Т. А. Кравченко a, *, Д. В. Конев c, В. С. Горшков a, В. А. Крысанов a, А. А. Босяченко a
a Воронежский государственный университет
394006 Воронеж, Университетская пл., 1, Россия
b Институт нефтехимического синтеза им. А.В. Топчиева РАН
119991 Москва, Ленинский просп., 29, Россия
c Институт проблем химической физики РАН
142432 Черноголовка, просп. академика Семенова, 1, Россия
* E-mail: krav280937@yandex.ru
Поступила в редакцию 29.01.2019
После доработки 14.02.2019
Принята к публикации 29.04.2019
Аннотация
С целью поверхностной модификации проведена обработка технического углерода марки CH210 путем химического восстановления диазо-производного антрахинона. Наличие антрахинонных групп на углеродной поверхности подтверждено методом ИК-спектроскопии нарушенного полного внутреннего отражения. Углерод с модифицированной антрахиноном поверхностью при помощи полимерного связующего нанесен на стеклоуглеродный носитель. Методом вращающегося дискового электрода изучено поведение полученного таким образом катализатора в процессе электровосстановления кислорода в щелочной среде. Определены кинетические характеристики реакции: потенциал полуволны, предельный ток, число электронов, тафелевский наклон, ток обмена, коэффициент переноса заряда. Показано, что образование пероксида водорода на поверхности углерод-полимерного композита происходит в области более положительных потенциалов по сравнению с электродом из технического углерода и стеклоуглерода, что позволяет использовать предложенный материал в качестве эффективного электрокатализатора данной реакции.
ВВЕДЕНИЕ
В настоящее время основным промышленным способом производства пероксида водорода является антрахинонный метод, в основе которого лежит циклический процесс восстановления 2‑этилантрахинона до 2-этилгидроксилантрахинона и обратного окисления с образованием пероксида водорода [1–3]. Для получения H2O2 невысоких концентраций используют реакцию электрохимического восстановления молекулярного кислорода по двухэлектронному механизму [4]. Преимуществом электрохимического синтеза является возможность использования кислорода воздуха и отсутствие необходимости пространственного разделения стадий синтеза [3, 5]. В качестве рабочих электродов для получения пероксида водорода могут служить компактное золото, пирографит, стеклоуглерод, другие углеродные материалы различной структуры и нанокомпозиты на их основе [6–14]. В перспективе, могут быть использованы композиты, состоящие из углеродной матрицы с физически или химически адсорбированными частицами катализатора и полимерного связующего [15].
Одними из наиболее активных катализаторов получения пероксида водорода являются соединения хинонного ряда (антрахинон, фенатренхинон, нафтохинон) [16–18]. Наиболее изученным является антрахинон (AQ) [19, 20]. Модифицирование поверхности углерода гидрохиноном позволяет создать композит, на котором возможно осуществить получение пероксида водорода по двум механизмам – химическому и электрохимическому [21].
Прививка хинонных групп к поверхности углеродной матрицы путем восстановления соответствующих солей диазония уменьшает перенапряжение электровосстановления кислорода, что значительно увеличивает скорость накопления промежуточного продукта – пероксида водорода. Молекулярный кислород в первую очередь взаимодействует с хинонными группами, находящимися на поверхности углеродной матрицы, то есть присоединение первого электрона к кислороду происходит через отрицательно заряженный ион хинона [17].
Различные хинонные соединения, адсорбированные на поверхности углеродного носителя, в разной степени изменяют константу скорости реакции [18]. Благодаря особенностям кинетики восстановления O2 на техническом углероде, модифицированном хинонными группами, такие материалы обладают преимуществом над немодифицированными углеродными материалами при проведении процесса электрохимического получения пероксида водорода.
Целью настоящей работы является исследование кинетических закономерностей и механизма электрохимического восстановления кислорода до пероксида водорода на тонкопленочном углерод/полимерном композите на основе технического углерода CH210, модифицированного антрахиноном.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Модификацию углеродного носителя, в качестве которого был выбран технический углерод марки CH210 (ООО “Омсктехуглерод”), проводили α-аминоантрахиноном (Acros Organics) и нитритом натрия (ЗАО “Вектон”) [22]. К 2.45 г α‑аминоантрахинона, растворенного при температуре 70°С в 72.25 г дистиллированной воды и 1.09 г 37% соляной кислоты, добавляли 5 г технического углерода. Для увеличения смачиваемости технического углерода в раствор вводили 22.5 мл изопропилового спирта (х. ч.). Далее в течение 5 мин к смеси по каплям добавляли 3 мл 3.6 М раствора нитрита натрия. Далее, при быстром перемешивании реакционную смесь охлаждали до комнатной температуры. Технический углерод, модифицированный антрахиноном, отфильтровывали, после чего сушили в течение 12 ч при 70°С. После этого модифицированный технический углерод экстрагировали в экстракторе Сокслета последовательно метанолом и толуолом в течение 12 ч.
Для подтверждения наличия групп антрахинона на поверхности технического углерода использовали инфракрасный фурье-спектрометр Perkin-Elmer Spectrum 100 (США) с приставкой МНПВО (многократно нарушенного полного внутреннего отражения). Образцами выступали антрахинон, исходный технический углерод марки CH210 и технический углерод, модифицированный антрахиноном.
Тонкопленочный композит получали смешиванием 0.8 г модифицированного антрахиноном технического углерода с 2 г 10%-ного раствора поливинилиденфторида в N-метилпирролидоне. Смесь доводили до необходимой вязкости раствором N-метилпирролидона с ацетоном (1 : 1) и подвергали гомогенизации в течение 15 мин с помощью ультразвукового диспергатора УЗГ 15-0.1/22 (ООО “Ультразвуковая техника”, Россия). Полученную смесь наносили с помощью микрошприца на полированную поверхность рабочего стеклоуглеродного электрода (GC) и высушивали в течение 12 ч при комнатной температуре. Полировку выполняли последовательной шлифовкой порошком Al2O3 c размером частиц 1 и 0.05 мкм, после чего поверхность электрода обезжиривали этиловым спиртом и многократно промывали дистиллированной водой. После испарения растворителя на стеклоуглеродной подложке получали тонкопленочный углерод/полимерный композит с соотношением технического углерода (С) и полимерного связующего (Р) 4 : 1.
Электрохимические исследования осуществляли в стандартной трехэлектродной ячейке ВЭД-06 (ООО НТФ “Вольта”, Россия) с использованием потенциостата Elins P-8 (ООО “Элинс”, Россия). Концентрацию кислорода в рабочем растворе измеряли с помощью анализатора кислорода АКПМ-0.1 (ООО “Альфа БАССЕНС”, Россия). В качестве электрода сравнения использовали хлоридсеребряный электрод, в качестве вспомогательного – электрод из спектрально чистого графита. Фоновым электролитом являлся 0.1 М раствор KOH. Перед началом работы рабочий раствор насыщали кислородом в течение часа до концентрации ${{c}_{{{{{\text{O}}}_{{\text{2}}}}}}} = 5.67 \times {{10}^{{ - 5}}}$ М. Для получения воспроизводимых результатов перед снятием вольт-амперных кривых поверхность рабочего электрода стандартизировали поляризацией при потенциале E = 0 В в течение 10 мин. Все значения потенциала даны относительно нормального водородного электрода (н. в. э.). Силу тока нормировали на геометрическую площадь поверхности рабочего электрода S = 7 × 10–6 м2. Измерения проводили при скорости развертки потенциала v = 0.002 В/с и скоростях вращения электрода в диапазоне 500–2000 об/мин.
Определение истинной площади поверхности Sист электродов проводили методом сканирующей микроскопии (СЭМ) с помощью многоцелевого растрового микроскопа JSM-6380LV (Япония). Также для определения истинной площади поверхности тонкопленочных электродов получали кривые заряжения в области формирования двойного электрического слоя (ДЭС) со скоростью развертки потенциала 0.0005–0.01 В/с. Получение кривых проводили в инертной атмосфере в 1 М растворе КОН в области потенциалов 0.6–0.1 В для немодифицированного электрода и 0.5–0.2 В для модифицированного электродов. Площадь поверхности рассчитывали по уравнению, представленному в [23]:
где Qк − заряд, соответствующий катодной части вольтамперограммы; ΔE − область потенциалов, отвечающая заряжению двойного электрического слоя; Cуд − удельная емкость поверхности технического углерода CH210, принятая равной 10 мкФ/см2 [24]. Анализ поверхности тонкопленочных электродов позволил определить среднеквадратичную шероховатость образцов и их удельную поверхность.При исследовании реакции электровосстановления кислорода на композитных электродах целесообразно проводить последовательное рассмотрение влияния отдельных компонентов, переходя от наиболее простой системы (однокомпонентной) к более сложным (многокомпонентным) [7]. Исходя из этого, реакция была изучена в следующих системах
Система 1. Стеклоуглеродный электрод (GC).
Система 2. Тонкопленочный углерод/полимерный композит на основе сажи на стеклоуглеродной подложке (С-Р/GC).
Система 3. Тонкопленочный углерод/полимерный композит на основе модифицированной антрахиноном сажи на стеклоуглеродной подложке (AQ@С-Р/GC).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Реакция электровосстановления кислорода является сложным электрохимическим процессом, стадии которого могут образовывать ряд параллельно-последовательных комбинаций. Единственным возможным стабильным промежуточным продуктом реакции, проходящей в водной среде, является пероксид водорода. Другие промежуточные продукты являются неустойчивыми. В связи с этим общую схему электровосстановления молекулярного кислорода на различных материалах можно представить следующим образом [25]
где ki – константы скорости соответствующих реакций; индекс “адс” соответствует молекулам в адсорбированном состоянии на электроде.Молекулярный кислород адсорбируется на поверхности, а затем в зависимости от типа катализатора восстанавливается по двухэлектронному механизму с образованием пероксида водорода или по четырехэлектронному механизму до воды. Образовавшийся пероксид водорода может как уйти вглубь раствора, так и далее восстановиться до воды или окислиться с образованием исходной молекулы. Наличие на углеродной поверхности кислородсодержащих групп, имеющих основный характер, способствует протеканию реакции через образование пероксида водорода [21]. Такие кислородсодержащие группы можно искусственно получить, модифицируя поверхность углерода различными хинонами (например, антрахиноном) с последующим восстановлением атома кислорода молекулы хинона до гидроксильной группы.
Модификация поверхности технического углерода молекулами антрахинона была выполнена химическим способом по следующему механизму [22]
Первой стадией модификации являлось протонирование исходной молекулы α-аминоантрахинона соляной кислотой по реакции (3). Протонированный α-аминоантрахинон нитровали, в результате чего получали соль диазония по реакции (4). Полученная соль самопроизвольно отщепляла молекулу азота N2 и переходила в активный радикал антрахинона, который хемосорбировался на техническом углероде по схеме (5) .
Наличие молекул антрахинона на поверхности технического углерода было подтверждено методом ИК-спектроскопии нарушенного полного внутреннего отражения (IR ATR). Спектры исследуемых порошков представлены на рис. 1. Первый и второй спектры принадлежат немодифицированному техническому углероду и антрахинону соответственно. Третий спектр принадлежит модифицированному техническому углероду. В нем наблюдаются пики с волновыми числами 1670, 1328, 1301 и 1280 см–1, выделенные рамками, которые соответствуют колебаниям молекул антрахинона и не проявляются в ИК-спектре чистого технического углерода, что подтверждает присутствие групп антрахинона на поверхности углеродной подложки.
Рис. 1.
ИК-спектры, полученные методом нарушенного полного внутреннего отражения образцов: 1 – технический углерод марки CH210, 2 – антрахинон, 3 – модифицированный антрахиноном технический углерод. Цифрами обозначено волновое число.

На рис. 2 представлены вольт-амперные кривые электровосстановления молекулярного кислорода на тонкопленочном углерод/полимерном композите на основе модифицированного антрахиноном технического углерода на стеклоуглероде (AQ@С-Р/GC), полученные в 0.1 М растворе КОН при разных скоростях вращения электрода (500–2000 об/мин). Токи приведены без поправки на фоновые значения. Кривые характеризуются двумя волнами восстановления кислорода с предельными токами.
Рис 2.
Вольт-амперные кривые электровосстановления кислорода на тонкопленочном углерод/полимерном композите на основе модифицированного антрахиноном технического углерода на стеклоуглероде в 0.1 М растворе KOH, насыщенном O2, при скорости развертки потенциала v = 0.002 В/с и различных скоростях вращения электрода ω, об/мин: 1 – 500, 2 – 750, 3 – 1000, 4 – 1500, 5 – 2000.

Переход от стеклоуглерода к модифицированному антрахиноном тонкопленочному углерод/полимерному композиту характеризуется увеличением скорости реакции электровосстановления молекулярного кислорода, вызванным возрастанием каталитической активности материала электрода (рис. 3).
Рис. 3.
Вольт-амперные кривые электровосстановления молекулярного кислорода. Электроды: 1 – GC, 2 – C-P/GC, 3 – AQ@C-P/GC. Скорость вращения электрода ω = 500 об/мин. Скорость развертки потенциала v = 0.002 В/с, 0.1 М раствор KOH, насыщенный O2.

Это утверждение подтверждается сдвигом потенциала полуволны восстановления кислорода на 0.03 В в более положительную область (табл. 1) [20, 26]. Первая поляризационная волна, проявляющаяся при восстановлении кислорода как на композите AQ@C-P/GC, так и на всех остальных исследованных материалах, отвечает двухэлектронному механизму восстановления кислорода до пероксида. Однако модифицирование углерод/полимерного композита приводит к накоплению пероксида водорода в области более низкой катодной поляризации, что позволяет получать его с меньшими энергетическими затратами.
Таблица 1.
Потенциал полуволны Е1/2, плотность предельного диффузионного тока ilim электровосстановления кислорода в 0.1 М растворе KOH, насыщенном O2, и количество электронов n при скорости развертки потенциала v = 0.002 В/с и скорости вращения ω = 500 об/мин. Номер поляризационной волны N: первая – I, вторая – II
| Электрод | N | Е1/2, В | –ilim, А/м2 | n |
|---|---|---|---|---|
| GC | I | –0.08 | 8.2 ± 0.4 | 2.06 |
| II | 13.7 ± 0.7 | 3.56 | ||
| C-P/GC | I | –0.07 | 10.6 ± 0.5 | 2.13 |
| II | 16.5 ± 0.9 | 3.98 | ||
| AQ@C-P/GC | I | –0.04 | 14.7 ± 0.7 | 2.23 |
| II | 24.3 ± 1.2 | 3.92 |
Количество электронов в каждой поляризационной волне электровосстановления кислорода рассчитывали по уравнению Левича [27]
(6)
${{i}_{{{\text{lim}}}}} = - {\text{ }}0.62nF{{D}^{{2{\text{/}}3}}}{{{\omega }}^{{1{\text{/}}2}}}{{{\nu }}^{{ - 1{\text{/}}6}}}{{c}_{0}},$Из экспериментально найденных значений предельного тока вычитали фоновые токи, измеренные в деаэрированном аргоном растворе. Значения потенциала полуволны, плотности предельного тока электровосстановления кислорода и расчетные количества электронов представлены в табл. 1.
Исходя из вычисленного количества электронов, первая поляризационная волна восстановления кислорода на GC отвечает реакции образования пероксида водорода [28, 29]
(7)
$\begin{gathered} {{O}_{{2\,{\text{адс}}}}} + {{e}^{ - }} \to \operatorname{O} _{{2\,{\text{адс}}}}^{{ \bullet - }}, \\ \operatorname{O} _{{2\,{\text{адс}}}}^{{ \bullet - }} + {{e}^{ - }} + {{H}_{2}}O \to {{O}_{2}}{{H}^{ - }} + O{{H}^{ - }}. \\ \end{gathered} $Полученное количество электронов во второй поляризационной волне соответствует дальнейшему протеканию реакции с восстановлением пероксида до воды. Зависимости ilim–ω1/2 первой и второй поляризационных волн экстраполируются в начало координат (рис. 3), что указывает на внешнедиффузионную природу процесса.
На тонкопленочном углерод/полимерном композите C-Р/GC, как и в случае стеклоуглерода, наблюдается две волны восстановления кислорода. Переход к композитному электроду характеризуется некоторым увеличением предельного тока электровосстановления кислорода (рис. 4). Зависимости ilim–ω1/2 первой и второй поляризационных волн не экстраполируются в начало координат, что свидетельствует о смешанном кинетически-диффузионном механизме, приводящем к повышению регистрируемого тока. Исходя из рассчитанного количества электронов (табл. 1), можно заключить, что электровосстановление кислорода на тонкопленочном углерод/полимерном композите протекает также в две стадии с образованием пероксида водорода и дальнейшим его восстановлением до воды.
Рис. 4.
Зависимость плотности предельного диффузионного тока ilim от скорости вращения электрода ω1/2: а – первая волна восстановления кислорода, б – вторая волна восстановления кислорода. Электроды: 1 – GC, 2 – C-P/GC, 3 – AQ@C-P/GC, 4 – теоретическая зависимость для двухэлектронного процесса, 5 – теоретическая зависимость для четырехэлектронного процесса. Скорость развертки потенциала v = 0.002 В, 0.1 М раствор KOH, насыщенный O2.

Зависимость ilim–ω1/2 при восстановлении кислорода на модифицированном композите AQ@C-P/GC (рис. 4) также не экстраполируется в начало координат, а увеличение регистрируемого тока свидетельствует о смешанном кинетически-диффузионном механизме с еще большим, чем на композите C-Р/GC, вкладом кинетической стадии.
Для выявления замедленной стадии был проведен анализ начальных участков поляризационных кривых в координатах $E{\text{--}}\lg \left( {\frac{{i{{i}_{{\lim }}}}}{{{{i}_{{\lim }}} - i}}} \right)$ (табл. 2). Близкие значения коэффициента переноса α для обеих исследуемых систем связаны с неизменностью механизма протекания реакции при переходе к модифицированному электроду. Исходя из величин тафелевских наклонов b можно предположить, что первой стадией электровосстановления кислорода на модифицированном композите является присоединение первого электрона к ковалентно связанному с углеродом антрахинону [5, 6] с последующим взаимодействием с молекулой кислорода по уравнениям
(9)
${\text{A}}{{{\text{Q}}}^{{ \bullet - }}} + {{{\text{O}}}_{2}} \to \operatorname{O} _{{2\,{\text{адс}}}}^{{ \bullet - }}\,\, + {\text{AQ}}{\text{.}}$Таблица 2.
Тафелевские наклоны b начальных участков поляризационных кривых в координатах $E{\text{--}}\lg \left( {\frac{{i{{i}_{{\lim }}}}}{{{{i}_{{\lim }}} - i}}} \right)$ электровосстановления молекулярного O2 и коэффициент переноса заряда α в 0.1 M растворе KOH на исследуемых электродах при скорости развертки потенциала v = 0.002 В/с
| Электрод | Область потенциалов Е, В | b, В | α |
|---|---|---|---|
| GC | –0.001…–0.081 | 0.120 ± 0.002 | 0.75 ± 0.01 |
| C-Р/GC | –0.001…–0.051 | 0.121 ± 0.002 | 0.76 ± 0.01 |
| AQ@C-P/GC | –0.010…–0.090 | 0.124 ± 0.003 | 0.76 ± 0.01 |
В описанном механизме скоростьопределяющей стадией является образование аниона супероксида $\operatorname{O} _{2}^{{ \bullet - }}$ [18]. На основании полученного количества электронов в первой поляризационной волне электровосстановления кислорода на модифицированном AQ тонкопленочном углерод/полимерном композите можно заключить, что далее протекает стадия с участием электрона по уравнению (6), что согласуется с работами [5, 6].
В табл. 3 приведены значения площади поверхности для модифицированного и немодифицированного композитных электродов, рассчитанные методами сканирующей микроскопии и заряжения двойного электрического слоя и отнесенные к единице массы сажи. Числовые значения удельной поверхности, определенные методом СЭМ, несколько ниже, чем для ДЭС, однако общие закономерности сохраняются, независимо от метода исследования.
Таблица 3.
Удельная площадь S исследованных электродов, токи обмена на единицу геометрической $i_{0}^{{\text{Г}}}$ и истинной $i_{0}^{{\text{И}}}$ поверхности
| Электрод | Удельная площадь S, м2/г | $i_{0}^{{\text{Г}}} \times {{10}^{4}},$ А/м2 | $i_{0}^{{\text{И}}} \times {{10}^{5}},$ А/м2 | ||
|---|---|---|---|---|---|
| СЭМ | ДЭС | СЭМ | ДЭС | ||
| C-P/GC | 13.1 ± 0.2 | 17.8 ± 1.2 | 5.8 ± 0.4 | 1.1 ± 0.3 | 4.1 ± 0.9 |
| AQ@C-P/GC | 15.3 ± 0.4 | 25.4 ± 0.7 | 11.1 ± 1.1 | 1.8 ± 0.5 | 5.5 ± 1.1 |
Сравнение полученных значений указывает на некоторое развитие поверхности вследствие модификации электрода. На основании значений площади электродов рассчитаны плотности токов обмена io. Переход от системы C-P/GC к AQ@C-P/GC сопровождается возрастанием io, что свидетельствует о более высокой электрокаталитической активности модифицированного электрода в реакции электровосстановления кислорода.
ЗАКЛЮЧЕНИЕ
В результате выполненной работы была исследована реакция электровосстановления кислорода на тонкопленочном углерод/полимерном композите, модифицированном антрахиноном с помощью химического восстановления диазониевых солей. Наличие антрахинона на поверхности углерода подтверждено методом ИК-спектроскопии нарушенного полного внутреннего отражения. Скорость реакции электровосстановления молекулярного кислорода увеличивается при переходе от стеклоуглерода и тонкопленочного углерод/полимерного композита к модифицированному AQ тонкопленочному углерод/полимерному композиту, что связано с возрастанием электрокаталитических свойств. Модификация поверхности технического углерода AQ сдвигает потенциал полуволны восстановления кислорода в область меньшей катодной поляризации и повышает ток обмена, благодаря чему данный материал является наиболее предпочтительным среди рассмотренных для реализации электрохимического синтеза пероксида водорода.
Список литературы
Сосновский, Г.Н., Сосновская, Н.Г., Ковалюк, Е.Н., Султанова, В.И. Основы электрохимической технологии, Ангарск: АГТА, 2005, 101 с.
Keita, B. and Nadjo, L., Catalytic synthesis of hydrogen peroxide: an attractive electrochemical and photoelectrochemical route to the reduction of oxygen, J. Electroanal. Chem., 1983, vol. 145, p. 431.
Samanta, C., Direct synthesis of hydrogen peroxide from hydrogen and oxygen: An overview of recent developments in the process, Appl. Cat. A: General., 2008, vol. 350, p. 133.
Campos, M., Siriwatcharapiboon, W., Potter, R.J., and Horswell, S.L., Selectivity of cobalt-based catalysts towards hydrogen peroxide formation during the reduction of oxygen, Catal. Today., 2013, vol. 202, p. 135.
Lobyntseva, E., Kallio, T., Alexeyeva, N., Tammeveski, K., and Kontturi, K., Electrochemical synthesis of hydrogen peroxide: Rotating disk electrode and fuel cell studies, Electrochim. Acta., 2007, vol. 52, p. 7262.
Mirkhalaf, F., Tammeveski, K., and Schiffrin, D.J., Substituent effects on the electrocatalytic reduction of oxygen on quinone-modified glassy carbon electrodes, Phys. Chem. Chem. Phys., 2004, vol. 6, p. 1321.
Кинетика сложных электрохимических реакций / Отв. ред. В.Е. Казаринов. М.: Наука, 1981. 309 с.
Assumpção, M.H.M.T., De Souza, R.F.B., Rascio, D.C., Silva, J.C.M., Calegaro, M.L., Gaubeur, I., Paixão, T.R.L.C., Hammer, P., Lanza, M.R.V., and Santos, M.C., A comparative study of the electrogeneration of hydrogen peroxide using Vulcan and Printex carbon supports, Carbon, 2011, vol. 49, p. 2842.
Jeyabharathi, C., Hasse, U., Ahrens, P., and Sholz, F., Oxygen electroreduction on polycrystalline gold electrodes and on gold nanoparticle-modified glassy carbon electrodes, Solid State Electrochem., 2014. vol. 18, p. 3299.
Гутерман, В.Е., Пустовая, Л.Е., Гутерман, А.В., Высочина, Л.Л. Боргидридный синтез Ptx−Ni/С-электрокатализаторов и исследование их активности в реакции электровосстановления кислорода. Электрохимия. 2007. Т. 43. С. 1147. [Guterman, V.E., Pustovaya, L.E., Guterman, A.V., and Vysochina, L.L., Borohydride synthesis of the Ptx–Ni/C electrocatalysts and investigation of their activity in the oxygen electroreduction reaction, Russ. J. Electrochem., 2007, vol. 43, p. 1091.]
Гудко, О.Е., Ластовина, Т.А., Смирнова, Н.В., Гутерман, В.Е. Бинарные Pt–Me/C нанокатализаторы: структура и каталитические свойства в реакции электровосстановления кислорода. Рос. нанотехнологии. 2009. Т. 4. С. 88. [Gudko, O.E., Smirnova, N.V., Lastovina, T.A., and Guterman, V.E., Binary Pt–Me/C nanocatalysts: structure and catalytic properties toward the oxygen reduction reaction, Nano-technologies in Russia, 2009, vol. 4, p. 309.]
Трипачев, О.В., Тарасевич, М.Р. Размерный эффект в электровосстановлении кислорода на золоте в широком диапазоне рН. Журн. физ. химии. 2013. Т. 87. С. 835. [Tripachev, O.V. and Tarasevich, M.R., Effect of size in oxygen electroreduction on gold over a wide range of pH, Russ. J. Phys. Chem. A., 2013, vol. 87, p. 820.]
Бригаднова, Н.С., Потапова, Г.Ф., Давыдов, Р.И., Касаткин, Э.В., Мантузов, А.В., Кузнецов, Е.В. Модифицированные углеграфитовые волокнистые материалы для электросинтеза перекисиси водорода. Изв. вузов. Сер. Химия и хим. технология. 2013. Т. 56. № 5. С. 19.
Корниенко, Г.В., Колягин, Г.А., Корниенко, В.Л., Парфенов, В.А. Исследование углеграфитовых материалов для электросинтеза Н2О2 из О2 в газодиффузионных электродах. Электрохимия. 2016. Т. 52. С. 1104. [Kornienko, G.V., Kolyagin, G.A., Kornienko, V.L., and Parfenov, V.A., Graphitized carbon materials for electrosynthesis of Н2О2 from О2 in gas-diffusion electrodes, Russ. J. Electrochem., 2016, vol. 52, p. 983.]
Yi, Y., Wang, L., Li, G., and Guo, H., A review on research progress in the direct synthesis of hydrogen peroxide from hydrogen and oxygen: noble-metal catalytic method, fuel-cell method and plasma method, Catal. Sci. Technol., 2016, vol. 6, p. 1593.
Shen, Y., Traube, M., and Wittstock, G., Detection of hydrogen peroxide produced during electrochemical oxygen reduction using scanning electrochemical microscopy, Anal. Chem., 2008, vol. 80, p. 750.
Šljukic, B., Banks, C.E., Mentus, S., and Compton, R.G., Modification of carbon electrodes for oxygen reduction and hydrogen peroxide formation: The search for stable and efficient sonoelectrocatalysts, Phys. Chem. Chem. Phys., 2004, vol. 6, p. 992.
Vaik, K., Sarapuu, A., Tammeveski, K., Mirkhalaf, F., and Schiffrin, D.J., Oxygen reduction on phenanthrenequinone-modified glassy carbon electrodes in 0.1 M KOH, J. Electroanal. Chem., 2004, vol. 564, p. 159.
Tammeveski, K., Kontturi, K., Nichols, R.J., Potter, R.J., and Schiffrin, D.J., Surface redox catalysis for O2 reduction on quinone-modifie glassy carbon electrodes, J. Electroanal. Chem., 2001, vol. 515, p. 101.
Sarapuu, A., Helstein, K., Schiffrin, D.J., and Tammeveski, K., Kinetics of oxygen reduction on quinone-modified HOPG and BDD electrodes in alkaline solution, Electrochem. and Solid-State Letters, 2005, vol. 8, p. E30.
Потапова, Г.Ф., Касаткин, Э.В., Панеш, А.М., Лозовский, А.Д., Козлова, Н.В. Электросинтез пероксида водорода на неплатиновых материалах, Электрохимия. 2004. Т. 40. С. 1390. [Potapova, G.F., Kasatkin, E.V., Panesh, A.M., Lozovskii, A.D., and Kozlova, N.V. Hydrogen peroxide electrosynthesis on nonplatinum materials, Russ. J. Electrochem., 2004, vol. 40, p. 1193.]
Pognon, G., Brousse, T., and Bélanger, D., Effect of molecular grafting on the pore size distribution and the double layer capacitance of activated carbon for electrochemical double layer capacitors, Carbon, 2011, vol. 49, p. 1340.
Тарасевич, М.Р., Бекетаева, Л.А., Ефремов, Б.Н., Загудаева, Н.М., Кузнецова, Л.Н., Рыбалка, К.В., Сосенкин, В.Е. Электрохимические свойства сажи АД-100 и АД-100, промотированной пирополимером тетра(n-метоксифенил)порфирина кобальта. Электрохимия. 2004. Т. 40. С. 612. [Tarasevich, M.R., Beketaeva, L.A., Efremov, B.N., Zagudaeva, N.M., Kuznetsova, L.N., Rybalka, K.V., and Sosenkin, V.E., Electrochemical properties of carbon black AD-100 and AD-100 promoted with pyropolymer of cobalt tetra(p-methoxyphenyl)porphyrin, Russ. J. Electrochem., 2004, vol. 40, p. 542.]
Колягин, Г.А., Корниенко, В.Л. Влияние состава смеси саж на структурные и электрохимические характеристики газодиффузионного электрода для электросинтеза пероксида водорода. Электрохимия. 2016. Т. 52. С. 213. [Kolyagin, G.A. and Kornienko, V.L., The effect of carbon black mixture composition on the structural and electrochemical characteristics of gas diffusion electrodes for electrosynthesis of hydrogen peroxide, Russ. J. Electrochem., 2016, vol. 52, p. 185.]
Wang, B., Recent development of non-platinum catalysts for oxygen reduction reaction, J. Power Sources, 2005, vol. 152, p. 1.
Гуэррини, Е., Трасатти, С. Некоторые последние достижения в понимании факторов электрокатализа. Электрохимия. 2006. Т. 42. С. 1131. [Guerrini, E. and Trasatti, S., Recent Developments in Understanding Factors of Electrocatalysis, Russ. J. Electrochem., 2006, vol. 42, p. 1017.]
Дамаскин, Б.Б., Петрий, О.А., Цирлина, Г.А. Электрохимия. М.: Химия, 2006. 672 с.
Huissoud A. and Tissot P., Electrochemical reduction of 2-ethy1-9, l0-anthraquinone (EAQ) and mediated formation of hydrogeп peroxide in a two-phase medium. Pt I: Electrochemical behaviour of EAQ on a vitreous carbon rotating disc electrode (RDE) in the two-phase medium, Appl. Electrochem., 1999, vol. 29, p. 11.
Appel, M. and Appleby, A.J., A ring-disk electrode study of the reduction of oxygen on active carbon in alkaline solution, Electrochim. Acta., 1978, vol. 23, p. 1243.
Дополнительные материалы отсутствуют.