Электрохимия, 2019, T. 55, № 2, стр. 131-140
Электроокисление метанола в щелочной среде с бинарными и тройными катализаторами на основе Ni: влияние Fe на активность катализаторов
М. Х. Назал a, b, О. С. Олакунле c, А. Аль-Ахмед d, А. С. Султан a, *, С. Ж. Зайди e
a Университет нефти и полезных ископаемых им. Короля Фахда, Центр нефтяных исследований
31261 Дахран, Королевство Саудовской Аравии
b Университет нефти и полезных ископаемых им. Короля Фахда, Центр воды и окружающей среды
31261 Дахран, Королевство Саудовской Аравии
c Университет нефти и полезных ископаемых им. Короля Фахда, Кафедра химии
31261 Дахран, Королевство Саудовской Аравии
d Университет нефти и полезных ископаемых им. Короля Фахда,
Центр преимущественных исследований в возобновляемых источниках энергии
31261 Дахран, Королевство Саудовской Аравии
e Катарский Университет
Доха, Катар
* E-mail: asultan@kfupm.edu.sa
Поступила в редакцию 16.01.2017
После доработки 23.07.2017
Принята к публикации 05.10.2017
Аннотация
Неплатиновые катализаторы электроокисления метанола с устойчивым действием представляют интерес, поскольку снижают стоимость топливных элементов с непосредственным окислением метанола. В настоящей работе приготовлены би- и триметаллические катализаторы на основе Ni на подложке из многостенных углеродных нанотрубок методом пропитки носителя по влагоемкости. Процесс окисления метанола в 1 M растворе KOH исследовали методами циклической вольтамперометрии и хроноамперометрии. В результате электрохимических исследований показано, что из всех изученных катализаторов наибольшую плотность тока (125.5 мA/cм2) и устойчивый электрохимический отклик показал катализатор CAT-3; он является весьма перспективным. Полученные катализаторы охарактеризованы с целью исследования их структурных и морфологических особенностей методами автоэлектронной сканирующей микроскопии (в сочетании с рентгеноспектральным электронно-зондовым микроанализом), просвечивающей электронной микроскопии, рентгенофазового анализа и рентгеновской фотоэлектронной спектрометрии. Полученные результаты показывают, что CAT-3 состоит из мелких равномерно распределенных частиц и является наиболее однородным. Показано, что добавка Fe к тройным катализаторам снижает содержание Cu в них и уменьшает их каталитическую активность. Все катализаторы отличаются высокой стабильностью, а CAT-3 показал самый высокий ток окисления, что можно объяснить высоким содержанием Cu.
ВВЕДЕНИЕ
До настоящего времени Pt является лучшим катализатором для топливных элементов с непосредственным окислением метанола (работающих как в кислой, так и в щелочной среде), если рассматривать их эксплуатационные характеристики в целом. Однако необходимо принимать во внимание чрезвычайно высокую стоимость Pt и отравление Pt-катализаторов частицами CO в кислой среде. Для того, чтобы справиться с проблемой отравления, были затрачены немалые усилия; однако высокая цена Pt все еще остается главным препятствием на пути коммерциализации топливных элементов [1–5]. В качестве многообещающего подхода к решению этой проблемы, по крайней мере для щелочных топливных элементов с непосредственным окислением метанола, рассматривается замена Pt и других драгоценных металлов, лежащих в основе катализаторов, на неблагородные металлы, такие как никель (Ni) [6–10] или Ni в сочетании с другими переходными металлами – медью [11], марганцем [12] и палладием [13, 14]. В топливных элементах с непосредственным окислением метанола в кислой среде был испробован ряд катализаторов на основе переходных металлов, но они не идут в сколько-нибудь существенное сравнение с катализаторами на основе Pt [15]. В щелочной среде катализаторы на основе Ni вполне устойчивы, и многие исследователи сосредоточились на таких металлах как на более дешевой альтернативе благородным металлам-катализаторам реакции окисления метанола [14, 16, 17]. Активность катализаторов на основе Ni зависит от метода их изготовления, структуры, являющейся результатом этого метода, доли Ni и общего состава такого катализатора. В работе [8] исследовали электроокисление метанола в щелочной среде, используя катализатор на основе Ni. Его готовили, диспергируя Ni на графите с помощью электроосаждения из подкисленного раствора Ni2SO4. Оказалось, что каталитическая активность C/Ni-электродов по отношению к окислению метанола зависит от количества электроосажденого Ni. Недавно [18] был приготовлен наноструктурированный бинарный Ni/Ti-электрокатализатор хлопьевидной формы; такие катализаторы продемонстрировали более высокую активность и лучшие эксплуатационные характеристики по сравнению с чистым Ni в его поликристаллической форме. С другой стороны, рассеивание каталитически активных центров по поверхности подложки существенно влияет на эффективность катализатора [19, 20]. Сплав Ni–Pd на электроде для окисления метанола в щелочном электролите был исследован в работе [21]. Изучение структурных характеристик этого электрокатализатора показало, что катализатор из Ni–Pd-сплава полностью образовал твердый раствор. Изменение d‑расстояния в решетке, вычисленное по рентгеновским дифрактограммам, находится в хорошем согласии с процентной долей Pd в сплаве. Эти катализаторы обладали активностью по отношению к окислению метанола в щелочной среде. Исследовались также оксиды типа перовскитов, как катализаторы окисления метанола и этиленгликоля для щелочных топливных элементов. В работе [17] гидроксид никеля(II) наносили на стеклоуглерод и обнаружили, что на таком электроде идет эффективное окисление метанола в щелочной среде. Опять-таки, для щелочных топливных элементов готовили тройные оксиды типа перовскита с молекулярной формулой La2– xSrxNiO4 (0 ≤ x ≤ 1) по модифицированной методике “золь–гель” с лимонной кислотой. В ходе реакции электроокисления не наблюдалось отравления таких катализаторов [22]. В работе [11] Ni и сплав Ni–Cu осаждали на стеклоуглеродный электрод в гальваностатическом режиме. Электрод, модифицированный сплавом Ni–Cu, демонстрировал более высокую плотность тока, чем электрод из чистого Ni. Во время эксперимента (регистрация циклических вольтамперограмм (ЦВА-кривых)) на поверхности электрода образовывался оксид никеля; добавка же меди существенно уменьшала образование NiOOH, обычно снижавшего эффективность.
В настоящей работе приготовлены катализаторы реакции окисления метанола на основе сплавов Ni–Cu и Ni–Cu–Fe на подложке из многостенных углеродных нанотрубок; их электрокаталитическое действие и долговременная стабильность в щелочном электролите были исследованы методами циклической вольтамперометрии (ЦВА) и хроноамперометрии. Морфологию и структуру поверхности приготовленных катализаторов характеризовали с помощью сканирующей электронной микроскопии (SEM), энергодисперсионной рентгеновской спектроскопии (EDX), автоэлектронной просвечивающей микроскопии (FE-TEM), рентгенофазового анализа и рентгеновской фотоэлектронной спектроскопии (XPS). Проанализировано влияние внедрения железа на эффективность этих катализаторов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Гидроксид калия, азотная кислота (69 мас. %), гексагидрат нитрата никеля, гидрат ацетата меди, гексагидрат хлорида железа(III) и абсолютный этанол (все квалификации “ч. д. а.”) были приобретены у компании Merck (Германия). 5%-ный раствор Нафиона был приобретен у компании Sigma (США). Многостенные углеродные нанотрубки (MWCNT) получены от Cheap Tube (США). Во всех экспериментах использовалась вода Milli-Q (18.2 MОм cм). Функционализацию MWCNT карбоновыми кислотами проводили путем кипячения с обратным холодильником в азотной и серной кислотах с использованием ранее описанной методики [23]. Сплавы Ni–Cu (биметаллический) и Ni–Cu–Fe (триметаллический) осаждали на функционализированные MWCNT методом пропитки носителя по влагоемкости. Полную нагрузку металлами установили на уровне 40 мас. % для всех образцов, но с разным процентным содержанием каждого из металлов (табл. 1). Эквивалентные количества гексагидрата нитрата никеля, гидрата ацетата меди и (если требовалось) гексагидрата хлорида железа(III) растворяли в требуемом объеме воды Millipore, в этот раствор добавляли MWCNT при воздействии ультразвука; смесь выдерживали в ультразвуковом поле (прибор 3510 BRANSON) при комнатной температуре в течение 2 ч. Полученную в результате смесь растирали в мелкий порошок и переносили в трубчатую печь (STF 15/450 CARBOLITE). Печь нагревали до 750°C в токе H2/Ar (10/90) при расходе 100 мл/мин и выдерживали при этой температуре в течение 4 ч, после чего печь охлаждали до комнатной температуры, поддерживая ту же атмосферу. Затем измеряли характеристики катализаторов и использовали их в реакции окисления метанола.
Измерение электрохимических характеристик
Гомогенные каталитические печатные краски готовили, помещая 5 мг тонкого порошка электрокатализаторов в 1 мл раствора, содержащего 80 мкл 5 мас. %-ного раствора Нафиона и 920 мкл этанола, под действием ультразвука. 20 мкл каталитической краски капали на поверхность стеклоуглеродного электрода, предварительно очищенную в разбавленной серной кислоте, а затем отполированную на ткани, смоченной суспензией оксида алюминия (зерно 5 мкм), промытую деионизованной водой, по крайней мере трижды, и высушенную на воздухе. Такие электроды затем использовали в электрохимических испытаниях в метанольных растворах, предварительно очищенных от воздуха пробулькиванием газообразного азота. ЦВА-кривые (скорость развертки потенциала 50 мВ/с) и хроноамперограммы получали в стандартной трехэлектродной ячейке с помощью потенциостата Bio-logic SAS VMP3. Стеклоуглеродный электрод (диаметр 3 мм, площадь геометрической поверхности 0.071 см2) BASi, покрытый катализатором, использовался в качестве рабочего электрода. Электродом сравнения служил Ag/AgCl-электрод (BASi), а вспомогательным электродом – Pt-фольга. Плотность тока ЦВА-кривых и хроноамперограмм (отнесенная к единице поверхности) обозначается как J.
Измерение физических характеристик
Морфологию поверхности приготовленных катализаторов Ni–Cu и Ni–Cu–Fe исследовали методом сканирующей электронной микроскопии (прибор TESCAN VELA3 GMU FIB-SEM в сочетании с энергодисперсионной рентгеновской спектроскопией, детектор Oxford, модель X‑Max, для оценки объемного состава катализаторов. Средний размер частиц сплавов металлов на поверхности MWCNT измеряли, пользуясь автоэмиссионным электронным микроскопом JEM-2100F Field (FE-TEM). Рентгенодифракционный анализ проводили на приборе Rigaku Mini Flex II Desktop с CuKα-излучением в интервале 2θ 10°–100°. Состояние окисления переходных металлов определяли с помощью фотоэлектронного спектрометра 250Xi (XPS).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Электрокаталитическая активность
Электрокаталитическую активность приготовленных катализаторов в окислении метанола определяли с помощью метода ЦВА в области потенциалов от –1.1 до 1.4 В. На рис. 1а–1в представлены ЦВА-кривые окисления 0.5 M метанола в щелочном растворе (1.0 M KOH) на поверхности стеклоуглеродного электрода, модифицированного различными электрокатализаторами. Потенциал начала окисления метанола с этими катализаторами около 0.26 В, причем с ростом содержания Cu потенциал окисления метанола сдвигается к менее положительным значениям (рис. 1a). Приготовленные в настоящей работе электрокатализаторы не дают сколько-нибудь значительного пика тока окисления при развертке потенциала в катодном направлении, что служит указанием на их стойкость против отравления CO и CO2 [24]. Большое значение отношения плотности тока окисления на “прямом” ходе развертки потенциала (If) к плотности тока окисления на обратном ходе (Ib) указывает на хорошую работу катализатора и его устойчивость по отношению к отравлению такими молекулами, как CO2, и на эффективное удаление этих адсорбированных молекул с его поверхности. В табл. 2 показано, что самый низкий потенциал окисления наблюдался приблизительно при +0.65 В (Ag/AgCl) на катализаторе CAT-3; на других катализаторах из биметаллических сплавов он близок к 0.72 В. Добавка Fe несколько повышает потенциал окисления и уменьшает плотность анодного пика тока окисления метанола. Биметаллические катализаторы показали более высокую плотность тока (J), чем триметаллические образцы. Самая высокая плотность тока (J = 125.5 мA/cм2) наблюдалась на катализаторе CAT-3, со слабым сдвигом потенциала окисления метанола в сторону отрицательных значений, в то время как самая низкая плотность тока (J = 64.31 мA/cм2) – на катализаторе CAT-5, на котором потенциал окисления выше. На катализаторе CAT-1, в котором содержание Ni выше, чем в других катализаторах, наблюдался также невысокий пик тока около +0.2 В, обязанный своим возникновением образованию гидроксида никеля (рис. 1a); на других образцах он не проявлялся [11].
Рис. 1.
Циклическая вольтамперограмма 5-го цикла при окислении 0.5 M метанола на стеклоуглеродном электроде, модифицированном биметаллическим сплавом на MWCNT(a), то же с триметаллическим сплавом, в 1 M растворе KOH (б) и на стеклоуглеродном электроде с чистой поверхностью в присутствии 0.5 M метанола (в) в сравнении с катализатором CAT-3 с 0.5 M метанолом и без метанола; Ag/AgCl-электрод сравнения, скорость развертки потенциала 50 мВ/с.
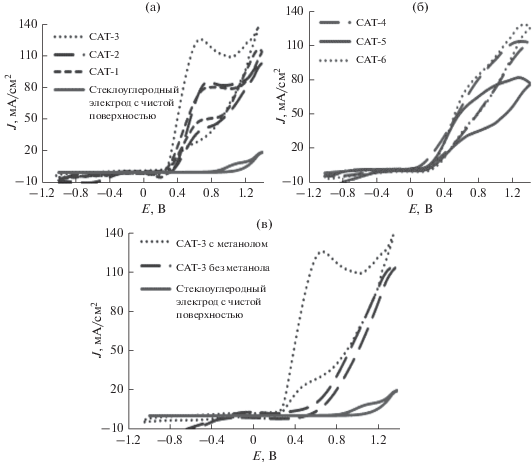
Таблица 2.
Сводка плотностей тока и потенциалы окисления метанола на приготовленных катализаторах и (для сравнения) стеклоуглеродном электроде с чистой поверхностью
| Состав | Потенциал окисления, В | Плотность тока, мA/cм2 |
|---|---|---|
| Стеклоуглерод с чистой поверхностью | 1.108 | 8.09 |
| CAT-1 | 0.721 | 79.38 |
| CAT-2 | 0.729 | 84.87 |
| CAT-3 | 0.655 | 125.50 |
| CAT-4 | 0.812 | 84.49 |
| CAT-5 | 0.841 | 66.99 |
| CAT-6 | 0.813 | 80.49 |
Долговременная стабильность и срок службы электрокатализаторов – это важные параметры для их коммерциализации. Для того, чтобы оценить электрохимическую устойчивость этих образцов катализаторов, мы применяли метод хроноамперометрии в растворах 1.0 M KOH + 0.5 M CH3OH при потенциале 0.7 В в течение 2 ч. Этот потенциал близок к потенциалу пика тока, наблюдаемого на ЦВА-кривых для большинства катализаторов, исследованных в настоящей работе. Как показывают результаты, представленные на рис. 2, все эти катализаторы устойчивы в течение всего периода испытаний; не наблюдается сколько-нибудь значительного ухудшения их работы, спада их каталитической активности. У всех электрокатализаторов из биметаллических сплавов наблюдался небольшой рост плотности тока после 10 мин работы, который составил 5–10% по отношению к исходному значению. Это можно объяснить активацией катализаторов, которая включает превращение Ni в Ni(OH)2 в щелочной среде, что в свою очередь ускоряет реакцию окисления метанола [8]. Из результатов хроноамперометрических измерений становится ясно, что во временнόй шкале электроокисления метанола на поверхности катализаторов – би- и триметаллических сплавов на MWCNT – не происходит образования каких-либо промежуточных соединений и их адсорбции на катализаторе.
Рис. 2.
Сравнение хроноамперограмм для стеклоуглеродного электрода, модифицированного Ni–Cu/MWCNT (a) и Ni–Cu–Fe/MWCNT (б), в растворе 1 M KOH + 0.5 M метанол; Ag/AgCl-электрод сравнения.

Все катализаторы оказались весьма устойчивы, причем катализатор CAT-3 показал максимальный ток окисления, что можно связать с наибольшим содержанием Cu. Поэтому последующий анализ мы сфокусировали именно на CAT-3. Как показано на рис. 3, повторяемость цикла окисления–восстановления метанола на поверхности стеклоуглеродного электрода, модифицированного катализатором CAT-3 (70% Ni–30% Cu/MWCNT) испытывали на протяжении 200 циклов. Показано, что на первых пяти циклах ток растет вследствие активации катализатора, затем медленно снижается и стабилизируется на 10-м цикле вплоть до 200-го.
Рис. 3.
1-я, 5-я, 10-я и 200-я циклические вольтамперограммы окисления 0.5 M метанола на поверхности стеклоуглеродного электрода, модифицированого CAT-3, в 1 M растворе KOH при скорости развертки потенциала 50 мВ/с.

Влияние концентрации метанола на плотность тока было исследовано в интервале концентраций от 0.1 до 2.0 M. Как и ожидалось, с ростом концентрации метанола плотность тока возрастает, причем между измеряемым током и концентрацией метанола существует хорошая корреляция (рис. 4).
Рис. 4.
Сравнение циклических вольтамперограмм, снятых при различных концентрациях метанола от 0.1 до 2.5 M в 1.0 M растворе электролита KOH на стеклоуглеродном электроде, модифицированном CAT-3, при скорости развертки потенциала 50 мВ/с. Врезка: линейная калибровочная кривая “плотность тока–концентрация метанола”.

Далее, были исследованы причины лучших эксплуатационных качеств катализатора CAT-3 и пониженной электрокаталитической активности триметаллических сплавов. SEM-микрофотография поверхности CAT-3 представлена на рис. 5, вместе с приведенными для сравнения микрофотографиями CAT-1 и CAT-4. Катализатор CAT-3 более гомогенный, с меньшими по размеру частицами, в то время как у двух других образцов просматривается слабая агломерация. У CAT-3 лучшее распределение частиц по размеру, что подтверждается и данными TEM-анализа. На рис. 6 представлены TEM-изображения образцов CAT-3 и CAT-4 (которые демонстрируют наивысшую плотность тока среди, соответственно, би- и триметаллических сплавов-катализаторов). Оба образца демонстрируют однородное распределение частиц со средним их размером, соответственно, 25 нм для CAT-3 и ~50 нм для CAT-4. Образец CAT-3 показал лучшую электрокаталитическую активность из-за более мелких частиц, равномерного их распределения и более высокого содержания Cu.
Как видно из рис. 7, рентгенограммы электрокатализаторов Ni–Cu и Ni–Cu–Fe демонстрируют их сплавной характер [25, 26]. Характерные d‑расстояния и положения пиков каждого катализатора сведены в табл. 3. Широкий пик при 2θ 25.419° относится к углероду MWCNT, а острые пики относятся к композитам Ni–Cu или Ni–Cu–Fe, что согласуется с опубликованными ранее характеристиками рентгенограмм сплавов никель–медь [27] и никель–медь–железо [26], с небольшим сдвигом пиков при увеличении процентного содержания металла. Это также указывает на образование кристаллической структуры в композитах Ni–Cu и Ni–Cu–Fe в приготовленных электрокатализаторах.
Рис. 7.
Сравнение рентгенограмм: Ni–Cu/MWCNT (a), электрокатализаторы Ni–Cu–Fe/MWCNT с различным отношением металлов, приготовленные при 750°C (б).
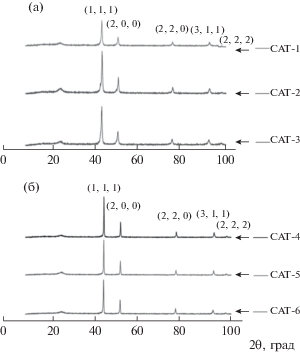
Таблица 3.
Дифракционные углы 2θ и d-расстояния в приготовленных образцах катализаторов
| No. | CAT-1 | CAT-2 | CAT-3 | CAT-4 | CAT-5 | CAT-6 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2θ, град | d, Å | 2θ, град | d, Å | 2θ, град | d, Å | 2θ, град | d, Å | 2θ, град | d, Å | 2θ, град | d, Å | |
| 1 | 25.789 | 3.452 | 25.786 | 3.452 | 25.843 | 3.445 | 25.419 | 3.501 | 25.653 | 3.470 | 25.608 | 3.476 |
| 2 | 44.319 | 2.042 | 44.426 | 2.037 | 44.219 | 2.047 | 44.376 | 2.040 | 44.309 | 2.043 | 44.191 | 2.048 |
| 3 | 51.554 | 1.771 | 51.743 | 1.765 | 51.469 | 1.774 | 51.638 | 1.769 | 51.570 | 1.771 | 51.440 | 1.775 |
| 4 | 76.048 | 1.250 | 76.134 | 1.249 | 75.874 | 1.253 | 76.031 | 1.251 | 75.863 | 1.253 | 75.699 | 1.255 |
| 5 | 92.793 | 1.064 | 92.594 | 1.066 | 92.271 | 1.068 | 92.558 | 1.066 | 92.359 | 1.068 | 92.011 | 1.071 |
| 6 | 97.804 | 1.022 | 98.223 | 1.019 | 98.067 | 1.020 | 98.087 | 1.020 | 97.777 | 1.022 | 97.745 | 1.023 |
XPS-спектры Ni, Cu и Fe представлены на рис. 8a–8в. Согласно научной XPS-библиотеке Thermo [28], имеются характеристические пики при 852.69 и 855.37 эВ для Ni 2p3/2, при 870.13 и 873.35 эВ для Ni 2p1/2 нулевого состояния окисления и для Ni+2 при 860.94 и 879.18 эВ. Это указывает на то, что образовались оба состояния окисления Ni. К нулевому состоянию окисления Cu относятся отчетливые пики при, соответственно, 932.47 и 952.59 эВ для Cu 2p2/3 и Cu 2p1/2, с пиками-сателлитами для Cu+2 при 943.54 и 963.20 эВ. XPS‑спектр Fe содержит пики при 705.21 и 711.87 эВ, соответственно, для Fe0 и Fe3+. В обоих катализаторах металлы Ni и Cu существуют в “смешанных” химических поверхностных состояниях, включающих присутствие оксидов и гидроксидов.
ЗАКЛЮЧЕНИЕ
Электрокатализаторы Ni–Cu и Ni–Cu–Fe на подложке из многостенных углеродных нанотрубок синтезированы методом пропитки носителя по влагоемкости. Сняты характеристики приготовленных катализаторов, а также оценивалась их работа в процессе окисления метанола в щелочной среде. Предварительные результаты показали, что катализатор на основе Ni–Cu/MWCNT превосходит по своим свойствам триметаллические катализаторы. Среди всех исследованных катализаторов этот образец CAT-3 показал наилучшие эксплуатационные характеристики (самую большую плотность тока). Это связано с однородными частицами и лучшим их распределением по размеру на MWCNT, как следует из данных SEM- и TEM-исследований. Показано, что Cu оказывает существенное влияние на реакцию окисления метанола в щелочной среде. Внедрение Fe в сплав уменьшает ток окисления, но, что касается долговременной стабильности, все катализаторы демонстрируют хороший токовый отклик и очень небольшое уменьшение тока окисления даже после 60 мин непрерывной работы.
Список литературы
Spătaru, T., Preda, L., Osiceanu, P., Munteanu, C., Marcu, M., Lete, C., Spătaru, N., and Fujishima, A., Electrochemical Deposition of Pt–RuOx nH2O Composites on Conductive Diamond and Its Application to Methanol Oxidation in Acidic Media, Electrocatalysis, 2016, vol. 7, p. 140.
Телли, Э., Сольмаз, Р., Кардаш, Г., Электрокаталитическое окисление метанола на Pt/NiZn-электроде в щелочной среде, Электрохимия, 2011, Т. 47, С. 865. [Telli, E., Solmaz, R., and Kardas, G., Electrocatalytic Oxidation of Methanol on Pt/Nizn Electrode in Alkaline Medium, Russ. J. Electrochem., 2011, vol. 47, p. 811.]
Susut, C. and Tong, Y.J., Size-Dependent Methanol Electro-oxidation Activity of Pt Nanoparticles with Different Shapes, Electrocatalysis, 2011, vol. 2, p. 75.
Thomas, S., Ren, X., and Gottesfeld, S., Influence of Ionomer Content in Catalyst Layers on Direct Methanol Fuel Cell Performance, J. Electrochem. Soc., 1999, vol. 146, p. 4354
Sarma, L.S., Dai Lin, T., Tsai, Y.-W., Chen, J.M., and Hwang, B.J., Carbon-Supported Pt–Ru Catalysts Prepared by The Nafion Stabilized Alcohol-Reduction Method for Application in Direct Methanol Fuel Cells, J. Power Sources, 2005, vol. 139, p. 44.
Жан Ю., Шангуан Л., Шуан Ш., Дон Ч. Электрокаталитическое окисление формальдегида и метанола на Ni(OH)2/Ni-электроде Электрохимия. 2013. Т. 49. С. 992. [Zhang, J., Shangguan, L., Shuang, S., and Dong, C., Electrocatalytic Oxidation of Formaldehyde and Methanol on Ni(OH)2/Ni Electrode, Russ. J. Electrochem., 2013, vol. 49, p. 888.]
Wang, Z., Yin, G., Zhang, J., Sun, Y., and Shi, P., Co-Catalytic Effect of Ni In The Methanol Electro-Oxidation on Pt–Ru/C Catalyst for Direct Methanol Fuel Cell, Electrochim. Acta, 2006, vol. 51, p. 5691.
Rahim, M.A., Hameed, R.A., and Khalil, M., Nickel as a Catalyst for the Electro-oxidation of Methanol in Alkaline Medium, J. Power Sources, 2004, vol. 134, p. 160.
Tehrani, R. and Ab Ghani, S., The Nanocrystalline Nickel with Catalytic Properties on Methanol Oxidation in Alkaline Medium, Fuel Cells, 2009, vol. 9, p. 579.
Risbud, M., Baxter, S., and Skyllas-Kazacos, M., Preparation of Nickel Modified Carbon Fibre Electrodes and their Application for Methanol Oxidation, Open Energy Fuels J., 2012, vol. 5, p. 9.
Danaee, I., Jafarian, M., Forouzandeh, F., Gobal, F., and Mahjani, M., Electrocatalytic oxidation of methanol on Ni and NiCu alloy modified glassy carbon electrode, Int. J. Hydrogen Energy, 2008, vol. 33, p. 4367.
Tammam, R., Fekry, A., and Saleh, M., Electrocatalytic oxidation of methanol on ordered binary catalyst of manganese and nickel oxide nanoparticles, Int. J. Hydrogen Energy, 2015, vol. 40, p. 275.
Zhao, Y., Yang, X., Tian, J., Wang, F., and Zhan, L., Methanol electro-oxidation on Ni@Pd core-shell nanoparticles supported on multi-walled carbon nanotubes in alkaline media, Int. J. Hydrogen Energy, 2010, vol. 35, p. 3249.
Amin, R., Hameed, R.A., El-Khatib, K., and Youssef, M.E., Electrocatalytic activity of nanostructured Ni and PdeNi on Vulcan XC-72R carbon black for methanol oxidation in alkaline medium, Int. J. hydrogen Energy, 2014, vol. 39, p. 2026.
Kakati, N., Maiti, J., Lee, S.H., Jee, S.H., Viswanathan, B., and Yoon, Y.S., Anode Catalysts for Direct Methanol Fuel Cells in Acidic Media: Do We Have Any Alternative for Pt or Pt–Ru? Chem. Rev., 2014, vol. 114, p. 12397.
Sheikh A.M., Abd-Alftah Khaled Ebn-Alwaled, and Malfatti, C.F., On reviewing the catalyst materials for direct alcohol fuel cells (DAFCs), Energy, 2014, vol. 1, p. 1.
Taraszewska, J. and Rosłonek, G., Electrocatalytic oxidation of methanol on a glassy carbon electrode modified by nickel hydroxide formed by ex situ chemical precipitation, J.Electroanal.l Chem., 1994, vol. 364, p. 209.
Yi, Q., Huang, W., Zhang, J., Liu, X., and Li, L., Methanol oxidation on titanium-supported nano-scale Ni flakes, Catalysis Commun., 2008, vol. 9, p. 2053.
Li, W., Liang, C., Zhou, W., Qiu, J., Zhou, Z., Sun, G., and Xin, Q., Preparation and Characterization of Multiwalled Carbon Nanotube-Supported Platinum for Cathode Catalysts of Direct Methanol Fuel Cells, J. Phys. Chem. B, 2003, vol. 107, p. 6292.
Wu, G., Chen, Y.-S., and Xu, B.-Q., Remarkable Support Effect of SWNTs in Pt Catalyst for Methanol Electrooxidation, Electrochem. Commun., 2005, vol. 7, p. 1237.
Kumar, K. S., Haridoss, P., and Seshadri, S., Synthesis and Characterization of Electrodeposited Ni–Pd Alloy Electrodes for Methanol Oxidation, Surf. Coatings Technol., 2008, vol. 202, p. 1764.
Singh, R., Sharma, T., Singh, A., Mishra, D., and Tiwari, S., Perovskite-Type La2 – xSrxNiO4 (0 ≤ x ≤ 1) as Active Anode Materials for Methanol Oxidation in Alkaline Solutions, Electrochim. Acta, 2008, vol. 53, p. 2322.
Serp, P., Corrias, M., and Kalck, P., Carbon Nanotubes and Nanofibers in Catalysis, Appl. Catalysis A: General, 2003, vol. 253, p. 337.
Jong Wan Hu, Advanced Material and Structural Engineering, London: Taylor Francis Group, 2016.
Crivello, J.-C., Nobuki, T., and Kuji, T., Thermal and Magnetic Properties of Mechanically Alloyed fcc Cu-Fe Supersaturated Solid Solutions, Mater. Transactions, 2008, vol. 49, p. 527.
Güler, E. and Güler, M., Deformation Induced Martensite characterization in Fe–30% Ni–5% Cu Alloy, J. Mining Metallurgy, Section B: Metallurgy, 2012, vol. 48, p. 259.
Sobha, J., Krishna, N., Sujatha, K., Sriveeraraghavan, S., Krishnan, R., and Natarajan, S., Electroplating of Nickel-Copper Alloys, Bull. Electrochem., 1996, vol. 12, p. 259
База данных NIST XPS, Spectrum <http://srdata.nist.gov/xps/EnergyTypeValSrch.aspx.> Последний доступ в январе 2016 г.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия





