Электрохимия, 2019, T. 55, № 2, стр. 222-232
Электрохимические свойства растворов LiAsF6 в смешанном растворителе пропиленкарбонат–ацетонитрил
Е. Ю. Тюнина a, *, М. Д. Чекунова b, **
a Институт химии растворов им. Г.А. Крестова РАН
153045 Иваново, ул. Академическая, 1, Россия
b Ивановский государственный политехнический университет
153037 Иваново, ул. 8 Марта, 20, Россия
* E-mail: tey@isc-ras.ru
** E-mail: marchekunova@mail.ru
Поступила в редакцию 07.06.2018
После доработки 05.09.2018
Принята к публикации 19.09.2018
Аннотация
Измерена удельная электропроводность растворов LiAsF6 в смешанном растворителе пропиленкарбонат (ПК)–ацетонитрил (АН) с содержанием ионофора от 0.2 до 1.4 моль/кг при температурах 283.15, 293.15, 303.15 и 313.15 К по всему составу смешанного растворителя. Концентрационная зависимость удельной электропроводности исследуемой системы описана уравнением Кастела–Амиса, за исключением растворов гексафторарсената лития в ацетонитриле. Определена энергия активации процесса переноса заряда в исследуемых растворах; наименьшие значения энергии активации характерны для растворов LiAsF6 в АН. По данным кондуктометрических измерений в разбавленной области с использованием уравнения Ли–Уитона рассчитаны значения предельной молярной электропроводности. Показано, что ассоциация ионов для растворов LiAsF6 в смесях ПК‒АН от 0.2093 до 0.9006 мольной доли АН отсутствует, и соль полностью диссоциирована в исследуемом диапазоне концентраций. Определена область электрохимической устойчивости для растворов 0.5моль/кг LiAsF6 в смешанном растворителе ПК–АН методом вольтамперометрии при 298.15 К. Потенциалы разложения в катодной области отвечают выделению лития и зависят от ион-молекулярных и межмолекулярных взаимодействий в исследуемой системе, анодные потенциалы разложения связаны с окислением растворителя.
ВВЕДЕНИЕ
Одной из фундаментальных научных задач исследований в области электрохимии растворов является развитие физико-химических основ процессов переноса на основе выявления эффектов среды на электрохимические характеристики электролитных систем в условиях изменения температуры и состава электролитов. Электропроводность и электрохимическая стабильность являются важными эксплуатационными характеристиками для неводных электролитов, применяющихся в электрохимических приборах хранения энергии [1–8]. Выбор электролитной композиции с оптимальными физико-химическими свойствами, обеспечивающими высокую электропроводность и широкое электрохимическое окно, является сложной задачей, решаемой в настоящее время в основном эмпирическими методами [2], поскольку до сих пор не создано общей теории жидкого состояния. Поиск оптимального электролита для перезаряжаемых литиевых элементов нельзя считать завершенным [9–16]. Этот процесс будет продолжаться в ходе совершенствования составляющих компонентов электролита. Как известно [1, 16, 17], применяемые в настоящее время апротонные электролиты состоят из алкилкарбонатов, простых и сложных эфиров, амидов, сульфоксидов, ионных жидкостей с растворенными сложными солями (LiPF6, LiAsF6, LiN(SO2CF3)2, LiSO3CF3 и др.). Выбор растворов LiAsF6 в пропиленкарбонате и ацетонитриле в качестве объектов исследования обусловлен, прежде всего, хорошей сольватирующей способностью, низкой вязкостью и высокой диэлектрической проницаемостью этих растворителей, влияющих на перенос заряда ионными формами, а также тем, что они представляют интерес для использования в первичных источниках тока [18–24]. Кроме того, эта соль, несмотря на некоторую токсичность, по сравнению с другими сложными солями имеет ряд преимуществ: негорюча, взрывобезопасна, термостабильна.
Индивидуальные растворители, как правило, не обеспечивают высокую электропроводность ионофора, и, в связи с этим, широко применяются смешанные растворители [2, 25–31]. Ранее [18, 32] было показано преимущество использования смешанного растворителя пропиленкарбонат–ацетонитрил в химических источниках тока по сравнению с LiClO4–ПК и LiAsF6–ПК электролитами. При этом отмечено, что LiAsF6–ПК–АН проявляет довольно высокую химическую стабильность по отношению к литию [32]. Однако не было изучено влияние состава смешанного растворителя и концентрации соли на процесс переноса заряда и электрохимическую стабильность растворов LiAsF6 в системе ПК–АН, что представляет интерес для развития теории концентрированных растворов электролитов. Понимание процессов и факторов, обеспечивающих высокие значения электрохимических свойств растворов электролитов, может способствовать созданию новых электролитов.
В центре внимания данной работы – исследование электропроводности растворов LiAsF6 в смешанном растворителе пропиленкарбонат–ацетонитрил (ПК–АН) при изменении концентрации ионофора от 0.2 до 1.4 моль/кг в области температур от 283.15 до 313.15 К, а также определение области электрохимической устойчивости электролитной системы: 0.5 моль/кг LiAsF6–смесь (ПК–АН) при разных мольных долях ацетонитрила при 298.15 К.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали соль LiAsF6, синтезированную по методике, описанной в [33]. Гексафторарсенат лития был синтезирован из металлического мышьяка (ч), фтористого водорода (ч) и гидрооксида лития (ч) [33]. Синтез включал нейтрализацию ортомышьяковой кислоты гидрооксидом лития и обработку полученного раствора плавиковой кислотой. С целью очистки от примесей полученную соль перекристаллизовывали из ацетонитрила (“х. ч.”) и сушили в вакууме в два этапа: сначала при медленном (в течение 6–7 ч) увеличении температуры от 303.15 до 363.15 К, а затем помещали в стеклянные ампулы с тефлоновыми вкладышами и выдерживали при 368.15 К в течение 24–26 ч. По окончании ампульной сушки проводили анализ соли: (а) на процентное содержание основного продукта с помощью ион-селективного электрода на [AsF6]– [34]; (б) на наличие примесей в виде гидроксоформ LiAsF5OH с помощью титрования раствором щелочи (NaOH) в присутствии индикатора – фенолфталеина: LiAsF5OH + 6NaOH → Na2HAsO4 + 4NaF + LiF + + 3H2O; (в) на содержание воды, определяемое с помощью метода кулонометрического титрования по К. Фишеру [35]. Содержание основного вещества составляло не менее 99.5 мас. %, а содержание влаги – не более 0.07 мас. %. Соль LiAsF6 хранили в запаянных ампулах в сухом боксе. Качество соли проверяли кондуктометрически путем сравнения экспериментальных значений Λ° с литературными данными [36–39].
Ацетонитрил (АН) “х. ч.” осушали фосфорным ангидридом в течение 2 сут и подвергали двухкратной перегонке, последняя проводилась над поташем [40]. Пропиленкарбонат (ПК) “х. ч.” выдерживали в атмосфере аргона над молекулярными ситами (типа 4Ǻ) в течение 2 сут и подвергали перегонке при пониженном давлении [41]. Полученные растворители проверяли на содержание воды титрованием по методу Фишера [35]. Концентрация воды в исследуемых растворителях не превышала 0.005 мас. %.
Приготовление растворов и проведение измерений выполняли без контакта с атмосферой. Растворы готовили весовым методом, используя весы “Sartorius-ME215S” (Германия) (точность взвешивания 1 × 10–5 г) с учетом приведения веса к вакууму.
Электропроводность исследуемых растворов электролитов измеряли на установке, включающей автоматический цифровой мост переменного тока Р-5083 (ООО “Приборэлектро”, Россия). В работе использовали герметичные стеклянные ячейки с двумя электродами из гладкой платины для концентрированных растворов и с тремя электродами из гладкой платины для разбавленных растворов. Калибровку ячеек проводили по водным растворам KCl, используя данные работ [42] и [43], соответственно, для разбавленных и концентрированных растворов. При определении удельной электропроводности раствора электролита учитывали поправку на электропроводность растворителя, определяемую путем прямого вычитания величины обратного сопротивления растворителя из величины обратного сопротивления исследуемых растворов. Измерения сопротивления растворов выполняли на пяти различных частотах в интервале 1–10 кГц с последующей экстраполяцией на бесконечную частоту. Для поддержания стабильности температуры с точностью лучше, чем 0.005 К, применяли метод двойного термостатирования. Относительная погрешность определения электропроводности χ составляла 0.1%.
Потенциалы разложения растворов электролитов измеряли в термостатируемой трехэлектродной ячейке, деаэрируемой аргоном при 298.15 К. В качестве рабочего (с поверхностью 0.1 см2) и вспомогательного (в виде тонкой проволоки с поверхностью 0.8 см2) электродов использовали платину, впаянную в стекло. Потенциалы рабочего электрода измеряли относительно серебряного электрода в растворе, содержащем 0.01 M AgNO3 и 0.5 M LiAsF6 в ацетонитриле (Е = = 0.305 В отн. хлоридсеребряного электрода). Вольт-амперные характеристики снимали со скоростью развертки потенциала 0.01 В/с на потенциостате ПИ-50-1 (“ЗИП”, Беларусь). Для определения потенциалов разложения электролитного раствора логарифмические участки поляризационных кривых экстраполировали до величины тока 10‒5 А/см2 [44]. Точность измерения потенциалов составляла ±2.5–5 мВ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Электропроводность в области больших разбавлений
Данные по молярной электропроводности растворов LiAsF6 в бинарном растворителе ПК–АН в области концентраций от 3.8 × 10–4 до 70 × × 10–4 моль/кг были проанализированы с использованием модели Ли–Уитона [45–47] в модификации Петибриджа [48], учитывающей диэлектрическое насыщение растворителя при его взаимодействии с электролитом. Предельные значения молярной электропроводности (Λ°) и константы ассоциации (КА) определяли на основе решения системы нелинейных уравнений:
1) зависимости молярной электропроводности от концентрации
(1)
$\begin{gathered} {\Lambda }_{i}^{{{\text{т е о р }}}} = {\alpha }\left\{ {{{{\Lambda }}^{{\text{0}}}}\left[ {{\text{1}} + {{C}_{{\text{1}}}}{\beta }k + {{C}_{{\text{2}}}}{{{{(\beta }k{\text{)}}}}^{{\text{2}}}} + {{C}_{{\text{3}}}}{{{{(\beta }k{\text{)}}}}^{{\text{3}}}}} \right] - } \right. \\ \left. { - \,\,\frac{{{\rho }k}}{{{\text{1}} + t}} \times \left[ {{\text{1}} + {{C}_{{\text{4}}}}{\beta }k + {{C}_{{\text{5}}}}{{{{(\beta }k{\text{)}}}}^{{\text{2}}}} + \frac{t}{{{\text{12}}}}} \right]} \right\}, \\ \end{gathered} $2) закона действующих масс для расчета константы ассоциации
(2)
${{K}_{{\text{A}}}} = \frac{{{\text{(1}} - {\alpha )}{{{\gamma }}_{{\text{a}}}}}}{{{{{\alpha }}^{{\text{2}}}}C{\gamma }_{ \pm }^{{\text{2}}}}},$3) выражения для расчета средних ионных коэффициентов активности
где α – степень диссоциации, q – бьеррумовская длина (параметр Бьеррума), γ – коэффициент активности, R – параметр наибольшего сближения ионов, С – молярная концентрация (M). Параметры уравнения (1) приведены в [46, 49]. Обработка экспериментальных данных заключалась в применении нелинейного метода наименьших квадратов для минимизации функции FX:(4)
${\text{FX}} = \sum\limits_{i = {\text{1}}}^n {{{{{{\left( {{\Lambda }_{i}^{{{\text{э к с п }}}} - {\Lambda }_{i}^{{{\text{т е о р }}}}} \right)}}^{2}}} \mathord{\left/ {\vphantom {{{{{\left( {{\Lambda }_{i}^{{{\text{э к с п }}}} - {\Lambda }_{i}^{{{\text{т е о р }}}}} \right)}}^{2}}} {{\text{(}}n - m{\text{)}}}}} \right. \kern-0em} {{\text{(}}n - m{\text{)}}}}} ,$Результаты расчетов приведены в табл. 1. Повышение температуры приводит к увеличению молярной электропроводности при бесконечном разведении. Предельные значения молярной электропроводности (Λ°) LiAsF6 в АН и ПК отличаются примерно на порядок. Электропроводность разбавленных растворов электролита определяется, прежде всего, изменением таких свойств системы, как вязкость и диэлектрическая проницаемость ε, и величина молярной электропроводности является результатом конкурирующего влияния этих двух факторов. Показано, что в исследуемых системах, содержащих растворители с высокими значениями ε, практически отсутствует ассоциация ионов, поскольку значения рассчитанных констант ассоциации оказались близкими к нулю в пределах ошибки во всем интервале состава смешанного растворителя. Таким образом, процессы переноса заряда и транспортные свойства исследуемой системы в области низких концентраций определяются вязкостью растворителя и ее зависимостью от температуры.
Таблица 1.
Результаты обработки кондуктометрических данных для растворов LiAsF6 в смешанном растворителе пропиленкарбонат–ацетонитрил (х2 – мольная доля ацетонитрила, σ(Λ) – стандартное отклонение молярной электропроводности)
| x2 | Т, К | Λ°, См см моль–1 | R, Ǻ | σ(Λ)*, См см моль–1 |
|---|---|---|---|---|
| 0.0000 | 253.15 | 7.634 ± 0.079 | 4.24 | 0.005 |
| 273.15 | 14.26 ± 0.18 | 4.27 | 0.028 | |
| 293.15 | 22.87 ± 0.21 | 4.31 | 0.036 | |
| 313.15 | 33.11 ± 0.15 | 4.38 | 0.022 | |
| 0.2093 | 253.15 | 12.63 ± 0.05 | 4.52 | 0.010 |
| 273.15 | 22.13 ± 0.12 | 4.55 | 0.018 | |
| 293.15 | 33.31 ± 0.08 | 4.61 | 0.025 | |
| 313.15 | 46.15 ± 0.21 | 4.68 | 0.041 | |
| 0.5070 | 253.15 | 27.34 ± 0.02 | 5.11 | 0.006 |
| 273.15 | 41.58 ± 0.15 | 5.17 | 0.027 | |
| 293.15 | 57.62 ± 0.02 | 5.25 | 0.004 | |
| 313.15 | 75.61 ± 0.16 | 5.34 | 0.023 | |
| 0.6956 | 253.15 | 44.49 ± 0.12 | 5.66 | 0.019 |
| 273.15 | 62.90 ± 0.12 | 5.71 | 0.020 | |
| 293.15 | 83.34 ± 0.06 | 5.86 | 0.010 | |
| 313.15 | 105.45 ± 0.05 | 6.00 | 0.027 | |
| 0.8023 | 253.15 | 58.63 ± 0.23 | 6.07 | 0.040 |
| 273.15 | 79.56 ± 0.07 | 6.09 | 0.005 | |
| 293.15 | 104.12 ± 0.12 | 6.26 | 0.016 | |
| 313.15 | 128.99 ± 0.18 | 6.48 | 0.022 | |
| 0.9006 | 253.15 | 76.86 ± 0.60 | 6.69 | 0.062 |
| 273.15 | 102.10 ± 0.13 | 6.80 | 0.021 | |
| 293.15 | 129.07 ± 0.43 | 6.93 | 0.270 | |
| 313.15 | 157.82 ± 0.17 | 7.08 | 0.028 | |
| 1.0000 | 253.15 | 102.62 ± 0.26 | 7.50 | 0.090 |
| 273.15 | 132.09 ± 0.19 | 7.55 | 0.043 | |
| 293.15 | 163.28 ± 0.09 | 7.63 | 0.012 | |
| 313.15 | 195.84 ± 0.14 | 7.71 | 0.026 |
* ($\sigma (y) = {{\left( {\sum {{{{{{\left( {y_{i}^{{{\text{э к с п е р }}}} - y_{i}^{{{\text{р а с ч е т }}}}} \right)}}^{{\text{2}}}}} \mathord{\left/ {\vphantom {{{{{\left( {y_{i}^{{{\text{э к с п е р }}}} - y_{i}^{{{\text{р а с ч е т }}}}} \right)}}^{{\text{2}}}}} n}} \right. \kern-0em} n}} } \right)}^{{0.{\text{5}}}}},$ где $y_{i}^{{{\text{э к с п е р }}}},$ $y_{i}^{{{\text{р а с ч е т }}}}$ – экспериментальное и расчетное значения измеряемой величины, n – число экспериментальных точек).
Электропроводность концентрированных растворов
Значения удельной электропроводности растворов LiAsF6 в смешанном растворителе ПК–АН при температурах 283.15, 293.15, 303.15 и 313.15 К приведены в табл. 2. Характер изменения удельной электропроводности растворов LiAsF6 от его концентрации в индивидуальных растворителях различен. Растворы LiAsF6 в ПК характеризуются четким максимумом на концентрационной зависимости удельной электропроводности, в то время как для растворов LiAsF6 в АН наблюдается монотонное увеличение удельной электропроводности с ростом концентрации вплоть до образования насыщенных растворов. Изотермы удельной электропроводности, для которых характерно наличие максимума электропроводности, могут быть описаны эмпирическим уравнением Кастела–Амиса [53]:
(5)
$\begin{gathered} {\chi \mathord{\left/ {\vphantom {\chi {{{\chi }_{{{\text{max}}}}}}}} \right. \kern-0em} {{{\chi }_{{{\text{max}}}}}}} = {{\left( {{m \mathord{\left/ {\vphantom {m {{{m}_{{{\text{max}}}}}}}} \right. \kern-0em} {{{m}_{{{\text{max}}}}}}}} \right)}^{а }} \times \\ \times \,\,{\text{exp}}\left[ {b{{{\left( {m--{{m}_{{{\text{max}}}}}} \right)}}^{{\text{2}}}}--am_{{{\text{max}}}}^{{--{\text{1}}}}\left( {m--{{m}_{{{\text{max}}}}}} \right)} \right], \\ \end{gathered} $Таблица 2.
Удельная электропроводность (χ × 103, См см–1) растворов LiAsF6 в бинарной системе пропиленкарбонат–ацетонитрил (х2 – мольная доля ацетонитрила)
| х2 | m, моль кг–1 | Т, К | |||
|---|---|---|---|---|---|
| 283.15 | 293.15 | 303.15 | 313.15 | ||
| 0.0000 | 0.1912 | 2.572 | 3.237 | 3.946 | 4.709 |
| 0.4006 | 3.886 | 4.993 | 6.183 | 7.474 | |
| 0.6085 | 4.296 | 5.652 | 7.136 | 8.766 | |
| 0.8123 | 4.146 | 5.603 | 7.223 | 9.030 | |
| 1.0974 | 3.442 | 4.875 | 6.519 | 8.404 | |
| 1.3901 | 2.499 | 3.765 | 5.288 | 7.032 | |
| 0.3081 | 0.3053 | 6.083 | 7.320 | 8.613 | 9.954 |
| 0.5867 | 8.242 | 10.11 | 12.08 | 14.16 | |
| 0.9694 | 8.496 | 10.74 | 13.17 | 15.80 | |
| 1.4610 | 6.475 | 8.727 | 11.27 | 14.06 | |
| 1.6000 | 5.588 | 7.749 | 10.17 | 12.91 | |
| 0.5089 | 0.2561 | 8.017 | 9.337 | 10.67 | 12.04 |
| 0.3633 | 10.05 | 11.77 | 13.52 | 15.29 | |
| 0.5307 | 12.15 | 14.36 | 16.48 | 18.95 | |
| 0.7129 | 13.36 | 15.97 | 18.62 | 21.42 | |
| 1.0810 | 13.53 | 16.62 | 19.81 | 23.19 | |
| 1.3970 | 12.61 | 15.81 | 19.18 | 22.74 | |
| 0.7438 | 0.3294 | 13.52 | 15.28 | 17.03 | 18.81 |
| 0.5322 | 17.94 | 20.42 | 22.90 | 25.41 | |
| 0.6898 | 20.09 | 23.03 | 25.97 | 28.94 | |
| 1.1527 | 21.77 | 25.53 | 29.39 | 33.29 | |
| 1.4441 | 20.63 | 24.63 | 28.79 | 33.01 | |
| 1.0000 | 0.1153 | 9.730 | 10.60 | 11.45 | 12.30 |
| 0.2255 | 18.12 | 19.78 | 21.38 | 22.97 | |
| 0.2933 | 22.22 | 24.48 | 26.47 | 28.45 | |
| 0.3835 | 27.09 | 29.64 | 32.11 | 34.52 | |
| 0.4912 | 32.00 | 35.09 | 38.09 | 40.98 | |
| 0.7257 | 39.72 | 43.73 | 47.67 | 51.48 | |
| 1.2021 | – | – | 57.93 | 63.23 | |
Таблица 3.
Параметры уравнения Кастела–Амиса для концентрированных растворов LiAsF6 в смешанном растворителе пропиленкарбонат–ацетонитрил при разных температурах (х2 – мольная доля ацетонитрила, σ(χ) – стандартное отклонение удельной электропроводности)
| х2 | Т, К | χmax × 103, См см–1 | mmax, моль кг–1 | а | b | σ(χ) × 103*, См см–1 |
|---|---|---|---|---|---|---|
| 0.0000 | 283.15 | 4.24 ± 0.05 | 0.668 ± 0.023 | 0.027 ± 0.032 | –1.024 ± 0.119 | 0.005 |
| 293.15 | 5.64 ± 0.07 | 0.732 ± 0.023 | 0.028 ± 0.034 | –0.946 ± 0.123 | 0.001 | |
| 303.15 | 7.22 ± 0.01 | 0.791 ± 0.022 | 0.029 ± 0.037 | –0.883 ± 0.128 | 0.002 | |
| 313.15 | 9.02 ± 0.01 | 0.846 ± 0.020 | 0.028 ± 0.038 | –0.839 ± 0.130 | 0.003 | |
| 0.3081 | 283.15 | 8.68 ± 0.04 | 0.818 ± 0.013 | 0.714 ± 0.101 | –0.376 ± 0.084 | 0.003 |
| 293.15 | 10.86 ± 0.04 | 0.866 ± 0.013 | 0.769 ± 0.088 | –0.282 ± 0.084 | 0.004 | |
| 303.15 | 13.24 ± 0.05 | 0.919 ± 0.015 | 0.778 ± 0.105 | –0.242 ± 0.085 | 0.008 | |
| 313.15 | 15.85 ± 0.08 | 0.969 ± 0.013 | 0.793 ± 0.090 | –0.205 ± 0.072 | 0.008 | |
| 0.5089 | 283.15 | 13.71 ± 0.03 | 0.922 ± 0.005 | 1.023 ± 0.030 | 0.078 ± 0.030 | 0.001 |
| 293.15 | 16.68 ± 0.04 | 0.996 ± 0.003 | 0.999 ± 0.019 | 0.062 ± 0.019 | 0.001 | |
| 303.15 | 19.83 ± 0.07 | 1.072 ± 0.010 | 0.945 ± 0.053 | 0.023 ± 0.052 | 0.005 | |
| 313.15 | 23.21 ± 0.09 | 1.128 ± 0.001 | 0.972 ± 0.007 | 0.043 ± 0.006 | 0.001 | |
| 0.7438 | 283.15 | 21.85 ± 0.02 | 1.063 ± 0.002 | 0.921 ± 0.013 | –0.068 ± 0.011 | 0.002 |
| 293.15 | 25.54 ± 0.03 | 1.125 ± 0.003 | 0.923 ± 0.020 | –0.052 ± 0.017 | 0.001 | |
| 303.15 | 29.90 ± 0.01 | 1.163 ± 0.009 | 0.712 ± 0.071 | –0.250 ± 0.058 | 0.001 | |
| 313.15 | 33.40 ± 0.02 | 1.246 ± 0.005 | 0.914 ± 0.016 | –0.036 ± 0.013 | 0.001 |
* ($\sigma (y) = {{\left( {{{\sum {{{{\left( {y_{i}^{{{\text{э к с п е р }}}} - y_{i}^{{{\text{р а с ч е т }}}}} \right)}}^{{\text{2}}}}} } \mathord{\left/ {\vphantom {{\sum {{{{\left( {y_{i}^{{{\text{э к с п е р }}}} - y_{i}^{{{\text{р а с ч е т }}}}} \right)}}^{{\text{2}}}}} } n}} \right. \kern-0em} n}} \right)}^{{0.{\text{5}}}}},$ где $y_{i}^{{{\text{э к с п е р }}}},$ $y_{i}^{{{\text{р а с ч е т }}}}$ – экспериментальное и расчетное значения измеряемой величины, n – число экспериментальных точек).
Температурная зависимость удельной электропроводности исследуемых растворов в интервале температур от 283.15 до 313.15 К может быть описана экспоненциальным уравнением (6) согласно теории переходного состояния [57, 58]:
(6)
$\chi = {{A}_{\chi }}\exp \left( {{{ - {{E}^{ \ne }}} \mathord{\left/ {\vphantom {{ - {{E}^{ \ne }}} {RT}}} \right. \kern-0em} {RT}}} \right),$Рис. 1.
Концентрационная зависимость энергии активации процесса переноса заряда для растворов LiAsF6 в смешанном растворителе пропиленкарбонат–ацетонитрил при разных мольных долях ацетонитрила (х2): 1 – 0; 2 – 0.308; 3 – 0.509; 4 – 0.744; 5 – 1.
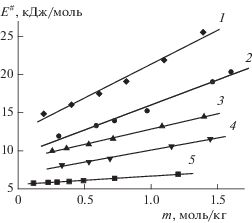
Зависимость энергии активации переноса заряда от концентрации электролита можно описать уравнением (7) [59]:
где E≠0 – вклад растворителя, а E≠el – вклад ионофора в энергию активации процесса переноса заряда, x2 – мольная доля растворенного вещества. Для нахождения параметров уравнения (7) была построена линейная зависимость E≠ = f(x2), тангенс угла наклона которой равен E≠el, а отрезок, отсекаемый на оси ординат равен E≠0. Параметры уравнения (7) приведены в табл. 4 для растворов LiAsF6 в исследуемых растворителях ПК и АН, а также в других апротонных растворителях с высокими значениями диэлектрической проницаемости, для которых характерен ион-миграционный механизм переноса заряда. Анализ данных табл. 4 показал, что наименьшими вкладами растворителя и ионофора в энергию активации процесса переноса заряда обладают растворы LiAsF6 в АН, что связано с незначительной величиной его вязкости, которая в несколько раз меньше вязкости ПК и других апротонных растворителей. Согласно ион-миграционному механизму, перенос заряда осуществляется посредством прыжков ионов из одного положения равновесия в другое под действием электрического поля [57, 58]. Данный перенос контролируется энергетическим барьером, который зависит от свойств растворителя и электролита. Важным фактором подвижности ионов является вязкость растворителя, менее вязкая среда способствует более быстрому перемещению ионов. Об этом свидетельствует симбатность изменения вязкости растворителя и величины E≠el, которые уменьшаются в ряду: АН < МП < < БЛ < ПК (табл. 4). Параметр E≠el в уравнении (7) характеризует перемещение ионов растворенного вещества в электрическом поле с учетом взаимодействий ион–растворитель.Таблица 4.
Параметры уравнения (7) для растворов LiAsF6 в апротонных растворителях
| Растворитель | η × 103, Па с (298.15 К) [3] | ε (298.15 К) [3] | E≠0 | E≠el | rcorr |
|---|---|---|---|---|---|
| Ацетонитрил | 0.341 (303.15 К) |
35.9 | 5.55 ± 0.03 | 28.16 ± 1.12 | 0.996 |
| N-метил-2-пирролидон | 1.67 | 32.2 | 11.34 ± 0.29 [60] |
41.79 ± 2.27 [60] |
0.989 |
| γ-Бутиролактон | 1.73 | 39.1 | 9.27 ± 1.01 [61] |
95.01 ± 9.72 [61] |
0.979 |
| Пропиленкарбонат | 2.53 | 64.92 | 12.13 ± 0.71 | 100.89 ± 8.93 | 0.984 |
Электрохимическая стабильность
Наряду с электропроводностью, электрохимическая стабильность является одной из важнейших характеристик новых композиций электролита, ориентированных на сочетание с катодными материалами высоковольтных литий-ионных аккумуляторов. Как известно [2, 3, 5, 16, 62], электролитные системы могут использоваться без заметного ухудшения их функциональности в ограниченных диапазонах электрического потенциала. Эти “потенциальные окна” должны быть достаточно широкими для их практического применения. Верхний и нижний пределы потенциала определяются многими факторами, такими как состав растворенного вещества и растворителя, реакции на поверхности между электрическим проводником и электролитом, примеси в электролите и др. [2, 3, 5, 16, 62]. Неводные электролиты стабильны в более широких диапазонах потенциалов, чем водные [13, 57, 63]. Мы исследовали электрохимическую устойчивость к окислению электролитной системы, содержащей 0.5 моль/кг LiAsF6 в смеси ПК–АН, с помощью вольтамперометрии. Результаты исследований потенциалов разложения исследуемых растворов при разных соотношениях со-растворителей в смеси представлены в табл. 5 и на рис. 2.
Таблица 5.
Потенциалы разложения раствора LiAsF6 (m = 0.5 моль кг–1) в бинарном растворителе пропиленкарбонат–ацетонитрил при 298.15 К (х2 – мольная доля ацетонитрила)
| х2 | Ек, В | Еа, В | Электрохимическое окно, В |
|---|---|---|---|
| 0 | –3.3 | 1.3 | 4.6 |
| 0.2 | –3.3 | 0.9 | 4.2 |
| 0.4 | –3.1 | 1.0 | 4.1 |
| 0.6 | –3.2 | 1.2 | 4.4 |
| 0.8 | –3.4 | 1.2 | 4.6 |
| 1 | –3.5 | 1.3 | 4.8 |
Рис. 2.
Анодные (а) и катодные (б) вольт-амперные кривые 0.5 моль/кг LiAsF6 растворов в смешанном растворителе пропиленкарбонат–ацетонитрил при разных мольных долях ацетонитрила (х2): 1 – 0; 2 – 0.2; 3 – 0.4; 4 – 0.6; 5 – 0.8; 6 – 1.0.

Анодный предел разложения растворов исследуемой электролитной системы определяется реакцией окисления растворителей. В результате окисления пропиленкарбоната происходит образование интермедиатов за счет раскрытия кольца в структуре растворителя [64]. Менее ясна природа реакций, происходящих при анодной поляризации растворов ацетонитрила [62].
Катодная область устойчивости электролита в апротонных растворителях ограничивается потенциалом восстановления катиона, согласно реакции: Li++1ē → Li. Системы LiAsF6–ПК и LiAsF6–АН характеризуются существенным отрицательным значением катодного потенциала разложения, что связано с разрядом ионов лития – металла, являющегося самым сильным восстановителем. Катодный предел разложения для систем LiAsF6–ПК и LiAsF6–АН составляет –3.3 и –3.5 В соответственно.
Необходимо отметить, что значение катодного потенциала разложения раствора LiAsF6 в АН более отрицательно, чем в случае раствора LiAsF6 в ПК. Это может быть связано с различной сольватацией электроактивных ионов лития, являющейся одним из факторов, определяющих электрохимические процессы. Большие по размеру ионы ${\text{AsF}}_{{\text{6}}}^{ - }$ практически не сольватируются, что обусловлено меньшей напряженностью электрического поля вокруг иона ${\text{AsF}}_{{\text{6}}}^{ - }$ по сравнению с ионом лития [63]. Часть молекул растворителя удерживается ионами лития. Координационное число ионов лития в АН (n = 4–9 [3, 65–67]) несколько выше, чем в ПК (n = 4–5 [3, 65, 66, 68]). В результате этого требуются дополнительные затраты энергии на стадию десольватации, которая предшествует электрохимической реакции восстановления ионов лития. В растворах, в которых содержание АН меняется от 0.4 до 0.6 мольной доли, процессы восстановления ионов лития происходят при более положительных значениях потенциала. В предыдущей работе [52] посредством расчета молярных объемов, молярных вязкостей и молярных емкостей нами обнаружено, что в смешанном растворителе ПК–АН при содержании ацетонитрила, равном 0.5 мольной доли, происходит образование комплекса между молекулами ПК и АН в соотношении 1 : 1. Соответственно, смещение потенциалов восстановления ионов лития в положительную сторону в смешанном растворителе с содержанием АН от 0.4 до 0.6 мольной доли может быть связано с конкуренцией двух процессов: сольватацией ионов лития и образованием комплекса между молекулами ПК и АН.
И хотя, на первый взгляд, может показаться, что полученные данные по электропроводности изучаемой системы (табл. 2) находятся в некотором противоречии с результатами исследования потенциалов разложения, тем не менее они дополняют друг друга. Согласно ион-миграционному механизму переноса заряда, электропроводность должна быть выше в тех растворах, где ион менее сольватирован, поскольку менее сольватированному иону легче совершать прыжок из одного положения равновесия в другое под действием электрического поля, в соответствии с теорией Эйринга [58]. Однако немаловажное значение имеет вязкость среды, в которой перемещаются ионы. Ион лития более сольватирован в АН, чем в ПК, исходя из катодных потенциалов разложения, но АН обладает незначительной вязкостью, а именно в 7 раз меньшей по сравнению с ПК (табл. 4), что приводит к существенному увеличению электропроводности LiAsF6 в ацетонитриле по сравнению с растворами пропиленкарбоната (табл. 2).
ЗАКЛЮЧЕНИЕ
Определены электропроводность и потенциалы разложения электролитной системы, содержащей гексафторарсенат лития в смешанном растворителе пропиленкарбонат–ацетонитрил при разных температурах. Показано, что в исследуемой системе LiAsF6/ПК–АН отсутствует ассоциация ионов в области разбавленных растворов, а процесс переноса заряда при высоких концентрациях осуществляется по ион-миграционному механизму. Повышение температуры приводит к увеличению удельной электропроводности в исследуемой области концентраций ионофора, а также молярной электропроводности при бесконечном разведении по всему составу бинарного растворителя ПК–АН. Энергия активации процесса переноса заряда для растворов LiAsF6 в смеси двух апротонных растворителей повышается при понижении содержания АН. Максимальными значениями удельной электропроводности обладают растворы ионофора в ацетонитриле вследствие незначительной динамической вязкости растворителя. Добавление АН улучшает проводимость электролита LiAsF6–ПК, а электролит LiAsF6–ПК–АН проявляет высокую химическую стабильность при контакте с литием. Исследуемые растворы характеризуются достаточно широкой областью электрохимической устойчивости, при этом наибольшей величиной электрохимического окна, равной 4.8 В, обладают растворы LiAsF6 в ацетонитриле. Таким образом, электролит LiAsF6–ПК–АН имеет в целом благоприятные характеристики и пригоден для использования в электрохимических приборах хранения энергии.
Список литературы
Xu, K., Nonaqueous Liquid Electrolytes for Lithium-based Rechargeable Batteries, Chem. Rev., 2004, vol. 104, p. 4303.
Карапетян, Ю.А., Эйчис, В.Н. Физико-химические свойства электролитных неводных растворов. М.: Химия, 1989. 256 с. [Karapetyan, Yu.A. and Eychic, V.N., Physico-chemical properties of electrolytic non-aqueous solutions (in Russian), Moscow: Khimiya, 1989. 256 p.]
Izutsu, K., Electrochemistry in Nonaqueous Solutions, Weinheim: Wiley-VCH Verlag, 2002. 415 p.
Zhang, S., Tsuboi, A., Nakata, H., and Ishikawa, T., Database and models of electrolyte solutions for lithium battery, J. Power Sources, 2001, vol. 97–98, p. 584.
Topics in Current Chemistry, Boschke, F., Ed., vol. 27, Berlin: Springer-Verlag, 1972. 270 p.
Ritchie, A.G., Recent developments and future prospects for lithium rechargeable batteries, J. Power Sources, 2001, vol. 96, p. 1.
Ярмоленко, О.В., Юдина, А.В., Хатмуллина, К.Г. Нанокомпозитные полимерные электролиты для литиевых источников тока (Обзор). Электрохимия. 2018. Т. 54. С. 377. [Yarmolenko, O.V., Yudina, A.V., and Khatmullina, K.G., Nanocomposite polymer electrolytes for lithium power sources (review), Russ. J. Electrochem., 2018, vol. 54. p. 325.]
Kitazawa, Y., Iwato, K., Kido R., Imaizumi, S., Tsuzuki, S., Shinoda, W., Ueno, K., Mandai, T., Kokubo, H., Dokko, K., and Watanabe, M., Polymer electrolytes containing solvate ionic liquids: A new approach to achieve high ionic conductivity, thermal stability, and a wide potential window, Chem. Mater., 2018, vol. 30, p. 252.
Seo, D.M., Reininger, S., Kutcher, M., Redmond, K., Euler, W.B., and Lucht, B.L., Role of mixed solvation and ion pairing in the solution structure of lithium ion battery electrolytes, J. Phys. Chem. C., 2015, vol. 119, p. 14038.
Bolloli, M., Kalhoff, J., Alloin, F., Bresser, D., Le, M.L.Ph., Langlois, B., Passerini, S., and Sanchez, J.-Y., Fluorinated carbamates as suitable solvents for LiTFSl-based lithium-ion electrolytes: Physicochemical properties and electrochemical characterization, J. Phys. Chem. C., 2015, vol. 119, p. 22404.
Ueno, K., Murai, J., Ileda, K., Tsuzuki, S., Tsuchiya, M., Tatara, R., Mandai, T., Umebayashi, Y., Dokko, K., and Watanabe, M., Li+ solvation and ionic transport in lithium solvate ionic liquids diluted by molecular solvents, J. Phys. Chem. C, 2016, vol. 120, p. 15792.
Croce, F., Appetecchi, G.B., Mustarelli, P., Quartarone, E., Tomasi, C., and Cazzanelli, E., Investigation of ion dynamics in LiClO4/EC/PC highly concentrated solutions by ionic conductivity and DSC measurements, Electrochim. Acta, 1998, vol. 43, p. 1441.
Safonov, V.A., Choba, M.A., and Petrii, O.A., The difference between interfaces formed by mechanically renewed gold and silver electrodes with acetonitrile and aqueous solutions, J. Electroanal. Chem., 2018, vol. 808, p. 278.
Ярмоленко, О.В., Тулибаева, Г.З., Петрова, Г.Н., Шестаков, А.Ф., Шувалова, Н.И., Мартыненко, В.М., Ефимов, О.Н. Экспериментальное и теоретическое исследование реакции разложения гамма-бутиролактона на поверхности литиевого электрода. Влияние слоя Li3N. Изв. АН. Сер. хим. 2010. № 3. С. 500. [Yarmolenko, O.V., Tulibaeva, G.Z., Petrova, G.N., Shestakov, A.F., Shuvalova, N.I., Martinenko, V.M., and Efimov, O.N., Experimental and theoretical investigation of γ-butyrolactone decomposition on lithium electrode surface. Effect of Li3N, Russ. Chem. Bull., vol. 59, p. 510.]
Эркабаев, А.М., Ярославцева, Т.В., Попов, С.Э., Бушкова, О.В. ИК-спектроскопическое и квантово-химическое исследование сольватации перхлорат-анионов в ацетонитриле. Журн. физ. химии. 2015. Т. 89. С. 76. [Erkabaev, A.M., Yaroslavtseva, T.V., Bushkova, O.V., and Popov, S.E., IR spectroscopic and quantum-chemical investigation of perchlorate anion salvation in acetonitrile, Russ. J. Phys. Chem. A, 2015, vol. 89, p. 76.]
Xu, K., Electrolytes and interphases in Li-ion batteries and beyond, Chem. Rev., 2014, vol. 114, p. 11503.
Тарасевич, М.Р., Андреев, В.Н., Корчагин, О.В., Трипачев, О.В. Литий-кислородные (воздушные) источники тока (современное состояние и перспективы). Физикохимия поверхности и защита металлов. 2017. Т. 53. С. 3. [Tarasevich, M.R., Andreev, V.N., Korchagin, O.V., and Tripachev, O.V., Lithium—oxygen (aerial) current sources (current state and prospects), Protection of Metals and Physical Chemistry of Surfaces, 2017, vol. 53, p. 3.]
Cedzynska, K., Parker, A.J., and Singh, P., LiAsF6 in propylene carbonate—acetonitrile for primary lithium batteries, J. Power Sources, 1983, vol. 10, p. 13.
Aravindan, V., Gnanaraj, J., Madhavi, S., and Liu, H.-K., Lithium-ion conducting electrolyte salts for lithium batteries, Chem. Eur. J., 2011, vol. 17, p. 14326.
Younesi, R., Veith, G.M., Johansson, P., Edstrombe, K., and Veggea, T., Lithium salts for advanced lithium batteries: Li–metal, Li–O2, and Li–S, Energy Environ. Sci., 2015, vol. 8, p.1905.
Henderson, W.A. Nonaqueous Electrolytes: Advances in lithium salts. Electrolytes for lithium and lithium-ion batteries, vol. 58, N.Y.: Springer, 2014. 476 p.
Gores, H.J., Barthel, J., Zugmann, S., Moosbauer, D., Amereller, M., Hartl, R., and Maurer, A., Liquid Nonaqueous Electrolytes. Handbook of Battery Materials, Weinheim: Wiley-VCH Verlag GmbH and Co. KGaA, 2011. 989 p.
Бушкова, О.В., Ярославцева, Т.В., Добровольский, Ю.А. Новые соли лития в электролитах для литий-ионных аккумуляторов (обзор). Электрохимия. 2017. Т. 53. С. 763. [Bushkova, O.V., Yaroslavtseva, T.V., and Dobrovolsky, Yu.A., New lithium salts in electrolytes for lithium-ion batteries (review), Russ J. Electrochem., 2017, vol. 53, p.677]
Ярмоленко, О.В., Юдин, А.В., Игнатова, А.А. Современное состояние и перспективы развития жидких электролитных систем для литий-ионных аккумуляторов. Электрохимическая энергетика. 2016. Т. 16. С. 155. [Yarmolenko, O.V., Yudina, A.V., and Ignatova, A.A., The state-of-the art and prospects for the development of electrolyte systems for lithium power sources, Elektrokhim. Energetika (in Russian), 2016, vol. 16, p. 155 ]
Das, B., Saha, N., and Hasra, D.K., Ionic association and conductances of some symmetrical tetraalkylammonium salts in methanol, acetonitrile, and methanol (1) + acetonitrile (2) mixtures at 298.15 K, J. Chem. Eng. Data, 2000, vol. 45, p. 353.
Sengwa, R.J., Khatri, V., Choudhary, Sh., and Sankhla, S., Temperature dependent static dielectric constant and viscosity behaviour of glycerol-amide binary mixtures: Characterization of dominant complex structures in dielectric polarization and viscous flow processes, J. Mol. Liq., 2010, vol. 154, p. 117.
Iloukhani, H. and Rakhsi, M., Excess molar volumes, and refractive indices for binary and ternary mixtures of {cyclohexanone (1) + N,N-dimethylacetamide (2) + N,N-diethylethanolamine (3)} at (298.15, 308.15, and 318.15) K, J. Mol. Liq., 2009, vol.149, p. 86.
Barthel, J., Neueder, R., and Roch, H., Density, relative permittivity, and viscosity of propylene carbonate + dimethoxyethane mixtures from 25°C to 125°C, J. Chem. Eng. Data, 2000, vol. 45, p. 1007.
Kinart, C.M., Maj, M., Ćwiklińska, A., and Kinart, W.J., Densities, viscosities and relative permittivities of some n-alkoxyethanols with sulfolane at T = 303.15 K, J. Mol. Liq., 2008, vol. 139, p. 1.
Neale, A.R., Schütter, Ch., Wilde, P., Goodrich, P., Hardacre, Ch., Passerini, S., Balducci, A., and Jacquemin, J., Physico-chemical characterization of binary mixtures of 1-butyl-1-methylpyrrolidinium bis{(trifluoromethyl)sulfonyl}imide and aliphatic nitrile solvents as potential electrolytes for electrochemical energy storage applications, J. Chem. Eng. Data, 2017, vol. 62, p. 376.
Cecchetto, L., Salomon, M., Scrosati, B., and Croce, F., Study of a Li-air battery having an electrolyte solution formed by a mixture of an ether-based aprotic solvent and an ionic liquid, J. Power Sources, 2012, vol. 213, p. 233.
Parker, A.J., Singh, P., and Fraze, E.J., The cycling behaviour and stability of the lithium electrode in propylene carbonate and acetonitrile electrolytes, J. Power Sources,1983, vol.10, p. 1.
Афанасьев, В.Н., Зятькова, Л.А., Тюнина, Е.Ю., Чекунова, М.Д. Сольвататционные взаимодействия в растворах гексафторарсената лития в пропиленкарбонате. Электрохимия. 2001. Т. 37. С. 56. [Afanas’ev, V.N., Zyat’kova, L.A., Tyunina, E.Yu., and Chekunova, M.D., Solvation interactions in solutions of lithium hexafluoroarsenate in propylene carbonate, Russ. J. Electrochem., 2001, vol. 37, p. 46.]
Afanasyev, V.N. and Zyatkova, L.A., Speed of sound, densities, and viscosities for solutions of lithium hexafluoroarsenate in tetrahydrofuran at 283.15, 298.15 and 313.15 K, J. Chem. Eng. Data, 1996, vol. 41, p. 1315.
Ничуговский, Г.Ф. Определение влажности химических веществ. Л.: Химия, 1977. 200 с. [Nichugovskiy, G.F., Determination of of the humidity of chemicals (in Russian), L.: Khimiya, 1977. 200 p.]
Hopkins, H.P., Jr., Jahagirdar, D.V., and Norman, A.B., Conductance studies of lithium salt – acetonitrile solutions at 25°C, J. Solution Chem., 1979, vol. 8, p. 147.
Salomon, M., Conductance of soltions of lithium bis(trifluoromethanesulfone)imide in water, propylene carbonate, acetonitrile and methyl formate at 25°C, J. Solution Chem., 1993, vol. 22, p. 715.
Salomon, M. and Plichta, E., Conductivities and ion association of 1 : 1 electrolytes in mixed aprotic solvents, Electrochim. Acta, 1983, vol. 28, p. 1681.
Barthel, J., Gores, H.-J., Carlier, P., Feuerlein, F., and Utz, M., The temperature dependence of the properties of electrolyte solutions. V. Determination of the glass transition temperature and comparison of the temperature coefficients of electrolyte conductance and solvent viscosity of propylene carbonate solutions, Ber. Bunsenges. Phys. Chem., 1983, vol. 87, p. 436.
Гордон, А., Форд, Р. Спутник химика. М.: Мир, 1976. 541 с. [Gordon, A.J. and Ford, R.A., The chemist’s companion. A handbook of practical data, techniques, and references, N.Y.–London: Wiley, 1972. 541 p.]
Тюнина, Е.Ю., Чекунова, М.Д., Афанасьев, В.Н. Электрохимические характеристики растворов тетрафторбората тетраэтиламмония в пропиленкарбонате. Электрохимия. 2013. Т. 49. С. 509. [Tyunina, E.Yu., Afanasie, V.N., and Chekunova, M.D., Electrochemical characteristics of propylene carbonate solutions of tetraethylammonium tetrafluoroborate, Russ. J. Electrochem., 2013, vol. 49, p. 453.]
Barthel, J., Feuerlein, F., Neueder, N., and Wachter, R., Calibration of conductance cells at various temperatures, J. Solution Chem., 1980, vol. 9, p. 209.
Jones, G. and Prendergast, M.J., The measurement of the conductance of electrolytes. VIII. A redetermination of the conductance of Kohlrausch’s standard potassium chloride solutions in absolute units, J. Amer. Chem. Soc., 1937, vol. 59, p. 731.
Фиалков, Ю.Я., Грищенко, В.Ф. Электровыделение металлов из неводных растворов. Киев: Наук. думка, 1985. 240 с. [Fialkov, Yu.Ya. and Grischenko, V.F., Electrovedelenie metallov iz nevodnih rastvorov (in Russian), Kiev: Nauk. dumka, 1985. 240 p.]
Lee, W.H. and Wheaton, R.J., Conductance of symmetrical, unsymmetrical and mixed electrolytes. Part.1. Relaxation terms, J. Chem. Soc. Faraday Trans. 2, 1978, vol. 74, p. 743.
Lee, W.H. and Wheaton, R.J., Conductance of symmetrical, unsymmetrical and mixed electrolytes. Part 2. Hydrodynamic terms and complete conductance equation, J. Chem. Soc. Faraday Trans. 2, 1978, vol. 74, p. 1456.
Lee, W.H. and Wheaton, R.J., Conductance of symmetrical, unsymmetrical and mixed electrolytes. Part 3. Examination of new model and analysis of data for symmetrical electrolytes, J. Chem. Soc. Faraday Trans. 2, 1979, vol. 75, p. 1128.
Pethybridze, A.D. and Taba, S.S., Precise conductimetric studies on aqueous solutions of 2:2 electrolytes. Part 2. Analysis of data for MgSO4 in terms of new equations from Fuoss and from Lee and Wheaton, J. Chem. Soc. Faraday Trans. Part 1, 1980, vol. 76, p. 368.
Артемкина, Ю.М., Ворошилова, Ю.В., Плешкова, Н.В., Калугин, О.Н., Седдон, К.Р., Щербаков, В.В. Ассоциация некоторых ионных жидкостей в ацетонитриле по данным кондуктометрических измерений. Успехи в химии и хим. технологии. 2008. Т. 22. С. 11. [Artemkina, Yu.M., Voroshilova, Yu.V., Pleshkova, N.V., Kalugin, O.N., Seddon, K.R., and Shcherbakov, V.V., Association of some ionic liquids in acetonitrile according to conductometric measurements (in Russian), Uspekhi in khimii and khim. tekhnologii, 2008, vol. 22, p. 11.]
Tyunina, E.Yu., Afanasiev, V.N., and Chekunova, M.D., Electroconductivity of tetraethylammonium tetrafluoroborate in propylene carbonate at various temperatures, J. Chem. Eng. Data, 2011, vol. 56, p. 3222.
D’Arprano, A., Sesta, B., Mauro, V., and Salomon, M., Interactions between tetra(trisfluoromethylsulfonyl)-1,4,8,11-tetraazocyclotetradecane and perchlorate anion in propylene carbonate, nitromethane, acetonitrile, and tetrahydrofuran, J. Solution Chem., 2000, vol. 29, p. 1075.
Тюнина, Е.Ю., Чекунова, М.Д. Физико-химические свойства бинарных растворов пропиленкарбонат-ацетонитрил в интервале 253.15–313.15 К. Журн. физ. химии. 2017. Т. 91. С. 845. [Tyunina, E.Yu. and Chekunova, M.D., Physicochemical properties of binary solutions of propylene carbonate–acetonitrile in the range of 253.15–313.15 K, Russ. J. Phys. Chem. A, 2017, vol. 91, p. 894.]
Casteel, J.F. and Amis, E.S., Specific conductance of concentrated solutions of magnesium salts in water-ethanol system, J. Chem. Eng. Data, 1972, vol. 17, p. 55.
Moumouzias, G., Ritzoulis, G., Siapkas, D., and Terzidis, D., Coparative study of LiBF4, LiAsF6, LiPF6, and LiClO4 as electrolytes in propylene carbonate–diethyl carbonate solutions for Li/LiMn2O4 cells, J. Power Sources, 2003, vol. 122, p. 57.
Berhaut, C.L., Porion, P., Timperman, L., Schmidt, G., Lemordant, D., and Anouti M., LiTDI as electrolyte salt for Li-ion batteries: transport properties in EC/DMC, Electrochim. Acta, 2015, vol. 180, p. 778.
Артемкина, Ю.М., Щербаков, В.В. Электропроводность систем ассоциированный электролит–вода. Журн. неорг. химии. 2010. Т. 55. С. 1573. [Artemkina, Y.M. and Shcherbakov, V.V., Electrical conductivity of associated electrolyte-water systems, Russ. J. Inorg. Chem., 2010, vol. 55, p. 1487.]
Erdey-Gruz, T., Transport Phenomena in Aqueous Solutions, Budapest: Akademiai Kiado, 1974. 420 p.
Глесстон, С., Лейдер, К., Эйринг, Г. Теория абсолютных скоростей реакций. М.: Изд-во иностр. лит-ры, 1948. 583 с. [Glasstone, S., Laidler, K., and Eyring, H., The theory of rate processes, N.Y.: McGraw-Hill, 1941. 580 p.]
Chagnes, A., Carre, B., Willman, P., and Lemordant, D., Ion transport theory of nonaqueous electrolytes. LiClO4 in γ-butyrolactone: the quasi lattice approach, Electrochim. Acta, 2001, vol. 46, p. 1783.
Тюнина, Е.Ю., Чекунова, М.Д. Электропроводность растворов LiAsF6 в апротонных растворителях с различной диэлектрической проницаемостью. Изв. вузов. Химия и хим. технология. 2015. Т. 58. С. 112. [Tyunina, E.Yu., and Chekunova, M.D., Electroconductivity of solutions of LiAsF6 in aprotic solvents with different permittivity, Izv. Vyssh. Uchebn. Zaved. Khim. Khim. Tekhnol., 2015, vol. 58, p.112.]
Афанасьев, В.Н., Зятькова, Л.А., Чекунова, М.Д. Температурная зависимость транспортных свойств и ион-молекулярные формы LiAsF6 в γ-бутиролактоне. Электрохимия. 2002. Т. 38. С. 876. [Afanas’yev, V.N., Zyat’kova, L.A., and Chekunova M.D., Temperature dependence of transport properties and ion-molecular forms of LiAsF6 in γ-butyrolactone, Russ. J. Electrochem., 2002, vol. 38, p. 781.]
Электрохимия металлов в неводных растворах. Колотыркин, Я.М., ред. М.: Мир, 1974. 440 с. [Electrochemistry of metals in non-aqueous solutions (in Russian), Kolotirkin, Ya.M., Ed., M.: Mir, 1974. 440 p.]
Измайлов, Н.А. Электрохимия растворов. М.: Химия, 1966. 576 с. [Izmailov, N.A., Electrochemistry of solutions (in Russian), Moscow: Khemiya, 1966. 576 p.]
Kanamura, K., Umegaki, T., Ohashi, M., Toriyama, Sh., Shiraishi, S., and Takehara, Z., Oxidation of propylene carbonate containing LiBF4 or LiPF6 on LiCoO2 thin film electrode for lithium batteries, Electrochim. Acta, 2001, vol. 47, p. 433.
Yuan, K., Bian, H., Shen, Y., Jiang, B., Li, J., Zhang, Y., Chen, H., and Zheng, J., Coordination number of Li+ in nonaqueous electrolyte solutions determined by molecular rotational measurements, J. Phys. Chem. B, 2014, vol. 118, p. 3689.
Ohtaki, H., Structural studies on salvation and complexation of metal ions in nonaqueous solution, Pure. Appl. Chem., 1987, vol. 59, p. 1143.
Spångberg, D., Cation solvation in water and acetonitrile from theoretical calculations, Acta Universitatis Upsaliensis. Uppsala, 2003, 50 p.
Iida, M., Mogi, K., and Yokoyama, H., Conductivity and solvation of Li+ ions of LiPF6 in propylene carbonate solutions, J. Phys. Chem. B, 2000, vol. 104, p. 5040.
Дополнительные материалы отсутствуют.


