Электрохимия, 2019, T. 55, № 6, стр. 757-768
Анодные процессы в концентрированном растворе метансульфокислоты на платиновом электроде
М. А. Ахмедов a, b, *, Ш. Ш. Хидиров b, **
a Аналитический центр коллективного пользования ДНЦ РАН
367025 Махачкала, ул. М. Гаджиева, 45, Россия
b ФБГОУ ВО Дагестанский государственный университет, Химический факультет
367000 Махачкала, ул. М. Гаджиева, 43-а, Россия
* E-mail: muhamadahmedov@mail.ru
** E-mail: khidirovdgu@mail.ru
Поступила в редакцию 02.10.2018
После доработки 27.11.2018
Принята к публикации 22.01.2019
Аннотация
В данной статье, методами вольтамперометрии изучены некоторые особенности процессов, протекающих при поляризации гладкого платинового электрода в 10.0 М растворе метансульфокислоты (СH3SO3H) в области высоких анодных потенциалов. На циклических вольтамперометрических кривых гладкой платины в концентрированном растворе МСК наблюдаются хорошо выраженные волны окисления при потенциалах Е = 2.0–2.5 В и Е = 2.9–3.7 В. Показано, что электрохимические процессы в пределах потенциалов Е = 2.0–2.5 В связаны с разрядом молекул воды, а широкая волна окисления при Е = 2.9–3.7 В – с образованием перекисных соединений. На основании проведенных электрохимических измерений и анализа продуктов электроокисления при препаративном электролизе было установлено образование сложного сераорганического пероксидного соединения – CH3S(O)2OOS(O)2CH3 – бис(метансульфонил) пероксида (др. название диметилдисульфопероксид, или диметансульфонилпероксид, или пероксида димезилат). Предложен механизм процессов анодного окисления в концентрированном растворе СH3SO3H. Предполагается, что образование перекисного соединения связано с участием мезильных радикалов, которые димеризуются на гладком платиновом аноде и затем десорбируются в объем раствора.
ВВЕДЕНИЕ
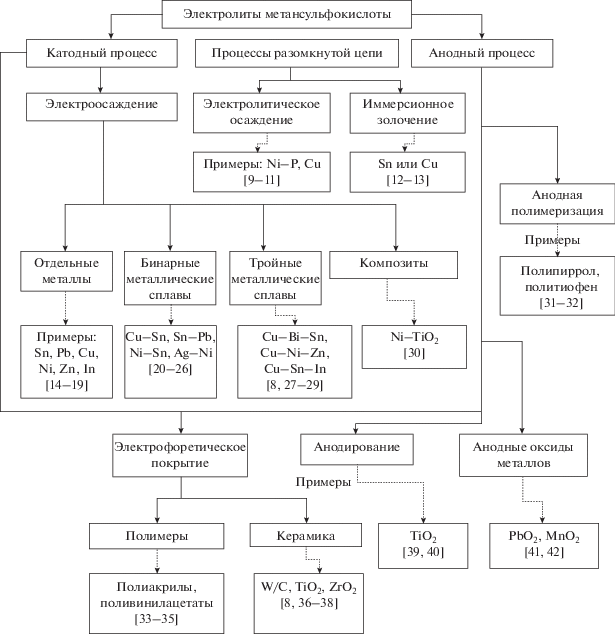
Метансульфокислота (МСК) – CH3SO3H – сильная алифатическая кислота, ее можно рассматривать как производное серной кислоты, в молекуле которой одна гидроксильная группа замещена на метильный радикал (CH3–). Такое замещение приводит к некоторым ее сходствам и отличиям в сравнении с H2SO4 по физическим и химическим свойствам [1]. Благодаря своим способностям растворять многие металлы, в том числе некоторые d-металлы с образованием водорастворимых солей, обладающих хорошей ионной проводимостью, МСК может быть использована в процессах электрохимического рафинирования (Ni, Sn, Cr, Cu, Pb и др.) и осаждения для получения широкого спектра покрытий для различных материалов, включая сплавы металлов, пленки из пористого оксида металла, проводящих полимеров и многих других композитов [1–8]. На рис. 1 приведена схема использования электролитных систем на основе метансульфокислоты для получения различных покрытий и материалов, дополненная соответствующими литературными ссылками.
Рис. 1.
Электролитные системы на основе метансульфокислоты для получения различных покрытий металлов, материалов и пленок.
В работах исследователей [43–47] представлены результаты использования электролитов на основе метансульфокислоты и ее производных в различных химических источниках тока.
Из работ [48–50] известно, что окно электрохимической стабильности МСК на электродах, выполненных из металлов платиновой группы, наблюдается в пределах потенциалов ±2.0 В (о. в. э.), а это позволяет ее использовать в качестве фонового электролита и одновременно растворителя для изучения электродных процессов в растворах органических и неорганических соединений [51–53]. В связи с этим, в настоящей работе изучены электродные процессы в 10.0 М растворе МСК, протекающие при поляризации гладкой платины в области высоких анодных потенциалов. Кроме того, анодные процессы в концентрированных растворах МСК на гладком платиновом электроде в области высоких анодных потенциалов (более 2.0 В) представляют интерес с целью выяснения механизма ее электроокисления и сопоставления с аналогичными процессами в растворе концентрированной серной кислоты.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Анодное окисление в концентрированном растворе метансульфокислоты изучено методами вольтамперометрии на потенциостате IPC – Pro MF (ООО “НТФ Вольта”, Россия) и препаративного электросинтеза. Все измерения проведены в трехэлектродной ячейке, относительно обратимого водородного электрода сравнения (о. в. э.) в том же растворе (Pt, H2/H+). Рабочим и вспомогательным электродами служила гладкая платина (Pt). Выбор гладкой платины в качестве анода обусловлен тем, что она обладает высоким перенапряжением выделения кислорода и устойчива при высоких положительных потенциалах. Истинная поверхность рабочего электрода, определенная методом кривых заряжения [54, 55] по водородному участку (0.03–0.4 В), в гальваностатическом режиме в 0.5 М растворе H2SO4 в среде инертного газа – аргона (Ar), составляла 0.057 см2.
Препаративный электросинтез осуществляли на платиновых электродах с геометрической поверхностью 1 см2 при контролируемом потенциале в диафрагменном электролизере с использованием выпрямителя TYPE:TR-9252. Диафрагмой служила перфторированная катионитовая мембрана марки МКФ. Температура при стационарном электролизе поддерживалась 40–45°С.
В качестве объекта исследования в работе использована метансульфокислота марки BASF. Все растворы готовили на бидистиллированной и деионизованной воде.
Для анализа метансульфонат-аниона в концентрированном растворе МСК была использована система капиллярного электрофореза (КЭ) “Капель-105М” (ООО “ЛЮМЭКС”, РФ) по методике [56]. В табл. 1 приведены все основные характеристики режима работы системы капиллярного электрофореза, использованного при анализе метансульфонат-аниона.
Таблица 1.
Режим работы на “Капель-105” для анализа метансульфонат-аниона
| Буфер | 5 мМ CrO3, 20 мМ ДЭА, 1.65 ЦТАБ |
|---|---|
| Проба | Модельный раствор МСК |
| Капилляр | Lэфф/Lобщ= 50 см, ID = 75 мкм |
| Ввод пробы | 300 мбар × с |
| Напряжение | –17 кВ |
| Детектирование | 364 нм, косвенное |
| Температура | 20°С |
Обработка результатов измерения полученных электрофореграмм осуществлялась с помощью программы МультиХром 1.5 (ООО Амперсенд, РФ).
Определение содержания активного кислорода при анализе продуктов окисления в 10.0 М МСК проводилось методом йодометрического титрования [57].
Для измерения спектров КРС анализируемый образец помещали в кварцевую ампулу, из которой откачивали воздух с помощью вакуумного насоса, а затем, заполнив ампулу аргоном, ее запаивали. Спектры КРС для CH3SO3H до и после электролиза снимали на приборе DXR Smart Raman Research (Thermo Scientific, США) с лазерным возбуждением (λ = 532 нм и мощностью 10 мВт), спектральный диапазон измерения 50–3500 см–1 с разрешением 3–5 см–1, время интегрирования каждого скана 20 с.
ИК-спектры снимали на ИК-фурье-спектрометре VERTEX70 (Bruker, Германия) с помощью приставки НПВО, в качестве материала призмы использовался ZnSe. Спектральное разрешение прибора 2 см–1, число сканов – 32. Для снятия ИК-спектров анолит после электролиза нейтрализовали щелочью до рН 7.
Анализ структуры исходной метансульфокислоты и продукта ее электроокисления был проведен методом ядерно-магнитного резонанса (ЯМР) с использованием спектрометра AVANCE III 500MHz, фирмы “Bruker” (Германия). Исследуемые образцы предварительно смешивали с дейтерированным растворителем ДМСО-d6 – 2.5 мл, где затем их запаивали и помещали в соответствующие пробирки (трубки) для ЯМР-анализа.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
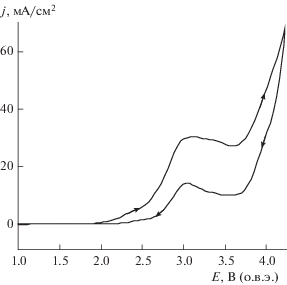
На рис. 2 представлены циклические вольтамперограммы (ЦВА) гладкого платинового электрода в 10.0 М растворе МСК в области высоких анодных потенциалов. На ЦВА (рис. 2), полученной со скоростью развертки потенциала 50 мВ/с, видно, что в пределах 2.0–2.5 и 2.9–3.7 В наблюдаются четко выраженные две волны окисления, причем вторая волна имеет широко выраженное плато.
Рис. 2.
ЦВА кривые гладкого Pt-электрода в растворе 10.0 M CH3SO3H, снятые при скорости развертки потенциала 50 мВ/с.
Как видно на рис. 3, с ростом скорости развертки потенциала максимумы токов обеих волн также возрастают. Стоит отметить, что первая волна окисления в области анодных потенциалов 2.0–2.5 В проявляется как в разбавленных [49], так и в концентрированных растворах МСК.
Рис. 3.
ЦВА кривые гладкого Pt-электрода в растворе 10.0 M CH3SO3H. Скорость развертки потенциала, мВ/с: 5 (1), 50 (2), 100 (3), 200 (4), 500 (5).

Первая волна окисления при потенциалах 2.0–2.5 В может быть обусловлена разрядом молекул воды с образованием кислородсодержащих реакционноспособных OH- и О-частиц (1–4).
(1)
${{{\text{H}}}_{{\text{2}}}}{\text{O}} - {\bar {e}} = {\text{O}}{{{\text{H}}}_{{{\text{ads}}}}} + {{{\text{H}}}^{ + }},$(3)
${\text{O}}{{{\text{H}}}_{{{\text{ads}}}}} - {\bar {e}} = {{{\text{O}}}_{{{\text{ads}}}}} + {{{\text{H}}}^{ + }},$Вторая волна при потенциалах более 2.5 В, по-видимому, связана с разрядом метансульфонат-анионов.
Следует отметить, что на рис. 2 анодный пик в области 3.0 В с ростом развертки потенциала также смещается в катодную сторону. Данное смещение имеет необратимый характер и проявляется в координатах: E, мB–lg v, мB/c и j, мA/cм2–$\sqrt v ,$ мB/c (рис. 4).
Рис. 4.
Зависимости потенциала максимума анодного тока от скорости развертки потенциала в координатах Ep–lg v (a) и плотности тока jp–$\sqrt v $ (б), полученные из ЦВА гладкого Pt-электрода в 10.0 M растворе МСК в пределах анодных потенциалов 2.94–3.25 В.

Из работы [58] о влиянии димеризации электродных продуктов на процессы с обратимой электрохимической стадией известно, что удаление продукта обратимой электрохимической реакции из приэлектродного пространства за счет химической реакции, наряду с диффузией, приводит к сдвигу потенциалов в соответствии с уравнением Нернста. По-видимому, в области 3.0 В, помимо самого процесса димеризации молекул МСК, происходит химическая реакция, связанная с разложением пероксида водорода на поверхности гладкого платинового электрода, что частично приводит к смещению анодного пика в катодную сторону 50–100 мВ.
(5)
$2{{{\text{H}}}_{2}}{{{\text{O}}}_{2}}\xrightarrow{{{\text{Pt}}}}2{{{\text{H}}}_{2}}{\text{O}} + {{{\text{O}}}_{2}}.$Для проверки приведенных выше предположений нами был проведен препаративный электролиз при выбранных потенциалах, в диафрагменном электролизере с использованием перфторированной катионитовой мембраны (МКФ) при количестве электричества 0.7 A ч (табл. 2). По окончании электролиза, проведенного при потенциале 3.0 В, обнаружено, что раствор анолита становится вязким, пенистым и слегка желтеет (рис. 5а). При охлаждении до –14°С (рис. 5б) анолит кристаллизуется.
Таблица 2.
Данные препаративного электролиза
| Образец № | С(СH3SO3H), М | Е, В | Q, A ч | Выход по току по содержанию активного кислорода, % |
|---|---|---|---|---|
| 1 | 10.0 | 2.2 | 0.7 | 14.0 |
| 2 | 10.0 | 3.0 | 0.7 | 47.0 |
Количественное определение выхода по току пероксидного соединения по содержанию активного кислорода проводили йодометрическим методом, а содержание метансульфонат-аниона – методом капиллярного электрофореза (рис. 6). Погрешность измерений выхода по току составляет 2–5%. На кривой 1 – электрофореграммы исходной метансульфокислоты (рис. 6), в начальном участке до 2.5 мин имеется сильный спад связанный с тем, что в процессе регистрации сигналов капиллярного электрофореза используется УФ-детектор, который очень чувствителен к pH среде анализируемого образца. В данном случае pH среда исходной МСК меньше 1, что и обуславливает данный спад. В методиках анализа опубликованных [56] от фирмы Люмэкс, имеется рекомендации в которых также указывается, что в интервале от 1 до 2.5 мин никакой регистрации сигнала не происходит, т.к. это время обусловлено протеканием в капиллярной колонки равновесных процессов между буфером и анализируемым образцом в УФ-области.
Рис. 6.
Электрофореграммы в 10.0 М растворе СH3SO3H до (1) и после (2) электролиза при потенциале Е = 3.0 В.

Результаты количественного определения продукта электроокисления МСК при Е = 2.9–3.7 В представлены в табл. 2.
Низкий выход пероксидного соединения (табл. 2), по-видимому, может быть связан с протеканием сопряженной реакции выделения кислорода.
Полученный конечный продукт идентифицировали методом КРС-спектроскопии. На КРС-спектрах исходной метансульфокислоты (рис. 7, спектр 1) и продуктов, полученных после электролиза (рис. 7, спектр 2), видно, что функциональные молекулярные фрагменты колебаний при рассеянии таких групп, как S–O, O=S=O, C‒S, CH, CH2, остаются фактически без изменения (табл. 3). Однако, в области 150–1350 см–1 и 2300–3400 см–1 после электролиза (рис. 7, спектр 2), наблюдаются очень широкие полосы рассеянного света в сравнении с полосами исходной метансульфокислоты (рис. 7, спектр 1). Данные полосы в КРС-спектрах могут быть обусловлены наличием люминесцирующих групп, которые характерны для органических соединений, содержащих в составе перекисную О–О группу [59].
Таблица 3.
Данные расшифровки КР-спектров МСК после электролиза
| Функцион. группа | Область, см–1 | Функцион. группа | Область, см–1 | Функцион. группа | Область, см–1 |
|---|---|---|---|---|---|
| С–Н | 3000–3100 | O=S=Oдеф | 950–1200 | S=O | 450–550 |
| СН2 | 2850–2950 | O=S=O | 850–900 | S=Oдеф | 550–650 |
| H2O | 1550–2000 | C–S=O | 1500–1350 | C–S–O | 50–150 |
| O–O | 2300–3300 | S–O–O–S | 150–1450 |
Сравнительный анализ спектров ИК-поглощения исходной МСК и ее анолита (рис. 8), полученного после электролиза, показал, что в области поглощения 2977 см–1 наблюдается широкая полоса, характерная для ассоциированных молекул ОН-группы, а в области поглощения 988–1000 и 1150–1250 см–1 исчезают полосы поглощения S–ОН, характерные для исходной МСК [60, 61], в то же время для образца МСК после электролиза заметно проявляются полосы поглощений, характерные для перекисной группы (О‒О) в области поглощения 3400–3450 и 3550–3650 см–1.
Для установления структуры продукта электроокисления метансульфокислоты в области потенциалов 2.9–3.7 В, нами был проведен ЯМР-анализ (рис. 9) в присутствии растворителя – ДМСО-d6. Спектр 1H-ЯМР (500 MHz, DMSO-d6) исходной МСК (рис. 9, спектр 1) имеет химический сдвиг (δ), м.д.: 2.38 (3H, CH3-синглет); 8.38 (1H, ОН-синглет). Спектр 1H-ЯМР (500 MHz, DMSO-d6) продукта анодного окисления МСК (рис. 9, спектр 2) имеет химический сдвиг δ, м.д.: 2.50 (3H, CH3-синглет); 9.40–9.43 (1H, ОН-синглет). Появление протонного сигнала (9.40–9.43 м.д.) и падение его интенсивности в слабом поле, относительно 1H-ЯМР-спектра исходной СH3SO3H, обусловлено наличием в образце смеси двух веществ: исходного непрореагировавшего вещества – МСК и продукта ее анодного окисления. Следует отметить, что при сравнении МСК до и после электролиза на 1H-ЯМР-спектрах наблюдается различие химических сдвигов протонных спектров для молекулярных фрагментов CH3- и ОН-групп, где разность их химических сдвигов 1H-ЯМР-спектрах для CH3-группы составляет 0.12 м.д., а 1H-ЯМР-спектрах для ОН-групп составляет 1.02–1.05 м.д., что также позволяет судить об изменении структуры конечного продукта. Необходимо отметить, что наличие возле протонов таких электроноакцепторных группировок, как О–О-группы, может приводить к разэкранированию самих протонов, т.е. оттягиванию электронной плотности от протонов и сдвигу их сигналов в более слабое поле (δ) [61].
Рис. 9.
1H-ЯМР-спектры исходной МСК (1) и продукта ее электроокисления при потенциале 3.0 В (2), снятые в присутствии ДМСО-d6-растворителя.

Таким образом, методами капиллярного электрофореза и молекулярной спектроскопии установлено, что изменения основных функциональных групп конечного продукта, полученного при препаративном электролизе МСК, соответствуют справочным значениям [60–62] для КРС-, ИК- и ЯМР-спектров бис(метансульфонил) пероксида со структурной формулой (6):
Бис(метансульфонил) пероксид (др. название диметилдисульфопероксид, или диметансульфонил пероксид, или пероксида димезилат) с общей формулой CH3S(O)2OOS(O)2CH3 представляет из себя сложное сераорганическое пероксидное соединение, устойчивое при н.у., однако, при температуре более 343 K на воздухе разлагается со взрывом с выделением газообразных продуктов [62–65]. Из работы авторов [64] также известно, что его фотоокисление, инициированное свободными радикалами HO∙ и NO3, в конечном итоге приводит к образованию таких кислот, как СH3SO3H и H2SO4, обе из которых, накапливаясь в верхних слоях атмосферы, влияют на образование токсичных атмосферных осадков и являются неотъемлемой частью веществ, входящих в круговорот соединений серы в природе.
На основании данных поляризационных измерений и анализа продукта окисления МСК нами предложен следующий, представленный ниже, механизм.
Известно, что водные растворы СH3SO3H хорошо диссоциированны (7):
По-видимому, при потенциалах Е > 2.5 В окисление анионов ${\text{С }}{{{\text{H}}}_{3}}{\text{SO}}_{3}^{ - }$ приводит к образованию мезилат радикалов CH3S(O)2O• по схеме (8) :
Последние подвергаются рекомбинации, что приводит к образованию диметилдисульфопероксида (9):
Электрохимическая поляризация платины в растворах МСК, как и в случае концентрированного раствора серной кислоты [66], в области анодных потенциалов более 2.5 В приводит к образованию надкислоты.
Таким образом, полученные результаты показывают возможность синтеза электрохимическим методом устойчивого пероксидного соединения из концентрированных растворов метансульфокислоты – диметилдисульфопероксида, который может найти применение в различных отраслях промышленности, как и другие органические пероксидные соединения [67–70].
ЗАКЛЮЧЕНИЕ
1. На основании проведенных электрохимических измерений установлено, что в 10.0 М растворе СH3SO3H при потенциалах 2.0–2.5 В происходит разряд молекул воды с образованием кислородсодержащих реакционноспособных частиц.
2. Показано, что при более высоких анодных потенциалах 2.9–3.7 В образуется новое пероксидное соединение – диметилдисульфопероксид (пероксида димезилата).
3. Предложен механизм анодного окисления МСК с образованием нового пероксидного соединения.
БЛАГОДАРНОСТИ
Работа выполнена с использованием оборудования центров коллективного пользования ДГУ и ДНЦ РАН. Авторы выражают благодарность компании BASF за предоставление опытных образцов MSA-70 и MSA-100, а также выражают отдельную благодарность сотрудникам АЦКП ИПХФ РАН (Московская область, г. Черноголовка) за проведенный ЯМР-анализ исходных и полученных веществ.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена при финансовой поддержке Фонда содействия развитию малых форм предприятий в научно-технической сфере (Фонд содействия инновациям), поддержанный грантом по программам УМНИК-14-1Г 3326ГУ1/2014 (код 0003751) и УМНИК 2-15-10 № 8809ГУ2/2015 (код 0016996).
ИНФОРМАЦИЯ О ВКЛАДЕ АВТОРОВ
Авторы М.А. Ахмедов и Ш.Ш. Хидиров придумали и разработали эксперимент, участвовали в написании текста статьи. Aвтор Ахмедов М.А. собрал экспериментальную установку с трехэлектродной ячейкой с обратимым водородным электродом-сравнения, провел электрохимическое исследование объекта методом препаративного электросинтеза, получил, выделил и очистил образцы соединений для их последующего физико-химического анализа (КРС-, ИК-, и ЯМР-спектроскопии), проводил обработку экспериментальных данных и теоретические расчеты. Все авторы участвовали в обсуждении результатов.
Список литературы
Gernon, M.D., Wu, M., Buszta, T., and Janney, P., Environmental benefits of methane sulfonic acid. Comparative properties and advantages, Green Chem., 1999, vol. 1, no. 3, p. 127. https://doi.org/10.1039/a900157c
Данилов, Ф.И., Скнар, И.В., Скнар, Ю.Е. Кинетика электроосаждения никеля из метансульфонового электролита. Электрохимия. 2011. № 9 (47). С. 1109. [Danilov, F.I., Sknar, I.V., and Sknar, Yu.E., Kinetics of nickel electroplating from methanesulfonate electrolyte, Russ. J. Electrochem., 2011, vol. 47, no. 9, p. 1035.] https://doi.org/10.1134/S1023193511090114
Данилов, Ф.И., Батурина, Т.Е, Проценко, В.С., Васильева, Е.А. Окисление Sn(II) в метансульфонатных электролитах в присутствии антиоксидантов. ЖПХ. 2010. № 4 (83). С. 700. [Danilov, F.I., Butyrina, T.E., Protsenko, V.S., and Vasil’eva, E.A., Oxidation of Sn(II) in methanesulfonate electrolytes in presence of antioxidants, Russ. J. Appl. Chem., 2010, vol. 83, no. 4, p. 752.] https://doi.org/10.1134/S1070427210040348
Bengoa, L.N., Pary, P., Conconi, M.S., and Egli, W.A., Electrodeposition of Cu–Sn alloys from a methanesulfonic acid electrolyte containing benzyl alcohol, Electrochim. Acta, 2017, vol. 256, p. 211. https:// doi.org/.https://doi.org/10.1016/j.electacta.2017.10.027.
Velichenko, A.B., Gruzdeva, E.V., Luk’yanenko, T.V., Danilov, F.I., and Amadelli, R., Electrodeposition of lead dioxide from methanesulfonate solutions, J. Power Sources, 2009, vol. 191, no. 1, p. 103. https:// doi.org/.https://doi.org/10.1016/j.jpowsour.2008.10.054.
Comisso, N., Cattarin, S., Guerriero, P., Mattarozzi, L., Musiani, M., and Verlato, E., Electrochemical behavior of porous PbO2 layers prepared by oxygen bubble templated anodic deposition, Electrochim. Acta, 2016, vol. 200, p. 259. https://doi.org/.https://doi.org/10.1016/j.electacta.2016.03.184.
Protsenko, V.S., Kityk, A.A., and Danilov, F.I., Kinetics and mechanism of chromium electrodeposition from methanesulfonate solutions of Cr(III) salts, Surf. Eng. and Appl. Electrochem., 2014, vol. 50, no. 5, p. 384. https://doi.org/10.3103/S106837551405007X
Walsh, F.C. and Ponce de León, C., Versatile electrochemical coatings and surface layers from aqueous methanesulfonic acid, Surf. Coat. Technol., 2014, vol. 259, p. 676. http://dx.doi.org/.https://doi.org/10.1016/j.surfcoat.2014.10.010.
Hasan, M. and Rohan, J.F., Cu electrodeposition from methanesulfonate electrolytes for ULSI and MEMS applications, J. Electrochem. Soc., 2010, vol. 157, no. 5, p. 278. https://doi.org/10.1149/1.3332729
Shahin, G.E., Electroless nickel plating solutions. Patent US20030232148A1 (USA). 2002.
Srinivasan, K.N. and John, S., Electroless nickel deposition from methane sulfonate bath, J. Alloys Compd., 2009, vol. 486, no. 3, p. 447. https:// doi.org/.https://doi.org/10.1016/j.jallcom.2009.06.178.
Huttunen-Saarivirta, E., Observations on the uniformity of immersion tin coatings on copper Surf. Coat. Technol., 2002, vol. 160, no. 3, p. 288. https:// doi.org/.https://doi.org/10.1016/S0257-8972(02)00412-7.
Bengoa, L.N., Tuckart, W.R., Zabala, N., Prieto, G., and Egli, W.A., Tin coatings electrodeposited from sulfonic acid-based electrolytes: Tribological behavior, J. Materi Eng. and Perform., 2015, vol. 24, no. 6, p. 2274. https://doi.org/10.1007/s11665-015-1503-4
Low, C.T.J. and Walsh, F.C., The influence of a perfluorinated cationic surfactant on the electrodeposition of tin from a methanesulfonic acid bath, J. Electroanal. Chem., 2008, vol. 615, p. 91. https://doi.org/.https://doi.org/10.1016/j.jelechem.2007.11.031.
Walsh, F.C. and Ponce de Leon, C., A review of the electrodeposition of metal matrix composite coatings by inclusion of particles in a metal layer: an established and diversifying technology, Transactions of the IMF, 2014, vol. 92, no. 2, p. 83. https:// doi.org/https://doi.org/10.1179/0020296713Z.000000000161.
Low, C.T.J., Kerr, C., Ponce-de-León, C., and Walsh, F.C., Electrodeposition: Properties, Processes and Applications, New York: Nova Publishers, 2012, p. 283–296.
Mollamahaleh, Y.B., Hosseini, D. Mazaheri, M., and Sadrnezhaad, S.K., Surfactant-free production of ni-based nanostructures, Mater. Sciences and Appl., 2011, vol. 2, p. 444. http://dx.doi.org/.https://doi.org/10.4236/msa.2011.25059.
Li, Q., Feng, Z., Liu, L., Sun, J., Qu, Li, Y.F., and An, M., Research on the tribological behavior of a nanocrystalline zinc coating prepared by pulse reverse electrodeposition, RSC Adv., 2015, vol. 5, p. 12025. https://doi.org/10.1039/c4ra13691h
Tsunoda K. and Tamura, T., Tetravalent tin salt of metastannic acid and a trivalent indium salt of an organosulfonic acid, chelating agent, a caustic alkali; cyanide free smoothness. Pat. US6331240B1 (USA). 2001.
Zanella, C., Xing, S., and Deflorian F., Effect of electrodeposition parameters on chemical and morphological characteristics of Cu–Sn coatings from a methanesulfonic acid electrolyte, Surf. Coat. Technol., 2013, vol. 236, p. 394. https://doi.org/.https://doi.org/10.1016/j.surfcoat.2013.10.020.
Low, C.T.J., Kerr, C., and Walsh, F.C., Electrodeposition of tin, copper and tin–copper alloys from a methanesulfonic acid electrolyte containing a perfluorinated cationic surfactant, Surf. Coat. Technol., 2008, vol. 202, no. 8, p. 1339. https://doi.org/.https://doi.org/10.1016/j.surfcoat.2007.06.032.
Pewnim, N. and Roy, S., Electrodeposition of tin-rich Cu–Sn alloys from a methanesulfonic acid electrolyte, Electrochim. Acta, 2013, vol. 90, p. 498. https:// doi.org/.https://doi.org/10.1016/j.electacta.2012.12.053.
Konetzki, R.A., Chang, Y.A. and Marcotte, V.C., Oxidation kinetics of Pb–Sn alloys, J. Mater. Res., 2011, vol. 4, no. 6, p. 1421. https://doi.org/.https://doi.org/10.1557/JMR.1989.1421.
Goh, Y., Haseeb, A.S.M.A., Faizul, M., and Sabri, M., Effects of hydroquinone and gelatin on the electrodeposition of Sn–Bi low temperature Pb-free solder, Electrochim. Acta, 2013, vol. 90, p. 265. https:// doi.org/.https://doi.org/10.1016/j.electacta.2012.12.036.
Yakymovych, A. and Ipser, H., Synthesis and characterization of pure Ni and Ni-Sn intermetallic nanoparticles, Nanoscale Research Letters, 2017, vol. 12, no. 1, p.142. https://doi.org/10.1186/s11671-017-1894-2
Zhang, Z., Nenoff T.M., Leung, K., Ferreira, S.R., et al., Room-temperature synthesis of Ag–Ni and Pd–Ni Alloy Nanoparticles, J. Phys. Chem. C, 2010, vol. 114, no. 34, p. 14309. https://doi.org/10.1021/jp911947v
Danilov, F.I., Protsenko, V.S., Vasil’eva, E.A., and Kabat O.S., Antifriction coatings of Pb–Sn–Cu alloy electro-deposited from methanesulphonate bath, Transactions of the IMF, 2011, vol. 89, no. 3, p. 151. https://doi.org/https://doi.org/10.1179/174591911X12977017699347.
Nogita, K., Gourlay, C.M., and Nishimura, T., Cracking and phase stability in reaction layers between Sn–Cu–Ni solders and Cu substrates, JOM, 2009, vol. 61, no. 6, p. 45. https://doi.org/10.1007/s11837-009-0087-6
Walsh, F.C. and Ponce de León C., A review of the electrodeposition of metal matrix composite coatings by inclusion of particles in a metal layer: An established and diversifying technology, Transactions of the IMF, 2014, vol. 92, no. 2, p. 83. https://doi.org/10.1179/0020296713Z.000000000161
Sun, X.J. and Li, J.G., Friction and wear properties of electrodeposited nickel–titania nanocomposite coatings, Tribol. Lett., 2007, vol. 28, p. 223. https://doi.org/10.1007/s11249-007-9254-5
Caramia, V., Walsh, F.C. Ponce de Leon, C., and Low, C.T.J., Anodic deposition of compact, freely-standing or microporous polypyrrole films from aqueous methanesulphonic acid, Transactions of the IMF, 2015, vol. 93, no. 3, p. 139. http:// dx.doi.org/https://doi.org/10.1179/0020296714Z.000000000203.
Sanglee, K., Chuangchote, S., Chaiwiwatworakul P., and Kumnorkaew P., PEDOT:PSS nanofilms fabricated by a nonconventional coating method for uses as transparent conducting electrodes in flexible electrochromic devices, J. Nanomaterials, 2017, vol. 4, p. 1. https://doi.org/.https://doi.org/10.1155/2017/5176481.
Tan, L.S., Simko, S.R., Bal, S.J., Vaia, R.A., et al., Phase of separated, conducting composites from polyaniline and benzobisthiazole rigid of rod polymer, J. Polym. Sci. B Polym. Phys., 2001, vol. 39, p. 2539. https://doi.org/.https://doi.org/10.1002/polb.1224.
Yasushi, A.K., Suzuki, T.T., and Kobata, T.S., Electrolytic liquid for electrolytic polishing and electrolytic polishing method. Patent US20080067077A1 (USA). 2008.
Jing, N., Riddle, J.A., Yu, Z., Xiong, M., Wang, Z., Chu, Y., Pan, R., Tiers, G.V.D., and Brown, K.A., Coating composition and method of making and using the same. Pat. 9944822B2 (USA). 2013.
Helle, K. and Walsh, F.C., Electrodeposition of composite layers consisting of inert inclusions in a metal matrix, Transactions of the IMF, 1997, vol. 75, p. 53. https://doi.org/https://doi.org/10.1080/00202967.1997.11871143.
Bicelli, L.P., Bozzini, Mele, B.C., and D’Urzo, L., A review of nanostructural aspects of metal electrodeposition, Int. J. Electrochem. Sci., 2008, vol. 3, no. 4, p. 356.
Васильева, Е.А., Семенова, И.В., Проценко, В.С., Константинова, Т.Е., Данилов, Ф.И. Электроосаждение твердых композиционных покрытий железо-диоксида циркония из метансульфонатного электролита. ЖПХ. 2013. № 11 (86). С. 1786. [Vasil’eva, E.A., Smenova, I.V., Protsenko, V.S., Konstantinova, T.E., and Danilov, F.I., Electrodeposition of hard iron-zirconia dioxide composite coatings from a methanesulfonate electrolyte, Russ. J. Appl. Chem., 2013, vol. 86, no. 11, p. 1735.] https://doi.org/10.1134/S1070427213110177
Low, C.T.J., de la Toba Corral, M., and Walsh, F.C., Anodising of titanium in methanesulphonic acid to form titanium dioxide nanotube arrays, Transactions of the IMF, 2011, vol. 89, no. 1, p. 44. https://doi.org/10.1179/174591911X12953503084903
Lee, K., Kim, D., Berger, S., Kirchgeorg, R., and Schmuki, P., Anodically formed transparent mesoporous TiO2 electrodes for high electrochromic contrast, J. Mater. Chem., 2012, vol. 22, no. 19, p. 9821. https://doi.org/10.1039/c2jm31244a
Couper, A.M., Pletcher, D., and Walsh, F.C., Electrode materials for electrosynthesis, Chem. Rev., 1990, vol. 90, no. 5, p. 837. https://doi.org/10.1021/cr00103a010
Li, X., Pletcher, D., and Walsh, F.C., Electrodeposited lead dioxide coatings, Chem. Soc. Rev., 2011, vol. 40, no. 7, p. 3879. https://doi.org/10.1039/c0cs00213e
Ambika, C., Hirankumar, G., Thanikaikarasan, S., Lee, K.K., Valenzuela, E., and Sebastian, P.J., Influence of TiO2 as filler on the discharge characteristics of a proton battery. J. New Mater. Electrochem. Syst., 2015, vol. 18, no. 4, p. 219. https://doi.org/.https://doi.org/10.14447/jnmes.v18i4.351.
Arenas, L.F., Walsh, F.C., and Ponce de Leon, C., The importance of cell geometry and electrolyte properties to the cell potential of Zn–Ce hybrid flow batteries, J. Electrochem. Soc., 2016, vol. 163, no. 1, p. A5170. https://doi.org/10.1149/2.0261601jes
Dong, J, Wu, X., Chen, Y., Brandon, N., Li, X., Yang, J., et al., A study on Pb2+/Pb electrodes for soluble lead redox flow cells prepared with methanesulfonic acid and recycled lead, J. Appl. Electrochem., 2016, vol. 46, no. 8, p. 861. https://doi.org/10.1007/s10800-016-0980-y
Govindan, M., He, K., and Moon, I.S., Evaluation of dual electrochemical cell design for cerium-vanadium redox flow battery to use different combination of electrodes, Int. J. Electrochem. Sci., 2013, vol. 8, no. 8, p. 10265.
Кулова, Т.Л., Скундин, А.М. Высоковольтовые материалы положительных электродов литий-ионных аккумуляторов (обзор). Электрохимия. 2016. № 6 (52). с. 563. [Kulova, T.L. and Skundin, A.M., High-voltage materials for positive electrodes of lithium ion batteries (review), Russ. J. Electrochem., 2016, vol. 52, no 6, p. 501]. https://doi.org/10.1134/S1023193516060070
Lutropur MSA – the friendly acid. The purest form of MSA methanesulfonic acid made by BASF, BASF report, 2011, 19 p. http://clc.am/9zJvjA.
Ахмедов, М.А., Хидиров, Ш.Ш. Определение состава и свойств метансульфокислоты методом вольтамперометрии. ЖСХ. № 6 (55). 2014. С. 1204–1207. [Akmedov, M.A. and Khidirov, Sh.Sh., Voltametric determination of the composition and properties of methane sulfonic acid, J. Struct. Chem., 2014, vol. 55. no. 6. p. 1148.] https://doi.org/10.1134/S0022476614060249
O’Reilly, M.E., Kim, R.S., Oh, S., and Surendranath, Y., Catalytic methane monofunctionalization by an electrogenerated high-valent Pd intermediate, ACS Cent. Sci., 2017, vol. 3, no. 11, p. 1174. https://doi.org/10.1021/acscentsci.7b00342
Ахмедов, М.А. Хидиров, Ш.Ш., Капарова, М.Ю., Хибиев, Х.С. Электрохимический синтез метансульфокислоты из водных растворов диметилсульфона. Изв. вузов. Химия и хим. технология. 2016. № 12 (59). С. 100. [Akhmedov, M.A., Khidirov, Sh.Sh., Koparova, M.Y., and Khibiev, Kh.S., Electrochemical synthesis of methanesulfonic acid from aqueous solutions of dimethylsulfone, Izv. Vyssh. Uchebn. Zaved. Khim. Khim. Tekhnol., 2016, vol. 59, no. 12, p. 100.] https://doi.org/10.6060/tcct.20165912.5345
Хидиров, Ш.Ш., Ахмедов, М.А., Хибиев, Х.С., Ахмедов, Ш.В. Электрохимическое модифицирование целлюлозы. Вестн. ДГУ. 2015. № 6. С. 191. [Khidirov, Sh.Sh., Akhmedov, M.A., Khibiev, Kh.S., and Akhmedov, Sh.V., Electrochemical modification of cellulose, Bulletin of the DSU (in Russian), 2015, no. 6, p. 191.]
Хидиров, Ш.Ш., Хибиев, Х.С., Ахмедов, М.А. Получение мезилатов целлюлозы электрохимическим методом. ХФЖ. 2016. № 12 (50). С. 46. [Khidirov, Sh.Sh., Khibiev, K.S., and Akhmedov, M.A., Electrochemical synthesis of cellulose mesylates, Pharmaceutical Chem. J., 2017, vol. 50, no. 12, p. 817.] https://doi.org/10.1007/s11094-017-1539-x
Петрий, О.А. Потенциалы нулевого заряда платиновых металлов и работы выхода электрона (обзор). Электрохимия. 2013. № 5 (49). С. 451. [Petrii, O.A., Zero charge potentials of platinum metals and electron work functions (Review), Russ. J. Electrochem., 2013, vol. 49, no. 5, p. 401.] https://doi.org/10.7868/S0424857013050149
Дамаскин, Б.Б., Петрий, О.А., Цирлина, Г.А. Электрохимия. М.: Лань, 2015. 672 с. [Damaskin, B.B., Petrii, O.A., and Tsirlina, G.A., Electrochemistry (in Russian), Moscow: Lan, 2008, 672 p.]
Комарова, Н.В., Каменцев, Я.С. Практическое руководство по использованию систем капиллярного электрофореза “Капель”, СПб: ООО “Веда”, 2006. 212 с. [Komarova, N.V. and Kamentsev, Ya.S., A practical guide to the use of capillary electrophoresis systems “Kapel” (in Russian), St. Petersburg: Ltd. “Veda”, 2006. 212 p.]
Р 4.2.2643-10 Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности: Руководство. М: ФЦГиЭ Роспотребнадзора, 2010. С. 34–35. [Р 4.2.2643-10 The Methods for laboratory testing and testing of disinfectants for their effectiveness and safety: Management (in Russian), Moscow: FCH and E. Rospotrebnadzor, 2010, p. 34–35.]
Томилов, А.П., Майрановский, С.Г., Фиошин, М.Я., Смирнов В.А. Электрохимия органических соединений. М: Химия, 1968. С. 54. [Tomilov, A.P., Mayranovskii, S.G., Fioshin, M.Ya., and Smirnov V.A., Electrochemistry of organic compounds (in Russian), Moscow: Chemistry, 1968. p. 54.]
Журавлев, А.И., Тростников, В.Н. Свечение живых тканей. М.: Наука, 1966. 128 c. [Zhuravlev, A.I. and Trostnikov, V.N. Glowofliving tissues (in Russian), Moscow: Nauka, 1966. 127 p.]
Chackalackal, S.M. and Stafford, F.E., Infrared spectra of methane-, fluoro-, and chlorosulfonic acids, JACS, 1966, vol. 88, no. 21, p. 4815. https://doi.org/10.1021/ja00973a010
Пентин, Ю.А., Курамшина, Г.М. Основы молекулярной спектроскопии, М.: Мир, 2008. 398 с. [Pentin, Yu.A. and Kuramshina, G.M., The fundamentals of molecular spectroscopy (in Russian), Moscow: Mir, 2008, 398 p.]
Zeng, X., Beckers, H., Willner, H., and Lehmann, C.W., Bis(methanesulfonyl) peroxide, CH3S(O)2OOS(O)2CH3: spectroscopic, structural, and thermal properties, Z. Anorg. Allg. Chem., 2010, vol. 636, nos. 13–14, p. 2447. https://doi.org/10.1002/zaac.201000184
Zhu, B., Zeng, X., Beckers, H., Francisco, J.S., and Willner, H., The methylsulfonyloxyl radical, CH3SO3, Angew. Chem. Int. Ed., 2015, vol. 54, no. 39, p. 11404. https://doi.org/10.1002/anie.201503776
Korth, H.G., Neville, A.G., and Lusztyk, J., Direct spectroscopic detection of sulfonyloxyl radicals and first measurements of their absolute reactivities, J. Phys. Chem., 1990, vol. 94, no. 25, p. 8835. https://doi.org/10.1021/j100388a017
Haszeldine, R.N., Heslop, R.B., and Lethbridge, J.W., The properties and reactions of dimethanesulphonyl peroxide, J. Chem. Soc., 1964, no. 0, p. 4901. https://doi.org/10.1039/jr9640004901
Прикладная электрохимия. Изд. 2-е, М.: Химия, 1975, 551 с. [Applied Electrochemistry, (in Russian), Izd. 2, Moscow: Chemistry, 1975, 551 p.]
Хавкинс, Э., Дж., Э. Органические перекиси, их получение и реакции, М.-Л.: Химия, 1961. 536 с. [Khavkins, E.,J.,E., Organic peroxides, their preparation and reactions (in Russian), Moscow-Leningrad: Chemistry, 1961, 536 p.]
Яблонский, О.П., Беляев, В.А., Виноградов, А.Н. Ассоциация гидроперекисей углеводородов. Успехи химии. 1972. Т. 61. № 7. С. 1260. [Yablonsky, O.P., Belyaev, V.A., and Vinogradov, A.N. Association of hydroperoxides of hydrocarbons, Russ. Chem. Rev., 1972, vol. 61, no. 7, p. 1260.]
Антоновский, В.Л., Хурсан, С.Л. Физическая химия органических пероксидов. М.: ИКЦ Академкнига, 2003. 391 с. [Antonovskii, V.L. and Khursan, S.L., Physical chemistry of organic peroxides (in Russian), Moscow: IKTs Akademkniga, 2003. 391 p.]
Carlos, G., Comiran, E., de Oliveira, M.H., Limberger, R.P., Bergold, A.M., and Fröehlich, P.E., Development, validation and comparison of two stability-indicating RP-LC methods using charged aerosol and UV detectors for analysis of lisdexamfetamine dimesylate in capsules, Arab. J. Chem., 2016, vol. 9, no. 12, p. 1905. https://doi.org/.https://doi.org/10.1016/j.arabjc.2015.06.001.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия









