Электрохимия, 2019, T. 55, № 6, стр. 644-653
Ускорение процессов на положительном электроде литий-кислородного аккумулятора: электрокатализатор или редокс-медиатор?
О. В. Корчагин a, *, В. А. Богдановская a, О. В. Трипачев a, Г. Д. Синенко b, В. В. Емец a
a Институт физической химии и электрохимии имени А.Н. Фрумкина РАН
119071 Москва, Ленинский проспект, 31, Россия
b Московский государственный университет им. М.В. Ломоносова, Химический факультет
119991 Москва, Ленинские горы, 1, Россия
* E-mail: oleg-kor83@mail.ru
Поступила в редакцию 25.09.2018
После доработки 23.10.2018
Принята к публикации 22.01.2019
Аннотация
Сопоставлены подходы к повышению эффективности литий-кислородного аккумулятора (ЛКА), основанные на использовании катализатора PtCo/углеродные нанотрубки (УНТ) и жидкофазного йодсодержащего медиатора. Установлено, что при использовании электролита 1 М LiClO4/ДМСО катализатор 20PtCo/УНТ обеспечивает повышение емкости макета ЛКА Swagelok при полном разряде до напряжения 2 В по сравнению с ЛКА на основе УНТ. В процессе циклирования ЛКА с каждым из материалов напряжение заряда возрастает до 4.5 В, что приводит не только к увеличению скорости электрохимического окисления пероксида лития, но и к ускорению коррозии электролита и активного материала. В присутствии соединений йода в электролите Li2O2 окисляется по химическому механизму, что позволяет снизить напряжение заряда. В электролите состава 0.05 М LiI + 1 М LiClO4/ДМСО получено 85 последовательных циклов при емкости 500 мА ч/гС на стадии разряда ЛКА и напряжении окончания заряда не более 3.8 В. При масштабировании ЛКА до размера положительного электрода 5 × 5 см2 достигнута емкость полного разряда, близкая к аналогичной характеристике макета Swagelok (из расчета на геометрическую поверхность электрода), а введение в электролит йодсодержащей добавки позволило получить до 100 циклов с емкостью 300 мА ч/гС. Результаты работы показывают, что использование редокс-медиатора на основе йода более эффективно с точки зрения стабильности характеристик ЛКА исследованного типа по сравнению с применением платиносодержащего катализатора.
ВВЕДЕНИЕ
Перезаряжаемый электрогенератор на основе системы Li–O2 представляет новое поколение высокоемких литиевых источников тока. Теоретическая удельная емкость литий-кислородного аккумулятора (ЛКА) в заряженном состоянии приближается к энергоемкости углеводородного топлива (если не учитывать массу кислорода и катодных материалов) и превосходит характеристики большинства разработанных источников тока [1]. Использование металлического лития на отрицательном электроде ЛКА обеспечивает высокие удельные характеристики, однако ограничивает выбор электролитов системами на основе апротонных растворителей, не вызывающими активную химическую коррозию лития. Известны примеры эффективной защиты лития, позволяющие устройству функционировать в атмосфере воздуха и даже в среде водных электролитов с достижением высоких энергетических характеристик. В частности, компанией PolyPlus разработан твердый электролит для защиты лития, что позволило реализовать первичный литий-воздушный элемент с емкостью до 800 Вт ч/кг (из расчета на массу источника тока) [2]. Однако создание аккумулятора на основе этой технологии остается предметом исследований. Более подробное обсуждение вопросов работы литиевого анода в ЛКА выходит за рамки настоящей статьи.
В среде апротонного электролита основными факторами, определяющими емкость и обратимость ЛКА, являются процессы на положительном электроде: 2-электронные реакции восстановления кислорода с образованием пероксида лития (стадия разряда) и выделения кислорода при окислении пероксида (стадия заряда). Величина ЭДС процесса 2Li + O2 ↔ Li2O2 составляет 2.96 В [3], что близко к значениям напряжения разомкнутой цепи ЛКА, наблюдаемым на практике [1, 4].
При разряде ЛКА нерастворимый Li2O2 накапливается в порах положительного электрода, при этом происходит снижение активной поверхности, а также сужение каналов подачи кислорода и ионов лития в зону реакции. Исчерпание возможности образования Li2O2 сопровождается резким падением напряжения ЛКА до 2 В. Блокировка электрода пероксидом лития также обуславливает высокое перенапряжение заряда ЛКА. При заряде обычно достигается напряжение 4.0–4.2 В и выше, что соответствует протеканию процессов коррозии активных компонентов положительного электрода, основу которых составляет, как правило, углерод, а также началу разложения известных апротонных растворителей [5]. Эти эффекты снижают разрядную емкость, а также обратимость ЛКА при циклировании.
Задача повышения характеристик ЛКА в большинстве работ решается, в первую очередь, путем оптимизации активного материала положительного электрода. Как показано в [1, 6], использование углеродных наноматериалов, сочетающих высокую поверхность с развитой структурой крупных пор, может обеспечить разрядную емкость апротонного ЛКА от 10 000 до 30 000 мА ч/гС22. Однако разность средних значений напряжений разряда и заряда ЛКА на основе углеродных материалов часто превышает 1.5 В. Модификация углеродных материалов оксидными или металлическими катализаторами позволяет повысить энергетическую эффективность функционирования положительного электрода. При выборе состава катализатора учитываются результаты исследований кинетики и механизма кислородной реакции (катодного восстановления и анодного выделения кислорода) как в неводных средах, так и в водных растворах [7]. В работе [8] было установлено, что перенапряжения разряда и заряда ЛКА можно снизить путем использования бифункционального катализатора PtAu/С, в составе которого платина и золото обеспечивают ускорение реакций выделения и восстановления кислорода соответственно. Положительные результаты получены на бинарных системах PtRu/С, PdRu/C [4, 9, 10], PdM/C (где M = Fe, Co, Ni) [11]. С другой стороны, механизм влияния катализатора на процессы, протекающие на кислородном электроде ЛКА с неводным электролитом, в настоящее время не имеет общепринятой интерпретации. В работе [12] показано, что замена сажи XC‑72 катализатором 20Pt/XC-72 не приводит к снижению электрохимической составляющей перенапряжения катодной и анодной реакций на положительном электроде ЛКА с электролитом на основе ДМСО. Эти данные согласуются с экспериментальными и теоретическими результатами, полученными ранее авторами [13].
Важная роль электролита в механизме образования продуктов разряда отмечена в ряде работ [7, 9, 14]. Показано, что использование электролитов с высоким донорным числом (ДМСО, DN = 29) облегчает, в результате стабилизации промежуточного продукта (LiO2) в объеме раствора и последующего осаждения Li2O2 на электроде в виде пористых тороидальных образований, последующее разложение Li2O2 при заряде. В отличие от ДМСО в ацетонитриле, имеющем низкое донорное число (DN = 14), восстановление кислорода, образование LiO2 и его последующее диспропорционирование происходят в адсорбированном состоянии c образованием пленки Li2O2, блокирующей поверхность. Образование такой пленки приводит к снижению величины поверхности, доступной для восстановления О2, в процессе разряда и затем реакции разложения пероксида лития на стадии заряда. Фактор электролита необходимо учитывать при оценке влияния материала положительного электрода на скорость кислородной реакции.
Альтернативным подходом к улучшению характеристик ЛКА (в первую очередь, на стадии заряда), является введение в состав электролита редокс-медиаторов, облегчающих обмен зарядами между электродом и частицами Li2O2 [7]. Механизм действия редокс-медиатора предполагает его восстановление в результате химической реакции с пероксидом лития. Последний превращается в растворимую соль, освобождая поверхность электрода, а редокс-медиатор затем электрохимически окисляется, возвращаясь в исходную форму. Наиболее высокие результаты, описанные в литературе, достигнуты авторами [15] при испытаниях ЛКА с положительным электродом на основе оксида графена в диметоксиэтан-содержащем электролите с 0.05 M LiI. Средняя разность напряжений заряда и разряда ЛКА составила менее 0.2 В при стабильном циклировании в течение 2000 циклов.
Целью настоящей работы является сопоставление подходов к повышению эффективности ЛКА, основанных на использовании нанесенного дисперсного катализатора на положительном электроде ЛКА с ДМСО-содержащим электролитом и жидкофазного медиатора. В качестве катализатора использована система PtCo/углеродные нанотрубки (УНТ), ранее показавшая высокие характеристики в реакции восстановления кислорода в водной среде [16]. Редокс-медиаторами служили соль LiI и молекулярный йод.
МЕТОДИКИ ЭКСПЕРИМЕНТОВ
Синтез и структурные характеристики PtCo/УНТ и УНТ
Методы синтеза и структурные характеристики системы 20PtCo/УНТ (указано массовое содержание металлов в катализаторе), а также УНТ описаны в предшествующих работах [4, 16]. Перед синтезом катализатора углеродный носитель подвергали обработке (функционализации) в щелочной среде. При обработке образец УНТ выдерживали в растворе 1 М NaOH при температуре 100°С в течение часа. Затем образец отмывали деионизованной водой до нейтрального значения рН и сушили в вакуумном шкафу.
Согласно [17], при восстановлении кислорода в апротонной среде формирование осадка пероксида лития происходит преимущественно на внешней поверхности активного материала, соответствующей полной площади поверхности за вычетом площади микропор. По результатам измерений методом БЭТ, характеристики пористой структуры катализатора 20PtCo/УНТ приблизительно соответствуют аналогичным характеристикам нанотрубок, обладающих внешней поверхностью ~270 м2/гС и суммарным объемом пор 4.5–4.7 см3/гС. Приведенные данные соответствуют выводам работы [18], согласно которым даже при формировании катализатора Pt/С, содержащего 46 мас. % Pt, не происходит существенных изменений структурных свойств углеродного носителя. Таким образом, электроды с одинаковым количеством 20PtCo/УНТ и УНТ (из расчета на массу углеродного носителя) будут характеризоваться близкими величинами поверхности, доступной для образования Li2O2.
Электрохимические исследования
Модельные эксперименты проводили в ячейке литий-кислородного источника тока типа Swagelok с площадью положительного электрода 1.13 см2. Положительные электроды формировали путем нанесения суспензии активного материала и связующего поливинилиденфторид (ПВДФ) в 1-метил-2-пирролидоне на газодиффузионный слой (ГДС) Sigracet 39 BC или сепаратор из полипропилена. Использовали соотношение ПВДФ/углеродный материал = 1/4. После нанесения сепаратор с активным слоем (положительный электрод) сушили на воздухе, прессовали давлением 80 кг/см2 и выдерживали под вакуумом при температуре 100°С не менее 12 ч.
Приготовление электролита, сборку ячейки и электрохимические измерения проводили в герметизированном сухом боксе, деаэрированном аргоном (“ос. ч.”). Анодом служила литиевая фольга. Апротонный электролит готовили на основе солей LiClO4 и LiI (batterygrade, dry, 99.99%) и ДМСО (anhydrous, ≥99.9%) производства компании Sigma-Aldrich. Количество электролита, вводимое в систему, составляло ~40 мкл. В качестве сепаратора использовали фильтровальную бумагу. Окислителем служил кислород квалификации “ос. ч.”. Другие особенности конструкции и сборки ячейки Swagelok подробно описаны в [9].
Для предварительной оценки характеристик исследуемых активных материалов и электролитов проводили однократный разряд ЛКА в гальваностатическом режиме до напряжения 2.0 В с последующим зарядом. В качестве основных характеристических параметров Li–O2 элемента оценивали разрядную емкость (Qразряда), конечное или среднее напряжение разряда и заряда (Uразряда и Uзаряда, соответственно), а также эффективность преобразования энергии (ε). Последний параметр определяли как отношение мощности, затраченной на разряд, к мощности, затраченной на заряд, что при разряде и заряде одинаковым током (I) приблизительно соответствует отношению средних напряжений разряда и заряда:
Эксперименты по циклированию ЛКА с достижением фиксированной емкости продолжали до снижения напряжения окончания разряда до 2.0 В. После каждого разряда направление тока меняли на противоположное и проводили заряд, по продолжительности соответствующий разряду.
С использованием ступенчатой развертки напряжения было исследовано влияние величины напряжения при анодной поляризации положительного электрода на распределение целевых и побочных процессов в Li–O2 системе. При этом проводили два отдельных эксперимента, включавших поляризацию в отсутствие продуктов разряда в системе (определение токов заряжения и коррозии) и поляризацию после заполнения положительного электрода пероксидом лития (определение суммарного тока побочных процессов и окисления продукта разряда). В первом случае электрод выдерживали при различных напряжениях без предварительной стадии разряда. Во втором – проводили предварительный разряд с достижением заданного заполнения электрода пероксидом лития. В каждом случае систему выдерживали в течение 3 мин при значениях напряжения 3.2, 3.6, 4.0 и 4.5 В, регистрируя установившийся ток.
Масштабирование ячейки ЛКА до размера электродов 5 × 5 см2 было проведено с учетом результатов, полученных ранее [4]. Положительный электрод формировали на поверхности ГДС. Для подведения кислорода использовали биполярную пластину испытательной ячейки ElectroChem для мембранно-электродных блоков топливных элементов, которая также служила токоотводом положительного электрода. Токоотводом отрицательного электрода являлась медная фольга, помещенная на жесткую подложку. Между электродами вставляли два стекловолоконных сепаратора типа Whatman, смоченных электролитом. Ячейку поджимали болтами, поддерживая степень сжатия 10–15% с помощью прокладок. Испытания ячейки проводили в условиях постоянной продувки кислорода через биполярную пластину ElectroChem со скоростью 5–10 мл/мин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Реакции на положительном электроде и начальные характеристики ЛКА
Исследование кинетики кислородной реакции проводили на положительных электродах, содержащих тонкий слой активного материала (100 мкгС/см2)33 на полипропиленовой пленке-подложке. В этих условиях обеспечивается максимальная доступность поверхности электрода для протекания кислородной реакции при отсутствии влияния подложки на электрохимические процессы.
На рис. 1 представлены поляризационные кривые, характеризующие электрохимическое перенапряжение реакций восстановления и выделения кислорода на 20PtCo/УНТ и УНТ в среде ДМСО. Кривые были построены методом экстраполяции гальваностатических разрядно-зарядных кривых, измеренных в начальной области разряда ЛКА, на бесконечно малое заполнение поверхности электрода пероксидом лития в соответствии с методикой, предложенной в [12]. Видно, что катализатор 20PtCo/УНТ обеспечивает ускорение каждого из процессов по сравнению с углеродным материалом (рис. 1). Эти данные отличаются от результатов, полученных при сравнении каталитических свойств сажи XC-72 и катализатора 20Pt/XC-72, которые близки по активности в реакциях восстановления и выделения кислорода в среде ДМСО [12].
Рис. 1.
Поляризационные кривые в тафелевских координатах, характеризующие кислородную реакцию на 20PtCo/УНТ и УНТ в электролите 1 M LiClO4/ДМСО. Величины плотности тока отнесены к внешней поверхности активных материалов.

Наклоны кривых восстановления кислорода на 20PtCo/УНТ и УНТ, по крайней мере, в средней области, приближаются к значению 2 × × 2.3RT/F, что формально указывает на лимитирование скорости катодной реакции одноэлектронным процессом [1, 13]:
При этом катодные кривые пересекаются с соответствующими анодными кривыми вблизи ЭДС системы O2/Li2O2 (2.96 В). С другой стороны, наклоны кривых реакции выделения кислорода заметно превышают значение 2 × 2.3RT/F. Это может означать различие лимитирующих стадий анодного и катодного процессов на положительном электроде ЛКА, что согласуется с имеющимися представлениями о механизме исследуемых реакций [7].
В табл. 1 представлены данные, соответствующие разряду ЛКА до 2.0 В с полным заполнением порового пространства положительного электрода пероксидом лития и последующим заряжением.
Таблица 1.
Разрядно-зарядные характеристики Li–O2 элементов по данным однократного разряда до напряжения 2.0 В с последующим зарядом. Uразряда и Uзаряда – среднее напряжение при разряде и заряде, соответственно. Плотность тока 210 мА/гС. Количество материала на положительном электроде 0.5–0.6 мгС/см2
| Активный материал | Состав электролита | Qразряда | Uразряда, В | Uзаряда, В | ε, % | |
|---|---|---|---|---|---|---|
| мА ч/гС | мА ч/см2 | |||||
| УНТ | 1 M LiClO4/ДМСО | 11 800 | 7.4 | 2.760 | 3.960 | 69.7 |
| PtCo/УНТ | 1 M LiClO4/ДМСО | 18 000 | 9.8 | 2.753 | 3.892 | 70.7 |
| 1 M LiClO4 + 0.05 M LiI/ДМСО | 16 100 | 8.9 | 2.705 | 3.480 | 77.7 | |
| 1 M LiClO4 + 0.1 M I2/ДМСО | 18 200 | 10 | 2.675 | 3.422 | 78.2 | |
| 1 M LiI/ДМСО | 16 350 | 9.0 | 2.674 | 3.364 | 80.0 | |
Как видно, ЛКА с катализатором 20PtCo/УНТ характеризуется более высокой емкостью, чем ЛКА с УНТ при близкой эффективности преобразования энергии (~70%) в электролите 1 М LiClO4 + + ДМСО. Добавка редокс-медиатора в электролит позволяет повысить ε, главным образом благодаря снижению Uзаряда. При этом величины разрядной емкости и Uразряда ЛКА с LiI несколько уступают аналогичным показателям ЛКА с электролитом без добавок. Присутствие в исходном электролите молекулярного йода снижает величины Uразряда и Uзаряда, не оказывая заметного влияния на разрядную емкость ЛКА.
В соответствии с работами [19, 20], основным эффектом применения редокс-медиаторов на основе йода является снижение напряжения при заряде ЛКА, что обусловлено освобождением поверхности электрода от пероксида лития в результате протекания следующих реакций:
(3)
${\text{I}}_{3}^{ - } + {\text{L}}{{{\text{i}}}_{2}}{{{\text{O}}}_{2}} \to 2{\text{LiI}} + {{{\text{O}}}_{2}} + {{{\text{I}}}^{ - }}.$Снижение разрядной емкости ЛКА при введении LiI, которое, однако, не превышает 10% от емкости ЛКА в отсутствии медиатора (табл. 1), вероятно, обусловлено частичной блокировкой активных центров катализатора при адсорбции йодида. Добавка молекулярного йода в электролит может привести к протеканию параллельной реакции на положительном электроде при разряде:
Этот процесс вносит дополнительный (но не целевой) вклад в емкость ЛКА. Кроме того, в случае протекания реакции (3) уже на стадии разряда увеличится доля участков на поверхности электрода, свободных от пероксида и доступных для восстановления кислорода. Эти эффекты, по-видимому, компенсируют отрицательное влияние адсорбции йодида, поддерживая разрядную емкость на уровне, близком к характеристикам ЛКА без добавок.
По результатам краткосрочных испытаний ЛКА с одним циклом разряда/заряда можно отметить большую эффективность преобразования энергии в присутствии редокс-медиатора (до 80%) по сравнению с аналогичной характеристикой, полученной при использовании электролита без добавок и каталитической системы в АС положительного электрода (70.7%) (табл. 1). С другой стороны, присутствие редокс-медиатора практически не влияет на разрядную емкость ЛКА или даже приводит к ее некоторому снижению, в то время как переход от исходного носителя к катализатору сопровождается значительным увеличением емкости.
Циклирование ЛКА
Сравнительные циклические испытания ЛКА на основе 20PtCo/УНТ и УНТ проводили, поддерживая емкость разряда, соответствующую заполнению поверхности электрода одним монослоем Li2O2. В этих условиях можно пренебречь влиянием морфологии продукта катодной реакции, а процесс его окисления, очевидно, должен характеризоваться минимальным перенапряжением. Удельное количество электричества, необходимое для осаждения одного монослоя Li2O2, принимали равным 0.26 мКл/см2 (из расчета на внешнюю поверхность активного материала) [17], что соответствует ~200 мА ч/гС.
Результаты циклирования ЛКА с положительными электродами на основе 20PtCo/УНТ и УНТ в электролите 1 М LiClO4 + ДМСО представлены на рис. 2. Как видно, 20PtCo/УНТ обеспечивает несколько меньшее напряжение заряда по сравнению с УНТ при одинаковом напряжении разряда в интервале 0–100 циклов. После 100 циклов для каждого из материалов начинается снижение энергетической эффективности. Можно отметить определенное соответствие между этими данными и результатами исследования кинетики кислородной реакции и начальных характеристик ЛКА, показавшими преимущества 20PtCo/УНТ по сравнению с УНТ. Однако при циклировании в обоих случаях достигается достаточно высокое напряжение заряда (более 4.5 В после 100–110 последовательных циклов), что может ускорить побочные процессы, ограничивая циклируемость ЛКА. Побочные процессы на положительном электроде могут включать как электроокисление компонентов катализатора, так и деградацию электролита. В частности, известна способность ДМСО вступать в реакции с кислородсодержащими радикалами (в том числе с интермедиатами реакций восстановления и выделения кислорода) в водных [21, 22] и в неводных [23] средах.
Рис. 2.
Разрядно-зарядные кривые ЛКА на основе УНТ (а), 20PtCo/УНТ (б) и зависимости напряжений окончания разряда Uразряд, заряда Uзаряд и энергетической эффективности (ε) от номера цикла (в). Емкость разряда 200 мА ч/гС. 1 M LiClO4/ДМСО.

На рис. 3 представлены зависимости стационарного тока в присутствии (iΣ) и отсутствии (iпоб) Li2O2 на поверхности электрода от величины напряжения заряда. Для обоих активных материалов заполнение поверхности электрода пероксидом лития перед измерением iΣ составляло 25 монослоев (5000 мА ч/гС). В случае, если присутствие пероксида на электроде не влияет на скорости побочных электрохимических процессов, имеем:
Рис. 3.
Зависимости стационарного тока в отсутствие (1, 1 ') и присутствии (2, 2 ') Li2O2 на поверхности электрода от величины напряжения ЛКА с материалами УНТ (1, 2) и 20PtCo/УНТ (1 ', 2 '). 1 M LiClO4/ДМСО.

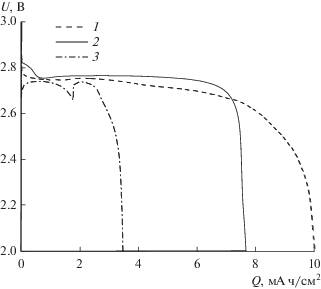
Как следует из рис. 4, использование добавки 0.05 M LiI более эффективно, с точки зрения величины напряжения заряда и продолжительности циклирования ЛКА, по сравнению с применением катализатора. Представленные данные соответствуют заполнению поверхности электрода ~2.5 монослоя Li2O2 (500 мА ч/гС) при каждом разряде. Заданная емкость ЛКА в присутствии LiI поддерживается в течение 85 циклов, при этом напряжение заряда не превышает 3.8 В.
Масштабирование конструкции ЛКА
Поскольку в настоящее время технология ЛКА находится на уровне лабораторных исследований, в литературе практически не обсуждаются вопросы масштабирования конструкции ячеек ЛКА. Очевидно, что при рассмотрении этих вопросов необходимо учитывать опыт разработки других источников тока, для которых реакции восстановления/выделения кислорода также являются критическими. Одной из проблем является оптимизация поступления окислителя к катоду. В топливных элементах (ТЭ) подача кислорода осуществляется с помощью газораспределительной биполярной пластины (БП), прижатой к катоду с тыльной стороны ГДС. Использование БП с разветвленными каналами (серпантином) с большой площадью поверхности обеспечивает эффективный токосъем, интенсивную принудительную конвекцию газа, снижает затопление катода ТЭ [25].
При разработке реальных источников тока важнейшей задачей является достижение удельных характеристик, близких к полученным в модельных экспериментах в ячейках небольшого размера. На рис. 5 сопоставлены кривые разряда ЛКА до 2.0 В, полученные в ячейке Swagelok и полноразмерных ячейках при подаче кислорода с помощью коммерческой БП ElectroChem (режим принудительной конвекции) или из герметичного резервуара над катодом (режим естественной конвекции). Как видно, функционирование ЛКА с положительным электродом площадью 25 см2 в режиме естественной конвекции не позволяет получать удельную емкость (из расчета на геометрическую поверхность электрода), сопоставимую с характеристиками ЛКА “Swagelok” с электродом площадью 1 см2. Однако использование газораспределительной плиты ElectroChem приводит к сближению характеристик полноразмерного ЛКА и Swagelok.
Рис. 5.
Разрядные кривые ЛКА на основе 20PtCo/УНТ c различной площадью электродов и способами подачи кислорода: 1 – 1 см2 (ячейка Swagelok, естественная конвекция), 2 – 25 см2 (ячейка с БП ElectroChem, принудительная конвекция), 3 – 25 см2 (ячейка с дополнительным резервуаром с кислородом, естественная конвекция). 1 M LiClO4/ДМСО.
Постоянная продувка кислорода через ячейку предотвращает избыточное увлажнение положительного электрода электролитом, но может приводить к уносу легколетучих компонентов раствора. Установлено, что ЛКА с БП ElectroChem и электролитом 0.05 M LiI + 1 M LiClO4 + ДМСО выдерживает не менее 100 последовательных циклов (рис. 6а) при заданной емкости ~300 мА ч/гС, однако циклирование сопровождается ростом напряжения заряда до значений более 4.40 В. Этот эффект может быть обусловлен уносом йода и, вероятно, ДМСО из системы в условиях постоянной продувки ячейки кислородом. Как показано на рис. 6б, замена ДМСО тетраглимом, обладающим меньшим давлением насыщенных паров [26], и введение в систему дополнительного количества йода позволяют поддерживать напряжение заряда ЛКА ниже 3.3 В при циклировании в течение более 300 ч.
ЗАКЛЮЧЕНИЕ
В работе сопоставлены подходы к повышению скорости кислородной реакции и характеристик ЛКА, основанные на использовании катализатора 20PtCo/УНТ и йодсодержащего жидкофазного медиатора в электролите на основе ДМСО.
Установлено, что катализатор 20PtCo/УНТ характеризуется меньшим перенапряжением реакций восстановления и выделения кислорода по сравнению с УНТ. Этим данным соответствует заметное повышение емкости ЛКА с катализатором в условиях полного разряда до напряжения 2.0 В по сравнению с ЛКА на основе УНТ (от 11 800 до 18 000 мА ч/гС). При циклировании ЛКА с постоянной емкостью, соответствующей осаждению одного монослоя Li2O2, преимущество катализатора перед углеродным материалом проявляется в меньшей степени, при этом напряжение заряда в каждом случае достигает 4.5 В после пропускания 100–110 последовательных циклов. Установлено, что высокое напряжение заряда приводит к ускорению электроокисления пероксида лития, однако при этом возрастает доля процессов деградации компонентов системы (до 30–40% от суммарного тока при 4.5 В), что наиболее выражено в случае ЛКА на основе катализатора.
Введение йода в апротонный электролит (в форме I2 или LiI) позволяет снизить напряжение заряда ЛКА благодаря окислению Li2O2 по химическому механизму. При использовании добавки 0.05 M LiI получено 85 последовательных циклов при емкости 500 мА ч/гС на стадии разряда ЛКА и напряжении окончания заряда не более 3.8 В.
Проведено масштабирование ЛКА до размера положительного электрода 5 × 5 см2 с применением для подачи кислорода биполярной пластины ElectroChem с газораспределительными каналами. Емкость разряда полноразмерного ЛКА приближается к аналогичной характеристике макета Swagelok (из расчета на геометрическую поверхность электрода), а введение в электролит йодсодержащих добавок обеспечивает циклируемость ЛКА до 100 циклов с емкостью 300 мА ч/гС.
Результаты работы показывают, что использование редокс-медиатора на основе йода более эффективно с точки зрения продолжительности циклирования и стабильности характеристик ЛКА по сравнению с применением платиносодержащего катализатора. Исследования по влиянию природы растворителя и концентрации йодсодержащих добавок на разрядно-зарядные характеристики и кинетику процессов на положительном электроде ЛКА будут продолжены.
Список литературы
Тарасевич, М.Р., Андреев, В.Н., Корчагин, О.В., Трипачев, О.В. Литий-кислородные (воздушные) источники тока (современное состояние и перспективы). Физикохимия поверхности и защита материалов. 2017. Т. 53. С. 3. [Tarasevich, M.R., Andreev, V.N., Korchagin, O.V., and Tripachev, O.V., Lithium–oxygen (air) batteries (state-of-the-art and perspectives), Prot. Met. Phys. Chem. Surf., 2017, vol. 53, p. 1.]
Visco, S.J., Nimon, V., Petrov, A., Pridatko, K., Goncharenko, N., Nimon, E., De Jonghe, L., Hendrickson, M., and Plichta, E., Lithium Air Batteries Based on Protected Lithium Electrodes, in The Lithium Air Battery: Fundamentals. Imanishi, N., Luntz, A.C., Bruce, P., Eds, Springer Science+Business Media New York, 2014, p. 179.
Chase, M.W.Jr., NIST-JANAF Thermochemical Tables, J. Phys. Chem. Ref. Data, 1998, Monogr. 9, p. 1510.
Богдановская, В.А., Корчагин, О.В., Тарасевич, М.Р., Андреев, В.Н., Нижниковский, Е.А., Радина, М.В., Трипачев, О.В., Емец, В.В. Мезопористые наноструктурированные материалы для положительного электрода литий-кислородного аккумулятора, Физикохимия поверхности и защита материалов. 2018. Т. 54. С. 232. [Bogdanovskaya, V.A., Korchagin, O.V., Tarasevich, M.R., Andreev, V.N., Nizhnikovskii, E.A., Radina, M.V., Tripachev O.V., and Emets V.V., Mesoporous nanostructured materials for the positive electrode of a lithium–oxygen battery, Prot. Met. Phys. Chem. Surf., 2018, vol. 54, p. 373.]
Ottakam Thotiyl, M.M., Freunberger, S.A., Peng, Z., and Bruce P.G., The carbon electrode in nonaqueous Li–O2 cells, J. Am. Chem. Soc., 2013, vol. 135, p. 494.
Nomura, A., Ito, K., and Kubo, Y., CNT sheet air electrode for the development of ultra-high cell capacity in lithium-air batteries, Scientific Reports, 2017, vol. 7, p. 45596.
Тарасевич, М.Р., Корчагин, О.В., Трипачев, О.В. Сравнительный анализ особенностей кислородной реакции (ионизация и выделение молекулярного кислорода) в водных и неводных растворах электролитов (обзор). Электрохимия. 2018. Т. 54. С. 3. [Tarasevich, M.R., Korchagin, O.V., and Tripachev, O.V., Comparative study of special features of the oxygen reaction (molecular oxygen ionization and evolution) in aqueous and nonaqueous electrolyte solutions (a review), Russ. J. Electrochem., 2018, vol. 54, p. 1.]
Lu, Y.-C., Xu, Z., Gasteiger, H.A., Chen, S., Hamad-Schifferli, K., and Shao-Horn, Y., Platinum–gold nanoparticles: a highly active bifunctional electrocatalyst for rechargeable lithium–air batteries, J. Amer. Chem. Soc., 2010, vol. 132, p. 12170.
Корчагин, О.В., Тарасевич, М.Р., Трипачев, О.В., Богдановская, В.А. Катализ кислородной реакции на положительном электроде литий-кислородного элемента в присутствии металлических наносистем. Физикохимия поверхности и защита материалов. 2016. Т. 52. С. 345. [Korchagin, O.V., Tarasevich, M.R., Tripachev, O.V., and Bogdanovskaya, V.A., Catalysis of oxygen reaction on positive electrode of a lithium–oxygen cell in the presence of metallic nanosystems, Prot. Met. Phys. Chem. Surf., 2016, vol. 52, p. 581.]
Трипачев, О.В., Корчагин, О.В., Богдановская, В.А., Тарасевич, М.Р. Особенности кислородной реакции на каталитических системах в электролитах на основе ацетонитрила. Электрохимия. 2016. Т. 52. С. 514. [Tripachev, O.V., Korchagin, O.V., Bogdanovskaya, V.A., and Tarasevich, M.R., Specific features of the oxygen reaction on catalytic systems in acetonitrile-based electrolytes, Russ. J. Electrochem., 2016, vol. 52, p. 456.]
Leng, L., Li, J., Zeng, X., Song, H., Shu, T., Wang, H., and Liao, S., Enhancing the cyclability of Li–O2 batteries using PdM alloy nanoparticles anchored on nitrogen-doped reduced graphene as the cathode catalyst, J. Power Sources, 2017, vol. 337, p. 173.
Korchagin, O.V., Bogdanovskaya, V.A., Tripachev, O.V., and Emets, V.V., Kinetics of oxygen reaction and discharge/charging overvoltages of Li–O2 battery with aprotic electrolytes, Electrochem. Commun., 2018, vol. 90, p. 43.
Viswanathan, V., Nørskov, J.K., Speidel, A., Scheffler, R., Gowda, S., and Luntz, A.C., Li–O2 kinetic overpotentials: Tafel plots from experiment and first-principles theory, J. Phys. Chem. Lett., 2013, vol. 4, p. 556.
Gittleson, F.S., Sekol, R.C., Doubek, G., Linardi, M., and Taylor, A.D., Catalyst and electrolyte synergy in Li–O2 batteries, Phys. Chem. Chem. Phys., 2014, vol. 16, p. 3230.
Liu, T., Leskes, M., Yu, W., Moore, A.J., Zhou, L., Bayley, P.M., Kim, G., and Grey, C.P. Cycling Li–O2 batteries via LiOH formation and decomposition, Science, 2015, vol. 350, p. 530.
Богдановская, В.А., Кольцова, Э.М., Тарасевич, М.Р., Радина, М.В., Жутаева, Г.В., Кузов, А.В., Гаврилова, Н.Н. Высокоактивные и стабильные катализаторы на основе нанотрубок и модифицированной платины для топливных элементов. Электрохимия. 2016. Т. 52. С. 810. [Bogdanovskaya, V.A., Kol’tsova, E.M., Tarasevich, M.R., Radina, M.V., Zhutaeva, G.V., Kuzov, A.V., and Gavrilova, N.N., Highly active and stable catalysts based on nanotubes and modified platinum for fuel cells, Russ. J. Electrochem., 2016, vol. 52, p. 723.]
Meini, S., Piana, M., Beyer, H., Schwammlein, J., and Gasteiger, H.A., Effect of carbon surface area on first discharge capacity of Li–O2 cathodes and cycle-life behavior in ether-based electrolytes, J. Electrochem. Soc., 2012, vol. 159, p. 2135.
Soboleva, T., Zhao, X., Malek, K., Xie, Z., Navessin, T., and Holdcroft, S., On the micro-, meso-, and macroporous structures of polymer electrolyte membrane fuel cell catalyst layers, Appl. Mater & Interfaces, 2010, vol. 2, p. 375.
McCloskey, B.D. and Addison, D., A Viewpoint on heterogeneous electrocatalysis and redox mediation in nonaqueous Li–O2 batteries, ACS Catal., 2017, vol. 7, p. 772.
Kwak, W.-J., Hirshberg, D., Sharon, D., Shin, H.-J., Afri, M., Park, J.-B., Garsuch, A., Chesneau, F.F., Frimer, A.A., Aurbach, D., and Sun, Y.-K., Understanding the behavior of Li–oxygen cells containing LiI, J. Mater. Chem. A, 2015, vol. 3, p. 8855.
Kurmaz, V.A., Kotkin, A.S., and Simbirtseva, G.V., Laser photoemission generation and electrochemical study of methyl radicals as secondary products of OH radicals capture by dimethyl sulfoxide molecules, J. Solid State Electrochem., 2011, vol. 15, p. 2119.
Курмаз, В.А., Коткин, А.С., Симбирцева, Г.В. Исследование электрохимического поведения вторичных продуктов захвата OH-радикалов молекулами диметилсульфоксида методами лазерной фотоэмиссии. Вестн. Моск. Ун-та. Сер. 2. Химия. 2013. Т. 54. С. 321. [Kurmaz, V.A., Kotkin, A.S., and Simbirtseva, G.V., Investigation of electrochemical behavior of secondary products of capture of oh radicals by dimethyl sulfoxide molecules using laser photoemission, Moscow University Chemistry Bulletin, 2013, vol. 68, p. 273.]
Kwabi, D.G., Batcho, T.P., Amanchukwu, C.V., Ortiz-Vitoriano, N., Hammond, P., Thompson, C.V., and Shao-Horn, Y., Chemical instability of dimethyl sulfoxide in lithium-air batteries, J. Phys. Chem. Lett., 2014, vol. 5, p. 2850.
Wong, R.A., Yang, C., Dutta, A., O, M., Hong, M., Thomas, M.L., Yamanaka, K., Ohta, T., Waki, K., and Byon, H.R., Critically Examining the Role of Nanocatalysts in Li–O2 Batteries: Viability towards Suppression of Recharge Overpotential, Rechargeability and Cyclability, ACS Energy Lett., 2018, vol. 3, p. 592.
Mepsted, G.O. and Moore, J.M., Performance and durability of bipolar plate materials, in Handbook of Fuel Cells—Fundamentals, Technology and Applications, Eds, Vielstich, W., Gasteiger, H.A., Lamm, A. and Yokokawa, H. John Wiley & Sons, Ltd., 2010, p. 1.
Flick, E.W., ed. Industrial solvents handbook. Westwood, N.Y.: Noyes Data Corporation; 1998. 994 p.
Дополнительные материалы отсутствуют.




