Электрохимия, 2019, T. 55, № 8, стр. 992-1004
Сульфидпроводящие ионные проводники со структурой CaFe2O4 и Yb3S4, допированные дисульфидом циркония
М. А. Пентин a, *, Б. А. Ананченко a, Л. А. Калинина a, Е. В. Кошелева a, Ю. Н. Ушакова a, И. В. Мурин b
a Вятский государственный университет, Институт химии и экологии
610000 Киров, ул. Московская, 36, Россия
b Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская набережная, 7, Россия
* E-mail: maksimpentin@gmail.com
Поступила в редакцию 02.10.2018
После доработки 06.02.2019
Принята к публикации 12.03.2019
Аннотация
Синтезированы сульфидпроводящие ионные соли тиоиттрат и тиоиттербиат кальция, тиосамарат бария с цитратно-нитратной предысторией получения шихты и полупроводниковый допант дисульфид циркония. Выбраны режимы получения гетерогенных смесей CaY2S4–ZrS2 (I), BaSm2S4–ZrS2 (II), CaYb2S4–ZrS2 (III). В результате аттестации образцов методами РФА и СЭМ обнаружено образование новых соединений Y2ZrS5, BaZrS3 в гетерофазных системах (I) и (II), соответственно, и образование в системе (III) твердого раствора на основе тиоиттербиата кальция протяженностью до 10 мол. % ZrS2. Методами ТГА и ДТА определена термическая устойчивость всех трех исследованных систем на воздухе. Исследованы температурные и концентрационные зависимости электропроводности гетерогенных смесей. Обнаружено существенное повышение электропроводности гетерогенных смесей (I) и (II) в области составов от 20 до 40 мол. % дисульфида циркония и понижение электропроводности при добавлении от 2 до 40 мол. % ZrS2 в тиоиттербиат кальция (система III).
ВВЕДЕНИЕ
Фазы на основе тройных сульфидов на квазибинарных разрезах MeLn2S4–Ln2S3, где Me–Ca, Ba; Ln–Y, Nd, Sm, Yb, кристаллизующиеся в структурах типа Th3P4, CaFe2O4, Yb3S4 [1–5], представляют интерес как известные твердые электролиты (ТЭ) с преимущественной проводимостью по ионам серы [6–8]. Авторами [9–14] были изучены структурные данные сульфидных фаз со структурным мотивом Th3P4, однако транспортные характеристики данных материалов слабо изучены из-за отсутствия возможности получения компактных образцов при отжиге таблетированных образцов. Ионным проводникам со структурными мотивами Yb3S4 и CaFe2O4, обладающими несомненным сходством, в соответствии с критериями реализации сульфидионного переноса присущ высокий вклад сульфидионного переноса [5, 15]. Фазы на основе CaYb2S4 и CaY2S4 (СТ Yb3S4) и BaSm2S4 (СТ CaFe2O4) с низким (до 20 мол. % Ln2S3) уровнем допирования характеризуются высоким вкладом анионной проводимости $\left( {{{t}_{{{{s}^{{2 - }}}}}} = 1 \pm 0.02} \right)$, но достаточно высоким сопротивлением 106–107 Ом см в электролитическом интервале температур 573–773 К [8, 17], что ограничивает их практическое применение, и, с определенной точки зрения, позволяет характеризовать эти фазы как диэлектрики, перенос зарядов в которых осуществляется в основном ионами. Исследования последних лет показали, что в композиционных материалах подобного типа “оксидный диэлектрик–оксидный полупроводник” [18] основным типом проводимости является ионный перенос, причина которого – физико-химические процессы на границе раздела фаз.
В настоящей работе исследовалась возможность повышения электропроводности известных сульфидпроводящих фаз путем получения композиционных твердых электролитов типа “сульфидный диэлектрик–сульфидный полупроводник”. С этой целью ионные соли CaYb2S4, CaY2S4, BaSm2S4 допировали полупроводниковой добавкой ZrS2, что должно увеличивать количество дополнительных поверхностных дефектов “ионная соль–полупроводниковый допант” и улучшить электропроводность гетерогенных смесей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для получения ионных солей CaYb2S4 и BaSm2S4 использовали цитратно-нитратный метод [11], а для CaY2S4 наряду с цитратно-нитратным и керамический метод [7]. В качестве исходных веществ использовали Ca(CH3COO)2 ⋅ H2O (“х. ч.”), Yb(CH3COO)3 ⋅ 4H2O (“ос. ч.”), BaCO3 (“ч. д. а.”), Sm2О3 (“ос. ч.”), Ca(NO3)2 ⋅ 4H2O (“х. ч.”), Y(NO3)3 ⋅ 5H2O (“ос. ч.”). Концентрацию ионов самария, иттербия и иттрия в приготовленных растворах определяли фотоколориметрическим методом с органическими реагентами на приборе КФК-3КМ (Россия). Содержание ионов бария и кальция определяли методом капиллярного электрофореза на приборе “Капель 150М” (Россия). Растворы ацетатов иттербия и кальция смешивали в эквимолярных соотношениях в термостойких стаканах. К растворам солей добавляли лимонную кислоту (“ос. ч.”) в соотношении 1 моль смеси солей/4 моль лимонной кислоты. К цитратной смеси добавляли этиленгликоль (“х. ч.”). Полученные растворы помещали в сушильный шкаф и упаривали при температуре 393 К до небольшого повышения вязкости. После начального этапа отверждения температуру плавно повышали до 573 К. Стаканы с упаренным материалом (цитратная смесь компонентов и этиленгликоля) переносили в муфель, устанавливали температуру в печи 673 К и выдерживали в течение 2 ч до образования золы. Полученную золу переносили в тигель, устанавливали температуру печи уже до 1173 К и выдерживали в течение 5 ч [19]. При использовании керамического метода синтеза порошки карбонатов ЩЗМ и оксидов РЗМ предварительно прокаливали для удаления влаги при температуре 1173 К, после чего смешивали в стехиометрическом соотношении в агатовой ступке и перетирали.
Сульфидные прекурсоры MeLn2S4 получали твердофазным синтезом при прокаливании полученных цитратно-нитратным и керамическим методами оксидных смесей в потоке аргона, в качестве сульфирующего агента использовали сероуглерод [20, 21]. Синтез проводили в графитовой лодочке, помещенной в кварцевую трубу (реактор), которую загружали в печь СУОЛ-0.4.2/11 (Россия). Температуру и время выдержки варьировали в зависимости от природы тернарного сульфида. Подготовленную оксидную шихту нагревали в потоке аргона до 1123 К, затем продолжали нагрев в потоке аргона насыщенного парами сероуглерода. После выдерживания образцов при определенных температуре и времени произошло автоматическое отключение печи. Полученные сульфидные прекурсоры охлаждали в потоке аргона насыщенного сероуглеродом до 823 К и в потоке чистого аргона доставали образцы. Для очистки инертного газа использовали устройство очистки и осушки инертных газов “ЭПИШУРА-11СЛ” (Россия). Все образцы тщательно измельчали, далее прессовали в таблетки и подвергали гомогенизирующему отжигу. Режимы представлены в табл. 1.
Таблица 1.
Условия синтеза сульфидных материалов
| Соединение | Исходные реагенты | Условия синтеза |
|---|---|---|
| BaSm2S4 | BaСO3, Sm2O3 | Ar + CS2 при 1323 К (8 ч) |
| CaYb2S4 | Yb2O3, CaO | Ar + CS2 при 1408К (8 ч) |
| CaY2S4 | Y2O3, CaO | Ar + CS2 при 1373К (6 ч) |
| ZrS2 | ZrO2 | Ar + CS2 при 1573 К (10 ч) |
| BaSm2S4–ZrS2 | BaSm2S4, ZrS2 | Ar + CS2 при 1273 К (7 ч) |
| CaYb2S4–ZrS2 | CaYb2S4, ZrS2 | Ar + CS2 при 1273 К (7 ч) |
| CaY2S4–ZrS2 | CaY2S4, ZrS2 | Ar + CS2 при 1273 К (7 ч) |
Дисульфид циркония получали из обезвоженного порошка ZrO2 (“ч. д. а.”). В связи со структурными особенностями ZrO2 возникла необходимость применения специального режима синтеза. Диоксид циркония имеет низкотемпературную моноклинную модификацию, что при обычных условиях позволяет получить смесь дисульфида и сульфоксида, что нежелательно. Для решения данной проблемы желательно использовать тетрагональную или кубическую модификацию ZrO2. Специальные условия – высокая температура и длительное время выдержки. Печь с оксидной шихтой нагревали до 1373 К в потоке аргона и до 1573 К в потоке аргона, насыщенного парами сероуглерода, и выдерживали в течение 10 ч. Полученный дисульфид циркония охлаждали по принципу, описанному выше.
Гетерогенные смеси получали смешиванием и перетиранием полученной ионной соли и гетерогенной добавки с добавлением ацетона в агатовой ступке, после чего таблетировали при постоянном давлении 30 кгс/см2 и подвергали высокотемпературному отжигу на той же установке, но при измененных параметрах режима. Прекурсоры и режимы получения представлены в табл. 1.
Аттестацию сульфидных прекурсоров и композиционных материалов проводили с помощью порошкового рентгенофазового анализа на дифрактометре XRD-7000S (Shimadzu, Япония) (излучение CuKα) в интервале углов 10° < 2θ < 70° с шагом 0.02°, временем экспозиции 0.6 с, при вращении образца 60 об./мин. Морфологию и полноту сульфидизации образцов исследовали с помощью сканирующего электронного микроскопа JEOL JSM-6510 LV (Япония), оснащенного энергодисперсионным рентгеновским микроанализатором INCA X-Max (Oxford Instruments, Великобритания), с последующим картированием образцов по элементам. Термогравиметрический (ТГА) и дифференциальный термический анализ (ДТА) проводили на дериватографе DTG-60 (Япония), при скорости нагрева 10°/мин в тиглях из оксида алюминия, в атмосфере воздуха.
Общую электропроводность образцов измеряли двухэлектродным методом [22] с блокирующими графитовыми электродами на фиксированной частоте 100 кГц в температурном интервале 445–667 К (измеритель иммитанса Е7–20, Беларусь). Импедансспектроскопические исследования образцов проводили на импедансметре Z-1000 Р (Elins, Россия) при фиксированных температурах 573, 623, 673, 723 К в частотном диапазоне 2 МГц–1 Гц. Обрабатывали полученные результаты с помощью ПО “ZView v.2.3f”.
Определение средних ионных чисел переноса $\left( {{{{\bar {t}}}_{i}}} \right)$ проводили двумя методами. Первый – метод ЭДС [23] в гальваническом элементе (1) с электродами, обратимыми относительно сульфид-ионов,
(1)
${\text{C|Fe|FeS}}\left| {{\text{ и с с л е д у е м ы й о б р а з е ц }}} \right|{\text{C}}{{{\text{u}}}_{{\text{2}}}}{\text{S|Cu|C}}$Второй метод основан на полученных данных об общей электропроводности (σобщ) и ее ионной составляющей (σi), определенной с помощью метода импедансной спектроскопии.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Полученная цитратно-нитратным методом оксидная шихта, синтезированные сульфидные ионные соли CaY2S4, CaYb2S4 и BaSm2S4, допант ZrS2 и гетерогенные смеси аттестовали методом РФА. Дифрактограммы тиоиттрата и тиоиттербиата кальция показали, что вне зависимости от их предыстории, это однофазные CaY2S4 и CaYb2S4, кристаллизирующиеся в структурном типе Yb3S4. Рентгенограмма тиосамарата бария, кроме BaSm2S4, показала наличие следов BaS и Sm2S3. Рентгенограмма полученного допанта содержала только пики гексагонального ZrS2. Таким образом, по данным РФА, при выбранных режимов синтеза происходит полная сульфидизация оксидных прекурсоров.
Исследование морфологии поверхности сульфидных полупродуктов показало, что полученные тернарные сульфиды являются достаточно однородными по форме, их размеры составляют порядка 1–4 мкм и не зависят от способа подготовки оксидной шихты (рис. 1).
Рис. 1.
Микрофотографии тиоиттрата кальция с различной предысторией получения оксидной шихты: а – керамический метод, увеличение 2500 раз; б – цитратно-нитратный метод, увеличение в 2500 раз.

Рентгенофазовое исследование результатов гетерогенного допирования изучаемых тиолантаноидатов щелочноземельных металлов полупроводниковым дисульфидом циркония показало неоднозначный характер формирования фаз.
В гетерогенной системе (100 – х) мол. % CaY2S4–х мол. % ZrS2 при использовании цитратно-нитратного метода подготовки оксидной шихты после спекания получены трехфазные смеси ZrS2 (гексагональная модификация), CaY2S4 и нового соединения Y2ZrS5 (рис. 2), что полностью совпадает с результатами [24], где использовался керамический метод подготовки шихты.
Рис. 2.
Рентгенограммы гетерогенных смесей: 90 мол. % CaY2S4–10 мол. % ZrS2 (a); 60 мол. % CaY2S4–40 мол. % ZrS2 (б).

Дифрактограммы гетерогенных смесей, полученных в результате допирования тиосамарата бария дисульфидом циркония (рис. 3), содержат рефлексы ионной соли BaSm2S4, взятой в большом избытке относительно гетерогенной добавки, рефлексы непрореагировавшего бинарного сульфида Sm2S3, следы BaS и пики новых сульфидных фаз: BaZrS3 и Ba2SiS4. Рефлексы исходной полупроводниковой добавки ZrS2 отсутствуют. Фаза Ba2SiS4 может образовываться в результате взаимодействия сероуглерода с диоксидом кремния кварцевого реактора с образованием активного порошка дисульфида кремния, который может прореагировать с сульфидом бария сульфидирующейся шихты.
Рис. 3.
Рентгенограммы гетерогенных смесей: 95 мол. % BaSm2S4–5 мол. % ZrS2 (а); 90 мол. % BaSm2S4–10 мол. % ZrS2 (б).

Данные электронно-микрозондового анализа с учетом статистики данных позволяют считать, что заданный элементный состав смеси в результате синтеза сохраняется.
На рис. 4 изображена зависимость концентрации присутствующих в композиционных материалах фаз от заданного количества дисульфида циркония.
Рис. 4.
Зависимость концентрации присутствующих в гетерогенных смесях (100 – х) мол. % BaSm2S4–х мол. % ZrS2 фаз от заданного количества допанта ZrS2.

Присутствие в синтезированных образцах тиосиликата бария указывает на взаимодействие исходных образцов с материалом реактора при выбранных условиях синтеза. Причем концентрацию соединения BaSiS4 можно считать постоянной и равной около 20% вне зависимости от количества заданного сульфида циркония в гетерогенных смесях. Отсутствие в конечном продукте дисульфида циркония можно объяснить взаимодействием BaS с ZrS2 на поверхности раздела фаз с образованием перовскитоподобного BaZrS3, являющегося сульфидпроводящим твердым электролитом [25]. Поэтому концентрация BaZrS3 растет с увеличением количества вводимого допанта в исходной шихте, а концентрация BaSm2S4 – падает.
Образование высокопроводящего слоя BaZrS3 на поверхности раздела фаз может способствовать увеличению электропроводности синтезированных композитов.
Результаты аттестации сложных сульфидных материалов (100 – х) мол. % CaYb2S4–х мол. % ZrS2 методом РФА представлены на рис. 5.
Рис. 5.
Рентгенограммы гетерогенных смесей: 98 мол. % CaYb2S4–2 мол. % ZrS2 (а); 90 мол. % CaYb2S4–10 мол. % ZrS2 (б).
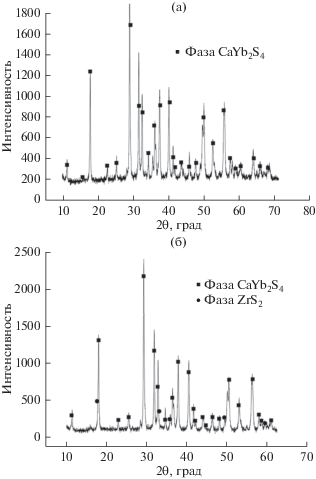
На рентгенограмме материалов, содержащих 2 и 5 мол. % ZrS2, присутствуют пики, относящиеся только к индивидуальному базисному соединению CaYb2S4. Рентгенограммы материала с добавкой от 10 до 40 мол. % ZrS2, кроме основных пиков базисного CaYb2S4, содержат слабые рефлексы ZrS2. Таким образом, допирование тиоиттербиата кальция дисульфидом циркония вплоть до 10 мол. % ZrS2 приводит к образованию однородных твердых растворов. И только при добавлении свыше 10 мол. % дисульфида циркония появляются следы второй фазы.
Для сложных сульфидных материалов изучалась морфология образцов. На рис. 6 и рис. 7 представлены микроструктура и карты элементов гетерогенных смесей (100 – х) мол. % CaYb2S4–х мол. % ZrS2.
Рис. 6.
Микрофотографии гетерогенной смеси 98 мол. % CaYb2S4–2 мол. % ZrS2: а – увеличение в 2500 раз; б – картирование.

Рис. 7.
Микрофотографии гетерогенной смеси 90 мол. % CaYb2S4–10 мол. % ZrS2: а – увеличение в 2500 раз; б – картирование.

Поверхность спеченных материалов всех составов характеризуется однородным распределением частиц. Для образцов с содержанием 2 и 5 мол. % ZrS2 наблюдаются частицы слегка вытянутой формы размером порядка 1 мкм. Для образцов с содержанием 10 и более мол. % ZrS2, кроме того, наблюдаются достаточно крупные агломераты неправильной формы размером порядка 2–10 мкм.
Результаты картирования позволили считать границей однофазной области состав 90 мол. % CaYb2S4–10 мол. % ZrS2.
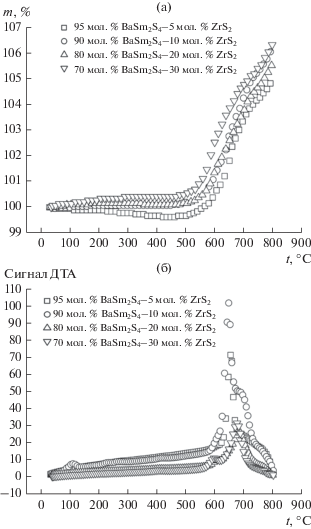
Для определения температурной устойчивости и интервала рабочих температур полученных гетерогенных смесей на воздухе использовали методы ТГА и ДТА. Для всех исследованных систем характерно уменьшение массы (~0.2%), связанное с дрейфом весов термоанализатора, до температуры 773 К и значительное увеличение массы при температуре 813 К, связанное с окислением фаз [26]. Согласно данным ДТА, все гетерогенные смеси на воздухе устойчивы до 813 К, а в системе (100 – х) мол. % BaSm2S4–х мол. % ZrS2 при температуре, близкой 948 К, наблюдается экзотермический пик, связанный скорее всего с образованием новой сульфидной фазы BaZrS3 (рис. 8).
Температурные зависимости электропроводности гетерогенных смесей состава (100 – х) мол. % BaSm2S4–х мол. % ZrS2 (рис. 9а) характеризуются одинаковым наклоном в интервале 525–740 К, а следовательно, одним типом проводимости. Величина энергии активации составляет 0.6–0.7 эВ.
Рис. 9.
Температурные зависимости электропроводности систем: (100 – х) мол. % BaSm2S4–х мол. % ZrS2 (а); (100 – х) мол. % CaYb2S4–х мол. % ZrS2 (б).

Для гетерогенных смесей на основе тиоиттербиата кальция температурные зависимости электропроводности содержат изломы при 620–635 К, связанные с изменением вкладов проводимости компонентов смеси в общую электропроводность (рис. 9б). Энергия активации среднетемпературного интервала (490–620 К) составляет 0.16–0.20 эВ, а в высокотемпературном интервале (620–700 К) увеличивается до 0.32 эВ, что свидетельствует о смешанном типе проводимости анализируемой системы на основе CaYb2S4. (Энергия активации ионного проводника BaSm2S4–Sm2S4 в высокотемпературном интервале составляет 0.7–0.8 эВ, а энергия активации смешанного проводника CaYb2S4–Yb2S4 в высокотемпературном интервале составляет 0.4–0.6 эВ). Межзеренная составляющая проводимости незначительна (рис. 6, 7).
Температурные зависимости ионной проводимости сульфидных смесей состава (100 – х) мол. % CaY2S4–х мол. % ZrS2, представленные на рис. 10, в исследуемом диапазоне температур для всех образцов имеют прямолинейный характер, а энергия активации ионной проводимости варьируется в пределах 0.4–0.66 эВ.
Рис. 10.
Температурные зависимости ионной проводимости системы (100 – х) мол. % CaYb2S4–x мол. % ZrS2.
Электролитические свойства исследованных сульфидных полупродуктов и гетерогенных смесей приведены в табл. 2.
Таблица 2.
Свойства электролитных материалов
| Материал | Электропроводность, См см–1 | Электролитический интервал температур, К |
|---|---|---|
| CaY2S4 | 10–7–10–6 | 620–700 |
| CaYb2S4 | 10–5–10–4 | 570–700 |
| BaSm2S4 | 10–7–10–6 | 620–700 |
| ZrS2 | 10–5.5–10–4.5 | 540–650 |
| CaY2S4–ZrS2 | 10–5–10–4 | 570–700 |
| BaSm2S4–ZrS2 | 10–5–10–4 | 570–700 |
| CaYb2S4–ZrS2 | 10–6–10–5 | 570–700 |
Влияние количества допанта на функциональные свойства исследуемых гетерогенных систем лучше всего прослеживается на изотермических зависимостях электропроводности от состава образцов.
Зависимость электропроводности от предыстории изучалась на примере гетерогенной смеси (100 – х) мол. % CaY2S4–х мол. % ZrS2. Сравнивали данные, полученные в настоящей работе, где использовали химический метод получения оксидного прекурсора, с данными работы [24], в которой использовали керамический метод подготовки оксидной шихты (рис. 11).
Рис. 11.
Изотермические зависимости свойство–состав системы (100 – х) мол. % CaY2S4–х мол. % ZrS2: а – керамическая предыстория; б – цитратно-нитратная предыстория.

В обоих случаях наблюдается рост электропроводности гетерогенных смесей при добавлении в тиоиттрат кальция до 40 мол. % ZrS2. Однако керамическая подготовка увеличивает электропровводность гетерогенных смесей по сравнению со стехиометрическим CaY2S4 на 3 порядка, а цитратно-нитратная – лишь на 2 порядка. Причем добавление к сульфидпроводящему CaY2S4 менее 10 мол. % полупроводникового ZrS2 несколько уменьшает ионную проводимость, очевидно, за счет образования нейтральных вакансий серы в соответствии с уравнением
Дальнейший рост электропроводности скорее всего связан с образованием и локализацией на межзеренных контактах высокопроводящего соединения Y2ZrS5.
Изотермические зависимости электропроводности гетерогенной системы (100 – х) мол. % BaSm2S4–х мол. % ZrS2 с цитратно-нитратной предысторией получения шихты (рис. 12) по характеру подобны смеси, содержащей тиоиттрат кальция. Обнаруженное повышение электропроводности на 2 порядка при добавлении 40 мол. % ZrS2 также можно связать с образованием высокопроводящего соединения BaZrS3 [25] и локализацией его на межзеренных контактах.
Полученный эффект позволяет считать гетерогенные системы (100 – х) мол. % CaY2S4–х мол. % ZrS2 и (100 – х) мол. % BaSm2S4–х мол. % ZrS2, где х = 20–40, композиционными материалами.
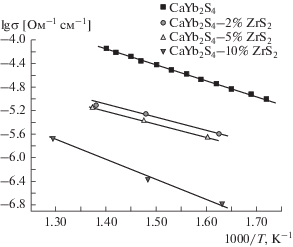
Совсем иная картина наблюдается при допировании тиоиттербиата кальция дисульфидом циркония (рис. 13). При введении в базисную ионную соль полупроводниковой добавки ионная проводимость падает на порядок величины и затем продолжает уменьшаться до 40 мол. % ZrS2. По данным РФА и СЭМ (рис. 6, 7), в этой системе образуется твердый раствор (ТР) и отсутствует взаимодействие базисной соли и допанта. В случае дисульфида циркония и образования однородных ТР на основе CaYb2S4 уменьшается число ионных носителей-заряженных вакансий серы [16], и появляются свободные электроны. При этом вклад ионной проводимости падает. Этот вывод находит подтверждение и в результатах определения чисел переноса, приведенных в табл. 3.
Таблица 3.
Ионные числа переноса образцов системы CaYb2S4–x мол. % ZrS2
| Состав мол. % ZrS2 | ${{\bar {t}}_{i}}$ ± 0.05 | ||
|---|---|---|---|
| 617 К | 673 К | 723 К | |
| 2 | 0.35 | 0.52 | 0.58 |
| 5 | 0.28 | 0.35 | 0.44 |
| 10 | 0.03 | 0.05 | 0.10 |
Кроме того, возможными причинами уменьшения электропроводности при допировании CaYb2S4 дисульфидом циркония могут являться отсутствие высокопроводящей фазы на межзеренных контактах, а также относительно высокая электропроводность базисного тиоиттербиата кальция, что не позволяет считать эту ионную соль диэлектриком. Таким образом, схема диэлектрик–полупроводник в данном случае не работает. Однако эти предположения требуют дальнейшей экспериментальной проверки.
ЗАКЛЮЧЕНИЕ
Были получены сульфидпроводящие полупродукты CaY2S4, CaYb2S4 (СТ Yb3S4) и BaSm2S4 (СТ CaFe2O4) с цитратно-нитратной предысторией, а также полупроводниковый допант ZrS2. Разработаны режимы для получения гетерогенных систем MeLn2S4–ZrS2 (Me–Ca, Ba; Ln–Yb, Y, Sm).
По данным микрозондового анализа, оксидная шихта сульфидирована полностью.
Аттестация полученных гетерогенных смесей методами РФА и СЭМ показала, что в системах CaY2S4–ZrS2 и BaSm2S4–ZrS2 при спекании, наряду с исходными тернарными сульфидами образуются соединения Y2ZrS2 и BaZrS3, соответственно. Спеченные образцы гетерофазны. В тиоиттербиате кальция дисульфид циркония растворяется при добавлении до 10 мол. % ZrS2, при более высоком содержании ZrS2 в спеченных образцах появляется вторая фаза – избыток допанта.
Согласно термогравиметрическому и дифференциальнотермическому анализам, все три исследованные системы термически устойчивы на воздухе до 813 К, при более высоких температурах происходит окисление сульфидов. Термическая устойчивость в аргоне не исследовалась. Импедансспектроскопическое исследование образцов системы CaYb2S4–ZrS2 не выявило сколько-нибудь заметную межзеренную составляющую межфазной проводимости.
Исследование температурной и концентрационной зависимости электропроводности образцов системы (100 – х) мол. % CaY2S4–х мол. % ZrS2 с различной предысторией оксидной шихты показало, что добавление 20–40 мол. % дисульфида циркония увеличивает электропроводность по сравнению с базисным тройным сульфидом, однако цитратно-нитратная подготовка оксидного прекурсора позволяет увеличить электропроводность на два порядка величины, в то время как керамическая подготовка – на три порядка.
При исследовании концентрационной зависимости электропроводности в системе (100 – х) мол. % BaSm2S4–х мол. % ZrS2 также наблюдался рост электропроводности при добавлении 20–40 мол. % ZrS2 на 2 порядка.
Повышение электропроводности при добавлении полупроводникового дисульфида циркония к тиоиттрату кальция и тиосамарату бария, скорее всего, связано с образованием новых высокопроводящих соединений Y2ZrS5 и BaZrS3, соответственно, и локализацией их на межзеренных границах, что приводит к композиционному эффекту.
При исследовании влиянии количества полупроводникового допанта ZrS2 на функциональные свойства CaYb2S4 наблюдается уменьшение электропроводности и ионных чисел переноса в области от 2 до 40 мол. % ZrS2.
Возможными причинами могут служить:
• падение вклада ионной проводимости за счет уменьшения числа заряженных вакансий серы и появления свободных электронов при образовании ТР;
• отсутствие образования высокопроводящей фазы, локализующейся на межзеренных контактах;
• относительно высокая электропроводность базисной ионной соли – тиоиттербиата кальция, что не позволяет считать эту соль диэлектриком, вследствие чего схема диэлектрик–полупроводник не работает.
Высказанные предположения о возможных причинах уменьшения электропроводности при добавлении ZrS2 к CaYb2S4 требуют дальнейшего экспериментального подтверждения.
Список литературы
Коротков, А.С., Хритохин, Н.А., Андреев, О.В. Карты устойчивости структурных типов соединений MLn2X4. Журн. неорган. химии. 2005. Т. 50. № 1. С. 65. [Korotkov, A.S., Hritohin, N.A., and Andreev, O.V., Structure stability maps for MLn2X4 compounds, Russ. J. Inorganic Chem., 2005, vol. 50, no. 1, p. 65.]
Андреев, О.В., Кисловская, Т.М., Кертман, А.В. Фазовые равновесия в системах CaS–Ln2S3 (Ln = = Nd, Gd, Dy). Журн. неорган. химии. 1990. Т. 35. № 5. С. 1280. [Andreev, O.V., Kislovskaya, T.M., and Kertman, A.V., Phase equilibria in systems CaS–Ln2S3 (Ln = Nd, Gd, Dy), Russ. J. Inorganic Chem., 1990, vol. 35, no. 5, p. 1280.]
Рустамов, П.Г., Алиев, О.М., Эйнуллаев, А.В. Хальколантанаты редких элементов. М.: Наука, 1989. 284 с. [Rustamov, P.G., Aliev, O.M., and Einullaev, A.V., Chalcolanthates of rare elements (in Russia), Moscow: Nauka, 1989. 284 p.]
Елисеев, А.А., Кузьмичева, Т.М., Белостоцкий, А.К. Кристаллохимическое прогнозирование и синтез тройных халькогенидов. Журн. неорган. химии. 1980. Т. 25. № 4. С. 895. [Eliseev, A.A., Kuzmicheva, T.M., and Belostotsky, A.K., Crystal chemical prediction and synthesis of triple chalcogenides, Russ. J. Inorganic Chem., 1980, vol. 25, no. 4, p. 895.]
Кузьмичева, Г.М., Андреев, О.В., Абдрахманов, Э.С. Рентгенографическое изучение фаз в системе CaS–Yb2S3 (0–50 мол. % Yb2S3). Журн. неорган. химии. 2003. Т. 48. № 2. С. 320. [Kuzmicheva, G.M., Andreev, O.V., and Abdrakhmanov, E.S., Radiographic study of phases in the system CaS–Yb2S3 (0–50 mol % Yb2S3), Russ. J. Inorganic Chem., 2003, vol. 48, no. 2, p. 320.]
Иванов-Шиц, А.К., Мурин, И.В. Ионика твердого тела: в 2 т. СПб.: Изд-во СПбГУ, 2010. Т. 2. 276 с. [Ivanov-Shits, A.K. and Murin I.V., Ionika of a solid: in 2 v (in Russian), Saint-Petersburg: St.PSU, 2010, vol. 2, 276 p.]
Калинина, Л.А., Широкова, Г.И., Мурин, И.В., Ушакова, Ю.Н. и др. Сульфидпроводящие твердые электролиты. Журн. прикл. химии. 2000. Т. 73. № 8. С. 1324. [Kalinina, L.A., Shirokova, G.I., Murin, I.V., Ushakova, Yu.N., et al., Sulfide-conducting solid electrolytes, Rus. J. Appl. Chem., 2000, vol. 73, no. 8, p. 1396.]
Kalinina, L., Ushakova, Ju., Fominykh, H., Medvedeva, O., Sulphur conductive solid electrolytes in MeS–Ln2S3 systems, Current Appl. Phys., 2008, vol. 8, no. 1, p. 107.
Лялина, М.Ю., Мурин, И.В., Калинина, Л.А., Широкова, Г.И. Синтез и исследование электропроводности твердого электролита BaNd2S4. Вестник СПбГУ. 1994. Т. 1. С. 99. [Lyalina, M.Yu., Murin, I.V., Kalinina, L.A., and Shirokova, G.I., Synthesis and study of the electrical conductivity of solid electrolyte BaNd2S4, Vestnik StPSU (in Russia), 1994, vol. 1, p. 99.]
Калинина, Л.А., Ушакова, Ю.Н., Юрлов, И.С., Байдерина, Т.В., Мурин, И.В. Изучение электрофизических свойств твердых электролитов на основе BaSm2S4. Электрохимия. 2009. Т. 45. № 6. С. 722. [Kalinina, L.A, Ushakova, Y.N., Yurlov, I.S., Bayderina, T.V., and Murin, I.V., Electrochemical properties of solid electrolytes based on BaSm2S4. Russ. J. Electrochem., 2009, vol. 45, no. 6, p. 677.]
Медведева, О.В., Калинина, Л.А., Метлин, Ю.Г., Ушакова, Ю.Н. Синтез и электролитические свойства фаз на основе тиогадолината кальция в зависимости от способа синтеза прекурсора. Электрохимия. 2005. Т. 41. № 5. С. 633. [Medvedeva, O.V., Kalinina, L.A., Ushakova, Yu.N., and Metlin, Yu.G., Synthesis and electrolytic properties of phases based on calcium thiogadolinate as a function of method of the precursor synthesis, Russ. J. Electrochem., 2005, vol. 41, no. 5, p. 555.]
Johnson, V.S., Synthesis and characterisation of ceramic potential sulphide conductors. Doctoral Thesis, Loughborough University, UK, 2005, p. 337.
White, R.J., Synthesis and characterisation of complex sulfide materials with potential use as high temperature inorganic sulfide-ion conductors. Doctoral Thesis, Loughborough University, UK, 2006, p. 416.
Калинина, Л.А., Широкова, Г.И., Лялина, М.Ю., Чернов, С.В., Мурин, И.В., Электрохимическое исследование сульфидпроводящих твердых электролитов. Сборник научных трудов “Электродика твердотельных систем”. 1994. С. 18. [Kalinina, L.A., Shirokova, G.I., Lyalina, M.Yu., Chernov, S.V., and Murin, I.V., Electrochemical study of sulphide-conducting solid electrolytes, Scientific Journal “Elektrodika tverdotel’nykh sistem” (in Russia), 1994, p. 18.]
Михайличенко, Т.В., Калинина, Л.А., Ушакова, Ю.Н., Широкова, Г.И., Токарева, Т.В. Получение и исследование электролитических свойств сложных сульфидных фаз BaSm2S4–Tm2S3. Электрохимия. 2011. Т. 47. № 5. С. 1. [Mikhailichenko, T.V., Kalinina, L.A., Ushakova, Y.N., Shirokova, G.I., Tokareva, T.V., Synthesis of complex sulfide phases BaSm2S4–Tm2S3 and studies of their electrolytic properties, Russ. J. Electrochem., 2011, vol. 47, no. 5, p. 556.]
Ананченко, Б.А., Мякишев, А.О., Кошелева, Е.В., Калинина, Л.А., Мурин, И.В. Влияние состава на характер дефектообразования и ионного переноса в фазах (1 – x)[Ca1 –yYb$_{y}^{{2 + }}$]Yb$_{2}^{{3 + }}$S4 – δYb2S3. Электрохимия. 2017. Т. 53. № 8. С. 899. [Ananchenko, B.A., Myakishev, A.O., Kalinina, L.A., Kosheleva, E.V., and Murin, I.V., Effect of composition on character of defect formation and ion transport in (1 – ‒ x)[Ca1 – yYb$_{y}^{{2 + }}$]Yb$_{2}^{{3 + }}$S4 – δYb2S3, Russ. J. Electrochem., 2017, vol. 53, no. 8, p. 799.]
Ушакова, Ю.Н., Калинина, Л.А., Ананченко, Б.А., Юрлов, И.С., Широкова, Г.И., Фоминых, Е.Г. Электролитические свойства сульфидпроводящих фаз на основе BaLn2S4 и CaLn2S4 различных структурных типов. Физика и химия стекла. 2009. Т. 35. № 3. С. 428. [Ushakova, Y.N., Kalinina, L.A., Ananchenko, B.A., Yurlov, I.S., Shirokova, G.I., and Fominykh, E.G., Electrolytic properties of sulfide-conducting phases based on the BaLn2S4 and CaLn2S4 compounds of different structural types, Glass Physics and Chemistry, 2009, vol. 35, no. 3, p. 332.]
Нейман, А.Я., Пестерева, Н.Н., Zhou, Yu.Y., Нечаев, Д.О. и др. Природа и механизм ионного переноса в вольфраматах Me2+{WO4} (Ca, Sr, Ba) и Me{WO4}3+ (Al, Sc, In) по данным метода Тубандта. Электрохимия, 2013. Т. 49. № 7. С. 999. [Neiman, A.Ya., Pestereva, N.N., Zhou, Yu.Y., and Nechaev, D.O., The nature and mechanism of ion transport in tungstates Me2+{WO4} (Ca, Sr, Ba) and Me{WO4}3+ (Al, Sc, In) according to the method of Tubandt, Russ. J. Electrochem., 2013, vol. 49, no. 7, p. 999.]
Ананченко, Б.А., Михайличенко, Т.В., Калинина, Л.А., Ушакова, Ю.Н., Пентин, М.А., Мякишев, А.О. Влияние метода подготовки оксидного прекурсора на электролитические свойства сульфидпроводящих твердых электролитов. Электрохимия. 2015. Т. 51. № 5. С. 545. [Ananchenko, B.A., Mikhailichenko, T.V., Kalinina, L.A., Ushakova, Yu.N., Pentin, M.A., and Myakishev, A.O., Effect of the method for the preparation of the oxide precursor on the electrolytic properties of sulfide-conducting solid electrolytes, Russ. J. Electrochem., 2015, vol. 51, no. 5, p. 473.]
Калинина, Л.А., Широкова, Г.И., Мурин, И.В., Ушакова, Ю.Н., Фоминых, Е.Г., Лялина, М.Ю. Сульфидпроводящие твердые электролиты. Журн. прикл. химии. 2000. Т. 73. № 8. С. 1324. [Kalinina, L.A., Shirokova, G.I., Murin, I.V., Ushakova, Yu.N., Fominykh, E.G., and Lyalina, M.Yu., Sulfide-conducting solid electrolytes, Russ. J. Appl. Chem., 2000, vol. 73, no. 8, p. 1396.]
Кошурникова, Е.В., Калинина, Л.А., Ушакова, Ю.Н., Пьянкова, М.В., Мурин, И.В. Синтез, структура и физико-химические свойства сульфидной керамики CaY2S4–Yb2S3. Электрохимия. 2013. Т. 49. № 8. С. 858. [Koshurnikova, E.V., Kalinina, L.A., Ushakova, Yu.N., Pyankova, M.V., and Murin, I.V., Synthesis, structure and physico-chemical properties of sulfide ceramics CaY2S4–Yb2S3, Russ. J. Electrochemistry, 2013, vol. 49, no. 8, p. 769.]
Electrical conductivity in ceramics and glass / Ed. Tallan, N.M., N. Y., 1974.
Kuikkola, K. and Wagner, C., Galvanic Cells for the Determination of the Standard Molar Free Energy of Formation of Metal Halides, Oxides, and Sulfides at Elevated Temperatures, J. Electrochem. Soc., 1957, vol. 104, no. 5, p. 308.
Кошелева, Е.В., Пентин, М.А., Калинина, Л.А., Михайличенко, Т.В., Лаптева, Т.А., Ушакова, Ю.Н. Гетерогенное допирование сульфидпроводящих фаз на основе тиолантанатов кальция и бария. Электрохимия. 2017. Т. 53. № 7. С. 887. [Kosheleva, E.V., Pentin, M.A., Kalinina, L.A., Mikhailichenko, T.V., Lapteva, T.A., and Ushakova, Yu.N., Heterogeneous doping of sulfide-conducting phases based on calcium and barium thiolanthanates, Russ. J. Electrochem., 2017, vol. 53, no. 7, p. 790.]
Калинина, Л.А. Исследование тройной системы BaS–ZrS2 с предполагаемой сульфидионной проводимостью: дис. …канд. хим. наук: 02.00.01, М.: МГУ, 1976. 152 с. [Kalinina, L.A., The study of the ternary system BaS–ZrS2 with the alleged sulfide conductivity: dis. … cand. chem. sciences: 02.00.01 (in Russia), Moscow: Moscow State University, 1976, p. 152]
Кертман, А.В., Андреев, О.В. Термоустойчивость фаз ALn2S4 на воздухе и в парах воды. Вестн. ТюмГУ. 2003. № 2. С. 194. [Kertman, A.V. and Andreev, O.V., The thermal stability of ALn2S4 phases in air and in water vapor, Vestnik TymGU, 2003, no. 2, р. 194.]
Дополнительные материалы отсутствуют.