Электрохимия, 2019, T. 55, № 8, стр. 899-918
Подвижность кислорода материалов твердооксидных топливных элементов и каталитических мембран (обзор)
В. А. Садыков a, b, *, Е. М. Садовская a, b, Н. Ф. Еремеев a, **, П. И. Скрябин a, А. В. Краснов a, Ю. Н. Беспалко a, С. Н. Павлова a, Ю. Е. Федорова a, Е. Ю. Пикалова c, d, А. В. Шляхтина e
a Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. академика Лаврентьева, 5, Россия
b Новосибирской государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
c Институт высокотемпературной электрохимии УрО РАН
620137 Екатеринбург, ул. Академическая, 20, Россия
d Уральский федеральный университет им. Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, Россия
e Институт химической физики им. Н.Н. Семёнова РАН
119991 Москва, ул. Косыгина, 4, Россия
* E-mail: sadykov@catalysis.ru
** E-mail: yeremeev21@catalysis.ru
Поступила в редакцию 29.11.2018
После доработки 16.01.2019
Принята к публикации 12.03.2019
Аннотация
Одним из важных факторов, определяющих электрохимическую активность электродов твердооксидных топливных элементов, а также проницаемость кислород- и протонпроводящих мембран на основе материалов со смешанной электронной и кислород-ионной проводимостью, является транспорт кислорода: его подвижность и реакционная способность. В настоящей работе обобщены данные по кислородному транспорту, полученные для ряда материалов таких устройств с использованием современных методик изотопного обмена кислорода. На основании разработанной модели диффузии и обмена кислорода, ряд материалов ТОТЭ и мембран был изучен методом изотопного обмена кислорода с 18O2 и C18O2 в изотермическом и термопрограммированном режимах с использованием закрытого и проточного реакторов. Для материалов твердых электролитов (допированные диоксиды церия и циркония), а также протонпроводящих материалов (Ln5.5(Mo,W)O11.25) показано влияние неоднородности состава на подвижность кислорода. Для Ln6 –xWO12 – δ показано сильное влияние структуры на кислородную подвижность. Для оксидов с асимметричной структурой, в которых перенос кислорода реализуется по кооперативному механизму (La2(Mo,W)2O9, (Ln,Ca)2NiO4), введение допанта нарушает кооперативный перенос, приводя к понижению кислородной подвижности и, в ряде случаев, появлению дополнительных каналов медленной диффузии. Для нанокомпозитов PrNi0.5Co0.5O3–Ce0.9Y0.1O2, являющихся материалами катода ТОТЭ и функционального слоя кислородпроводящих мембран, наблюдалось наличие 2-х каналов диффузии, причем более подвижный кислород соответствует фазе со структурой флюорита и межфазным границам, а менее подвижный – фазе со структурой перовскита. Это реализуется благодаря особенностям перераспределения катионов между фазами.
ВВЕДЕНИЕ
Твердооксидные топливные элементы (ТОТЭ) являются экологически безопасными устройствами для получения электроэнергии из водорода или синтез-газа. ТОТЭ являются перспективными источниками энергии для стационарных энергоустановок [1–8]. Водород или синтез-газ, энергию которых преобразуют в электрическую, получают из топлива (в том числе биотоплива) как непосредственно на аноде (внутренний риформинг) [7, 9, 10], так и в различного рода реакторах (внешний риформинг), в том числе на основе каталитических мембран (кислород- и протонпроводящих) [3, 5, 7, 11–13]. Такие мембраны обладают селективной проницаемостью по водороду и кислороду и позволяют получать водород или синтез-газ в каталитической реакции путем выделения реагента (кислород) или продукта (водород).
Одним из важных факторов, определяющих электрохимическую активность электродов ТОТЭ со смешанной электронной и кислород-ионной проводимостью, является транспорт кислорода: его подвижность и реакционная способность [5, 14–16]. В частности, известная модель Адлера–Лэйна–Стила [14, 17, 18] связывает электрохимическую активность электродов с подвижностью и реакционной способностью кислорода материала, из которого изготовлен электрод, наряду с другими факторами, такими как морфологические и текстурные характеристики электрода. Эти свойства являются важными характеристиками катода, так как в случае низкой кислородной подвижности проходящая на нем реакция восстановления кислорода лимитируется трехфазной границей газ/катод/электролит.
Помимо очевидного влияния транспорта кислорода на работу кислородпроводящих мембран, он влияет и на работу протонпроводящих мембран: во-первых, один из механизмов протонного транспорта предполагает участие структурных гидроксилов (“экипажный” механизм) [19]; во-вторых, дополнительный выход водорода может быть получен реакцией разложения воды с последующим переносом анионов кислорода через мембрану [20]. Поэтому необходимость исследования подвижности и реакционной способности кислорода материалов ТОТЭ и каталитических мембран не вызывает сомнения.
Подвижность кислорода и его реакционная способность на поверхности исследуются рядом методов, включая измерение ионной проводимости, изотопный обмен кислорода, релаксационные методы и т.д. [7, 21–29]. Для методов изотопного обмена, в силу различных скоростей обмена в газовой фазе и в образце существенно большая скорость во втором случае позволяет корректно регистрировать скорость обмена в образце, благодаря чему метод получил широкое развитие. Явление изотопного обмена известно с начала XX в. Первыми работами, в которых использовался обмен с применением стабильных изотопов для изучения кинетики обмена кислорода с оксидными системами, можно считать работы Цименса (Zimens) и Винтера (Winter), которые были опубликованы в конце 1940-х–начале 1950‑х годов [30, 31]. В конце 1950‑х годов была описана кинетика изотопного обмена кислорода на поверхности простых оксидов [32], однако данная модель нуждалась в существенной доработке. В 1960-е годы большой вклад в развитие методов изотопного обмена кислорода внесли советские ученые Г.К. Боресков, В.С. Музыкантов и другие, которые начали отходить от исследования чистых оксидов и перенесли применение методов на другой уровень, применяя его для исследования замещенных оксидов, композитов и т.д. [21]. Одновременно и независимо К. Клиром (Klier) и соавторами также была предложена теория изотопного обмена [33]. Впоследствии как методы проведения эксперимента, так и модели для расчета характеристик подвижности кислорода были усовершенствованы: за последние четверть века за рубежом исследования представлены работами Килнера (Kilner) [22, 25, 34], Адлера (Adler) [35], и других авторов [36, 37]; в России, в частности, известны работы Садовской [23, 24, 38], Курумчина, Ананьева [39–41].
На данный момент принято различать два основных варианта метода изотопного обмена кислорода:
1. Метод изотопного обмена кислорода с анализом газовой фазы в различных динамических условиях (динамический, статический, статический с циркуляцией, импульсный) [23, 24, 38–42].
2. Метод изотопного обмена кислорода с анализом концентрации изотопов в твердом теле и с анализом профиля распределения метки в объеме образца [22, 25, 34, 37].
В настоящей работе обобщены данные по кислородному транспорту, полученные авторским коллективом для ряда материалов ТОТЭ и каталитических мембран с использованием современных методик изотопного обмена кислорода с анализом газовой фазы.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Взаимодействие O2 с оксидами идет по механизму диссоциативной адсорбции–десорбции [43–45], включающему стадии:
1) физической адсорбции;
2) химической адсорбции с диссоциацией:
3) внедрения (собственно обмен):
Эффективная константа обмена keff определяется как коэффициент пропорциональности между изменением концентрации кислородных вакансий ${{C}_{{V_{{\text{O}}}^{{ \bullet \bullet }}}}}$ и вызванным им потоком обменивающегося кислорода (j):
В состоянии равновесия keff = kex, которую можно выразить как
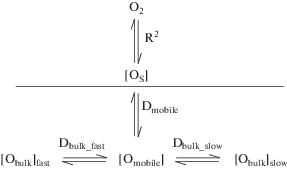
Процесс переноса каждого типа частиц i в объеме твердого тела в отсутствие градиента химического потенциала можно описать коэффициентом самодиффузии или коэффициентом хаотической диффузии Di, который подчиняется законам Фика. Стоит отметить, что коэффициент самодиффузии изотопа кислорода $D_{{\text{O}}}^{*}$ (англ. tracer diffusion coefficient), определяемый методами изотопного обмена кислорода, связан с коэффициентом самодиффузии кислорода DO (англ. oxygen self-diffusion coefficient) соотношением:
где fO – корреляционный множитель (как правило, 0.5 ≤ fO ≤ 1), соответствующий взаимному влиянию встречных потоков анионов природного и меченного изотопов кислорода [34].Отношение коэффициента диффузии и константы обмена называется характеристической толщиной LC = DO/kex. Если характерный размер частицы образца больше LC, то диффузия является лимитирующим процессом, если меньше, то лимитирует обмен [47].
При введении изотопной метки происходит процесс изотопного обмена кислорода, который протекает по трем кинетически независимым типам механизмов обмена, которые, по классификации Музыкантова [21, 23], подразделяются на:
1. Гомообмен без участия атомов кислорода оксида, твердого раствора или нанокомпозита (тип I, скорость обмена обозначается R0):
(1)
${}^{{16}}{{{\text{O}}}_{2}} + {}^{{18}}{{{\text{O}}}_{2}} = 2{}^{{16}}{\text{O}}{}^{{18}}{\text{O}}{\text{.}}$2. Простой гетерообмен с участием одного атома кислорода оксида, твердого раствора или нанокомпозита (тип II, R1):
(2)
$^{{18}}{{{\text{O}}}_{2}} + \left[ {{}^{{16}}{\text{O}}} \right] = {}^{{16}}\operatorname{O} {}^{{18}}{\text{O}} + \left[ {{}^{{18}}{\text{O}}} \right].$3. Сложный (двухстадийный обмен) с участием двух атомов кислорода оксида, твердого раствора или нанокомпозита (тип III, R2):
(3)
$^{{18}}{{{\text{O}}}_{2}} + 2\left[ {{}^{{16}}{\text{O}}} \right] = {}^{{16}}{{{\text{O}}}_{2}} + 2\left[ {{}^{{18}}{\text{O}}} \right].$В общем случае модель изотопного обмена между кислородсодержащим реагентом газовой фазы (O2 или СO2) и кислородом оксида, твердого раствора или нанокомпозита можно представить в виде уравнений изотопной кинетики [23, 24, 48]:
(4)
$\frac{{\partial {{{\alpha }}_{{\text{g}}}}}}{{\partial t}} + {\text{O}}(\tau ) = \frac{{{{N}_{{\text{s}}}}}}{{{{N}_{{\text{g}}}}}}{{R}^{\sum }}({{{\alpha }}_{{\text{s}}}} - {{{\alpha }}_{{\text{g}}}}),$(5)
$\frac{{\partial {{{\alpha }}_{{\text{s}}}}}}{{\partial t}} = {{R}^{\sum }}({{{\alpha }}_{{\text{g}}}} - {{{\alpha }}_{{\text{s}}}}) - \frac{{{{N}_{{{\text{bulk}}}}}}}{{{{N}_{{\text{s}}}}}}\frac{{{{D}_{{\text{O}}}}}}{{{{h}^{2}}}}{{\left. {\frac{{\partial {{{\alpha }}_{{{\text{bulk}}}}}}}{{\partial {\eta }}}} \right|}_{{{\eta } = 0}}},$(6)
$\frac{{\partial {{{\alpha }}_{{{\text{bulk}}}}}}}{{\partial t}} = \frac{{{{D}_{{\text{O}}}}}}{{{{h}^{2}}}}\frac{{{{\partial }^{2}}{{{\alpha }}_{{{\text{bulk}}}}}}}{{\partial {{{\eta }}^{2}}}},$(7)
$\begin{gathered} \frac{{\partial {{f}_{{16 - 18}}}}}{{\partial t}} + {\text{O}}({\tau }) = {{R}^{0}}(2{{{\alpha }}_{{\text{g}}}}(1 - {{{\alpha }}_{{\text{g}}}}) - {{f}_{{16 - 18}}}) + \\ + \,\,\frac{{{{N}_{{\text{s}}}}}}{{{{N}_{{\text{g}}}}}}({{R}^{2}}(2{{{\alpha }}_{{\text{s}}}}(1 - {{{\alpha }}_{{\text{s}}}}) - {{f}_{{16 - 18}}}) + \\ + \,\,{{R}^{1}}({{{\alpha }}_{{\text{g}}}}(1 - {{{\alpha }}_{{\text{s}}}}) + {{{\alpha }}_{{\text{s}}}}(1 - {{{\alpha }}_{{\text{g}}}}) - {{f}_{{16 - 18}}})). \\ \end{gathered} $Начальные и граничные условия: $t = 0 \Rightarrow {{{\alpha }}_{i}} = {\alpha }_{i}^{0}.$
В уравнениях (4)–(7) αg, αs и αbulk – атомные доли 18O в газофазном реагенте, на поверхности и в объеме образца, соответственно; Ng, Ns и Nbulk – количество атомов кислорода в газовой фазе, на поверхности и в объеме оксида; f16–18 – молекулярная доля 16O18O (в случае обмена с O2) или С16O18O16 (в случае с CO2); R0, R1, R2 – скорости различных типов обмена по классификации Музыкантова [21] (уравнения (1)–(3)); RΣ = 0.5R1 + + R2 − общая скорость гетерообмена, DO – коэффициент самодиффузии кислорода, h – характеристический размер частицы образца, η – безразмерная величина удаленности от поверхности; t – время; O(τ) – оператор, зависящий от режима массопереноса в реакторе:
Константа обмена на поверхности kex может быть пересчитана как
В изотермическом случае скорости обмена и коэффициенты диффузии принимаются постоянными. Для описания термопрограммированных экспериментов скорости обмена и коэффициенты диффузии выражаются аррениусовcкой зависимостью:
Рис. 1.
Термопрограммированный изотопный обмен кислорода с C18O2 в проточном реакторе для образцов Pr2NiO4 + δ (1, 1 '), Pr1.7Ca0.3NiO4+δ (2, 2 ') и Pr1.4Ca0.6NiO4 + δ (3, 3 ') [49]. Точки – эксперимент, линии – модель.

При обработке данных, полученных в изотермических экспериментах, возможен расчет значений kex и DO без применения численных методов. Подробно алгоритм вычисления константы обмена и коэффициента диффузии изложен в работе [38]. Скорость обмена можно определить следующим образом:
где b – отношение количества атомов кислорода в образце и в газовой фазе; R = RΣ/Nas – приведенная на число активных центров скорость гетерообмена; ατ и αinput – атомные доли 18O в газофазном реагенте при времени контакта в реакторе τ и на входе в реактор, соответственно. В случае лимитирования диффузией ${{e}^{{ - {\tau }bR}}} \approx 0.$Нахождение значения коэффициента диффузии производится по пределу
Также для полуколичественной оценки подвижности кислорода в термопрограммированном режиме в статической установке используется динамическая степень изотопного обмена (XS), которая показывает число монослоев, обменявшихся при достижении определенной температуры [50, 51]:
МАТЕРИАЛЫ ЭЛЕКТРОДОВ ТОТЭ И КИСЛОРОДПРОВОДЯЩИХ МЕМБРАН
Перовскиты и нанокомпозиты на их основе как материалы катодов ТОТЭ и кислородпроводящих мембран
Одними из самых распространенных материалов как катодов ТОТЭ, так и кислородпроводящих мембран являются оксиды со структурой перовскита ABO3 либо материалы на их основе. Классическими катодными материалами являются манганиты лантана, допированные стронцием (La1 –xSrxMnO3 – δ, LSM). Несмотря на низкую кислородную подвижность, способность к взаимодействию с электролитами на основе диоксидов циркония и церия с образованием низкопроводящих фаз цирконатов/цератов лантана и стронция и ряд других недостатков, благодаря высокой удельной электропроводности они широко используются до сих пор [1–8, 52, 53]. Улучшению кислородной подвижности способствуют также и иные подходы к модификации манганита лантана, в том числе допирование другими щелочноземельными металлами и фтором [52–56]. В частности, значения DO при 400°C для LaMnO3.19 и LaMnO3.19F0.2 составляют 2 × 10–19 и 1.9 × 10–18 см2/с соответственно. Для Ca-допированных манганитов данный эффект также наблюдался, хоть и в меньшей степени: DO = 2 × 10–19 и 3 × 10–19 см2/с для La0.8Ca0.2MnO3.07 и La0.8Ca0.2MnO3.07F0.2 при 400°C соответственно. Схожие тенденции были показаны и для скорости обмена кислорода [55]. Была показана корреляция между кислородной подвижностью и структурными характеристиками: большие значения DO были показаны для образцов с большей длиной связи Mn–O (и, соответственно, более слабой связью) и меньшим координационным числом Mn–O [54].
В работах [57–62] было показано, что существенное отклонение от кислородной стехиометрии в перовскито-подобных оксидах сопровождается наноструктурированием, при этом доменные границы являются каналами облегченной диффузии. Таким образом процесс кислородного транспорта в наноструктурированных оксидах может быть описан двумя коэффициентами диффузии: Dv – в объеме зерна и Dgb – по границам зерен, который на несколько порядков выше, чем Dv.
Создание нанокомпозитов с материалами, обладающими высокой кислородной проводимостью, в частности с материалами электролита, увеличивает подвижность кислорода благодаря влиянию развитой межфазной границы, обеспечивающей быстрый перенос кислорода, что, в частности, было продемонстрировано для нанокомпозита LSM со стабилизированным скандием и церием диоксидом циркония (ScCeSZ) [5, 6, 63].
Альтернативами LSM являются допированные стронцием ферриты-никелаты La1 –xSrxFe1 –yNiyO3 – δ и ферриты-кобальтиты лантана La1 –xSrxFe1 –yCoyO3 – δ (LSFN и LSFC, соответственно), а также нанокомпозиты на их основе. Они обладают высокой кислородной подвижностью и его реакционной способностью на поверхности [5, 6]. В частности, для состава La0.8Sr0.2Fe0.7Ni0.3O3 – δ было показано, что при 700°C значение коэффициента диффузии для объема составляет 6 × 10–14 см2/с, а по межзеренным границам – не менее 4 × 10–9 см2/с. Для нанокомпозита с допированным гадолинием диоксидом церия (GDC или CGO) состава Ce0.9Gd0.1O1.95 (Dv > 7 × 10–14 и Dgb > 2 × 10–9 см2/с при 700°C) значения коэффициента диффузии ≥3 × 10–13, 9 × 10–14 и ≥5 × 10–9 см2/с при 700°C для фаз перовскита, флюорита и по их межфазной границе соответственно [64]. По сравнению с LSFN и LSFC, для нанокомпозитов LSFN–GDC и LSFC–GDC скорость обмена кислорода также в несколько раз выше [65]. Такая тенденция обусловлена указанным выше преимуществом нанокомпозитов перед индивидуальными оксидами. Предложенная схема кислородного транспорта в таких композитах проиллюстрирована на рис. 2 [6].
Рис. 2.
Гетерогенная модель изотопного обмена с нанокомпозитом GDC–LSFN0.3. Рисунок позаимствован из [6] на правах лицензии Creative Commons Attribution-NonCommercial-NoDerivs 3.0.
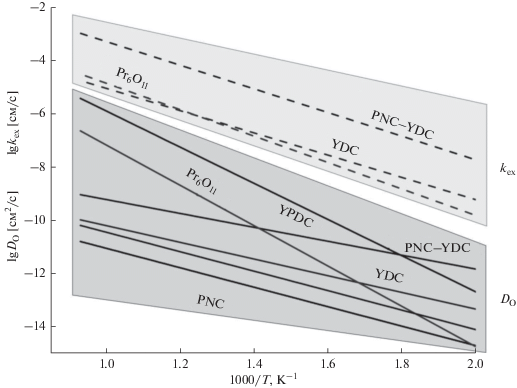
Однако перовскиты с катионами La3+ и щелочноземельных металлов в A-положении имеют способность к взаимодействию с электролитами на основе диоксидов циркония и церия с образованием плохо проводящих фаз цирконатов/цератов лантана и стронция, а также склонны к карбонизации [3, 5, 6]. Поэтому необходим поиск химически стабильных материалов, кислородная подвижность и реакционная способность которых не уступала бы LSFN, LSFC и нанокомпозитам на их основе. Один из путей решения данной проблемы – отказ от допирования Sr и другими щелочноземельными металлами, а также использование катионов меньшего радиуса (например, Pr3+) в A-положении, цераты и цирконаты которых термодинамически нестабильны [1, 2]. В частности, хорошие характеристики были показаны для никелатов-кобальтитов празеодима PrNi1 –xCoxO3 – δ (PNC) и их нанокомпозитов с допированным иттрием диоксидом церия Ce0.9Y0.1O2 – δ (YDC или CYO) [6, 7, 66–71]. Было показано, что PNC сами по себе обладают высокой кислородной подвижностью и реакционной способностью, а их нанокомпозиты PNC–YDC не уступают или даже превосходят LSFN–GDC и LSFC–GDC по данным параметрам. Это достигается как за счет описанного выше влияния развитой межфазной границы, так и за счет перераспределения катионов между фазами. Миграция катионов празеодима в фазу флюорита увеличивает кислородную подвижность этой фазы за счет того, что катионы могут легко менять заряд 4+/3+. Это приводит к образованию широкого канала быстрой диффузии по межфазным границам и фазе флюорита. Это, в частности, подтверждается свойствами кислородного транспорта отдельно синтезированных материалов, которые входят в состав таких нанокомпозитов (рис. 3) [71].
Рис. 3.
Зависимость коэффициента самодиффузии и константы обмены кислорода PNC, PNC–YDC и индивидуальных фазовых составляющих. Рисунок позаимствован из [71] на правах лицензии CC BY-NC-ND.
Фазы Раддлсдена–Поппера и нанокомпозиты на их основе как материалы катодов ТОТЭ и кислородпроводящих мембран
Фазы Раддлсдена–Поппера (РП) – оксиды со структурой, представляющей собой чередующиеся слои со структурой перовскита и каменной соли. Они являются перспективными для катодов СТ ТОТЭ и кислородпроводящих мембран, так как обладают высокой подвижностью кислорода, стабильны к карбонизации, совместимы со многими электролитами и обладают умеренным КТР [6, 16, 72–75]. Общая формула таких соединений An+ 1BnX3n+ 1 (n = 1, 2, 3…), где A и B – катионы, X – анион (в т.ч. O2–), a n – число октаэдрических подслоев в слое перовскита; таким образом, при n = 1 это K2NiF4-подобные соединения, а при n → ∞ структура превращается в перовскитоподобную. В данной части будут рассмотрены материалы на основе первых гомологов фаз РП.
Высокая кислородная подвижность фаз РП типа Ln2NiO4 + δ (Ln = La, Pr, Nd, …) (DO ~ 10–8 см2/с при 700°C [41, 74–78]) обусловлена особенностями структуры. Кооперативный механизм переноса кислорода включает как межузельный кислород слоев со структурой каменной соли, так и регулярный кислород слоев со структурой перовскита. При этом слои со структурой каменной соли способны аккумулировать большие количества высокоподвижного межузельного кислорода, в то время как в слоях со структурой перовскита, в зависимости от состава, могут содержаться кислородные вакансии. За счет вовлеченности обоих типов слоев достигается высокая кислородная подвижность [76, 79–81]. Несмотря на сосуществование двух структурно различимых форм кислорода, по причине реализации кооперативного механизма переноса с кинетической точки зрения эти формы становятся эквивалентными, что и отражается при моделировании кривых изотопного обмена.
Были изучены различные модификации первых гомологов фаз РП. Для ряда дефицитных по A-положению никелатов празеодима Pr2 –xNiO4 + δ (x = 0 – 0.3) не обнаружено значительных изменений подвижности и реакционной способности кислорода в зависимости от x [79]. О схожих результатах для катион-дефицитных Nd2 –xNiO4 + δ сообщается в работе [37]. Иное же поведение наблюдалось для никелата празеодима с высоким содержанием допанта, а также для допированных катионами щелочноземельных металлов никелатов лантана. Примеры кривых изотопного обмена с C18O2 для Pr2 –xCaxNiO4 + δ приведены на рис. 1. В зависимости от природы исходного катиона A-положения и катиона допанта, а также от степени допирования значительное уменьшение подвижности и реакционной способности кислорода в ряде случаев может приводить к образованию 1–2 дополнительных каналов медленной диффузии кислорода [48, 49, 76, 77, 82]. В частности, для допированных катионами различных щелочноземельных металлов никелатов лантана La1.7M0.3NiO4 + δ (M = Ca, Sr, Ba) было продемонстрировано, что, помимо канала быстрой диффузии кислорода, существует и канал медленной диффузии, с коэффициентом диффузии на 2‒3 порядка ниже по сравнению с первым (Dfast ~ ~ 10–9 см2/с и Dslow ~ 10–12 – 10–11 см2/с при 700°C), причем доля кислорода, вовлеченного в канал медленной диффузии, возрастает с радиусом катиона допанта (40, 60 и 75% для M = Ca, Sr и Ba соответственно, рис. 4а) [76]. В ряду Ln2 –xCaxNiO4 + δ (Ln = La, Pr, Nd, x = 0 – 0.5) для Ln = La образование дополнительного канала диффузии наблюдалось уже для x = 0.3 [48, 76, 77], в то время как для Ln = Pr это происходило лишь при x ≥ 0.4 [49], а для Ln = Nd, несмотря на некоторое уменьшение подвижности кислорода по сравнению с недопированным Nd2NiO4 + δ в области средних и высоких температур, образования дополнительных каналов диффузии не наблюдалось для x = = 0–0.5 [72, 73]. Сравнение значений коэффициента самодиффузии кислорода для допированных Ca никелатов Ln приведено на рис. 4б.
Вышеперечисленное позволяет предположить следующие возможные причины уменьшения подвижности кислорода, обусловленные допированием катионами щелочноземельных металлов. Первая связана с компенсацией изменения заряда катионов A-положения путем изменения заряда катионов Ni3+/2+ и потерей высокоподвижного межузельного кислорода слоев со структурой каменной соли [37, 76]. Вторая связана со стерическими затруднениями при переносе межузельного кислорода в слоях со структурой каменной соли, а именно через треугольник Ln3 –xMx (Ln = La, Pr; M = Ca, Sr, Ba) [37, 76], что приводит к нарушению кооперативного механизма переноса кислорода и появлению дополнительного канала медленной диффузии по слоям со структурой перовскита (при наличии вакансий) либо по слоям со структурой перовскита и каменной соли (частичная блокировка переноса через треугольник Ln3 –xCax) [76, 83]. При этом снижение константы обмена кислорода может быть связано с карбонизацией активных центров на поверхности оксидов [76].
Тем не менее, подвижность и реакционная способность кислорода фаз РП на основе никелатов Ln остаются на уровне традиционных и современных материалов катодов ТОТЭ или даже его превосходят [5–7].
Для нанокомпозитов Pr1.9NiO4 + δ–Сe0.9Gd0.1O2 – δ (PN–GDC) и Pr1.9NiO4 + δ–Y2(Ti0.8Zr0.2)1.6Mn0.4O7 – δ (PN–YTZM) наблюдалось уменьшение значений коэффициента самодиффузии кислорода на ~1 и ~1.5 порядка по сравнению с Pr1.9NiO4 + δ, соответственно (рис. 5). Это может быть связано с влиянием перераспределения катионов между фазами. В случае с PN–GDC внедрение катионов гадолиния в слои со структурой каменной соли приводит к нарушению кооперативного механизма переноса кислорода. В случае с PN–YTZM, внедрение катионов титана, марганца и циркония в положение катионов никеля слоев со структурой перовскита приводит к увеличению энергии связи M–O и, тем самым, еще сильнее уменьшает подвижность кислорода в объеме нанокомпозита. На данный момент нельзя однозначно сказать, выше или ниже скорость обмена кислорода на поверхности: разные методы показывают как увеличение, так и уменьшение скорости обмена для этих нанокомпозитов, что может быть объяснено как сильной чувствительностью скорости обмена кислорода для данных нанокомпозитов к парциальному давлению кислорода и другим условиям эксперимента, так и другими факторами [80].
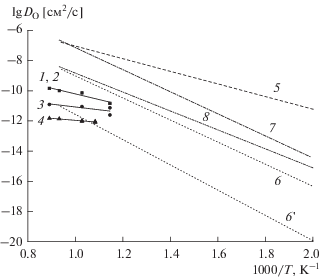
Рис. 5.
Зависимость коэффициента самодиффузии кислорода от температуры в координатах Аррениуса для материалов на основе никелатов лантаноидов: 1 – Pr2NiO4 + δ [80], 2 – Pr1.9NiO4 + δ [80], 3 – Pr1.9NiO4 + δ – Ce0.9Gd0.1O2 – δ [80], 4 – Pr1.9NiO4 + δ–Y2(Ti0.8Zr0.2)1.6Mn0.4O7 – δ [80], 5 – Pr2NiO4 + δ [49, 76, 77], 6, 6' – Pr1.6Ca0.4NiO4 + δ [49], 7 – Nd2NiO4 + δ [76, 77, 83], 8 – Nd1.6Ca0.4NiO4 + δ [83]; 6 – Dfast, 6' – Dslow.
Материалы анодов ТОТЭ
Широко используемыми являются керамометаллические аноды, особенно нанокомпозит никеля и стабилизированного иттрием диоксида циркония Ni/Zr0.84Y0.16O2 – δ (Ni/YSZ). Аноды из Ni/YSZ показывают превосходные каталитические характеристики и высокую стабильность в ТОТЭ, работающих на водороде [84]. Однако, для работы таких ТОТЭ необходимо получение водорода. Как указывалось выше, для достижения этой цели могут использоваться каталитические реакторы на основе кислород- и протонпроводящих мембран. Другим путем решения проблемы является разработка анодов, которые могут работать на более доступных видах топлива (природный газ, биотоплива и т.д.) и осуществлять его внутренний риформинг [7, 9, 10]. К сожалению, аноды на основе Ni/YSZ склонны к коксованию в таких условиях. Перспективными являются нанокомпозиты на основе наночастиц Ni или Ni-содержащего сплава на поверхности оксидов с высокой подвижностью и реакционной способностью кислорода, которые стабильны в восстановительных условиях. Бифункциональность таких материалов достигается за счет активации молекул топлива на активных центрах металлических частиц, а кислородсодержащих молекул – на поверхности оксида с последующим быстрым переносом кислорода к металлическим частицам и взаимодействию с фрагментами молекул топлива с образованием синтез-газа [85–88].
Одним из наиболее простых вариантов дизайна анодов является модификация поверхности традиционного Ni/YSZ-анода нанокомпозитами на основе сложных оксидов и металлов платиновой группы [89]. В частности, при использовании метана в качестве топлива перспективными являются аноды на основе Ni/YSZ, модифицированные Pt и Pd, нанесенными на смешанный оксид церия-циркония [51, 90]. Был исследован ряд таких катализаторов на основе Ce0.5Zr0.5O2, допированных 5–30 ат. % Ln (Ln = La, Pr, Sm, Gd) с нанесенными 1.4 вес. % Pt. Было показано, что с увеличением содержания допанта Ln уменьшается динамическая степень обмена XS (см. Теоретический анализ, уравнение (8)) [90]. Это может быть объяснено тем, что предпочтительное расположение кислородных вакансий в координационной сфере катионов допанта приводит к перестройке локальной структуры, и, следовательно, к увеличению координационного числа Zr–O, плотности микронапряжений и т.п. Действительно, была показана такая корреляция, когда увеличение координационного числа Zr–O соответствовало уменьшению XS (табл. 1) [50, 90–93]. Стоит отметить, что небольшое увеличение кислородной подвижности для образца с максимальным содержанием Pr может быть объяснено появлением пар Pr3+/Pr4+ на границах доменов, которые приводят к появлению смешанной ионной-электронной проводимости.
Таблица 1.
Динамическая степень обмена XS образцов Pt/M0.3Ce0.35Zr0.35O2 и эффективное координационное число Zr–O N* образцов M0.3Ce0.35Zr0.35O2 (M = = La, Sm и Gd) [90]
| M = | La | Sm | Gd |
|---|---|---|---|
| XS, монослоев | 0.7 | 0.1 | <0.1 |
| N* | 4.5; 2.9 | 4.6; 2.9 | 4.9; 3.1 |
МАТЕРИАЛЫ ЭЛЕКТРОЛИТОВ ТОТЭ
Флюориты
Оксиды и твердые растворы со структурой флюорита на основе диоксида циркония являются давно и широко распространенными материалами для электролитов ТОТЭ. Стабилизированный иттрием диоксид циркония Zr0.84Y0.16O2 – δ (YSZ) стал традиционным электролитом [4]. Широкая популярность YSZ обусловлена главным образом его высокой химической стабильностью. Однако, YSZ обладает нужной для работы ячейки высокой ионной проводимостью только в области температур 850°C и выше, поэтому, как правило, используется в высокотемпературных ТОТЭ. Для снижения рабочей температуры необходим поиск материалов с более высокой ионной проводимостью. Стабилизированный скандием диоксид циркония (ScSZ) является перспективным электролитом СТ ТОТЭ ввиду повышенной ионной проводимости и неплохой химической стабильности [94]. Были исследованы кубические (Fm3m) флюориты на основе диоксида циркония, стабилизированного 10 вес. % Sc (10ScSZ), и допированного 1 вес. % Ce 10ScSZ (1Ce10ScSZ) [95]. Были продемонстрированы высокая подвижность и реакционная способность кислорода для обоих материалов, причем скорость гетерообмена кислорода для 1Ce10ScSZ была выше по сравнению с 10ScSZ, что может быть вызвано сегрегацией катионов церия на поверхности. Также известны флюориты на основе диоксида циркония, стабилизированного Yb и другими катионами, однако, YSZ представляет собой среди материалов на основе диоксида циркония компромисс между ионной проводимостью и стабильностью к восстановлению [96].
Электролиты на основе диоксида церия являются альтернативой электролитам на основе диоксида циркония по причине высокой кислородной подвижности [97]. Была изучена подвижность и реакционная способность допированного гадолинием диоксида церия Ce1 –xGdxO2 – δ (GDC) (x = 0 – 0.5). Было показано, что максимальное значение динамической степени обмена XS достигается при x = 0.2 [98]. Такое поведение коррелирует с плотностью кислородных вакансий в объеме и на поверхности доменов, что является следствием двух процессов: образования кислородных вакансий и сегрегации катионов Gd3+, которые сильнее связаны с кислородом на поверхности, причем последнее явление хорошо известно для электролитов на основе диоксида церия [99]. Аналогичное явление наблюдалось и для допированого самарием диоксида церия (SDC), однако кислородная подвижность Ce0.8Sm0.2O1.9 была несколько ниже по сравнению с Ce0.8Gd0.2O1.9 [100]. Также интерес представляет допированный иттрием диоксид церия (YDC) [8, 96]. Однако главной проблемой материалов на основе диоксида церия является недостаточная стабильность к восстановлению, так как катионы Ce способны восстанавливаться до Ce3+, что приводит к росту электронной проводимости, которая недопустима для электролитов [101].
В табл. 2 приведено сравнение подвижности кислорода различных флюоритов [71, 102]. Стоит добавить, что рассмотренные выше флюоритоподобные оксиды/твердые растворы и их аналоги могут быть применены как основа для катализаторов различных процессов, в том числе в качестве каталитических слоев кислород- и протонпроводящих мембран, а также в качестве добавок для электродов ТОТЭ, что и было описано выше.
Апатиты
Помимо флюоритоподобных оксидов и твердых растворов, благодаря высокой кислородной подвижности привлекают внимание материалы со структурой апатита на основе допированных силикатов лантана (La1 –xMx)10((Si1 –xRx)O4)6X2 (M = Mg2+, Ca2+ и т.д.; R = Ge4+, P5+ и т.д.; X = O2–, OH–, F– и т.д.). Такие материалы имеют высокую кислород-ионную проводимость в области средних температур [103, 104]. Исходя из традиционных представлений о транспорте кислорода в апатитах на основе силиката лантана, предполагается, что он происходит с участием межузельного кислорода благодаря особенностям дефектной структуры [105]. Катионы с координационным числом 7 формируют каналы вдоль оси c, по которым осуществляется быстрая диффузия кислорода [104]. При кислородной сверхстехиометрии или дефиците катионов происходит смещение анионов кислорода таких каналов из центра в межузельную позицию [103–106]. Таким образом, реальная/дефектная структура и, как следствие, кислородная подвижность зависят от состава апатитов: для апатитов с катионными вакансиями (например, La9.33Si6O26) или с избыточным кислородом (например, La9.67Si6O26.5 и La9SrSi6O26.5) она выше по сравнению со стехиометрическими (например, La8Sr2Si6O26).
Однако, в более поздних работах выдвигаются предположения, что перенос кислорода в апатитах осуществляется по более сложному механизму. Исходя из высоких значений динамической степени обмена XS следует, что в переносе участвует не только межузельный кислород [104, 106]. По всей видимости, имеет место кооперативный перенос по аналогии с фазами РП (см. выше) или переносом протонов по механизму Гроттгуса. В модели диффузии кислорода, предложенной Кендрик (Kendrick) и соавторами [103], ионный перенос включает кооперативные смещения силикатной субструктуры, которые сопровождаются образованием одних связей Si–O и разрывом других связей Si–O. Такой механизм позволяет материалам на основе силиката лантана иметь близкие к таковым для YSZ и GDC (и даже превосходящие) значения скорости обмена и коэффициента самодиффузии кислорода. В табл. 3 приведены примеры значений коэффициента самодиффузии кислорода различных материалов со структурой апатита [7, 24]. Таким образом, было показано, что апатиты на основе силиката лантана не уступают и даже превосходят традиционные и современные флюоритоподобные электролиты [7, 103, 104].
LAMOX
Другими перспективными электролитами СТ ТОТЭ являются оксиды на основе La2Mo2O9 (LAMOX). Структуре LAMOX присуща высокая концентрация кислородных вакансий, благодаря чему у таких материалов наблюдается быстрый ионный (кислородный) транспорт. Однако, при понижении температуры ниже 580°C происходит переход La2Mo2O9 из высокопроводящей β-фазы в α-фазу, обладающую более низкой проводимостью [107–110]. Поэтому необходима модификация исходного La2Mo2O9.
Методом изотопного обмена с C18O2 была изучена подвижность кислорода La2MoWO9 (LMW) и La1.8Sm0.2Mo2O9 (LMS) [111]. Поскольку лимитирует диффузия, вычислить значение константы обмена невозможно. Было показано, что для LMW кислород в объеме имеет одинаковую подвижность и может быть охарактеризован коэффициентом самодиффузии 1.0 × 10–10 см2/с при 630°C (рис. 6а). В то же время для LMS было продемонстрировано наличие медленного (Dslow = = 2.0 × 10–10 см2/с при 630°C, 80% кислорода, рис. 6б) и быстрого (Dfast = 2.0 × 10–9 см2/с при 630°C, 20% кислорода, рис. 6б') каналов диффузии. При этом данные изотопного обмена в разумных пределах согласуются с данными импеданс-спектроскопии [111]. Таким образом, было показано, что изученные LAMOX-материалы не уступают по подвижности и реакционной способности флюоритам и даже превосходят их.
Рис. 6.
Зависимость коэффициента самодиффузии кислорода от температуры в координатах Аррениуса для La1.8Sm0.2Mo2O9 (а) и La2MoWO9 (б, б ').

Наличие двух каналов диффузии в однофазном оксиде может говорить о создании дополнительного пути миграции кислорода благодаря частичному разупорядочению структуры [111]. Возможно, это связано с термической активацией каркаса из антитетраэдров [O1(LaR)3Mo(W)], которые способны наклоняться и вращаться друг относительно друга, открывая новые пути ионного переноса [110, 112].
МАТЕРИАЛЫ ПРОТОНПРОВОДЯЩИХ МЕМБРАН
Ниобаты лантана
Орто-ниобаты и орто-танталаты редкоземельных элементов (РЗЭ) и нанокомпозиты на их основе являются перспективными материалами протонпроводящих мембран по причине высокой протонной проводимости (~10–3 См/см при 900°C) [113–115]. В зависимости от условий системы RE1 –xAxMO4 – δ (RE = редкоземельный элемент, A = акцепторный допант (например, Ca), M = Nb или Ta) обладают электронной, чисто ионной (кислородной/протонной) или смешанной ионно-электронной проводимостью. Сложные оксиды RE1 –xAxMO4 – δ образуют низкотемпературную моноклинную и высокотемпературную тетрагональную фазы, которые обладают высокой протонной проводимостью [114], а также могут содержать примеси, изоструктурные La3NbO7 или LaNb3O9, первые из которых могут являться смешанными ионными (кислород-ионными и протонными) и электронными (n- или p‑типа) проводниками в зависимости от состава и условий, а вторые являются полупроводниками n-типа [113, 114, 116–119].
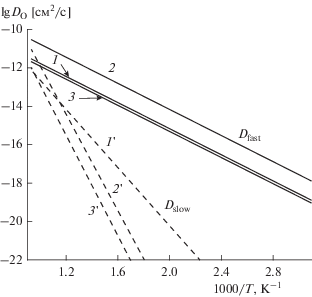
Была изучена подвижность кислорода ниобатов лантана La0.99Ca0.01NbO4 (LCNb), LaNb3O9 (LNb), а также нанокомпозита La0.99Ca0.01NbO4–LaNb3O9 (LCNb–LNb) [115]. Значение константы обмена составляет 1.1 × 10–7, 1.1 × 10–8 и 3.7 × × 10–8 см/с при 700°C для LCNb, LNb и LCNb–LNb соответственно. С точки зрения объемной подвижности кислорода, для всех материалов наблюдалась ее неоднородность: данные изотопного обмена описываются моделью с участием двух каналов диффузии (рис. 7). Так, для LCNb при 700°C Dfast = 1.4 × 10–11 см2/с, а Dslow = 5.5 × × 10–12 см2/с, причем значение кажущейся энергии активации канала медленной диффузии существенно превышает таковое для канала быстрой диффузии, что говорит о наличии затрудненного переноса кислорода. Наличие двух каналов диффузии может быть объяснено особенностями фазового состава, локальной неоднородностью состава, а также нарушением кооперативного переноса (см. выше) [115].
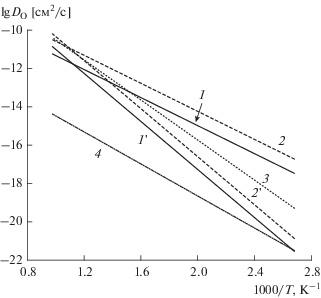
Рис. 7.
Зависимость коэффициента самодиффузии кислорода от температуры в координатах Аррениуса для La0.99Ca0.01NbO4 (1, 1 '), LaNb3O9 (2, 2 ') и La0.99Ca0.01NbO4–LaNb3O9 (3, 3 '); 1, 2, 3 – канал быстрой диффузии; 1 ', 2 ', 3 ' – канал медленной диффузии [115].
Вольфраматы и молибдаты лантаноидов
В последнее время среди неперовскитных протонпроводящих материалов основное внимание было привлечено к твердым растворам La6 –xWO12 – δ (x = 0–0.8) на основе вольфрамата лантана La6WO12, поскольку величина их протонной проводимости высока и достигает 1.5 × 10–3 См/см при 600°C во влажном воздухе [112–123].
Недавно было проведено исследование протонпроводящих молибдатов Ln6 –xZrxMoO12 + δ (Ln = La, Nd, Sm, Gd, Dy, Ho; x = 0.2–0.6), большинство из которых, за исключением ромбоэдрического ($R\bar {3}$) La5.8Zr0.2MoO12.1, относится к структурному типу флюорита $Fm\bar {3}m$ [124–127]. Интересно, что наиболее высокопроводящим оказался ромбоэдрический ($R\bar {3}$) оксид La5.8Zr0.2MoO12.1 с общей проводимостью 2.5 × 10–5 См/см при 500°C во влажном воздухе. Обнаружена высокая устойчивость La5.8Zr0.2MoO12.1 в восстановительных условиях и отсутствие какого-либо зернограничного вклада в проводимость в его импеданс-спектрах в процессе редокс-циклирования как в сухом воздухе или аргоне, так и в аналогичных по составу влажных средах в температурном интервале 350–700°С [125, 126].
При исследовании цирконий-допированных твердых растворов со структурой флюорита Ln6 ‒ xZrxMoO12 + δ (Ln = La, Nd, Sm, Gd, Dy, Ho; x = 0.2–0.6) авторы [124–126] наблюдали снижение величины протонной проводимости по мере уменьшения ионного радиуса редкоземельного катиона. Согласно [128], введение циркония в качестве донорного допанта снижает величину кислород-ионной проводимости (в сухих атмосферах) и протонной (во влажных атмосферах), хотя, как мы понимаем, и стабилизирует молибдаты РЗЭ при восстановлении. В связи с последним была предпринята попытка синтеза чистых, не содержащих цирконий молибдатов редкоземельных элементов, к числу которых принадлежат следующие составы: La6– xMoO12 – δ (x = 0.5, 0.6), Sm6 –xMoO12 – δ (x = 0, 0.5), Ln6 –xMoO12 – δ (Ln = = Gd, Dy, Ho, Er, Tm, Yb, Lu; x = 0, 0.5) [129]. Исследование всей серии молибдатов РЗЭ проводили, используя для их синтеза метод предварительной механоактивации смеси оксидов с заданным соотношением Ln/Mo, с последующим отжигом в широком температурном интервале 900–1600°С, с целью исследования полиморфизма соединений и твердых растворов молибдатов РЗЭ.
При исследовании структуры молибдатов РЗЭ La6 –xMoO12 – δ (x = 0.5), Ln6 –xMoO12 – δ (Ln = Sm, Gd, Dy, Ho, Er, Tm, Yb, Lu; x = 0, 0.5) в температурном интервале 900–1600°С в [129, 130] был обнаружен богатый полиморфизм исследуемых соединений. Соединения Ln6MoO12 могут быть получены в виде низкотемпературных ромбоэдрических модификаций ($R\bar {3},$ № 148) и высокотемпературных биксбиитов ($Ia\bar {3},$ № 206) для молибдатов тяжелых РЗЭ Ln6MoO12 (Ln = Er, Tm, Yb), а также в виде низкотемпературных тетрагональных фаз и высокотемпературных флюоритов (Fm3m) для молибдатов Ln6MoO12 (Ln = Gd, Dy, Ho) середины ряда РЗЭ. Твердый раствор La5.5MoO11.25 обладает особой структурой, образованной на базе ромбоэдрической фазы $R\bar {3},$ параметры которой связаны с таковыми для $R\bar {3}$ следующими соотношениями: $C = {{{{C}_{R}}} \mathord{\left/ {\vphantom {{{{C}_{R}}} {\sqrt 3 }}} \right. \kern-0em} {\sqrt 3 }};$ $A = {{A}_{R}} \times {2 \mathord{\left/ {\vphantom {2 {\sqrt {14} }}} \right. \kern-0em} {\sqrt {14} }},$ и этот структурный тип наиболее устойчив в восстановительных условиях [131].
Таким образом, в [129] впервые были найдены условия синтеза биксбиитов в молибдатных системах Ln2O3–MoO3, хотя соединения с этой структурой достаточно давно были получены для большинства вольфраматов РЗЭ аналогичного состава, за исключением Ln6WO12 (Ln = Ce, Eu, Tb, Tm) [120]. Однако, крайне высокие температуры синтеза (~2000°C) высокотемпературных биксбиитов в вольфраматных системах до сих пор не позволили исследовать электрохимические свойства этого нового структурного типа [132].
На рис. 8 приведено сравнение кислородной подвижности различных вольфраматов c флюоритоподобной структурой [115, 133]. Характерна существенная неоднородность по подвижности кислорода в объеме. Наиболее точные оценки коэффициента самодиффузии кислорода получились для наиболее быстро замещаемого кислорода, количество которого составляет 35–45% от общего количества кислорода оксида. Скорость замещения остального кислорода ниже на несколько порядков по сравнению с таковой для канала быстрой диффузии. Аналогично случаю с ниобатами, это может быть связано с локальной неоднородностью состава, дефектами и другими особенностями структуры.
Рис. 8.
Зависимость коэффициента самодиффузии кислорода от температуры в координатах Аррениуса для образцов вольфраматов/молибдатов Nd и нанокомпозитов на их основе [115, 133]: 1, 1 ' – Nd5.5WO11.25 – δ, 2, 2 ' – Nd5.5W0.5Mo0.5O11.25 – δ, 3 – NiCu–Nd5.5WO11.25 – δ, 4 – NiCu–Nd5.5W0.5Mo0.5O11.25 – δ.
ЗАКЛЮЧЕНИЕ
Были рассмотрены несколько классов оксидов, твердых растворов и нанокомпозитов как перспективных материалов для дизайна твердооксидных топливных элементов и каталитических мембран с кислородной и протонной проводимостью. С использованием методов изотопного обмена кислорода с 18O2 и C18O2 были изучены особенности кислородного переноса в таких материалах, а также реакционная способность кислорода на поверхности. Для нанокомпозитов перовскит – флюорит характерной особенностью является формирование широкого канала быстрой диффузии благодаря развитой межфазной поверхности и перераспределению катионов между фазами. Для никелатов лантаноидов со структурой Раддлсдена–Поппера свойственен кооперативный механизм переноса с участием межузельных и регулярных анионов кислорода. Для допированных щелочноземельными металлами аналогов показано частичное нарушение этого механизма, в ряде случаев приводящее к формированию медленных каналов диффузии. Предложен механизм формирования затрудненных путей транспорта кислорода. Для материалов со структурами апатита и LAMOX также характерен своего рода кооперативный перенос кислорода вследствие особенностей структуры. Для ниобатов и вольфраматов/молибдатов Ln предположено, что такие свойства кислородного транспорта, как формирование двух каналов диффузии, связаны с особенностями реальной и дефектной структуры, фазового состава, локальной неоднородностью катионного состава.
БЛАГОДАРНОСТИ
Авторский коллектив выражает благодарность Организационному комитету 14-го Международного совещания “Фундаментальные проблемы ионики твердого тела” (9–13 сентября 2018 г., г. Черноголовка, Россия).
ФИНАНСИРОВАНИЕ РАБОТЫ
Разные части работ были выполнены при финансовой поддержке Российского научного фонда (Проект № 16-13-00112) и в рамках государственного задания Института катализа СО РАН (Проект № АААА-А17-117041110045-9), Института высокотемпературной электрохимии УрО РАН и за счет субсидии, выделенной ИХФ РАН на выполнение государственного задания № 0052-2014-0011 “нанохимия”, регистрационный номер АААА-А17-111711600093-8, а также поддержана грантами РФФИ (Проекты №№ 16-03-00143, 18‑38-20063 мол_а_вед).
Список литературы
Steele, B.C.H. and Heinzel, A., Materials for fuel-cell technologies, in Materials for Sustainable Energy, Dusastre, V., Ed, World Scientific Publishing Co Pte Ltd, Co-Published with Macmillan Publishers Ltd., UK, 2010, p. 224. https://doi.org/10.1142/9789814317665_0031
Basu, R.N., Materials for solid oxide fuel cells, in Recent Trends in Fuel Cell Science and Technology, Basu, S., Ed, New York: Springer, 2007, p. 286. https://doi.org/10.1007/978-0-387-68815-2_12
Sadykov, V., Usoltsev, V., Fedorova, Y., Mezentseva, N., Krieger, T., Eremeev, N., Arapova, M., Ishchenko, A., Salanov, A., Pelipenko, V., Muzykantov, V., Ulikhin, A., Uvarov, N., Bobrenok, O., Vlasov, A., Korobeynikov, M., Bryazgin, A., Arzhannikov, A., Kalinin, P., Smorygo, O., and Thumm, M., Advanced sintering techniques in design of planar IT SOFC and supported oxygen separation membranes, in Sintering of Ceramics, Lakshmanan. A.. Ed, Vienna: IntechOpen, 2012, p. 121. https://doi.org/10.5772/34958
Ormerod, R.M., Solid oxide fuel cells, Chem. Soc. Rev., 2003, vol. 32, p. 17. https://doi.org/10.1039/b105764m
Sadykov, V.A., Pavlova, S.N., Kharlamova, T.S., Muzykantov, V.S., Uvarov, N.F., Okhlupin, Y.S., Ishchenko, A.V., Bobin, A.S., Mezentseva, N.V., Alikina, G.M., Lukashevich, A.I., Krieger, T.A., Larina, T.V., Bulgakov, N.N., Tapilin, V.M., Belyaev, V.D., Sadovskaya, E.M., Boronin, A.I., Sobyanin, V.A., Bobrenok, O.F., Smirnova, A.L., Smorygo, O.L., and Kilner, J.A., Perovskites and their nanocomposites with fluorite-like oxides as materials for solid oxide fuel cells cathodes and oxygen-conducting membranes: Mobility and reactivity of the surface/bulk oxygen as a key factor of their performance, in Perovskites: Structure, Properties and Uses, Borovski, M., Ed, New York: Nova Science Publishers, 2010, p. 67.
Sadykov, V.A., Muzykantov, V.S., Yeremeev, N.F., Pelipenko, V.V., Sadovskaya, E.M., Bobin, A.S., Fedorova, Y.E., Amanbaeva, D.G., and Smirnova, A.L., Solid oxide fuel cell cathodes: Importance of chemical composition and morphology, Catal. Sustain. Energy, 2015, vol. 2, p. 57. https://doi.org/10.1515/cse-2015-0004
Sadykov, V.A., Mezentseva, N.V., Bobrova, L.N., Smorygo, O.L., Eremeev, N.F., Fedorova, Y.E., Bespalko, Y.N., Skriabin, P.I., Krasnov, A.V., Lukashevich, A.I., Krieger, T.A., Sadovskaya, E.M., Belyaev, V.D., Shmakov, A.N., Vinokurov, Z.S., Bolotov, V.A., Tanashev, Y.Y., Korobeynikov, M.V., and Mikhailenko, M.A., Advanced materials for solid oxide fuel cells and membrane catalytic reactors, in Advanced Nanomaterials for Catalysis and Energy, Sadykov, V.A., Ed, Elsevier, 2019, p. 435. https://doi.org/10.1016/B978-0-12-814807-5.00012-7
Steele, B.C.H. State-of-the-art SOFC ceramic materials, Proc. 1 Eur. SOFC Forum, 1994, p. 375.
Dicks, A., Advances in catalysts for internal reforming in high temperature fuel cells, J. Power Sources, 1998, vol. 71, p. 111. https://doi.org/10.1016/S0378-7753(97)02753-5
Kim, I., Pillai, M.R., and Barnett, S.A., Liquid-hydrocarbon internal reforming in catalyst-assisted SOFCs, ECS Trans., 2007, vol. 7, p. 81. https://doi.org/10.1149/1.2729170
De Souza, E.C.C. and Muccillo, R., Properties and applications of perovskite proton conductors, Mater. Res., 2010, vol. 13, p. 385. https://doi.org/10.1590/S1516-14392010000300018
Adhikari, S. and Fernando, S. Hydrogen membrane separation techniques, Ind. Eng. Chem. Res., 2006, vol. 45, no. 3, p. 875. https://doi.org/10.1021/IE050644L
Sadykov, V., Smirnova, A., Lukashevich, A., Vostrikov, Z., Rogov, V., Krieger, T., Ishchenko, A., Zaikovsky, V., Bobrova, L., Ross, J., Smorygo, O., Smirnova, A., Rietveld, B., and van Berkel, F., Nanocomposite catalysts for steam reforming of methane and biofuels: Design and performance, in Advances in Nanocomposites—Synthesis, Characterization and Industrial Applications, Reddy, B., Ed, Rijeka: InTech, 2011, p. 90.
Adler, S.B., Factors governing oxygen reduction in solid oxide fuel cell cathodes, Chem. Rev., 2004, vol. 104, p. 4791. https://doi.org/10.1021/CR020724O
Gao, Z., Mogni, L.V., Miller, E.C., Railsback, J.G., and Barnett, S.A., A perspective on low-temperature solid oxide fuel cells, Energy Environ. Sci., 2016, vol. 9, p. 1602. https://doi.org/10.1039/C5EE03858H
Kolchugin, A.A., Pikalova, E.Y., Bogdanovich, N.M., Bronin, D.I., Pikalov, S.M., Plaksin, S.V., Ananyev, M.V., and Eremin, V.A., Structural, electrical and electrochemical properties of calcium-doped lanthanum nickelate, Solid State Ionics, 2016, vol. 288, p. 48. https://doi.org/10.1016/j.ssi.2016.01.035
Flura, A., Nicollet, C., Vibhu, V., Zeimetz, B., Rougier, A., Bassat, J.-M., and Grenier, J.-C., Application of the Adler-Lane-Steele model to porous La2NiO4 + δ SOFC cathode: Influence of interfaces with gadolinia doped ceria, J. Electrochem. Soc., 2016, vol. 163, p. F523. https://doi.org/10.1149/2.0891606jes
Adler, S.B., Lane, J.A., and Steele, B.C.H., Electrode kinetics of porous mixed-conducting oxygen electrodes, J. Electrochem. Soc., 1996, vol. 143, p. 3554. https://doi.org/10.1149/1.1837252
Poetzsch, D., Merkle, R., Maier, J., Maier, J., Merkle, R., Maier, J., Maier, J., Kölsch, P., and Werth, S., Proton conductivity in mixed-conducting BSFZ perovskite from thermogravimetric relaxation, Phys. Chem. Chem. Phys., 2014, vol. 16, p. 16446. https://doi.org/10.1039/C4CP00459K
Escolástico, S., Somacescu, S., and Serra, J.M., Tailoring mixed ionic–electronic conduction in H2 permeable membranes based on the system Nd5.5W1 ‒ xMoxO11.25–δ, J. Mater. Chem. A., 2015, vol. 3, p. 719. https://doi.org/10.1039/C4TA03699A
Музыкантов, В.С., Поповский, В.В., Боресков, Г.К. Кинетика изотопного обмена в системе молекулярный кислород–твердый окисел. Кинетика и катализ. 1964. Т. 5. № 4. С. 624. [Muzykantov, V.S., Popovskii, V.V., and Boreskov, G.K., Kinetics of isotope exchange in a molecular oxygen–solid oxide system, Kinetika i Kataliz (in Russian), 1964, vol. 5, no. 4, p. 624.].
Chater, R.J., Carter, S., Kilner, J.A., and Steele, B.C.H., Development of a novel SIMS technique for oxygen self-diffusion and surface exchange coefficient measurements in oxides of high diffusivity, Solid State Ionics, 1992, vol. 53–56, p. 859. https://doi.org/10.1016/0167-2738(92)90266-R
Садыков, В.А., Садовская, Е.М., Уваров, Н.Ф. Метод изотопных релаксаций для оценки коэффициентов диффузии кислорода в твердых электролитах и материалах со смешанной ионно-электронной проводимостью. Электрохимия. 2015. Т. 51. № 5. С. 529. [Sadykov, V.A., Sadovskaya, E.M. and Uvarov, N.F., Methods of isotopic relaxations for estimation of oxygen diffusion coefficients in solid electrolytes and materials with mixed ionic-electronic conductivity, Russ. J. Electrochem., 2015, vol. 51, no. 5, p. 458. doi 10.1134/S1023193515050109]https://doi.org/10.7868/S0424857015050114
Sadykov, V., Sadovskaya, E., Bobin, A., Kharlamova, T., Uvarov, N., Ulikhin, A., Argirusis, C., Sourkouni, G., and Stathopoulos, V., Temperature-programmed C18O2 SSITKA for powders of fast oxide-ion conductors: Estimation of oxygen self-diffusion coefficients, Solid State Ionics, 2015, vol. 271, p. 69. https://doi.org/10.1016/j.ssi.2014.11.004
De Souza, R.A. and Kilner, J.A., Oxygen transport in La1 –xSrxMn1 –yCoyO3 ± δ perovskites: Part I. Oxygen tracer diffusion, Solid State Ionics, 1998, vol. 106, p. 175. https://doi.org/10.1016/S0167-2738(97)00499-2
Музыкантов, В.С., Кемнитц, Э., Садыков, В.А., Лунин, В.В. Интерпретация изотопных данных “без времени”: неизотермический обмен дикислорода с оксидами. Кинетика и катализ. 2003. Т. 44. № 3. С. 349. [Muzykantov, V.S., Kemnitz, E., Sadykov, V.A., and Lunin, V.V., Interpretation of isotope exchange data “without time”: Nonisothermal exchange of dioxygen with oxides, Kinetics and Catalysis, 2003, vol. 44, no. 3, p. 319.]
Starkov, I.A., Bychkov, S.F., Chizhik, S.A., and Nemudry, A.P., Oxygen release from grossly nonstoichiometric SrCo0.8Fe0.2O3–δ perovskite in isostoichiometric mode, Chem. Mat., 2014, vol. 26, p. 2113. https://doi.org/10.1021/cm4040775
Бычков, С.Ф., Попов, М.П., Немудрый, А.П. Изучение кинетики кислородного обмена нестехиометрического оксида SrFeO3 – δ в изостехиометрических условиях методом релаксации парциального давления кислорода. Кинетика и катализ. 2016. Т. 57. № 5. С. 705. [Bychkov S.F., Popov M.P., and Nemudry A.P., Study of the oxygen exchange kinetics in the nonstoichiometric oxide SrFeO3 – δ under isostoichiometric conditions using the oxygen partial pressure relaxation technique, Kinetics and Catalysis, 2016, vol. 57, no. 5, p. 697. doi 10.1134/S0023158416050050]https://doi.org/10.7868/S0453881116050051
Bychkov, S.F., Gainutdinov, I.I., Chizhik, S.A., and Nemudry, A.P., Novel oxygen partial pressure relaxation technique for study of oxygen exchange in nonstoichiometric oxides. The model of relaxation kinetics, Solid State Ionics, 2018, vol. 320, p. 297.
Zimens, K.E., Zur Kinetik heterogener Austaiisclireaktionen, Akt. Kemi, Mineral. o. Geol., 1945, vol. 20A, p. 1.
Winter, E.R.S., The reactivity of oxide surfaces, Adv. Catal., 1958, vol. 10, p. 196.
Рогинский, С.З. Теоретические основы изотопных методов изучения химических реакций. М.: Изд-во АН СССР, 1956. 617 c. [Roginskii, S.Z., Theorhetical basics of isotopic methods of chemical reactions study (in Russian), Moskow: Izdatel’stvo AN SSSR, 1956, 617 p.].
Klier, K., Nováková, J., and Jíru, P., Exchange reactions of oxygen between oxygen molecules and solid oxides, J. Catal., 1963, vol. 2, p. 479. https://doi.org/10.1016/0021-9517(63)90003-4
Kilner, J.A., De Souza, R.A., and Fullarton, I.C., Surface exchange of oxygen in mixed conducting perovskite oxides, Solid State Ionics, 1996, vol. 86–88, p. 703. https://doi.org/10.1016/0167-2738(96)00153-1
Adler, S.B., Chen, X.Y., and Wilson, J.R., Mechanisms and rate laws for oxygen exchange on mixed-conducting oxide surfaces, J. Catal., 2007, vol. 245, p. 91. https://doi.org/10.1016/J.JCAT.2006.09.019
Bouwmeester, H.J.M., Song, C., Zhu, J., Yi, J., van Sint Annaland, M. and Boukamp, B.A., A novel pulse isotopic exchange technique for rapid determination of the oxygen surface exchange rate of oxide ion conductors, Phys. Chem. Chem. Phys., 2009, vol. 11, p. 9640. https://doi.org/10.1039/b912712g
Boehm, E., Bassat, J., Dordor, P., Mauvy, F., Grenier, J., and Stevens, P., Oxygen diffusion and transport properties in non-stoichiometric Ln2 –xNiO4 + δ oxides, Solid State Ionics, 2005, vol. 176, p. 2717. https://doi.org/10.1016/j.ssi.2005.06.033
Sadovskaya, E.M., Bobin, A.S., and Skazka, V.V., Isotopic transient analysis of oxygen exchange over oxides, Chem. Eng. J., 2018, vol. 348, p. 1025. https://doi.org/10.1016/J.CEJ.2018.05.027
Ананьев, М.В., Курумчин, Э.Х., Поротникова, Н.М. Влияние кислородной нестехиометрии на кинетику обмена и диффузию кислорода в кобальтитах лантана-стронция. Электрохимия. 2010. Т. 46. № 7. С. 840. [Ananyev, M.V., Kurumchin, E.K., and Porotnikova, N.M., Effect of oxygen nonstoichiometry on kinetics of oxygen exchange and diffusion in lanthanum-strontium cobaltites, Russ. J. Electrochem., 2010, vol. 46, no. 7, p. 789. doi 10.1134/S1023193510070128]
Ananyev, M.V., Farlenkov, A.S., and Kurumchin, E.K., Isotopic exchange between hydrogen from the gas phase and proton-conducting oxides: Theory and experiment, Int. J. Hydrogen Energy, 2018, vol. 43, p. 13373.
Ananyev, M.V., Tropin, E.S., Eremin, V.A., Farlenkov, A.S., Smirnov, A.S., Kolchugin, A.A., Porotnikova, N.M., Khodimchuk, A.V., Berenov, A.V., and Kurumchin, E.K., Oxygen isotope exchange in La2NiO4 ± δ, Phys. Chem. Chem. Phys., 2016, vol. 18, p. 9102.
Parfenov, M.V., Starokon, E.V., Semikolenov, S.V., and Panov, G.I., O2 isotopic exchange in the presence of O− anion radicals on the FeZSM-5 surface, J. Catal., 2009, vol. 263, p. 173. https://doi.org/10.1016/J.JCAT.2009.02.009
Боресков, Г.К. Катализ: Вопросы теории и практики: Избранные труды, Новосибирск: Наука, 1987. 536 c. [Boreskov, G.K., Catalysis: Problems on theory and practice: Selected works (in Russian), Novosibirsk: Nauka, 1987, 536 p.].
Boreskov, G.K. and Muzykantov, V.S., Investigation of oxide-type oxidation catalysts by reactions of oxygen isotopic exchange, Ann. N.Y. Acad. Sci., 1973, vol. 213, p. 137. https://doi.org/10.1111/j.1749-6632.1973.tb51065.x
Muzykantov, V.S., Isotopic studies of dioxygen activation on oxide catalysts for oxidation: Problems, results and perspectives, React. Kinet. Catal. Lett., 1987, vol. 35, p. 437. https://doi.org/10.1007/BF02062178
Mizusaki, J., Mima, Y., Yamauchi, S., Fueki, K., and Tagawa, H., Nonstoichiometry of the perovskite-type oxides La1–xSrxCoO3–δ, J. Solid State Chem., 1989, vol. 80, p. 102. https://doi.org/10.1016/0022-4596(89)90036-4
Armstrong, E.N., Duncan, K.L., and Wachsman, E.D., Effect of A- and B-site cations on surface exchange coefficient for ABO3 perovskite materials, Phys. Chem. Chem. Phys., 2013, vol. 15, p. 2298. https://doi.org/10.1039/c2cp42919e
Пикалова, Е.Ю., Кольчугин, А.А., Садыков, В.А., Садовская, Е.М., Филонова, Е.А., Еремеев, Н.Ф., Богданович, Н.М. Структура, транспортные свойства и электрохимическое поведение слоистых никелатов лантаноидов, допированных кальцием. Альтернативн. энергетика и экология. 2018. Т. 1–3. С. 70. [Pikalova, E.Y., Kolchugin, A.A., Sadykov, V.A., Sadovskaya, E.M., Filonova, E.A., Eremeev, N.F., and Bogdanovich, N.M., Structure, transport properties and electrochemical behavior of the layered lanthanide nickelates doped with calcium, Int. J. Hydrogen Energy, 2018, vol. 43, p. 17373. https://doi.org/10.15518/isjaee.2018.01-03.070-093
Sadykov, V.A., Pikalova, E.Y., Kolchugin, A.A., Filonova, E.A., Sadovskaya, E.M., Eremeev, N.F., Ishchenko, A.V., Fetisov, A.V., and Pikalov, S.M., Oxygen transport properties of Ca-doped Pr2NiO4, Solid State Ionics, 2018, vol. 317, p. 234. https://doi.org/10.1016/j.ssi.2018.01.035
Sadykov, V., Mezentseva, N.V., Alikina, G.M., Lukashevich, A.I., Borchert, Y.V., Kuznetsova, T.G., Ivanov, V.P., Trukhan, S.N., Paukshtis, E.A., Muzykantov, V.S., Kuznetsov, V.L., Rogov, V.A., Ross, J.R.H., Kemnitz, E., and Mirodatos, C., Pt-supported nanocrystalline ceria-zirconia doped with La, Pr or Gd: Factors controlling syngas generation in partial oxidation/autothermal reforming of methane or oxygenates, Solid State Phenom., 2007, vol. 128, p. 239. https://doi.org/10.4028/www.scientific.net/SSP.128.239
Sadykov, V.A., Kuznetsova, T.G., Frolova-Borchert, Y.V., Alikina, G.M., Lukashevich, A.I., Rogov, V.A., Muzykantov, V.S., Pinaeva, L.G., Sadovskaya, E.M., Ivanova, Y.A., Paukshtis, E.A., Mezentseva, N.V., Batuev, L.C., Parmon, V.N., Neophytides, S., Kemnitz, E., Scheurell, K., Mirodatos, C., and van Veen, A.C., Fuel-rich methane combustion: Role of the Pt dispersion and oxygen mobility in a fluorite-like complex oxide support, Catal. Today. 2006, vol. 117, p. 475. https://doi.org/10.1016/j.cattod.2006.06.017
Поротникова, Н.М., Ананьев, М.В., Еремин, В.А., Молчанова, Н.Г., Курумчин, Э.Х. Влияние акцепторного замещения в перспективных материалах электрохимических устройств – перовскитах La1 –xAxMnO3 ± δ (A = Ca, Sr, Ba) на кинетику взаимодействия с кислородом газовой фазы. Электрохимия. 2016. Т. 52. № 8. С. 803. [Porotnikova, N.M., Ananyev, M.V., Eremin, V.A., Molchanova, N.G., and Kurumchin, E.K., Effect of acceptor substitution in perovskites La1 –xAxMnO3 ± δ (A = Ca, Sr, Ba) on the kinetics of interaction of gas-phase oxygen, Russ. J. Electrochem., 2016, vol. 52, no. 8, p. 717.]
Porotnikova, N.M., Eremin, V.A., Farlenkov, A.S., Kurumchin, E.Kh., Sherstobitova, E.A., Kochubey, D.I., and Ananyev, M.V. Effect of AO segregation on catalytical activity of La0.7A0.3MnO3 ± δ (A = Ca, Sr, Ba) regarding oxygen reduction reaction, Catalysis Letters, 2018, vol. 148, no. 9, p. 2839.
Sadykov, V.A., Kuznetsova, T.G., Simakov, A.V., Rogov, V.A., Zaikovskii, V.I., Moroz, E.M., Kochubei, D.I., Novgorodov, B.N., Ivanov, V.P., Trukhan, S.N., Litvak, G.S., Bulgakov, N.N., Lunin, V.V., and Kemnitz, E., Effect of lanthanum manganite modification by calcium and/or fluorine on the bonding strength, mobility and reactivity of the lattice and surface oxygen, MRS Proc., 2002, vol. 751, p. Z3.27.1. https://doi.org/10.1557/PROC-751-Z3.27
Sadykov, V.A., Bulgakov, N.N., Muzykantov, V.S., Kuznetsova, T.G., Alikina, G.M., Lukashevich, A.I., Potapova, Y.V., Rogov, V.A., Burgina, E.B., Zaikovskii, V.I., Moroz, E.M., Litvak, G.S., Yakovleva, I.S., Isupova, L.A., Zyryanov, V.V., Kemnitz, E., and Neophytides, S., Mobility and reactivity of the surface and lattice oxygen of some complex oxides with perovskite structure, in Mixed Ionic Electronic Conducting Perovskites for Advanced Energy Systems,: Orlovskaya, N., Browning, N., Eds., Dordrecht: Springer Netherlands, 2004, p. 53. https://doi.org/10.1007/978-1-4020-2349-1_5
Isupova, L.A., Tsybulya, S.V., Kryukova, G.N., Alikina, G.M., Boldyreva, N.N., Yakovleva, I.S., Ivanov, V.P., and Sadykov, V.A., Real structure and catalytic activity of La1 –xCaxMnO3 + δ perovskites, Solid State Ionics, 2001, vol. 141‑142, p. 417. https://doi.org/10.1016/S0167-2738(01)00737-8
Goldberg, E., Nemudry, A., Boldyrev, V., and Schöllhorn, R., Model for anomalous transport of oxygen in nonstoichiometric perovskites. 1. General formulation of the problem, Solid State Ionics, 1998, vol. 110, p. 223. https://doi.org/10.1016/S0167-2738(98)00149-0
Goldberg, E., Nemudry, A., Boldyrev, V., and Schöllhorn, R., Model for anomalous transport of oxygen in nonstoichiometric perovskites. 2. Analytical and numerical solutions, Solid State Ionics, 1999, vol. 122, p. 17. https://doi.org/10.1016/S0167-2738(98)00553-0
Nemudry, A., Rogachev, A., Gainutdinov, I., and Schöllhorn, R., Reactivity of the perovskite system Ca1 –xSrxFeO2.5 +y in the topotactic electrochemical oxidation at ambient temperature, J. Solid State Electrochem., 2001, vol. 5, p. 450. https://doi.org/10.1007/s100080000188
Nemudry, A., Goldberg, E.L., Aguirre, M., and Alario-Franco, M.Á., Electrochemical topotactic oxidation of nonstoichiometric perovskites at ambient temperature, Solid State Sciences, 2002, vol. 4, p. 677. https://doi.org/10.1016/S1293-2558(02)01313-4
Nemudry, A. and Uvarov, N., Nanostructuring in composites and grossly nonstoichiometric or heavily doped oxides, Solid State Ionics, 2006, vol. 177, p. 2491. https://doi.org/10.1016/j.ssi.2006.05.002
Zhogin, I.L., Nemudry, A.P., Glyanenko, P.V., Kamenetsky, Yu.M., Bouwmeester, H.J.M., and Ismagilov, Z.R., Oxygen diffusion in nanostructured perovskites, Cat. Today, 2006, vol. 118, p. 151. https://doi.org/10.1016/j.cattod.2006.02.088
Sadykov, V., Alikina, G., Lukashevich, A., Muzykantov, V., Usoltsev, V., Boronin, A., Koscheev, S., Krieger, T., Ishchenko, A., Smirnova, A., Bobrenok, O., and Uvarov, N., Design and characterization of LSM/ScCeSZ nanocomposite as mixed ionic–electronic conducting material for functionally graded cathodes of solid oxide fuel cells, Solid State Ionics, 2011, vol. 192, p. 540. https://doi.org/10.1016/j.ssi.2010.08.015
Sadykov, V., Mezentseva, N., Usoltsev, V., Sadovs-kaya, E., Ishchenko, A., Pavlova, S., Bespalko, Y., Kharlamova, T., Zevak, E., Salanov, A., Krieger, T., Belyaev, V., Bobrenok, O., Uvarov, N., Okhlupin, Y., Smorygo, O., Smirnova, A., Singh, P., Vlasov, A., Korobeynikov, M., Bryazgin, A., Kalinin, P., and Arzhannikov, A., Solid oxide fuel cell composite cathodes based on perovskite and fluorite structures, J. Power Sources, 2011, vol. 196, p. 7104. https://doi.org/10.1016/j.jpowsour.2010.07.096
Sadykov, V., Kharlamova, T., Batuev, L., Mezentseva, N., Alikina, G., Muzykantov, V., Krieger, T., Pavlova, S., Zaikovskii, V., Ishchenko, A., Zarubina, V., Rogov, V., Bobrenok, O., Uvarov, N., Kilner, J., Druce, J., and Smirnova, A. Design and characterization of nanocomposites based on complex perovskites and doped ceria as advanced materials for solid oxide fuel cell cathodes and membranes, MRS Proc., 2008, vol. 1098, p. 1098-HH07-06. https://doi.org/10.1557/PROC-1098-HH07-06
Садыков, В.А., Еремеев, Н.Ф., Садовская, Е.М., Бобин, А.С., Федорова, Ю.Е., Музыкантов, В.С., Мезенцева, Н.В., Аликина, Г.М., Кригер, Т.А., Беляев, В.Д., Рогов, В.А., Улихин, А.С., Охлупин, Ю.С., Уваров, Н.Ф., Бобренок, О.Ф., Макдональд, Н., Уоттон, Дж., Дир, А., Штайнбергер-Уилкинс, Р., Мертенс, Й., Винке, И.К. Катодные материалы для среднетемпературных твердооксидных топливных элементов на основе никелатов-кобальтитов празеодима. Электрохимия. 2014. Т. 50. № 7. С. 747. [Sadykov, V.A., Eremeev, N.F., Sadovskaya, E.M., Bobin, A.S., Fedorova, Y.E., Muzykantov, V.S., Mezentseva, N.V., Alikina, G.M., Kriger, T.A., Belyaev, V.D., Rogov, V.A., Ulikhin, A.S., Okhlupin, Y.S., Uvarov, N.F., Bobrenok, O.F., McDonald, N., Watton, J., Dhir, A., Steinberger-Wilckens, R., Mertens, J., and Vinke, I.C., Cathodic materials for intermediate-temperature solid oxide fuel cells based on praseodymium nickelates-cobaltites, Russ. J. Electrochem., 2014, vol. 50, no. 7, p. 669.]https://doi.org/10.7868/S0424857014070147
Sadykov, V., Eremeev, N., Alikina, G., Sadovskaya, E., Muzykantov, V., Pelipenko, V., Bobin, A., Krieger, T., Belyaev, V., Ivanov, V., Ishchenko, A., Rogov, V., Ulihin, A., Uvarov, N., Okhlupin, Y., Mertens, J., and Vinke, I., Oxygen mobility and surface reactivity of PrNi1 –xCoxO3 + δ–Ce0.9Y0.1O2–δ cathode nanocomposites, Solid State Ionics, 2014, vol. 262, p. 707. https://doi.org/10.1016/j.ssi.2014.01.020
Sadykov, V., Eremeev, N., Sadovskaya, E., Bobin, A., Ishchenko, A., Pelipenko, V., Muzykantov, V., Krieger, T., and Amanbaeva, D., Oxygen mobility and surface reactivity of PrNi1−xCoxO3−δ perovskites and their nanocomposites with Ce0.9Y0.1O2 − δ by temperature-programmed isotope exchange experiments, Solid State Ionics, 2015, vol. 273, p. 35. https://doi.org/10.1016/j.ssi.2014.11.021
Sadykov, V.A., Eremeev, N.F., Bolotov, V.A., Tanashev, Y.Y., Fedorova, Y.E., Amanbayeva, D.G., Bobin, A.S., Sadovskaya, E.M., Muzykantov, V.S., Pelipenko, V.V., Lukashevich, A.I., Krieger, T.A., Ishchenko, A.V., and Smirnova, A.L., The effect of microwave sintering on stability and oxygen mobility of praseodymium nickelates-cobaltites and their nanocomposites, Solid State Ionics, 2016, vol. 288, p. 76. https://doi.org/10.1016/j.ssi.2016.02.003
Sadykov, V.A., Eremeev, N.F., Vinokurov, Z.S., Shmakov, A.N., Kriventsov, V.V., Lukashevich, A.I., Krasnov, A.V., and Ishchenko, A.V., Structural studies of Pr nickelate-cobaltite—Y-doped ceria nanocomposite, J. Ceram. Sci. Technol., 2017, vol. 8, p. 129. https://doi.org/10.4416/JCST2016-0009
Sadykov, V.A., Pavlova, S.N., Vinokurov, Z.S., Shmakov, A.N., Eremeev, N.F., Fedorova, Y.E., Yakimchuk, E.P., Kriventsov, V.V., Bolotov, V.A., Tanashev, Y.Y., Sadovskaya, E.M., Cherepanova, S.V., and Zolotarev, K.V., Application of SR methods for the study of nanocomposite materials for hydrogen energy, Phys. Procedia, 2016, vol. 84, p. 397. https://doi.org/10.1016/j.phpro.2016.11.068
Amow, G., Davidson, I.J., and Skinner, S.J., A comparative study of the Ruddlesden-Popper series, Lan + 1NinO3n+ 1 (n = 1, 2 and 3), for solid-oxide fuel-cell cathode applications, Solid State Ionics, 2006, vol. 177, p. 1205. https://doi.org/10.1016/J.SSI.2006.05.005
Geffroy, P.-M., Reichmann, M., Chartier, T., Bassat, J.-M., and Grenier, J.-C., Evaluating oxygen diffusion, surface exchange and oxygen semi-permeation in Ln2NiO4 + δ membranes (Ln = La, Pr and Nd), J. Memb. Sci., 2014, vol. 451, p. 234. https://doi.org/10.1016/J.MEMSCI.2013.08.035
Porotnikova, N.M., Khodimchuk, A.V., Ananyev, M.V., Eremin, V.A., Tropin, E.S., Farlenkov, A.S., Pikalova, E.Y., and Fetisov, A.V., Oxygen isotope exchange in praseodymium nickelate, J. Solid State Electrochem., 2018, vol. 22, no. 7, p. 2115.
Tropin, E.S., Ananyev, M.V., Farlenkov, A.S., Khodimchuk, A.V., Berenov, A.V., Fetisov, A.V., Eremin, V.A., and Kolchugin, A.A., Surface defect chemistry and oxygen exchange kinetics in La2 –xCaxNiO4 + δ, J. Solid State Chem., 2018, vol. 262, p. 199.
Sadykov, V.A., Sadovskaya, E.M., Pikalova, E.Y., Kolchugin, A.A., Filonova, E.A., Pikalov, S.M., Eremeev, N.F., Ishchenko, A.V., Lukashevich, A.I., and Bassat, J.M., Transport features in layered nickelates: correlation between structure, oxygen diffusion, electrical and electrochemical properties, Ionics, 2018, vol. 24, p. 1181. https://doi.org/10.1007/s11581-017-2279-3
Sadykov, V.A., Pikalova, E.Y., Kolchugin, A.A., Fetisov, A.V., Sadovskaya, E.M., Filonova, E.A., Eremeev, N.F., Goncharov, V.B., Krasnov, A.V., Skriabin, P.I., Shmakov, A.N., Vinokurov, Z.S., Ishchenko, A.V., and Pikalov, S.M., Transport properties of Ca-doped Ln2NiO4 for intermediate temperature solid oxide fuel cells cathodes and catalytic membranes for hydrogen production, Int. J. Hydrogen Energy, 2019 (in press). https://doi.org/10.1016/j.ijhydene.2018.03.039
Pikalova, E., Kolchugin, A., Bogdanovich, N., Medvedev, D., Lyagaeva, J., Vedmid’, L., Ananyev, M., Plaksin, S., and Farlenkov, A., Suitability of Pr2 ‒ xCaxNiO4 + δ as cathode materials for electrochemical devices based on oxygen ion and proton conducting solid state electrolytes, Int. J. Hydrogen Energy, 2019 (in press). https://doi.org/10.1016/J.IJHYDENE.2018.06.023
Li, X. and Benedek, N.A., Enhancement of ionic transport in complex oxides through soft lattice modes and epitaxial strain, Chem. Mater., 2015, vol. 27, p. 2647. https://doi.org/10.1021/acs.chemmater.5b00445
Садыков, В.А., Еремеев, Н.Ф., Усольцев, В.В., Бобин, А.С., Аликина, Г.М., Пелипенко, В.В., Садовская, Е.М., Музыкантов, В.С., Булгаков, Н.Н., Уваров, Н.Ф. Механизм переноса кислорода в слоистых никелатах лантаноидов Ln2 –xNiO4 + δ (Ln = La, Pr) и их нанокомпозитах с твердыми электролитами Сe0.9Gd0.1O2 – δ и Y2(Ti0.8Zr0.2)1.6Mn0.4O7 – δ. Электрохимия. Т. 49. № 7. С. 725. [Sadykov, V.A., Eremeev, N.F., Usol’tsev, V.V., Bobin, A.S., Alikina, G.M., Pelipenko, V.V., Sadovskaya, E.M., Muzykantov, V.S., Bulgakov, N.N., and Uvarov, N.F., Mechanism of oxygen transfer in layered lanthanide nickelates Ln2 –xNiO4 + δ (Ln = La, Pr) and their nanocomposites with Ce0.9Gd0.1O2 – δ and Y2(Ti0.8Zr0.2)1.6Mn0.4O7 − δ solid electrolytes, Russ. J. Electrochem., 2013, vol. 49, no. 7, p. 645. https://doi.org/10.7868/S0424857013070141
Pikalova, E.Yu., Medvedev, D.A., and Khasanov, A.F., Structure, stability and thermo-mechanical properties of Ca-substituted Pr2NiO4 + δ, Phys. Solid State, 2017, vol. 59, p. 679. https://doi.org/10.1134/S1063783417040187
Pikalova, E.Y., Sadykov, V.A., Filonova, E.A., Eremeev, N.F., Sadovskaya, E.M., Bogdanovich, N.M., Kolchugin, A.A., Lyagaeva, J.G., Goncharov, V.B., Vedmid’, L.B., and Ishchenko, A.V., Transport properties and electrode performance of Ca-substituted Nd2NiO4, Proceeding of SEEP2018, Paisley, UK, 2018, vol. 3, p. 379.
Pikalova, E.Y., Sadykov, V.A., Filonova, E.A., Eremeev, N.F., Sadovskaya, E.M., Bogdanovich, N.M., Kolchugin, A.A., Lyagaeva, J.G., Vedmid’, L.B., Ishchenko, A.V., and Goncharov, V.B., Structure, oxygen transport properties and electrode performance of Ca substituted Nd2NiO4, Solid State Ionics, 2019, vol. 335, p. 53. https://doi.org/10.1016/j.ssi.2019.02.012
Atkinson, A., Barnett, S., Gorte, R.J., Irvine, J.T.S., McEvoy, A.J., Mogensen, M., Singhal, S.C., and Vohs, J., Advanced anodes for high-temperature fuel cells, Nat. Mater., 2004, vol. 3, p. 17. https://doi.org/10.1038/nmat1040
Sadykov, V., Bobrova, L., Pavlova, S., Simagina, V., Makarshin, L., Parmon, V., Ross, J.R., van Veen, A.C., and Mirodatos, C., Syngas generation from hydrocarbons and oxygenates with structured catalysts, in Syngas: Production Methods, Post Treatment and Economics, Kurucz, A. and Bencik, I., Eds, New York: Nova Science Publishers, 2009, p. 530.
Sadykov, V., Mezentseva, N., Alikina, G., Bunina, R., Rogov, V., Krieger, T., Belochapkine, S., and Ross, J., Composite catalytic materials for steam reforming of methane and oxygenates: Combinatorial synthesis, characterization and performance, Catal. Today, 2009, vol. 145, p. 127. https://doi.org/10.1016/j.cattod.2008.04.034
Yaseneva, P., Pavlova, S., Sadykov, V., Alikina, G., Lukashevich, A., Rogov, V., Belochapkine, S., and Ross, J., Combinatorial approach to the preparation and characterization of catalysts for biomass steam reforming into syngas, Catal. Today, 2008, vol. 137, p. 23. https://doi.org/10.1016/j.cattod.2008.03.016
Souza, M.M.V. and Schmal, M., Combination of carbon dioxide reforming and partial oxidation of methane over supported platinum catalysts, Appl. Catal. A Gen., 2003, vol. 255, p. 83. https://doi.org/10.1016/S0926-860X(03)00646-X
Sadykov, V., Mezentseva, N., Pelipenko, V., Smorygo, O., and Rietveld, B., Anode materials for IT SOFC based on NiO/YSZ doped with complex oxides and promoted by Pt, Ru or Pd: Properties and catalytic activity in the steam reforming of CH4, Fuel Cells A Sustain. World, Proc. 8th Eur. SOFC Forum, June 30–July 4, 2008, Lucerne, Switzerland, 2008, p. 1.
Sadykov, V., Mezentseva, N., Alikina, G., Lukashevich, A., Muzykantov, V., Bunina, R., Boronin, A., Pazhetnov, E., Paukshtis, E., Kriventsov, V., Smirnova, A., Vasylyev, O., Irvine, J., Bobrenok, O., Voronin, V., and Berger, I., Doped Nanocrystalline Pt-promoted ceria-zirconia as anode catalysts for IT SOFC: Synthesis and properties, MRS Proc., 2007, vol. 1023, p. 1023–JJ02-07. https://doi.org/10.1557/PROC-1023-JJ02-07
Sadykov, V.A., Kriventsov, V.V., Moroz, E.M., Borchert, Y.V., Zyuzin, D.A., Kol’ko, V.P., Kuznetsova, T.G., Ivanov, V.P., Trukhan, S.N., Boronin, A.I., Pazhetnov, E.M., Mezentseva, N.V., Burgina, E.B., and Ross, J.R.H., Ceria-zirconia nanoparticles doped with La or Gd: Effect of the doping cation on the real structure, Solid State Phenom., 2007, vol. 128, p. 81. https://doi.org/10.4028/www.scientific.net/SSP.128.81
Sadykov, V., Borchert, Y., Alikina, G., Lukashevich, A., Bunina, R., Zabolotnaya, G., Mezentseva, N., Moroz, E., Zaikovskii, V., Zyuzin, D., Uvarov, N., Zyryanov, V., and Orlovskaya, N., One-pot synthesis of mixed ionic-electronic conducting nanocomposites comprised of fluorite-like and perovskite-like phas es as catalytic materials for SOFC, Mater. Res. Soc. Symp. Proc., 2006, vol. 900E, p. O10.08.1‑6.
Sadykov, V.A., Mezentseva, N., Alikina, G., Lukashevich, A., Muzykantov, V., Kuznetsova, T., Batuev, L., Fedotov, M., Moroz, E., Zyuzin, D., Kolko, V., Kriventsov, V., Ivanov, V., Boronin, A., Pazhetnov, E., Zaikovskii, V., Ishchenko, A., Rogov, V., Ross, J., and Kemnitz, E., Nanocrystalline doped ceria-zirconia fluorite-like solid solutions promoted by Pt: Structure, surface properties and catalytic performance in syngas generation, MRS Online Proc. Libr. Arch., 2006, vol. 988, p. 0988-QQ06-04.1. https://doi.org/10.1557/PROC-988-0988-QQ06-04
Lei, Z. and Zhu, Q., Low temperature processing of dense nanocrystalline scandia-doped zirconia (ScSZ) ceramics, Solid State Ionics, 2005, vol. 176, p. 2791. https://doi.org/10.1016/J.SSI.2005.09.005
Smirnova, A., Sadykov, V., Muzykantov, V., Mezentseva, N., Ivanov, V., Zaikovskii, V., Ishchenko, A., Sammes, N., Vasylyev, O., Kilner, J., Irvine, J., Vereschak, V., Kosacki, I., Uvarov, N., and Zyryanov, V., Scandia–stabilized zirconia: Effect of dopants on surface/grain boundary segregation and transport properties, Mater. Res. Soc. Symp. Proc., 2007, vol. 972, p. AA10-05. https://doi.org/10.1557/PROC-0972-AA10-05
Sammes, N. and Du, Y., Intermediate-temperature SOFC electrolytes, in Fuel Cell Technologies: State and Perspectives, Sammes, N., Smirnova, A. and Vasylyev, O., Eds, Berlin/Heidelberg: Springer-Verlag, 2005, p. 19. https://doi.org/10.1007/1-4020-3498-9_3
Inaba, H. and Tagawa, H., Ceria-based solid electrolytes, Solid State Ionics, 1996, vol. 83, p. 1. https://doi.org/10.1016/0167-2738(95)00229-4
Sadykov, V.A., Frolova, Y.V., Alikina, G.M., Lukashevich, A.I., Muzykantov, V.S., Rogov, V.A., Moroz, E.M., Zyuzin, D.A., Ivanov, V.P., Borchert, H., Paukshtis, E.A., Bukhtiyarov, V.I., Kaichev, V.V., Neophytides, S., Kemnitz, E., and Scheurell, K., Mobility and reactivity of lattice oxygen in Gd-doped ceria promoted by Pt, React. Kinet. Catal. Lett., 2005, vol. 85, p. 367. https://doi.org/10.1007/s11144-005-0287-1
Ito, Y., Lei, Y., Browning, N.D., and Mazanec, T.J., Analysis of the atomic-scale defect chemistry at interfaces in fluorite structured oxides by electron energy loss spectroscopy, MRS Proc., 2001, vol. 70, p. V11.10. https://doi.org/10.1557/PROC-703-V11.10
Sadykov, V.A., Frolova, Y.V., Kriventsov, V.V., Kochubei, D.I., Moroz, E.M., Zyuzin, D.A., Potapova, Y.V., Muzykantov, V.S., Zaikovskii, V.I., Burgina, E.B., Borchert, H., Trukhan, S., Ivanov, V.P., Neophytides, S., Kemnitz, E., and Scheurell, K., Specificity of the local structure of nanocrystalline doped ceria solid electrolytes, MRS Proc., 2004, vol. 835, p. K3.6. https://doi.org/10.1557/PROC-835-K3.6
Wachsman, E.D., Jayaweera, P., Jiang, N., Lowe, D.M., and Pound, B.G., Stable high conductivity ceria/bismuth oxide bilayered electrolytes, J. Electrochem. Soc., 1997, vol. 144, p. 233. https://doi.org/10.1149/1.1837390
Sadykov, V.A., Kuznetsova, T.G., Veniaminov, S.A., Kochubey, D.I., Novgorodov, B.N., Burgina, E.B., Moroz, E.M., Paukshtis, E.A., Ivanov, V.P., Trukhan, S.N., Beloshapkin, S.A., Potapova, Y.V., Lunin, V.V., Kemnitz, E., and Aboukais, A., Cation/anion modified ceria-zirconia solid solutions promoted by pt as catalysts of methane oxidation into syngas by water in reversible redox cycles, React. Kinet. Catal. Lett., 2002, vol. 76, p. 83. https://doi.org/10.1023/A:1015617512304
Kendrick, E., Islam, M.S., and Slater, P.R., Developing apatites for solid oxide fuel cells: insight into structural, transport and doping properties, J. Solid State Chem., 2007, vol. 17, p. 3104. https://doi.org/10.1039/B704426G
Kharlamova, T., Pavlova, S., Sadykov, V.A., Krieger, T., Batuev, L., Muzykantov, V., Lapina, O., Khabibulin, D., Chaikina, M., Uvarov, N., Pavlukhin, Y., Petrov, S., and Argirusis, C., Doped apatite type lanthanum silicates: Structure and property characterization, MRS Proc., 2008, vol. 1126, p. 1126-S11-04. https://doi.org/10.1557/PROC-1126-S11-04
Tolchard, J.R., Islam, M.S., and Slater, P.R., Defect chemistry and oxygen ion migration in the apatite-type materials La9.33Si6O26 and La8Sr2Si6O26, J. Mater. Chem., 2003, vol. 13, p. 1956. https://doi.org/10.1039/b302748c
Sadykov, V., Kharlamova, T., Pavlova, S., Muzykantov, V., Ishchenko, A., Krieger, T., Lapina, O., Uvarov, N., Chaikina, M., Pavlyukhin, Y., Argirusis, C., Bebelis, S., Gasparyan, H., Stathopoulos, V., Jothinathan, E., and Van der Biest, O., Doped lanthanum silicates with the apatite structure as oxide-ion conducting electrolytes: synthesis, characterization and application for design of intermediate temperature solid oxide fuel cell, in Lanthanum: Compounds, Production and Applications, Moore, R.J., Ed, New York: Nova Science Publishers, Inc., 2010, p. 1.
Lacorre, P., Goutenoire, F., Bohnke, O., Retoux, R., and Laligant, Y., Designing fast oxide-ion conductors based on La2Mo2O9, Nature, 2000, vol. 404, p. 856. https://doi.org/10.1038/35009069
Georges, S., Goutenoire, F., Bohnke, O., Steil, M.C., Skinner, S.J., Wiemhofer, H.D., and Lacorre, P., The LAMOX family of fast oxide-ion conductors: Overview and recent results, J. New Mater. Electrochem. Syst., 2004, vol. 7, p. 51.
Pavlova, S., Bespalko, Y., Krieger, T., Sadykov, V., and Uvarov, N., Genesis, structural, and transport properties of La2Mo2–xWxO9 prepared via mechanochemical activation, Ionics, 2017, vol. 23, p. 877. https://doi.org/10.1007/s11581-016-1869-9
Pavlova, S., Kharlamova, T., Bespalko, Y., Krieger, T., Sadykov, V., Chesalov, Y., Ulihin, A., Uvarov, N., and Smirnova, A., Low-temperature synthesis, structural and transport properties of doped LAMOX—electrolytes for IT SOFS, ECS Trans., 2013, vol. 57, p. 939. https://doi.org/10.1149/05701.0939ecst
Pavlova, S., Bespalko, Y., Sadykov, V., Eremeev, N., Krieger, T., Sadovskaya, E., Ishchenko, A., Bobin, A., Ulihin, A., Uvarov, N., and Smirnova, A., Structural and transport properties of doped LAMOX – Electrolytes for IT SOFC, Solid State Ionics, 2015, vol. 288, p. 103. https://doi.org/10.1016/j.ssi.2016.01.026
Lacorre, P., Selmi, A., Corbel, G., and Boulard, B., On the flexibility of the structural framework of cubic LAMOX compounds, in relationship with their anionic conduction properties, Inorg. Chem., 2005, vol. 45, p. 627. https://doi.org/10.1021/IC0513080
Xing, W., Syvertsen, G.E., Grande, T., Li, Z., and Haugsrud, R., Hydrogen permeation, transport properties and microstructure of Ca-doped LaNbO4 and LaNb3O9 composites, J. Memb. Sci., 2012, vol. 415, p. 878. https://doi.org/10.1016/j.memsci.2012.06.008
Haugsrud, R. and Norby, T., Proton conduction in rare-earth ortho-niobates and ortho-tantalates, Nat. Mater., 2006, vol. 5, p. 193. https://doi.org/10.1038/nmat1591
Sadykov, V.A., Bespalko, Y.N., Krasnov, A.V., Skriabin, P.I., Lukashevich, A.I., Fedorova, Y.E., Sadovskaya, E.M., Eremeev, N.F., Krieger, T.A., Ishchenko, A.V., Belyaev, V.D., Uvarov, N.F., Ulihin, A.S., and Skovorodin, I.N., Novel proton-conducting nanocomposites for hydrogen separation membranes, Solid State Ionics, 2018, vol. 322, p. 69. https://doi.org/10.1016/j.ssi.2018.05.003
Brandão, A.D., Gracio, J., Mather, C.C., Kharton, V.V., and Fagg, D.P., B-site substitutions in LaNb1 –xMxO4 – δ materials in the search for potential proton conductors (M = Ga, Ge, Si, B, Ti, Zr, P, Al), J. Solid State Chem., 2011, vol. 184, p. 863. https://doi.org/10.1016/j.jssc.2011.02.012
Haugsrud, R. and Risberg, T., Protons in acceptor-doped La3NbO7 and La3TaO7, J. Electrochem. Soc., 2009, vol. 156, p. B425. https://doi.org/10.1149/1.3068397
Wood, J.R., Master Thesis, University of Oslo, 2007.
Syvertsen, G.E., Estournès, C., Fjeld, H., Haugsrud, R., Einarsrud, M.-A., and Grande, T., Spark plasma sintering and hot pressing of hetero-doped LaNbO4, J. Am. Ceram. Soc., 2012, vol. 95, p. 1563. https://doi.org/10.1111/j.1551-2916.2012.05101.x
Shimura, T., Fujimoto, S., and Iwahara, H., Proton conduction in non-perovskite-type oxides at elevated temperatures, Solid State Ionics, 2001, vol. 143, p. 117. https://doi.org/10.1016/S0167-2738(01)00839-6
Magrasó, A., Frontera, C., Marrero-López, D., and Núñez, P., New crystal structure and characterization of lanthanum tungstate “La6WO12” prepared by freeze-drying synthesis, Dalt. Trans., 2009, vol. 46, p. 10273. https://doi.org/10.1039/b916981b
Seeger, J., Ivanova, M.E., Meulenberg, W.A., Sebold, D., Stöver, D., Scherb, T., Schumacher, G., Escolástico, S., Solís, C., and Serra, J.M., Synthesis and Characterization of Nonsubstituted and Substituted Proton-Conducting La6 – xWO12 – y, Inorg. Chem., 2013, vol. 52, p. 10375. https://doi.org/10.1021/ic401104m
Escolástico, S., Schroeder, M., and Serra, J.M., Optimization of the mixed protonic–electronic conducting materials based on (Nd5/6Ln1/6)5.5WO11.25 − δ, J. Mater. Chem. A., 2014, vol. 2, p. 6616. https://doi.org/10.1039/c3ta14324d
Savvin, S.N., Shlyakhtina, A.V., Kolbanev, I.V., Knotko, A.V., Belov, D.A., Shcherbakova, L.G., and Nuñez, P., Zr-doped samarium molybdates—potential mixed electron–proton conductors, Solid State Ionics, 2014, vol. 262, p. 713. https://doi.org/10.1016/J.SSI.2014.01.031
Savvin, S.N., Shlyakhtina, A.V., Borunova, A.B., Shcherbakova, L.G., Ruiz-Morales, J.C., and Núñez, P., Crystal structure and proton conductivity of some Zr-doped rare-earth molybdates, Solid State Ionics, 2015, vol. 271, p. 91. https://doi.org/10.1016/J.SSI.2014.12.003
Shlyakhtina, A.V., Savvin, S.N., Knotko, A.V., Shcherbakova, L.G., and Núñez, P., Electrical conductivity of Ln6 –xZrxMoO12 + δ (Ln = La, Nd, Sm; x = 0.2, 0.6) ceramics during thermal cycling, Inorg. Mater., 2016, vol. 52, p. 1055. https://doi.org/10.1134/S0020168516100149
Shlyakhtina, A.V., Savvin, S.N., Lyskov, N.V., Belov, D.A., Shchegolikhin, A.N., Kolbanev, I.V., Karyagina, O.K., Chernyak, S.A., Shcherbakova, L.G., and Núñez, P., Sm6 –xMoO12 – δ (x = 0, 0.5) and Sm6WO12—Mixed electron-proton conducting materials, Solid State Ionics, 2017, vol. 302, p. 143. https://doi.org/10.1016/j.ssi.2017.01.020
Norby, T., A Kröger-Vink compatible notation for defects in inherently defective sublattices, J. Korean Ceram. Soc., 2010, vol. 47, p. 19. https://doi.org/10.4191/KCERS.2010.47.1.019
Shlyakhtina, A.V., Savvin, S.N., Lyskov, N.V., Kolbanev, I.V., Karyagina, O.K., Chernyak, S.A., Shcherbakova, L.G., and Núñez, P., Polymorphism in the family of Ln6 –xMoO12 – δ (Ln = La, Gd–Lu; x = 0, 0.5) oxygen ion- and proton-conducting materials, J. Mater. Chem. A., 2017, vol. 5, p. 7618. https://doi.org/10.1039/C6TA09963G
Shlyakhtina, A.V., Kolbanev, I.V., Degtyarev, E.N., Lyskov, N.V., Karyagina, O.K., Chernyak, S.A., and Shcherbakova, L.G., Kinetic aspects of the synthesis of Ln6 –xMoO12 – δ (Ln = Sm, Ho–Yb; x = 0, 0.5) rare-earth molybdates using mechanical activation of oxides, Solid State Ionics, 2018, vol. 320, p. 272. https://doi.org/10.1016/J.SSI.2018.02.004
Savvin, S.N., Avdeev, M., Kolbanev, I.V., Kharitonova, E.P., Shcherbakova, L.G., Shlyakhtina, A.V., and Nuñez, P., Stability against reduction of fluorite-like rhombohedral La5.5MoO11.25 and Ho5.4Zr0.6MoO12.3 fluorite: Conductivity and neutron diffraction study, Solid State Ionics, 2018, vol. 319, p. 148. https://doi.org/10.1016/J.SSI.2018.02.001
Foex, M., A family of refractory compounds-rare earths tungstates of type R6WO12, Bull. LA Soc. Chim. Fr., 1967, vol. 10, p. 3696.
Bespalko, Y., Sadykov, V., Eremeev, N., Skryabin, P., Krieger, T., Sadovskaya, E., Bobrova, L., Uvarov, N., Lukashevich, A., Krasnov, A., and Fedorova, Y., Synthesis of tungstates/Ni0.5Cu0.5O nanocomposite materials for hydrogen separation cermet membranes, Compos. Struct., 2018, vol. 202, p. 1263. https://doi.org/10.1016/J.COMPSTRUCT.2018.06.004
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия



