Электрохимия, 2020, T. 56, № 7, стр. 579-590
Электрохимическое получение Fe–Cu-композитов на основе феррита меди(II) и их электрокаталитические свойства
Н. М. Иванова a, *, Е. А. Соболева a, Я. А. Висурханова a, З. Мулдахметов a
a ТОО “Институт органического синтеза и углехимии Республики Казахстан”
100008 Караганда, ул. Алиханова, 1, Казахстан
* E-mail: nmiva@mail.ru
Поступила в редакцию 29.07.2019
После доработки 01.11.2019
Принята к публикации 10.12.2019
Аннотация
Феррит меди(II) получен методом соосаждения без и в присутствии поливинилового спирта и термически обработан при 300, 500, 700 и 900°С. Определена удельная поверхность приготовленных образцов. На основе данных рентгенофазового анализа установлено осуществление частичного термического восстановления образцов CuFe2O4 + полимер. Образцы CuFe2O4, синтезированные без полимера, восстанавливаются в электрохимической системе с образованием Fe–Cu-композитов с различным содержанием восстановленных металлов, на которое оказывает влияние температура термической обработки. Методом электронной спектроскопии в образцах, восстановленных электрохимически, обнаружено присутствие кристаллитов в форме гексагональных призм, состоящих, предположительно, из медных или железо-медных слоев и покрытых восстановленным железом и его оксидом Fe3O4. Проведенными экспериментами показано, что полученные Fe–Cu-композиты обладают электрокаталитической активностью в электрогидрировании ацетофенона: скорость гидрирования повышается в 2.5–6.4 раза по сравнению с его электрохимическим восстановлением.
ВВЕДЕНИЕ
Применение ферритов переходных металлов и, в частности, феррита меди(II) в качестве катализаторов в различных химических реакциях хорошо известно. Например, в кратком обзоре [1] обсуждены исследования по применению наноразмерных ферритов кобальта, никеля, меди и цинка и их смешанных комбинаций с Cr и Cd как гетерогенных катализаторов, главным образом, в реакциях органической химии. Для наночастиц феррита меди, CuFe2O4, приводятся такие примеры, как синтез 1,4-дигидропиридинов, β,γ-ненасыщенных кетонов, α-аминонитрилов, фотокаталитический распад красителя метиленового синего и др. Высокую каталитическую эффективность показал трехмерный пористый феррит меди CuFe2O4/С в гидрировании п-нитрофенола и метиленового синего [2]. Известно также применение ферритов металлов в электрохимических исследованиях, например, в работе [3] установлена высокая электроемкость образца феррита меди (520 мА ч/г), полученного золь–гель-методом и использованного в качестве анода в литиевых батареях. Фотоэлектрохимическое восстановление СО2 изучено с применением феррита меди как катализатора [4]. Создан новый сенсор для определения дакарбазина (противоопухолевого средства) на электроде из угольной пасты, модифицированном многостенными углеродными нанотрубками и наночастицами CuFe2O4 [5]. Хорошие электрокаталитические свойства обнаружены у ферритов металлов MFe2O4 (M = Co, Ni, Cu, Mn) в виде нановолокон, синтезированных методом электроспиннинга, в процессах восстановления H2O2 и генерирования кислорода [6]. Здесь же можно упомянуть обзорную работу [7], посвященную электровосстановлению диоксида углерода с применением медьсодержащих биметаллических катализаторов. К преимуществам ферритных катализаторов, обладающих магнитными свойствами, относят возможность их легкого извлечения из реакционной зоны и хорошую возобновляемость каталитической активности.
Другим направлением использования ферритов переходных металлов в качестве катализаторов и электрокатализаторов является создание на их основе моно- или биметаллических каталитических систем путем восстановления катионов металлов из структуры ферритов и образования металлических частиц или их сплавов, обладающих каталитическими свойствами. Чаще всего ферриты металлов восстанавливают в среде водорода при температурах 200–800°С [8–12]. Согласно [13], восстановление ферритов металлов MFe2O4 (M = Cu, Ni, Co) осуществляется ступенчато. Для CuFe2O4 на первой стадии восстанавливаются катионы меди: 3CuFe2O4 + 4H2 → 3Cu + + 2Fe3O4 +4H2O, затем восстанавливается Fe3O4. Следовательно, имеется возможность получения каталитических систем, состоящих из Cu и Fe3O4 [10–12] и из смеси металлов Cu и Fe [8, 9, 14].
В данной работе изучена возможность восстановления феррита меди(II), синтезированного известным способом соосаждения (без и в присутствии полимерного стабилизатора) и термически обработанного, в электрохимической системе при температуре 30°С. Следует отметить, что возможность восстановления катионов металлов в составе порошковых полимер-металлических композитов в электрохимической системе при нанесении их на горизонтально расположенный катод, без закрепления на его поверхности была продемонстрирована нами в работах [15–17]. Феррит меди обладает магнитными свойствами и удерживается на поверхности катода внешним магнитом. Полученные образцы Fe–Cu-композитов применены в качестве электрокатализаторов в электрогидрировании ацетофенона (АФ) не только как модельного органического соединения, но и как источника получения метилфенилкарбинола – известного душистого вещества (“гиацинт-карбинола”), широко используемого в парфюмерной промышленности [18].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы феррита меди(II) были получены по следующей методике синтеза: в 100 мл дистиллированной воды растворяют нитрат меди Cu(NO3)2 · · 3H2O и хлорид железа FeCl3 · 6H2O в соотношении 1 : 2, перемешивают при 40°С на магнитной мешалке в течение 30 мин. Далее по каплям приливают 1 М раствор NaOH до рН 12 при постоянном перемешивании. Постепенно образуется красновато-коричневый осадок. Полученный осадок фильтруют и промывают дистиллированной водой, подогретой до 50°С. Сушат при 80°С в течение 24 ч. Высушенный темно-коричневый порошок термически обрабатывают в электропечи (ПЛ 5/12,5; ЗАО “Накал” – промышленные печи”, Россия) при 300, 500, 700 и 900°С в течение 2 ч. Образцы загружаются в неразогретую печь, от комнатной заданная температура устанавливается через 5.5, 8.0, 13.5 и 21.5 мин соответственно. После выдерживания образцов при заданной температуре в течение 2 ч они остаются в печи до ее охлаждения до 300°С, затем вынимаются. Полностью остывшие образцы измельчают на мельнице Tube Mill control (IKA, Китай).
Содержание меди и железа в фильтратах после синтеза ферритов меди было определено методом комплексонометрического титрования [19]. По результатам титрования было установлено отсутствие катионов меди и железа в полученных прозрачных фильтратах, что указывает на практически полное их осаждение в виде соответствующих гидроксидов или оксидов. Кристаллический феррит меди(II) формируется только в ходе термической обработки (ТО). Обобщенное уравнение реакции имеет следующий вид:
(1)
$\begin{gathered} {\text{Cu(N}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{2}}}} + {\text{2FeC}}{{{\text{l}}}_{{\text{3}}}} + {\text{8NaOH}} \to \\ \to {\text{CuF}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{4}} + {\text{6NaCl}} + {\text{2NaN}}{{{\text{O}}}_{3}} + {\text{4}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $С целью получения ультрадисперсных частиц феррита меди и их стабилизации в ходе синтеза, а также для изучения влияния полимерного стабилизатора на структурно-фазовые изменения термически обработанного феррита меди и его электрокаталитические свойства были получены образцы CuFe2O4 по вышеописанной методике с растворением солей двух металлов в 3%-ном растворе поливинилового спирта (ПВС). Отфильтрованные осадки промывали дистиллированной водой комнатной температуры. После высушивания термически обрабатывали при тех же температурах.
Электрохимическое восстановление образцов CuFe2O4 было проведено в диафрагменной ячейке в водно-щелочном растворе (исходная концентрация NaOH составляла 2%) при силе тока 1.5 А и температуре 30°С. Порошок феррита меди(II) (массой 1 г) наносили на горизонтально расположенный медный катод (площадью 0.05 дм2), плотно прилегающий к дну электролизера. Порошок CuFe2O4, обладающий магнитными свойствами, удерживался на катоде внешним магнитом, расположенным под дном электролизера. Магнитная индукция создаваемого магнитного поля составляет 0.05 Тл. Анодом служила платиновая сетка. Для изучения влияния силы тока на продолжительность электрохимического восстановления (до прекращения поглощения водорода) эксперименты были выполнены также при силе тока 2.0; 2.5 и 3.0 А для образца CuFe2O4 (700°С). С целью выяснения механизма электрохимического восстановления катионов меди и железа из феррита были проведены также эксперименты с их остановкой при продолжительности (τ) 30, 60 и 90 мин с применением образца CuFe2O4 (700°С) массой 0.5 г.
Электрокаталитическое гидрирование органического соединения на восстановленных металлокомпозитах проводили после прекращения поглощения водорода (до установления соотношения выделяющихся газов V(H2) : V(O2) = 2 : 1). В католит вносили ацетофенон, растворенный в этиловом спирте, соотношение которого к объему щелочного раствора католита составляло 1 : 2. Концентрация АФ в католите была равна 0.198 М. Электрогидрирование АФ проводили при силе тока 1.5 А и температуре 30°С. Продукты гидрирования экстрагировали из католита хлороформом, полученную вытяжку анализировали с помощью хроматографа “Кристалл-5000.1” (Хроматэк, Россия).
Фазовые составы приготовленных образцов феррита меди и их морфологические особенности были изучены на рентгеновском дифрактометре ДРОН-2 до и после проведения электрохимического восстановления и применения их в электрогидрировании АФ и на растровом сканирующем электронном микроскопе TESCAN MIRA 3 LMU (Чехия). Удельная поверхность частиц синтезированных порошковых образцов CuFe2O4 была измерена методом БЭТ (Брунауэра, Эммета, Теллера) на приборе Sorbi-MS (МЕТА, Россия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Согласно проведенным рентгенофазовым анализам (РФА), высушенный при 80°С осадок после синтеза имеет аморфное строение, на его рентгенограмме присутствуют только низкие и уширенные пики, соответствующие оксиду меди(II). Подобный фазовый состав имеет образец CuFe2O4 с термической обработкой при 300°С (рис. 1, 1а), но с более четкими пиками для CuO и слабым рефлексом для α-Fe2O3 (гематита). По-видимому, феррит меди(II), представляющий собой соединение из двух оксидов металлов (CuO и Fe2O3), не сформировался полностью и присутствует в составе этого образца в аморфном состоянии. После электрохимического восстановления и применения в электрогидрировании АФ в составе этого образца появляются кристаллические фазы металлов Cu0, Fe0 и их оксидов Cu2O и Fe3O4.
Рис. 1.
Рентгенограммы образцов CuFe2O4 до (а) и после (б) гидрирования АФ, обработанные при 300 (1), 500 (2), 700 (3) и 900°С (4).
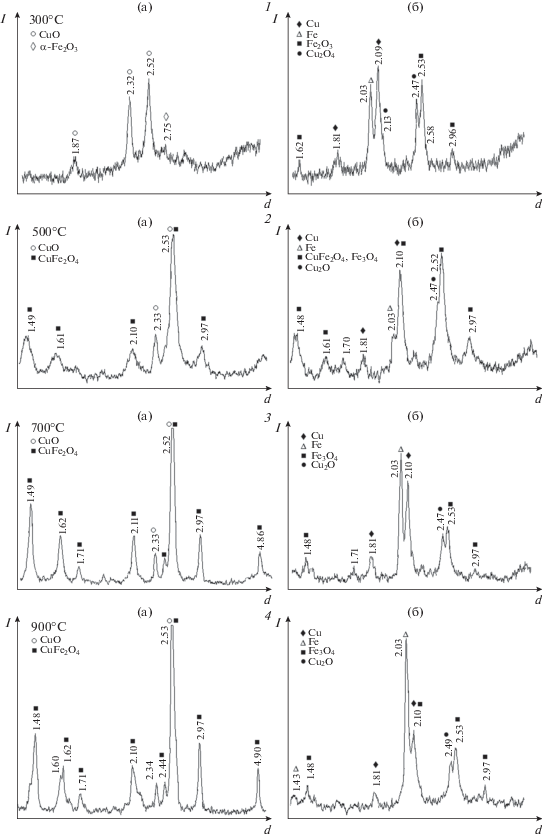
Формирование магнетита Fe3O4 из CuFe2O4 возможно при восстановлении катионов меди, как это было отмечено выше. Его характерные рефлексы на рентгенограмме локализуются практически при одних и тех же межплоскостных расстояниях d с ферритом меди, что указывает на схожесть строения их кристаллов, но затрудняет их идентификацию на рентгенограммах. Образование оксида меди(I) может происходить как при неполном восстановлении оксида меди(II), так и в результате окисления восстановленной меди.
Образцы CuFe2O4 с ТО при 500, 700 и 900°С (рис. 1, 2а–4а) имеют одинаковые фазовые составы, представленные кристаллическими фазами феррита меди(II), кристалличность которых возрастает с повышением температуры ТО, и оксидом меди(II) со слабыми рефлексами на рентгенограммах. Электрохимическое восстановление этих образцов сопровождается формированием фазовых составов, заметно отличающихся друг от друга (рис. 1, 2б–4б). В образце с ТО при 500°С в большем количестве восстанавливаются катионы меди, чем железа, т.е. Fe0 < Cu0, при этом образуется магнетит (с возможным остатком CuFe2O4) и появляются кристаллические фазы Cu2O. В составе образца CuFe2O4 (700°С) соотношение восстановленных металлов приблизительно равное с небольшим преобладанием железа Fe0 ≥ Cu0 и резким снижением содержания Fe3O4. В образце CuFe2O4 (900°С) количество электрохимически восстановленного железа становится существенно больше, чем меди: Fe0 > Cu0. Можно сделать вывод, что температура ТО оказывает влияние на фазовый состав формирующихся Fe–Cu-композитов в ходе восстановления в электрохимической системе и на относительное содержание обоих восстановленных металлов. Кроме того, следует отметить, что в электрохимической системе (при 30°С), например, в случае образца CuFe2O4 (700°С) (рис. 2) восстановление катионов обоих металлов происходит почти одновременно с некоторым запаздыванием восстановительного процесса для железа, что определяется, по-видимому, его большим количеством в феррите меди, а также отличиями в электрохимических потенциалах.
Рис. 2.
Рентгенограммы CuFe2O4 (700°С) после электрохимического восстановления в течение 30 (а), 60 (б) и 90 мин (в).

Проведение соосаждения прекурсоров феррита меди(II) из водного раствора ПВС и последующая их термическая обработка приводят к формированию образцов CuFe2O4, фазовые составы которых отличаются от приготовленных без полимера. Рентгенограммы образцов CuFe2O4 + ПВС представлены на рис. 3.
Рис. 3.
Рентгенограммы образцов CuFe2O4 + ПВС до (а) и после (б) гидрирования АФ, термически обработанные при 300 (1), 500 (2), 700 (3) и 900°С (4).

Как следует из рис. 3, 1а, в составе образца CuFe2O4 + ПВС (300°С) после ТО появляются кристаллические фазы восстановленной меди, образующейся под действием продуктов термического разложения ПВС (оксиды углерода, водород и др.). Полимер частично остается в образцах CuFe2O4 + ПВС после фильтрования и промывания дистиллированной водой комнатной температуры, адсорбируясь на частицах полученного осадка. Следует отметить, что в этом образце в отличие от CuFe2O4 (300°С) без полимера (рис. 1, 1а) сформированы кристаллические фазы феррита меди, и после выхода атомов меди из его кристаллической решетки появляются фазы магнетита. В этом образце после электрохимического восстановления и электрокаталитического гидрирования АФ возрастает содержание меди и в сравнительно большом количестве присутствует оксид меди(I). ТО образца CuFe2O4 + ПВС при 500°С также сопровождается восстановлением только катионов меди(II) (рис. 3, 2а). После электрохимической системы содержание в нем Cu0 повышается, и в малом количестве появляется восстановленное железо. В образцах CuFe2O4 + ПВС (700°С) и (900°С) в ходе ТО (рис. 3, 3а и 4а) происходит восстановление катионов обоих металлов, но в образце с ТО при более высокой температуре оно осуществляется полнее. После электрохимического восстановления в их составах увеличиваются количества восстановленных металлов при резком снижении кристаллических фаз магнетита (рис. 3, 3б и 4б). На рентгенограммах этих восстановленных образцов видно, что в отличие от CuFe2O4, приготовленного без добавления полимера (рис. 1, 3б и 4б), интенсивность пиков, соответствующих фазам Cu0, выше, чем для Fe0. Можно заключить, что синтез исходного феррита меди(II) в водном растворе ПВС и последующая термическая обработка, во-первых, позволяют получать композиты с частично восстановленными металлами Fe0 и Cu0 сразу после ТО и с дополнительным электрохимическим восстановлением катионов этих металлов; во-вторых, оказывают благоприятное влияние на восстановление катионов Cu2+ в случае образцов CuFe2O4 + + ПВС (700°С) и (900°С) – содержание меди в образующихся Fe–Cu-композитах возрастает.
Измерения удельной поверхности частиц в образцах CuFe2O4, полученных после термической обработки и измельченных в одинаковых условиях на электромельнице, показали ее зависимость, а значит и размеров частиц в этих образцах, от температуры ТО (см. табл. 1 ниже): с ее повышением удельная поверхность снижается. Эти результаты находятся в согласии с данными работы [20], в которой CuFe2O4 был также получен методом соосаждения из нитрата меди(II) и хлорида железа(III). Увеличение размеров частиц от образца CuFe2O4 (700°С) (35 нм и выше) к CuFe2O4 (900°С) (100 нм и выше) хорошо заметно на их микроснимках (рис. 4). Удельная площадь поверхности образцов CuFe2O4 + ПВС, прошедших ТО (табл. 1), меньше, а ее изменение не столь последовательно, чем у образцов, синтезированных без полимера. Очевидно, плавление ПВС (Тпл ~ 230°С), содержащегося в образцах, и продукты его разложения оказывают на частицы феррита меди и продукты его термического восстановления агломерирующее действие.
Таблица 1.
Характеристики электрохимического восстановления образцов феррита меди(II) и электрокаталитического гидрирования ацетофенона
| Образец феррита меди | Удельная поверхность, м2/г | Электрохимическое восстановление CuFe2O4 | Электрокаталитическое гидрирование АФ | ||||
|---|---|---|---|---|---|---|---|
| I, A | τ, мин | ${{V}_{{{{{\text{H}}}_{2}}}}},$ мл | W, мл Н2/мин | η, % | α, % | ||
| Cu-катод | – | 1.5 | 0 | – | 1.0 | 6.9 | 22.1 |
| Cu скелетная (1 г) | – | 1.5 | 0 | 0 | 8.4 | 79.9 | 99.0 |
| Fe скелетное (1 г) | – | 1.5 | 180 | 206.3 | 0 | 0 | 0 |
| CuFe2O4 (300°C) | 99.3 | 1.5 | 160 | 207.6 | 4.6 | 43.3 | 90.7 |
| CuFe2O4 (500°C) | 40.8 | 1.5 | 50 | 43.2 | 3.4 | 34.4 | 100.0 |
| CuFe2O4 (700°C) | 13.3 | 1.5 | 300 | 265.3 | 5.4 | 51.7 | 98.5 |
| CuFe2O4 (700°C) | 13.3 | 2.0 | 190 | 273.1 | 5.4 | 52.5 | 98.9 |
| CuFe2O4 (700°C) | 13.3 | 2.5 | 120 | 286.7 | 5.6 | 52.5 | 99.5 |
| CuFe2O4 (700°C) | 13.3 | 3.0 | 120 | 287.8 | 5.5 | 51.0 | 98.0 |
| CuFe2O4 (900°C) | 2.2 | 1.5 | 130 | 226.5 | 5.7 | 54.2 | 100.0 |
| CuFe2O4 + ПВС (300°C) | 26.8 | 1.5 | 60 | 47.5 | 2.5 | 22.9 | 70.0 |
| CuFe2O4 + ПВС (500°C) | 5.7 | 1.5 | 60 | 30.2 | 3.2 | 28.9 | 100.0 |
| CuFe2O4 + ПВС (700°C) | 7.3 | 1.5 | 50 | 152.5 | 6.4 | 62.5 | 97.4 |
| CuFe2O4 + ПВС (900°C) | 2.9 | 1.5 | 60 | 130.2 | 4.4 | 41.7 | 100.0 |
В составе образца CuFe2O4 (700°С) после электрохимических экспериментов присутствуют кристаллиты кубической формы, в виде игольчатых палочек, а также в форме шестигранных призм. Последние можно заметить на микроснимках рис. 5а. Высота этих призм составляет около 100 нм, длина стороны в шестиугольнике ~300–350 нм. В образце CuFe2O4 (900°С) подобные, но более округлые кристаллиты имеют высоту ~250–275 нм. В обоих образцах присутствуют и более тонкие шестиугольные призмы. Возможно, образование подобных кристаллических структур происходит под действием внешнего магнитного поля. Согласно проведенным энергодисперсионным рентгеноспектральным микроанализам образца CuFe2O4 (700°С) и построенным многослойным картам, можно предположить, что шестигранные призмы имеют медную или железо-медную основу и почти полностью покрыты восстановленным железом и его оксидом Fe3O4, присутствие которых в составе этого образца установлено РФ-анализами (рис. 1, 3б). Рост таких шестигранных призм возможен в результате последовательного присоединения гексагональных слоев или их отдельных участков к кристаллу, растущих параллельно подложке (рис. 5б).
Рис. 5.
Микроснимки CuFe2O4 (700°C) (а) и CuFe2O4 (900°C) (б) после электрокаталитического гидрирования АФ.

На рис. 6а приведены микроснимки образца CuFe2O4 + ПВС (700°C) после ТО, на которых видны частицы, похожие на те, что получают из застывших расплавов при их измельчении. В то же время можно разглядеть отдельные кристаллические пластинки округлой и квадратной формы. В этом же образце после электрокаталитического гидрирования АФ (рис. 6б) частицы имеют меньшие размеры и более четкие очертания в виде пластинок разной формы, включая и слабо различимые гексагональные призмы.
Рис. 6.
Микроснимки CuFe2O4 + ПВС (700°C) до (а) и после (б) электрокаталитического гидрирования АФ.

Термически обработанные образцы CuFe2O4 и CuFe2O4 + ПВС были изучены на способность их к электрохимическому восстановлению в заданных условиях (см. раздел “Экспериментальная часть”) и проявлению электрокаталитической активности в электрогидрировании АФ: C6H5–CO–CH3 + + 2e + 2H+ → C6H5–CH(OH)–CH3. Результаты выполненных исследований приведены в табл. 1, в которой обозначены: I – сила тока, τ – продолжительность стадии электрохимического восстановления феррита меди(II), ${{V}_{{{{{\text{H}}}_{2}}}}}$ – объем поглощенного водорода на этой же стадии, W – средняя скорость гидрирования АФ за период его превращения α = 25%, η – коэффициент использования водорода при α = 25% и α – степень превращения АФ или его конверсия.
Полное восстановление катионов меди(II) и железа(III) в CuFe2O4 (массой 1 г) должно сопровождаться поглощением 375 мл водорода, что следует из обобщенного уравнения
(2)
${\text{CuF}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}} + 8{\text{е}} + 4{{{\text{H}}}_{2}} \to {\text{C}}{{{\text{u}}}^{0}} + 2{\text{F}}{{{\text{e}}}^{0}} + 4{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Однако не все образцы после ТО содержат только феррит меди (рис. 1 и 3), в них присутствуют также оксиды меди, а в образцах с ПВС и восстановленные металлы. Поэтому достоверно вычислить степень превращения только CuFe2O4 оказалось затруднительно, хотя, например, для образца CuFe2O4 (900°С) с наименьшим содержанием CuO (рис. 1, 4а) она составляет 60.4%, учитывая объем поглощенного водорода ${{V}_{{{{{\text{H}}}_{{\text{2}}}}}}}$ в приведенной табл. 1.
Согласно данным табл. 1 и рентгенограммам на рис. 1, образцы CuFe2O4, термически обработанные при разных температурах, в электрохимической системе восстанавливаются с поглощением различных объемов водорода и заметно отличающейся продолжительностью этих процессов. Наиболее полно, по-видимому, восстановление катионов обоих металлов происходит в образце CuFe2O4 (700°С), но с большими затратами времени. При повышении силы тока до 2.5 А продолжительность восстановительного процесса заметно снижается, при этом поглощается немного больше водорода (табл. 1). В образце CuFe2O4 (300°С) кристаллическая структура феррита меди(II) сформирована не до конца, что показывает его рентгенограмма (рис. 1, 1а). Поэтому восстановление катионов металлов осуществляется, главным образом, из их оксидов CuO и α-Fe2O3, очевидно взаимодействующих друг с другом. Следует отметить, что при нанесении на Cu-катод готовых порошков оксидов железа Fe3O4 и α‑Fe2O3 восстановление катионов железа в аналогичных условиях практически не происходит.
В образце CuFe2O4 (500°С) с сформировавшейся кристаллической структурой феррита меди (рис. 1, 2а) электрохимическому восстановлению подвергаются, главным образом, катионы меди(II) как из CuFe2O4, так и из присутствующего оксида меди CuO и в небольшом количестве катионы железа(III). При этом водород поглощается в наименьшем количестве среди образцов, синтезированных без полимера. В результате образуется композит, содержащий восстановленную медь, в небольших количествах железо, их оксиды Fe3O4 и Cu2O и, возможно, остаточное количество феррита меди (рис. 1, 2б).
Как было отмечено выше, образцы CuFe2O4, синтезированные в растворе ПВС, частично восстанавливаются в ходе ТО. Для этих образцов измеренные объемы поглощенного водорода указывают на их способность дополнительного восстановления в электрохимической системе, которая для образцов с ТО при 700 и 900°С оказывается выше (табл. 1), чем для других образцов с ПВС, так как более интенсивно осуществляется восстановление катионов железа (рис. 3, 3б и 4б).
Электрохимическое восстановление АФ на Cu-катоде, согласно полученным результатам (табл. 1), проходит с низкой скоростью и невысокой степенью превращения АФ. При этом основным продуктом его восстановления является пинакон (смесь диастереомеров α,α'-диметилгидробензоина) (~70%), образующийся в результате гидродимеризации АФ. Электрокаталитическое гидрирование АФ в присутствии всех исследованных образцов феррита меди осуществляется быстрее и с более высокими значениями коэффициента использования водорода и конверсии АФ, чем в электрохимическом процессе (табл. 1). Основным продуктом гидрирования АФ на всех синтезированных образцах является метилфенилкарбинол, а образование димерных продуктов не превышает 0.8–2.0%.
Среди образцов CuFe2O4 без полимера более высокую электрокаталитическую активность в исследуемом процессе проявили образцы с ТО при 700 и 900°С, в которых содержание восстановленного железа немного (700°С) или заметно (900°С) больше, чем меди (рис. 1, 3б и 4б). В то же время, проверочным экспериментом при нанесении на поверхность Cu-катода скелетного железа было показано, что гидрирование АФ в аналогичных условиях не идет. При насыщении этого катализатора водородом поглощается 206.3 мл Н2 (табл. 1), что указывает на протекание восстановительных процессов. РФ-анализами этого катализатора после данного эксперимента было установлено наличие в его составе как Fe0, так и его оксида Fe3O4 почти в равных количествах. В Fe–Cu-композитах, полученных после электрохимического восстановления образцов CuFe2O4 (700°С) и CuFe2O4 (900°С) и электрокаталитического гидрирования АФ, согласно ЭДС-микроскопическим исследованиям, все образующиеся частицы (в том числе гексагональные призмы) покрыты восстановленным железом, которое, по-видимому, взаимодействуя с атомами меди, активизируется, приобретая каталитические свойства в электрогидрировании АФ. Кроме того, можно предположить, что присутствие в восстановленных образцах большого количества кристаллических фаз магнетита (Fe3O4) оказывает ингибирующее действие на электрокаталитические свойства образующихся композитов. Например, в образце CuFe2O4 (500°С) после электрохимических экспериментов образуется Fe–Cu-композит с большим содержанием восстановленной меди, а также магнетита (рис. 1, 2б), однако его электрокаталитическая активность меньше по сравнению с другими восстановленными образцами CuFe2O4 (табл. 1).
Проведенными ранее исследованиями [21] было показано, что медные катализаторы (Cu Ренея, электрохимический порошок меди) являются довольно эффективными в электрогидрировании АФ. Для сравнения был проведен эксперимент по электрокаталитическому гидрированию АФ с применением скелетной меди (массой 1 г) в условиях, аналогичных заданным (см. “Экспериментальная часть”), который показал среднюю скорость гидрирования АФ за период α = 25%, равную 8.4 мл Н2/мин (табл. 1). И хотя напрямую сравнивать эти данные с экспериментами с участием получаемых Fe–Cu-композитов не совсем корректно (например, в 1 г невосстановленного образца CuFe2O4 (500°С) содержится только 0.274 г меди), эффективность медных катализаторов в электрогидрировании АФ должна быть выше, чем железных.
Термически и электрохимически восстановленные образцы CuFe2O4 + ПВС, кроме образца с ТО при 700°С, проявили меньшую электрокаталитическую активность, чем Fe–Cu-композиты, образующиеся в результате электрохимического восстановления соответствующих образцов феррита меди(II), синтезированного в отсутствие ПВС (табл. 1). Электрокаталитическое гидрирование АФ на восстановленном образце CuFe2O4 + + ПВС (700°C) проходит с наиболее высокой скоростью гидрирования АФ среди всех исследованных образцов. Содержание восстановленной меди в образующемся Fe–Cu-композите, согласно его рентгенограмме (рис. 3, 3б), несколько большее, чем восстановленного железа, и в нем содержится малое количество магнетита. Очевидно, на активность этого композита оказывает влияние и фазовый состав его предшественника, образующегося в ходе термической обработки в результате восстановления катионов меди и железа из CuFe2O4 под действием продуктов распада ПВС (рис. 3, 3а).
ЗАКЛЮЧЕНИЕ
Таким образом, выполненными исследованиями показано, что феррит меди(II), синтезированный методом соосаждения с последующей термической обработкой, способен восстанавливаться в описанной электрохимической системе при нанесении его порошков на Cu-катод с внешним магнитом. Установлено влияние температуры ТО на фазовый состав и соотношение электрохимически восстановленных металлов в образующихся Fe–Cu-композитах. Методом сканирующей электронной микроскопии обнаружено формирование кристаллитов в форме гексагональных призм в восстановленных образцах CuFe2O4, предположительно состоящих из медных или железо-медных слоев и покрытых восстановленным железом и его оксидом Fe3O4. Показано, что в ходе термической обработки феррита меди(II), приготовленного в 3%-ном растворе ПВС, осуществляется частичное восстановление катионов меди(II) и железа(II, III) продуктами распада полимера, что способствует более полному восстановлению этих катионов в электрохимической системе. Fe–Cu-композиты, полученные после электрохимического восстановления, обладают электрокаталитическими свойствами в электрогидрировании ацетофенона, определяемыми содержанием в них обоих восстановленных металлов.
Можно отметить, что установленное влияние температуры термической обработки феррита меди(II) и его получение в присутствии полимера на формирование Fe–Cu-композитов в ходе электрохимического восстановления дает возможность создания композитных материалов с превалирующим содержанием одного из металлов, а значит управления их свойствами, в том числе и каталитическими.
Список литературы
Kharisov, B.I., Dias, H.V.R., and Kharisova, O.V., Mini-review: Ferrite nanoparticles in the catalysis, Arabian J. Chem., 2014. https://doi.org/10.1016/j.arabjc.2014.10.049
Zhuang, Y.-T., Gao, W., Yu, Y.-L., and Wang, J.-H., Facile fabrication of three-dimensional porous CuFe2O4 cages as highly efficient and recyclable heterogeneous catalyst, Materials & Design, 2017, vol. 130, p. 302.
Bomio, M., Lavela, P., and Tirado, J.L., Electrochemical evaluation of CuFe2O4 samples obtained by sol–gel methods used as anodes in lithium batteries, J. Solid State Electrochem., 2008, vol. 12, p. 729.
Karim, K.M.R., Ong, H.R., Abdullah, H., Yousuf, A., Cheng, C.K., and Khan, M.K.R., Electrochemical study of copper ferrite as a catalyst for CO2 photoelectrochemical reduction, Bull. Chem. Reaction Engineering & Catalysis, 2018, vol. 13(2), p. 236.
Хасанпур, Ф., Таэй, М., Фуладгар, М. Вольтамперометрический сенсор для определения дакабазина на основе электрода из угольной пасты, модифицированного наночастицами феррита меди со структурой шпинели и многостенными углеродными нанотрубками. Электрохимия. 2018. Т. 54. С. 82. [Hasanpour, F., Taei, M., and Fouladgar, M., A voltammetric sensor based on spinel-structured copper ferrite nanoparticles multiwalled carbon nanotubes modified carbon paste electrode for determination of dacarbazine, Russ. J. Electrochem., 2018, vol. 54, p. 70.]
Li, M., Xiong, Y., Liu, X., Bo, X., Zhang, Y., Han, C., and Guo, L., Facile synthesis of electrospun MFe2O4 (M = Co, Ni, Cu, Mn) spinel nanofibers with excellent electrocatalytic properties for oxygen evolution and hydrogen peroxide reduction, Nanoscale, 2015, vol. 7, p. 8920.
Birhanu, M.K., Tsai, M.-C., Kahsay, A.W., Chen, C.-T., Zeleke, T.S., Ibrahim, K.B., Huang, C.-J., Su, W.-N., and Hwang, B.-J., Copper and copper-based bimetallic catalysts for carbon dioxide electroreduction, Adv. Mater. Interfaces, 2018, 1800919. https://doi.org/10.1002/admi.201800919
Khedr, M.H., Farghali, A.A., and Abdel-Khalek, A.A., Microstructure, kinetics and mechanisms of nano-crystalline CuFe2O4 reduction in flowing hydrogen at 300–600°C for the production of metallic nano-wires, J. Anal. Appl. Pyrolysis, 2007, vol. 78, p. 1.
Shin, H.-Ch., Choi, S.-Ch., Jung, K.-D., and Han, S.-H., Mechanism of M-Ferrites (M = Cu and Ni) in the CO2 decomposition, Chem. Mater., 2001, vol.13, p. 1238.
Yang, Sh.-Ch., Su, W.-N., Lin, Sh. D., Rick, J., and Cheng, J.-H. et al., Preparation of nano-sized Cu from a rod-like CuFe2O4: Suitable for high performance catalytic applications, Appl. Catalysis B: Environmental., 2011, vol. 106, p. 650.
Kameoka, S., Tanabe, T., and Tsai, A.P., Self-assembled porous nano-composite with high catalytic performance by reduction of tetragonal spinel CuFe2O4, Appl. Catalysis A: General, 2010, vol. 375, p. 163.
Lin, X., Zhang, Y., Yin, L., Chen, Ch., and Li, D., Characterization and catalytic performance of copper-based WGS catalysts derived from copper ferrite, Intern. J. Hydrogen Energy, 2014, vol. 39, p. 6424.
Jiaowen, S., Kim, D.W., Kim, S.B., and Jo, Y.M., CO2 decomposition using metal ferrites prepared by co-precipitation method, Korean J. Chem. Eng., 2016, vol. 33, p. 3162.
Shin, H.-Ch., Jung, K.-D., Han, S.-H., and Kim, J.W. Decomposition of H2O with M-Ferrite (M = Cu and Ni) for H2 generation, J. Ceram. Process. Res., 2003, vol. 4, p. 30.
Иванова, Н.М., Соболева, Е.А., Висурханова, Я.А., Кирилюс, И.В. Электрокаталитическая активность полианилин-медных композитов в электрогидрировании п-нитроанилина. Электрохимия. 2015. Т.51. С. 197. [Ivanova, N.M., Soboleva, E.A., Visurkhanova, Ya.A., and Kirilyus, I.V., Electrocatalytic activity of polyaniline-copper composites in electrohydrogenation of p-nitroaniline, Russ. J. Electrochem., 2015, vol. 51, p. 166.]
Ivanova, N.M., Visurkhanova, Ya.A., Soboleva, E.A., and Kenzhetaeva, S.O., Two-step fabrication of iron-containing polyaniline composites for electrocatalytic hydrogenation of nitroarenes, Electrochem. Comm., 2018, vol. 9, p. 66.
Иванова, Н.М., Соболева, Е.А., Висурханова, Я.А., Лазарева, Е.С. Структурно-фазовые изменения полимерных композитов с введенным нитратом серебра и их электрокаталитическая активность. Электрохимия. 2018. Т. 54. С. 1010. [Ivanova, N.M., Soboleva, E.A., Visurkhanova, Ya.A., and Lazareva, E.S., Structure-phase changes in polymer composites doped with silver nitrate and their electrocatalytic activity, Russ. J. Electrochem., 2018, vol. 54, p. 999.].
Хейфиц, Л.А., Дашунин, В.М. Душистые вещества и другие продукты для парфюмерии, М.: Химия, 1994. 256 с. [Kheifitz, L.A. and Dashunin, V.M., Fragrances and other products for perfumery (in Russian), Moscow: Khimiya, 1994. 256 p.]
Васильев, В.П., Морозова, Р.П., Кочергина, Л.А. Практикум по аналитической химии, М.: Химия, 2000. 328 с. [Vasil’ev, V.P., Morozova, R.P., and Kochergina, L.A., Practicum on analytical chemistry (in Russian), Moscow: Khimiya, 2000. 328 p.]
Agouriane, E., Rabi, B., Essoumhi, A., Razouk, A., Sahlaoui, M., Costa, B.F.O., and Sajieddine, M., Structural and magnetic properties of CuFe2O4 ferrite nanoparticles synthesized by co-precipitation, J. Mater. Environ. Sci., 2016, vol. 7, p. 4116.
Соболева, Е.А., Бекенова, У.Б., Кирилюс, И.В., Иванова, Н.М., Тусупбекова, Г.К., Закарин, С.З. Способ получения метилфенилкарбинола, Предпат. 19050 (Казахстан). 2008. [Soboleva, E.A., Bekenova, U.B., Kirilyus, I.V., Ivanova, N.M., Tusupbekova, G.K., and Zakarin, S.Z., Method of producing methyl phenyl carbinol, Prepatent 19050 (Kazakhstan), 2008.]
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия



