Электрохимия, 2020, T. 56, № 8, стр. 710-725
Бензимидазо[1',2':1,2]хинолино[4,3-b][1,2,5]оксодиазоло[3,4-f]хиноксалин – новый медиатор для электросинтеза наночастиц металлов
В. В. Янилкин a, *, Р. Р. Фазлеева a, Г. Р. Насретдинова a, Ю. Н. Осин b, Н. А. Жукова a, В. А. Мамедов a
a Институт органической и физической химии им. А.Е. Арбузова ФИЦ Казанский научный центр РАН
420088 Казань, ул. Арбузова, 8, Россия
b Казанский (Приволжский) федеральный университет, Междисциплинарный центр “Аналитическая микроскопия”
420018 Казань, ул. Кремлевская, 18, Россия
* E-mail: yanilkin@iopc.ru
Поступила в редакцию 01.04.2019
После доработки 16.10.2019
Принята к публикации 12.12.2019
Аннотация
Выполнен электросинтез сферических наночастиц серебра (НЧ-Ag), стабилизированных в оболочке поли(N-винилпирролидона) (ПВП), бензимидазо[1',2':1,2]хинолино[4,3-b][1,2,5]оксодиазоло[3,4-f]хиноксалин (BIQOQ) медиаторным восстановлением ионов Ag+ в присутствии ПВП и целлюлозных нановолокон (НЦ) при контролируемом потенциале генерирования BIQOQ•– в среде ДМФА/0.1 M Bu4NBF4 при комнатной температуре. Медиатор в ходе процесса не расходуется, генерируемый металл на катоде не осаждается и количественно образуется в объеме раствора при пропускании теоретического количества электричества. Результатом синтеза являются целлюлозные нановолокна, предельно плотно декорированные наночастицами серебра в оболочке ПВП (Ag@ПВП/НЦ). Размер НЧ-Ag в нанокомпозите Ag@ПВП/НЦ (11 ± 3 нм) существенно ниже, чем в нанокомпозите Ag@ПВП, синтезированном метилвиологен-медиаторным восстановлением ионов Ag+ в аналогичных условиях в отсутствие НЦ (20 ± 7 нм). Полученный нанокомпозит проявляет каталитическую активность в реакциях восстановления нитроароматических соединений боргидридом натрия в водных средах.
ВВЕДЕНИЕ
В электрохимических реакциях медиатор это соединение, являющееся посредником в передаче электронов от электрода на субстрат (процессы восстановления) или, наоборот, от субстрата на электрод (процессы окисления) [1]. Требования к медиаторам общеизвестны: хорошая растворимость, химическая обратимость стадий электронного переноса, сохранение медиатора и высокая эффективность (высокая скорость, селективность и полная конверсия субстрата при теоретическом количестве электричества) медиаторного процесса. Медиаторы и в особенности катализаторы широко применяются в электрохимических реакциях как окисления, так и восстановления органических и элементорганических субстратов [1–3]. Они востребованы и при электрохимическом восстановлении ионов металлов [4, 5]. Восстановление ионов металлов непосредственно на электроде приводит к осаждению генерируемого металла на электроде, а медиаторное восстановление позволяет генерировать в объеме раствора ионы металлов низкой степени окисления, атомы и кластеры металлов, проявляющие высокие каталитические свойства, в частности при электровосстановлении галогенорганических соединений.
Метод медиаторного восстановления ионов металлов оказался эффективным и при электросинтезе наночастиц ряда металлов и их сплавов в объеме раствора [5, 6].
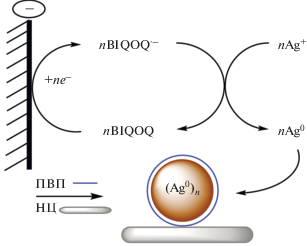
В качестве нового потенциального медиатора для процессов электровосстановления наше внимание привлекла недавно синтезированная нами [7] из 3-(2-фторфенил)хиноксалин-2(1H)-она и 4,5-диамино-2,1,3-бензоксадиазол по перегруппировке Мамедова [8–12] новая гетероциклическая система – бензимидазо[1',2':1,2]хинолино[4,3-b][1,2,5]оксодиазоло[3,4-f]хиноксалин (BIQOQ) (рис. 1).
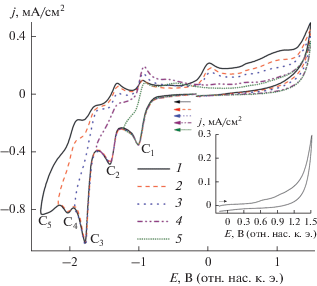
Восстановление BIQOQ в ДМФА по первой ступени протекает химически и электрохимически обратимо (рис. 2) с переносом одного электрона и образованием стабильных анион-радикалов [7]. Это делает принципиально возможным использования данного соединения в качестве медиатора при потенциалах генерирования его анион-радикалов в процессах электрохимического восстановления различных субстратов, а особенно при электросинтезе НЧ-М.
Рис. 2.
ЦВА системы (1.3 мМ BIQOQ + 0.25 г/л НЦ) в среде ДМФА/0.1 М Bu4NBF4 в катодной (1–5) и анодной (врезка) областях. v = 100 мВ/с.
Ранее в качестве медиатора при электросинтезе НЧ-М использовали метилвиологен, свободный [6, 13–27] или ковалентно связанный на различных платформах [13, 16, 28–30], кислород [31, 32], антрацен [33], фуллерены и их производные [34–37], металлокомплексы [38]. В большинстве своем они удовлетворяют общим требованиям к медиаторам и позволяют осуществить эффективный медиаторный электросинтез НЧ-М. При этом природа медиатора, его восстановительная способность, связанная с потенциалом восстановления, является одним из ключевых факторов, позволяющих управлять размером и формой НЧ-М [5].
Теоретически в отсутствие осложняющих факторов выполнение соединением функций медиатора определяется прежде всего соотношением потенциалов восстановления медиатора и субстрата [5]. Более отрицательное значение потенциала восстановления BIQOQ (Ер = –0.99 В отн. нас. к. э.) по сравнению с потенциалом восстановления метилвиологена (Ер = –0.47 В) – эффективного медиатора электросинтеза наночастиц ряда металлов (Ag [14, 15, 17, 21, 22, 26], Au [19, 24], Pd [13, 16, 18, 20], Pt [23], Rh [6], Cu [25]) и их сплавов (Pd–Rh [6], Pd–Ag [27]) – делает потенциально возможным использования BIQOQ в качестве нового универсального медиатора в электросинтезе наночастиц не только названных, но и других металлов, ионы которых восстанавливаются несколько труднее. Исходя из потенциалов восстановления, можно ожидать более высокую скорость медиаторного восстановления ионов металлов по сравнению с метилвиологен-медиаторным восстановлением и как следствие образование более мелких НЧ-М, представляющих большой интерес для гетерогенного катализа вследствие высокой развитости поверхности.
Среди металлических нанокатализаторов особое внимание привлекают так называемые псевдогомогенные нанокатализаторы – наночастицы металлов, связанные на поверхности диспергированных или растворенных во всем объеме раствора носителей. В качестве носителей НЧ-М могут быть использованы НЧ разной природы, в частности полимеры [39, 40], пористый углерод [41, 42], модифицированные углеродные нанотрубки [43, 44], окисленный графен [45, 46], cиликатные НЧ (SiO2) [15, 18, 47, 48], оксиды металлов [48–52], целлюлоза [53–73]. В таких нанокомпозитах большая часть поверхности НЧ-М остается свободной и сохраняет каталитическую активность, а неподвижность НЧ-М обеспечивает их агрегативную устойчивость. При равномерном распределении нанокомпозитов в растворе зоной каталитической реакции является весь объем раствора, вследствие этого в большой степени снимаются диффузионные ограничения, характерные для гетерогенных реакций.
В данном сообщении представлены результаты исследования BIQOQ в качестве медиатора при электросинтезе наночастиц Ag в ДМФА при использовании целлюлозных нановолокон в качестве носителя НЧ-М. Наноцеллюлоза (НЦ) может быть получена из целлюлозы, самого распространенного возобновляемого биополимера на земле. Этот наноматериал нетоксичен, устойчив, и его уже получают в промышленном масштабе. В отличие от других типичных наноматериалов, наноцеллюлоза обладает рядом привлекательных свойств, таких как биоразлагаемость, замечательная коллоидная стабильность в воде, высокое соотношение сторон, высокая развитость поверхности. В силу названных причин композиты НЧ‑М с наноцеллюлозой (НЧ-М/НЦ) очень привлекательны и могут представить интерес в разных областях, в частности в катализе в “зеленой” химии [53–61], сенсорных устройствах [61‒66], медицине [67, 68]. Такие композиты получают химическим восстановлением ионов металлов в присутствии наноцеллюлозы. Имеющиеся данные по синтезу и каталитической активности обобщены в обзоре [58]. Для эффективного связывания НЧ-М на поверхности волокон НЦ НЧ-М иногда предварительно стабилизируют в оболочке катионного поверхностно-активного вещества (цетилтриметиламмоний бромид) [69], а наноцеллюлозу окисляют с использованием ТЕМПО, превращая поверхностные ОН-группы в карбоксильные [61, 62, 67]. Электрохимических способов получения композитов НЧ-М/НЦ мы не обнаружили. Мы использовали немодифицированные волокна НЦ, полученные ультразвуковым диспергированием фильтровальной бумаги (зольная, ТУ 6-09-1706–82, ОАО “Завод Химреактивкомплект”) в ДМФА. Хотя размер волокон (длина l = 5946 ± 4819 нм, ширина b = 147 ± 38 нм) несколько превышает принятый для нановолокон размер (l = 50–3000 нм, b = 5–50 нм), они все же ближе к нановолокнам, чем к микроволокнам, ширина которых обычно составляет несколько микрон. Поэтому мы их условно называем НЦ. Каталитические свойства полученных нанокомпозитов тестировали в реакции гидрирования нитроароматических соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследования были выполнены с использованием методов циклической вольтамперометрии (ЦВА), микроэлектролиза, препаративного электролиза, сканирующей и просвечивающей электронной микроскопии (СЭМ и ПЭМ), спектроскопии УФ-видимой области (UV-VIS) и динамического светорассеяния (ДСР).
Циклические вольтамперограммы регистрировали с помощью потенциостата P-30S (без IR-компенсации) (Elins, Россия) в атмосфере аргона. Рабочим электродом служил стеклоуглеродный (СУ) дисковый электрод (d = 2 мм), впаянный в стекло. Перед каждым измерением электрод очищали механическим полированием. Вспомогательный электрод – Pt-проволока. Потенциалы измерены относительно водного насыщенного каломельного электрода (нас. к. э.), связанного с исследуемым раствором мостиком с фоновым электролитом и имеющего потенциал –0.41 В относительно формального потенциала, $E_{0}^{'}$, редокс-пары (Fc+/Fc). Температура 295 К.
Препаративный электролиз проводили в диафрагменной трехэлектродной стеклянной ячейке в потенциостатическом режиме в атмосфере инертного газа (аргон) при комнатной температуре (Т = 295 К) с помощью потенциостата P-30S (Elins, Россия). В ходе электролиза раствор перемешивали магнитной мешалкой. Рабочий электрод – СУ-пластина (S = 3.2 см2), электрод сравнения – нас. к. э., соединенный с исследуемым раствором через мостик с фоновым электролитом, вспомогательный электрод – Pt-проволока. После окончания электролиза полученный раствор исследовали методом ЦВА на индикаторном СУ-электроде (d = 2 мм) непосредственно в электролизере.
Для электролиза готовили раствор ДМФА объемом 15 мл. Раствор содержал 7.1 мг BIQOQ (1.3 мМ), 3.8 мг AgNO3 (1.5 мМ), 3.8 мг НЦ, 124.9 мг поли(N-винилпирролидона) (ПВП) (75 мМ), 493.5 мг Bu4NBF4 (0.1 М).
Для исследования полученных в ходе электролиза наночастиц серебра методами СЭМ, ПЭМ и спектроскопии УФ-видимой области их осадили центрифугированием (14 500 об/мин, 3 ч), 2 раза промыли ДМФА и этанолом. Промывка заключалась в диспергировании соникацией в растворитель и последующем осаждении центрифугированием (14 500 об/мин, 3 ч (ДМФА) и 1 ч (этанол)). Полученный осадок методом соникации диспергировали в этанол.
В случае СЭМ полученный раствор наносили на поверхность титановой фольги, предварительно очищенной ультразвуковой обработкой в воде и этаноле. Затем образец высушивали при комнатной температуре. Для ПЭМ 10 микролитров раствора помещали на 3 мм медную сеточку, покрытую подложкой формвар/углерод (Formvar/Carbon, Lacey Formvar) и высушивали при комнатной температуре. После полного высыхания сеточку помещали в просвечивающий электронный микроскоп в специальный графитовый держатель для проведения микроанализа.
Электронно-микроскопический анализ. Исследования методом СЭМ проводили на автоэмиссионном сканирующем электронном микроскопе Merlin (Carl Zeiss, Германия). Съемку морфологии поверхности проводили в режиме вторичных электронов (SE) при ускоряющем напряжении первичных электронов 5 кВ и зондовом токе 300 пА для минимального воздействия на объект исследования. Для выявления фазового контраста ускоряющее напряжение первичных электронов составляло 20 кВ, а зондовый ток 1 нА. Съемку проводили в режиме обратно-рассеянных электронов (AsB). Микроскоп оснащен спектрометром энергетической дисперсии AZtec X-MAX (Oxford Instruments, Великобритания). Разрешение спектрометра 127 эВ. Точность измерения составляет 0.01–1%. Элементный анализ проводили при ускоряющем напряжении 20 кэВ и рабочем отрезке 9.6 мм, что позволяет минимизировать погрешности. Глубина зондирования составляет менее 1 микрона. Для проведения количественного анализа использовали набор эталонов, установленных в программу Aztec (reference standart for X-RAY microanalysis “Registered Standart No. 8842”).
Исследование методом просвечивающей электронной микроскопии осуществляли в HR-TEM режиме на просвечивающем электронном микроскопе Hitachi HT 7700 Exalens (Япония) при ускоряющем напряжении 100 кэВ с разрешением 0.144 нм. Элементный анализ проводили при помощи приставки Oxford Instruments X-Maxn 80T (Великобритания) с применением специального держателя.
Спектры УФ-видимой области регистрировали на спектрометре Perkin-Elmer Lambda 25 (США).
Коммерческие соли AgNO3, Bu4NBF4 (“Aldrich”), ПВП (40 000 D) (“Alfa Aesar”), цетилтриметиламмоний хлорид (ЦТАХ) (“Acros Organics”), использовали без дополнительной очистки. BIQOQ синтезировали по методике [7]. Все соли в использованных средах достаточно хорошо диссоциируют, поэтому оперируем в основном ионами.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты циклической вольтамперометрии
Для выбора условий препаративного электросинтеза НЧ-М и доказательства протекания медиаторного электровосстановления ионов металлов использовали обычно применяемую для этих целей процедуру регистрации ЦВА [5] при различных режимах.
ЦВА системы (1.3 мМ BIQOQ + 1.5 мМ Ag+ + + 0.25 г/л НЦ) представляет собой аддитивную кривую отдельно взятых BIQOQ и Ag+ (рис. 3). На ней присутствуют пик восстановления ионов Ag+ (СAg) и сопряженный с ним пик реокисления генерированного и осажденного на электроде металлического серебра (АAg). При более катодных потенциалах (табл. 1) фиксируется первый обратимый пик восстановления BIQOQ (СBIQOQ).
Рис. 3.
ЦВА (1.3 мМ BIQOQ + 1.5 мМ Ag+ + 0.25 г/л НЦ) в среде ДМФА/0.1 М Bu4NBF4 с начальной разверткой потенциала в катодную (1, 2) и анодную области (3). v = 100 мВ/с.
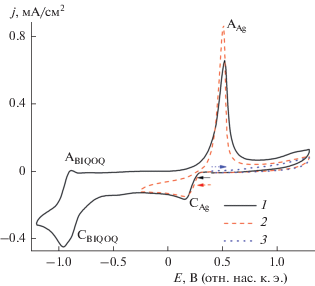
Таблица 1.
Потенциалы (В отн. нас. к. э.) пиков восстановления (EС) и реокисления (EА) исследованных субстратов на СУ-электроде в среде ДМФА/0.1 М Bu4NBF4*
| Субстрат | $E_{{\text{C}}}^{{{\text{A}}{{{\text{g}}}^{{\text{ + }}}}}}$ | i1С, мкА | $E_{{\text{A}}}^{{{\text{A}}{{{\text{g}}}^{{\text{ + }}}}}}$ | $E_{{\text{C}}}^{{{\text{AgCl}}}}$ | $E_{{\text{A}}}^{{{\text{AgCl}}}}$ | $E_{{1{\text{C}}}}^{{{\text{BIQOQ}}}}$ | $E_{{1{\text{A}}}}^{{{\text{BIQOQ}}}}$ |
|---|---|---|---|---|---|---|---|
| Ag+ | 0.07 | 22 | +0.55 | ||||
| AgCl | 1.3 | –0.84 | 0.23 | ||||
| BIQOQ | 9.4 | –0.99 | –0.89 | ||||
| AgCl + ЦТАХ | 8.7 | –1.60 | –0.27 | ||||
| BIQOQ + Ag+ | 0.11 | 6.0 | 0.56 | –0.94 | –0.87 | ||
| BIQOQ + Ag+ + ПВП | 0.12 | 5.2 | 0.52 | –0.95 | –0.87 | ||
| BIQOQ + AgCl + ЦТАХ | 15 | –0.24 | –1.00 | –0.90 |
С увеличением времени предварительного микроэлектролиза при потенциале восстановления только иона металла (–0.25 В) возрастает количество осажденного металла (рис. 4а), как и в отсутствие НЦ в аналогичных условиях [14, 17, 21, 22, 26]. При тех же временах микроэлектролиза при потенциале генерирования BIQOQ•– (–1.20 В) пики окисления металлического серебра АAg имеют меньшую интенсивность (рис. 4б). Из сравнения площадей пиков АAg, полученных при микроэлектролизе при разных потенциалах, следует, что при микроэлектролизе при потенциале восстановления BIQOQ в течение 1 и 3 мин на поверхности катода осаждается 30 и 51% генерированного металла соответственно. По всей видимости, в этом случае реализуется BIQOQ-медиаторное электровосстановление ионов Ag+, однако значительная часть генерированного металла осаждается на электроде. Независимо от связывающей и стабилизирующей роли НЦ в этом процессе, большая доля осажденного на электроде металла делает неприемлемым получение НЧ-Ag в объеме раствора в этих условиях и необходимым введение в раствор стабилизаторов НЧ-М.
Рис. 4.
ЦВА системы (1.3 мМ BIQOQ + 1.5 мМ Ag+ + 0.25 г/л НЦ) в среде ДМФА/0.1 М Bu4NPF6 после выдержки электрода при E = –0.25 В (а) и E = –1.20 В (б) в течение, с: 5 (1), 120 (2), 180 (3). v = 100 мВ/с.

В качестве стабилизаторов НЧ-М использовали широко применяемые для этих целей ПВП и ЦТАХ.
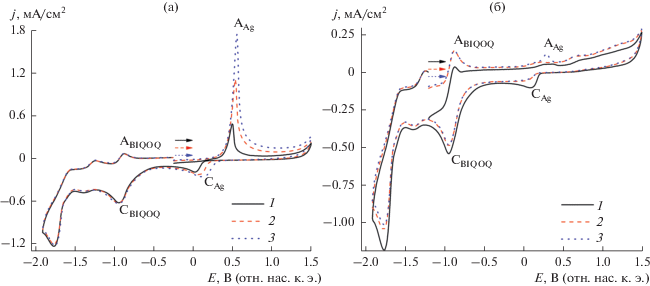
Введение ПВП (75 мМ) в раствор системы (1.3 мМ BIQOQ + 1.5 мМ Ag+ + 0.25 г/л НЦ) практически не отражается на морфологии ЦВА этой системы и на выходе по току осажденного на электроде серебра при восстановлении ионов Ag+ непосредственно на электроде при Е = –0.25 В (рис. 5а). Однако ПВП оказывает сильное влияние на количество осажденного металла при микроэлектролизе при потенциале генерирования BIQOQ•– в течение 1 и 3 мин. На поверхности катода осаждается только 11 и 5% генерированного металла, соответственно, основное же количество металла (89 и 95%) получается в растворе (рис. 5б). На основании ранее [14, 17, 21, 22, 26] полученных результатов медиаторного электросинтеза НЧ-М полагаем, что как в отсутствие, так и в присутствии ПВП при микроэлектролизе при потенциалах восстановления BIQOQ лишь вначале процесса происходит восстановление ионов Ag+ непосредственно на электроде с осаждением генерируемого металла на нем. В дальнейшем же реализуется медиаторное восстановление (рис. 6) с образованием кластеров и НЧ-Ag в объеме раствора. В отсутствие ПВП они частично осаждаются на электроде, в присутствии же стабилизатора они инкапсулируются в оболочке ПВП и уже не осаждаются на электроде.
Рис. 5.
ЦВА системы (1.3 мМ BIQOQ + 1.5 мМ Ag+ + 0.25 г/л НЦ + 75 мМ ПВП) в среде ДМФА/0.1 М Bu4NPF6 после выдержки электрода при E = –0.25 В (а), E = –1.20 В (б) в течение, с: 5 (1), 120 (2), 180 (3). v = 100 мВ/с.
Хлорид серебра AgCl слабо растворим в ДМФА, поэтому на ЦВА отсутствует четко выраженный пик восстановления этой соли. ЦТАХ связывает AgCl и тем самым увеличивает его растворимость. На ЦВА в этом случае регистрируется отчетливый пик восстановления AgCl при потенциале (Ер = –1.60 В), более отрицательном пика восстановления BIQOQ. На обратной ветви наблюдается пик реокисления осажденного металла (рис. 7а), количество которого возрастает с увеличением времени восстановления (рис. 7б).
Рис. 7.
ЦВА системы (1.5 мМ AgCl + 75 мМ ЦТАХ) в среде ДМФА/0.1 М Bu4NPF6 (а) и после выдержки электрода при E = –2.00 В (б) в течение, с: 5 (1), 120 (2), 180 (3). v = 100 мВ/с.

На ЦВА системы (1.3 мМ BIQOQ + 1.5 мМ AgCl + + 0.25 г/л НЦ + 75 мМ ЦТАХ) пик восстановления AgCl отсутствует, однако высота пика восстановления BIQOQ соответствует суммарной высоте пиков восстановления отдельно взятых BIQOQ и AgCl, а на обратной ветви фиксируется пик ААg (рис. 8). Очевидно, что при потенциале восстановления BIQOQ происходит и количественное восстановление AgCl. ЦТАХ эффективно стабилизирует НЧ-М, и при медиаторном электросинтезе генерируемый металл обычно в заметной степени не осаждается на электроде [6, 15, 20, 22, 27]. В данном же случае при микроэлектролизе при потенциале восстановления BIQOQ (–1.20 В) значительное количество генерируемого металла осаждается на электроде (рис. 8б). В качестве гипотезы предлагаем следующее объяснение. AgCl восстанавливается труднее BIQOQ, значительно труднее ионов Ag+ (табл. 1) и, как следствие, BIQOQ-медиаторное восстановление AgCl происходит медленно. Скорость медиаторного процесса ниже скорости подвода AgCl к поверхности электрода. Какое-то количество образующегося металлического серебра осаждается на электроде, на котором восстановление AgCl происходит при значительно менее катодных потенциалах, чем на СУ-электроде вследствие выигрыша энергии за счет нуклеации образующихся атомов серебра. Таким образом, при потенциалах восстановления медиатора BIQOQ (–1.20 В) наряду с медиаторным восстановлением происходит заметное восстановление AgCl непосредственно на электроде. Последний процесс и приводит к осаждению генерированного металла на электроде.
Рис. 8.
ЦВА системы (1.3 мМ BIQOQ + 1.5 мМ AgCl + 0.25 г/л НЦ + 75 мМ ЦТАХ) без выдержки (а) и после выдержки электрода при E = –1.20 В (б) в течение, с: 5 (1), 120 (2), 180 (3), 300 (4). Среда ДМФА/0.1 М Bu4NPF6, v = 100 мВ/с.

Результаты, полученные методом ЦВА, показывают принципиальную возможность использования BIQOQ в качестве медиатора при электрохимическом синтезе НЧ-Ag в объеме раствора восстановлением ионов Ag+ в среде ДМФА/0.1 М Bu4NBF4 в присутствии НЦ и стабилизаторов НЧ-Ag. Меньшее осаждение на электроде и больший выход НЧ-Ag в объеме раствора можно ожидать в присутствии ПВП, поэтому препаративное электровосстановление было выполнено с использованием этого стабилизатора НЧ-М.
Препаративный медиаторный электросинтез нанокомпозита Ag@PVP/НЦ
Препаративный диафрагменный электролиз системы (1.3 мМ BIQOQ + 1.5 мМ Ag+ + 0.25 г/л НЦ + + 75 мМ ПВП) проводили на СУ-электроде при комнатной температуре в среде ДМФА/0.1 М Bu4NBF4 при контролируемом потенциале восстановления BIQOQ до BIQOQ•– (Е = –1.10 В). В ходе электролиза (13 мин), протекающего гладко без пассивации электрода, пропустили количество электричества, теоретически необходимое для восстановления ионов Ag+ до Ag0 (1 F в расчете на Ag+). Во время электролиза исходный желтый мутноватый раствор темнел, становился более мутным и к концу электролиза приобрел коричневый цвет (рис. 9), характерный для НЧ-Ag в ДМФА [21]. Во время электролиза ни генерируемый металл, ни какие-либо иные продукты реакции не осаждались на катоде, о чем свидетельствовало равенство веса электрода до и после электролиза.
Рис. 9.
Фотографии электролизной ячейки во время электролиза системы (1.3 мМ BIQOQ + 1.5 мМ Ag+ + 0.25 г/л НЦ + + 75 мМ ПВП) при E = –1.10 В в среде ДМФА/0.1 М Bu4NBF4 при различных количествах пропущенного электричества (F в расчете на Ag+): 0 (a), 0.2 (б), 1.0 (в).

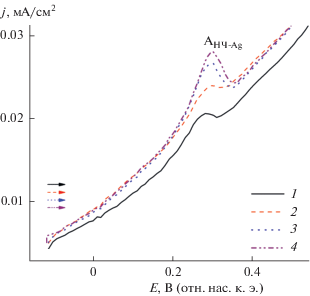
На ЦВА системы после электролиза наблюдаются пики медиатора, соответствующие исходным, что свидетельствует о сохранении BIQOQ в ходе электролиза, пик же восстановления ионов Ag+ на ЦВА отсутствует (рис. 10). При этом в анодной области наблюдается пик окисления адсорбированных на электроде НЧ-Ag при потенциале Е = 0.28 В, высота которого возрастает с увеличением времени выдержки электрода без перемешивания раствора (рис. 11).
Рис. 10.
ЦВА системы (1.3 мМ BIQOQ + 1.5 мМ Ag+ + 0.25 г/л НЦ + 75 мМ ПВП) в среде ДМФА/0.1 М Bu4NBF4 до (а) и после (б) препаративного электролиза при E = –1.10 В (Q = 1 F в расчете на 1.5 мМ Ag+). v = 100 мВ/с.

Рис. 11.
ЦВА системы (1.3 мМ BIQOQ + 1.5 мМ Ag+ + + 0.25 г/л НЦ + 75 мМ ПВП) в среде ДМФА/0.1 М Bu4NBF4 после препаративного электролиза при E = = –1.10 В (Q = 1 F в расчете на 1.5 мМ Ag+) в анодной области после выдерживания электрода в растворе в течение, с: 5 (1), 120 (2), 180 (3), 300 (4). v = 100 мВ/с.
Полученные результаты свидетельствуют о количественном BIQOQ-медиаторном восстановлении ионов Ag+ с образованием НЧ-Ag в объеме раствора.
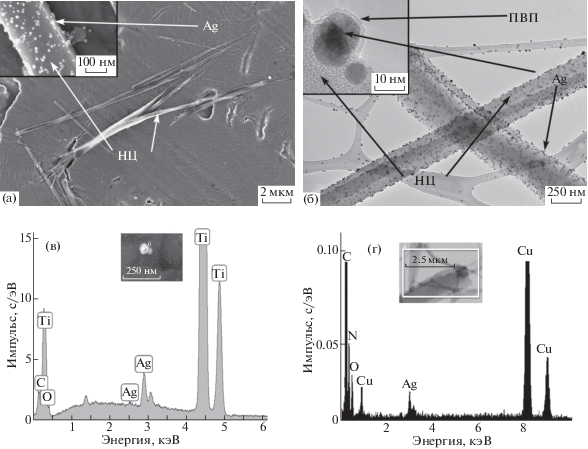
Полученные растворы, а также выделенные и диспергированные в этанол НЧ исследовали комплексом методов. По данным ДСР средний размер НЧ в растворе после электролиза составляет 3020 и 4812 нм, а размер наибольшего числа частиц – 2916 нм (PdI = 0.304 ± 0.085 нм) (рис. 12а). Наблюдаемый размер НЧ соответствует размеру НЦ, а НЧ меньшего размера (11–103 нм), характерные для агрегированных НЧ-Ag в оболочке ПВП (Ag@ПВП) [21], не регистрируются. Это означает, что образующиеся НЧ Ag@ПВП практически количественно связываются на поверхности волокон НЦ. На UV-VIS-спектрах присутствуют три полосы поглощения в области 294–407 нм (рис. 12б). Полосы в области 294–345 нм относятся к медиатору, а полоса при 399–407 нм обусловлена поглощением как медиатором, так и поверхностным плазмонным резонансом НЧ-Ag [74, 75]. На спектре выделенных НЧ полосы поглощения медиатора отсутствуют и присутствует только полоса поглощения НЧ-Ag (рис. 12б). Из ПЭМ-изображения (рис. 13б) видно, что НЧ-Ag имеют сферическую форму и они инкапсулированы в оболочке ПВП (Ag@ПВП). Часть частиц Ag@ПВП осаждается на поверхность подложки в индивидуальном виде, а большая часть связана на поверхности волокон НЦ. Средний размер НЧ-Ag в нанокомпозите Ag@ПВП/НЦ составляет 11 ± 3 нм, а в отдельных частицах Ag@ПВП несколько выше (13 ± 3 нм). СЭМ-изображения (рис. 13а) позволили определить средний размер НЧ-Ag совместно с оболочкой ПВП, который составил для Ag@ПВП – 25 ± 5 нм, а для нанокомпозита Ag@ПВП/НЦ – 19 ± 4 нм. Наличие серебра в наночастицах доказывается микрозондовым элементным анализом (энерго-дисперсионные спектры) (рис. 13в, 13г). Методом ДСР в исходном растворе индивидуальные частицы Ag@ПВП или их агрегаты не обнаруживались. Перед нанесением на подложку для исследования методами СЭМ и ПЭМ НЧ в растворах диспергировали в ультразвуковой ванне. По-видимому, более крупные НЧ Ag@ПВП частично стряхиваются с поверхности НЦ в ходе такой обработки и осаждаются на подложку в индивидуальном виде.
Рис. 12.
Диаграмма распределения по размеру (ДСР) (а) и спектры поглощения (б) нанокомпозита Ag@ПВП/НЦ в исходном растворе ДМФА (1), после выделения и диспергирования в этанол (2) и раствора BIQOQ в ДМФА (3).
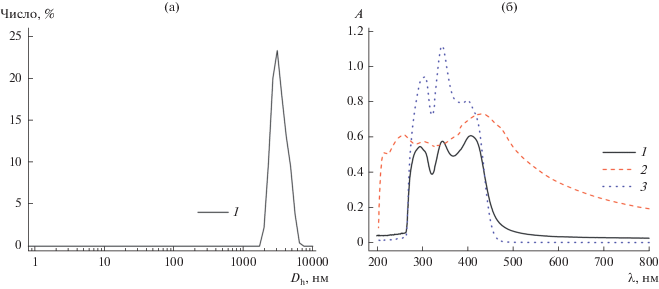
Рис. 13.
СЭМ- (а) и ПЭМ- (б) изображения и энерго-дисперсионные спектры (в, г) нанокомпозита Ag@ПВП/НЦ. (Cu, Ti – от подложки).
Таким образом, с использованием BIQOQ в качестве нового медиатора в ДМФА осуществили эффективный электросинтез НЧ-Ag, инкапсулированных в оболочке ПВП. Полученные частицы Ag@ПВП связываются НЦ и практически полностью заполняют всю поверхность волокон НЦ. Использование BIQOQ в качестве медиатора вместо метилвиологена в аналогичных условиях в отсутствие НЦ [21] привело к уменьшению размера НЧ-Ag от 20 ± 7 до 11 ± 3 нм.
Каталитическая активность нанокомпозита Ag@ПВП/НЦ
Каталитическую активность полученного нанокомпозита Ag@ПВП/НЦ тестировали в реакциях восстановления п-нитрофенола (НФ) и 5‑(4-метилпиперазин-1-ил)-2-нитроанилина (МПНА) боргидридом натрия. В каталитической реакции использовали аликвоту растворов нанокомпозитов, полученных при электролизе. Реакцию проводили в водной среде в присутствии 50-кратного избытка боргидрида натрия (NaBH4, 5 мМ). Исходная концентрация НФ и МПНА составляла 0.1 мМ. Контроль над прохождением реакции осуществляли с помощью УФ-видимой спектроскопии. Реакция восстановления не идет в отсутствие катализатора: в УФ-видимом спектре реакционной смеси не наблюдаются какие-либо изменения в течение длительного времени (60 и более минут). При добавлении полученных нанокомпозитов (2 мол. % Ag по отношению к НФ и МПНА) полосы поглощения п-нитрофенолят иона в области 400 нм и МПНА в области 408 нм падают и возрастают полосы поглощения продуктов восстановления: при 300 нм п-аминофенола и при 306 нм 4-(4-метилпиперазин-1-ил)-1,2-диаминобензола соответственно (рис. 14а, 14б). Индукционный период реакции, в течение которого скорость реакции мала и, согласно [76, 77], происходит диффузия реагентов к поверхности металла или реструктуризация поверхности катализатора для адсорбции реагентов, составляет в случае реакции восстановления НФ 1170 с, а в случае восстановления МПНА 1400 с. После индукционного периода скорости реакций резко возрастают. Каталитические реакции характеризуются псевдопервым порядком. Константы скорости псевдопервого порядка (k1) и каталитическая активность нанокомпозитов (k2), вычисленная как отношение k1 к молярной концентрации НЧ-Ag, обобщены в табл. 2. Как видно, в обеих реакциях нанокомпозит каталитически активен, однако в реакции восстановления МПНА он в 2 раза активнее.
Рис. 14.
Восстановление НФ и МПНА (0.1 мМ) боргидридом натрия (5 мМ) в водной среде, катализируемое Ag@ПВП/НЦ (c(НЧ-Ag) = 2 × 10–6 М): изменения в УФ-видимом спектре реакционной смеси после добавления катализатора для НФ (а) и МПНА (б); полулогарифмическая кинетическая кривая (в) восстановления НФ (1) и МПНА (2).

Таблица 2.
Каталитическая активность нанокомпозита Ag@ПВП/НЦ в реакции восстановления нитроароматических соединений боргидридом натрия в водной среде*
| № | Субстрат | Наночастица | Каталитическая активность наночастиц | |
|---|---|---|---|---|
| k1, с–1 | k2, М–1 с–1 | |||
| 1 | НФ | Ag@ПВП/НЦ | 3.9 × 10–4 | 2.0 × 102 |
| 2 | МПНА | Ag@ПВП/НЦ | 9.0 × 10–4 | 4.5 × 102 |
Необходимо также отметить, что в реакции восстановления НФ каталитическая активность композита в 2 раза ниже активности стабилизированных ПВП НЧ-Ag на носителе из оксида-гидроксида кобальта (Ag@ПВП/СоОxHy), полученных кислород-медиаторным электровосстановлением Ag+ также в среде ДМФА/0.1 M Bu4NBF4 в сопоставимых условиях [78]. Отличия в сравниваемых нанокомпозитах существенные. В композите Ag@ПВП/СоОxHy: (i) заметно выше размер НЧ-Ag (26 ± 9 нм); (ii) в ~13 раз ниже каталитически активная удельная поверхность НЧ-Ag; (iii) примерно во столько же раз выше толщина оболочки ПВП; (iv) в ~3 раза меньше индукционный период (360 ± 96 с); (v) в ~4 раза ниже размер частиц нанокомпозита в растворах после электролиза. При проведении каталитической реакции растворы нанокомпозитов разбавляются в 750 раз. При этом размер композита Ag@ПВП/СоОxHy может существенно уменьшиться, в то время как размер Ag@ПВП/НЦ сохранится. Предполагаем, что меньшая каталитическая активность композита Ag@ПВП/НЦ обусловлена заметно большим его размером, что приводит к уменьшению зоны каталитической реакции поверхностью НЦ, т.е. псевдогомогенный катализатор Ag@ПВП/НЦ в определенном смысле является более гетерогенным, чем Ag@ПВП/СоОxHy.
ЗАКЛЮЧЕНИЕ
Электросинтез сферических НЧ-Ag, стабилизированных в оболочке ПВП, протекает эффективно при BIQOQ-медиаторном восстановлении ионов Ag+ в присутствии ПВП и НЦ при контролируемом потенциале генерирования BIQOQ•– в среде ДМФА/0.1 M Bu4NBF4 при комнатной температуре. Весьма примечательно, что в результате целлюлозные нановолокна предельно плотно декорируются наночастицами серебра в оболочке ПВП (Ag@ПВП/НЦ). Это первый пример использования BIQOQ в качестве медиатора и первый пример электросинтеза наночастиц металлов на носителях из НЦ. НЧ-Ag в нанокомпозите Ag@ПВП/НЦ имеют существенно меньший размер (11 ± 3 нм), чем в нанокомпозите Ag@ПВП, полученном метилвиологен-медиаторным восстановлением ионов Ag+ в аналогичных условиях в отсутствие НЦ (20 ± 7 нм). Полученный нанокомпозит проявляет каталитическую активность в реакциях восстановления нитроароматических соединений боргидридом натрия в водных средах того же порядка, что и стабилизированные ПВП НЧ-Ag на носителе из оксида-гидроксида кобальта(II).
Список литературы
Байзер, М.M. Электрохимия органических соединений, М: Мир. 1976. С. 731. [Baizer, M.M., Organic electrochemistry: an introduction and a guide (in Russian), New York: M. Dekker, 1973, p. 1072.]
Ефимов, О.Н., Стрелец, В.В. Металлокомплексный катализ электродных процессов. Успехи химии. 1988. Т. 57. С. 228 [Efimov, O.N. and Strelets, V.V., Metal Complex Catalysis of Electrode Processes, Russ. Chem. Rev. (in Russian), 1988, vol. 57, p. 129.]
Francke, R. and Little, R.D., Redox catalysis in organic electrosynthesis: basic principles and recent developments, Chem. Soc. Rev., 2014, vol. 43, p. 2492.
Янилкин, В.В., Максимюк, Н.И., Струнская, Е.И. Двойная медиаторная система “органический переносчик электронов–ионы металла” в реакциях электрохимического восстановления бром- и хлорорганических соединений. Электрохимия. 1996. Т.32. С. 130. [Yanilkin, V.V., Maksimuk, N.I., and Strunskaya, E.I., The double mediated system “the organic transmission vector of electrons–metal ions” in reactions of electrochemical reduction of organobromine and organochlorine compounds, Russ. J. Electrochem. (in Russian), 1996, vol. 32, p. 130.]
Янилкин, В.В., Насретдинова, Г.Р., Кокорекин, В.А. Медиаторный электрохимический синтез наночастиц металлов. Успехи химии. 2018. Т. 87. С. 1080. [Yanilkin, V.V., Nasretdinova, G.R., and Kokorekin, V.A., Mediated electrochemical synthesis of metal nanoparticles, Russ. Chem. Rev., 2018, vol. 87, p. 1080.
Yanilkin, V.V., Nastapova, N.V., Nasretdinova, G.R., Osin, Y.N., Evtugyn, V.G., Ziganshina, A.Y., and Gubaidullin, A.T., Structure and catalytic activity of ultrasmall Rh, Pd and (Rh + Pd) nanoparticles obtained by mediated electrosynthesis, New J. Chem., 2019, vol. 43, p. 3931.
Mamedov, V.A., Zhukova, N.A., Kadyrova, M.S., Fazleeva, R.R., Bazanova, O.B., Beschastnova, T.N., Gubaidullin A.T., Rizvanov, I.K., Yanilkin, V.V., Latypov, S.K., and Sinyashin, O.G., “Environmentally friendly and efficient method for the synthesis of the new α,α'-diimine ligands with benzimidazole moiety”, J. Heterocycl. Chem., 2019, in press.
Hassner, A., Namboothiri, I. Organic Syntheses Based on Name Reactions, 3th ed., Amsterdam: Elsevier, 2012, p. 299.
Mamedov, V.A., Quinoxalines. Synthesis, Reactions, Mechanisms and Structure, Switzerland: Springer, 2016.
Mamedov, V.A. and Zhukova, N.A., Progress in Quinoxaline Synthesis (Part 2), In Progress in Heterocyclic Chemistry, Gribble, G.W., Joule, J.A., Eds., Amsterdam: Elsevier, 2013, vol. 25, p. 1.
Mamedov, V.A., Recent advances in the synthesis of benzimidazol(on)es via rearrangements of quinoxalin(on)es, RSC Adv., 2016, vol. 6, p. 42132.
Mamedov, V.A. and Murtazina, A.M., Recyclization reactions leading to benzimidazoles. Russ. Chem. Rev., 2011, vol. 80, p. 397.
Янилкин, В.В., Насыбуллина, Г.Р., Султанова, Э.Д., Зиганшина, А.Ю., Коновалов, А.И. Метилвиологен и тетравиологеновый каликс[4]резорцин – медиаторы электрохимического восстановления [PdCl4]2– с образованием мелкодисперсного Pd(0). Изв. АН, сер. хим. 2014. № 6. С. 1409. [Yanilkin, V.V., Nasybullina, G.R., Sultanova, E.D., Ziganshina, A.Yu., and Konovalov, A.I., Methyl viologen and tetraviologen calix[4]resorcinol as mediators of the electrochemical reduction of [PdCl4]2– with formation of finely dispersed Pd0, Russ.Chem.Bull., Int.Ed., 2014, vol. 63, 1409.]
Nasretdinova, G.R., Fazleeva, R.R., Mukhitova, R.K., Nizameev, I.R., Kadirov, M.K., Ziganshina, A.Y., and Yanilkin, V.V., Electrochemical synthesis of silver nanoparticles in solution, Electrochem. Commun., 2015, vol. 50, p. 69.
Yanilkin, V.V., Nastapova, N.V., Nasretdinova, G.R., Fazleeva, R.R., Toropchina, A.V., and Osin Y.N., Methylviologen mediated electrochemical reduction of AgCl—a new route to produce a silica core/Ag shell nanocomposite material in solution, Electrochem. Commun., 2015, vol. 59, p. 60.
Янилкин, В.В., Настапова, Н.В., Насретдинова, Г.Р., Мухитова, Р.К., Зиганшина, А.Ю., Низамеев, И.Р., Кадиров, М.К. Электрохимический синтез наночастиц Pd0 в растворе. Электрохимия. 2015. Т. 51. С. 1077. [Yanilkin, V.V., Nastapova, N.V., Nasretdinova, G.R., Mukhitova, R.K., Ziganshina, A.Yu., Nizameev, I.R., and Kadirov, M.K., Mediated Electrochemical Synthesis of Pd0 Nanoparticles in Solution, Russ J. Electrochem., 2015, vol. 51, p. 951.]
Насретдинова, Г.Р., Фазлеева, Р.Р., Мухитова, Р.К., Низамеев, И.Р., Кадиров, М.К., Зиганшина, А.Ю., Янилкин, В.В. Медиаторный электрохимический синтез наночастиц серебра в объеме раствора. Электрохимия. 2015. Т. 51. С. 1164. [Nasretdinova, G.R., Fazleeva, R.R., Mukhitova, R.K., Nizameev, I.R., Kadirov, M.K., Ziganshina, A.Yu., and Yanilkin, V.V., Electrochemical Mediated Synthesis of Silver Nanoparticles in Solution, Russ J. Electrochem., 2015, vol. 51, p. 1029.]
Fedorenko, S., Jilkin, M., Nastapova, N., Yanilkin, V., Bochkova, O., Buriliov, V., Nizameev, I., Nasretdinova, G., Kadirov, M., Mustafina, A., and Budnikova, Y., Surface decoration of silica nanoparticles by Pd(0) deposition for catalytic application in aqueous solutions, Colloids and Surfaces A: Physicochem. Eng. Aspects, 2015, vol. 486, p. 185.
Yanilkin, V.V., Nastapova, N.V., Nasretdinova, G.R., Fedorenko, S.V., Jilkin, M.E., Mustafina, A.R., Gubaidullin A.T., and Osin, Y.N., Methylviologen mediated electrosynthesis of gold nanoparticles in the solution bulk. RSC Advances., 2016, vol. 6. p. 1851.
Nasretdinova, G.R., Osin, Y.N., Gubaidullin, A.T., and Yanilkin, V.V. Methylviologen mediated electrosynthesis of palladium nanoparticles stabilized with CTAC, J. Electrochem. Soc., 2016, vol. 163, p. G99.
Yanilkin, V.V., Fazleeva, R.R., Nasretdinova, G.R., Nastapova, N.V., and Osin, Yu.N., The role of solvent in methylviologen mediated electrosynthesis of silver nanoparticles stabilized with polyvinylpyrrolidone, Butlerov Commun., 2016, vol. 46, p. 128.
Насретдинова, Г.Р., Фазлеева, Р.Р., Осин, Ю.Н., Губайдуллин, А.Т., Янилкин, В.В. Метилвиологен-медиаторный электрохимический синтез наночастиц серебра восстановлением наносфер AgCl, стабилизированных хлоридом цетилтриметиламмония. Электрохимия. 2017. Т. 53. С. 31. [Nasretdinova, G.R., Fazleeva, R.R., Osin, Y.N., Gubaidullin, A.T., and Yanilkin, V.V., Methylviologen mediated electrochemical synthesis of silver nanoparticles by reduction of AgCl nanospheres stabilized with cetyltrimethylammonium chloride, Russ. J. Electrochem., 2017, vol. 53, p. 31.]
Янилкин, В.В., Настапова, Н.В., Насретдинова, Г.Р., Фазлеева, Р.Р., Федоренко, С.В., Мустафина, А.Р., Осин, Ю.Н. Метилвиологен-медиаторный электрохимический синтез наночастиц платины в объеме раствора. Электрохимия. 2017. Т. 53. С. 578. [Yanilkin, V.V., Nastapova, N.V., Nasretdinova, G.R., Fazleeva, R.R., Fedorenko, S.V., Mustafina, A.R., and Osin, Yu.N., Methylviologen-Mediated Electrochemical Synthesis of Platinum Nanoparticles in Solution Bulk, Russ. J. Electrochem., 2017, vol. 53, p. 509.]
Yanilkin, V.V., Nastapova, N.V., Nasretdinova, G.R., and Osin, Yu.N., Electrosynthesis of gold nanoparticles mediated by methylviologen using a gold anode in single compartment cell, Mendeleev Commun., 2017, vol. 27, p. 274.
Кокорекин, В.А., Гамаюнова, А.В., Янилкин, В.В., Петросян, В.А. Медиаторный электрохимический синтез наночастиц меди в растворе. Изв. АН, сер. хим. 2017. №11. С. 2035. [Kokorekin, V.A., Gamayunova, A.V., Yanilkin, V.V., and Petrosyan, V. A., Mediated electrochemical synthesis of copper nanoparticles in solution bulk, Russ.Chem.Bull. (in Russian), Int. Ed., 2017, no. 11, p. 2035.]
Yanilkin, V.V., Fazleeva, R.R., Nasretdinova, G.R., Nastapova, N.V., and Osin, Y.N., Methylviologen mediated electrosynthesis of silver nanoparticles in a water medium. Effect of chain length and concentration of poly(N-vinylpyrrolidone) on particle size, New Materials, Compounds and Applications., 2018, vol. 2, no. 1, p. 28.
Nasretdinova, G.R., Fazleeva, R.R., Osin, Yu.N., Evtugin, V.G., Gubaidullin, A.T., Ziganshina, A.Yu., and Yanilkin, V.V., Methylviologen Mediated Electrochemical Synthesis of Catalytically Active Ultrasmall Pd–Ag Bimetallic Nanoparticles Stabilized by CTAC, Electrochim. Acta, 2018, vol. 285, p. 149.
Yanilkin, V.V., Nasybullina, G.R., Ziganshina, A.Y., Nizamiev, I.R., Kadirov, M.K., Korshin, D.E., and Konovalov, A.I., Tetraviologen calix[4]resorcine as a mediator of the electrochemical reduction of [PdCl4]2– for the creation of nanoparticles Pd(0), Mendeleev Commun., 2014, vol. 24, no. 2, p. 108.
Янилкин, В.В., Настапова, Н.В., Султанова, Э.Д., Насретдинова, Г.Р., Мухитова, Р.К., Зиганшина, А.Ю., Низамеев, И.Р., Кадиров, М.К. Электрохимический синтез нанокомпозита наночастиц палладия с полимерной виологенсодержащей нанокапсулой, Изв. АН, сер. хим. 2016. № 1. С. 125. [Yanilkin, V.V., Nastapova, N.V., Sultanova, E.D., Nasretdinova, G.R., Mukhitova, R.K., Ziganshina, A.Yu., Nizameev, I.R., and Kadirov, M.K., Electrochemical synthesis of nanocomposite of palladium nanoparticles with polymer viologen-containing nanocapsule, Russ. Chem. Bull, 2016, vol. 65, no. 1, p. 125.
Янилкин, В.В., Настапова, Н.В., Фазлеева, Р.Р., Насретдинова, Г.Р., Султанова, Э.Д., Зиганшина, А.Ю., Губайдуллин, А.Т., Самигуллина, А.И., Евтюгин, В.Г., Воробьев, В.В., Осин, Ю.Н. Электрохимический синтез наночастиц металлов с использованием полимерного медиатора, восстановленная форма которого адсорбируется (осаждается) на электроде. Изв. АН. Сер. хим. 2018. № 2. С. 215. [Yanilkin, V.V., Nastapova, N.V., Fazleeva, R.R., Nasretdinova, G.R., Sultanova, E.D., Ziganshina, A.Yu., Gubaidullin, A.T., Samigullina, A.I., Evtugin, V.G., Vorobev, V.V., and Osin, Yu.N., Electrochemical synthesis of metal nanoparticles using a polymeric mediator, whose reduced form is adsorbed (deposited) on an electrode, Russ. Chem. Bull., 2018, vol. 67, p. 215.]
Yanilkin, V.V., Nastapova, N.V., Nasretdinova, G.R., Fazleeva, R.R., and Osin, Yu.N., Molecular oxygen as a mediator in the electrosynthesis of gold nanoparticles in DMF, Electrochem. Commun., 2016, vol. 69, p. 36.
Янилкин, В.В., Настапова, Н.В., Фазлеева, Р.Р., Насретдинова, Г.Р., Султанова, Э.Д., Зиганшина, А.Ю., Губайдуллин, А.Т., Самигуллина, А.И., Евтюгин, В.Г., Воробьев, В.В., Осин, Ю.Н. Молекулярный кислород в роли медиатора при электросинтезе наночастиц металлов в ДМФА. Электрохимия. 2018. Т. 54. С. 307. [Yanilkin, V.V., Nastapova, N.V., Fazleeva, R.R., Nasretdinova, G.R., Sultanova, E.D., Ziganshina, A.Yu., Gubaidullin, A.T., Samigullina, A.I., Evtyugin, V.G., Vorob’ev, V.V., and Osin, Yu.N., Molecular Oxygen as Mediator in the Metal Nanoparticles’ Electrosynthesis in N,N-Dimethylformamide, Russ. J. Electrochem., 2018, vol. 54, p. 265.]
Yanilkin, V.V., Nasretdinova, G.R., Osin, Y.N., and Salnikov, V.V., Anthracene mediated electrochemical synthesis of metallic cobalt nanoparticles in solution, Electrochim. Acta, 2015, vol. 168, p. 82.
Yanilkin, V.V., Nastapova, N.V., Nasretdinova, G.R., Osin, Yu.N., and Gubaidullin, A.T., Fullerene mediated electrosynthesis of Au/C60 nanocomposite, ECS J. Solid State Sci. Technol., 2017, vol. 6, no. 4, p. M19.
Yanilkin, V.V., Nastapova, N.V., Nasretdinova, G.R., Fazleeva, R.R., Samigullina, A.I., Gubaidullin, A.T., Ivshin, Y.V., Evtyugin, V.G., and Osin, Y.N., Fullerene-mediated electrosynthesis of Ag–C60 nanocomposite in a water-organic two-phase system, Mendeleev Commun., 2017, vol. 27, p. 577.
Yanilkin, V.V., Nastapova, N.V., Nasretdinova, G.R., Fazleeva, G.M., Islamova, L.N., Osin, Yu.N., Gubaidullin, A.T., Mediated electrosynthesis of nanocomposites: Au nanoparticles in matrix of C70 and some derivatives of C60 fullerene, ECS J. Solid State Sci. Technol., 2017, vol. 6, no. 12, p. M143.
Yanilkin, V.V., Fazleeva, R.R., Nasretdinova, G.R., Nastapova, N.V., and Osin, Yu.N., Fullerene Mediated Electrosynthesis of Silver Nanoparticles in Toluene-DMF, J. Solid State Sci. Technol., 2018, vol. 7, no. 4, p. M55.
Янилкин, В.В., Фазлеева, Р.Р., Настапова, Н.В., Насретдинова, Г.Р., Губайдуллин, А.Т., Березин, Н.Б., Осин, Ю.Н. Исследование комплексов кобальта(III) и хрома(III) в качестве медиатора при электросинтезе наночастиц серебра в водной среде. Электрохимия. 2018. Т. 54. С. 747. [Yanilkin, V.V., Fazleeva, R.R., Nastapova, N.V., Nasretdinova, G.R., Gubaidullin, A.T., Berezin, N.B., and Osin, Yu.N., Studies of Cobalt(III) and Chromium(III) Complexes as Mediators in the Silver Nanoparticle Electrosynthesis in Aqueous Media, Russ. J. Electrochem., 2018, vol. 54, p. 650.
Suh, M.P., Metal-Organic Frameworks and Porous Coordination Polymers: Properties and Applications, Bull. Jpn. Soc. Coord. Chem., 2015, vol. 65, p. 9.
Caia, X., Denga, X., Xiea, Z., Shia, Y., Panga, M., and Lina, J., Controllable synthesis of highly monodispersed nanoscale Fe-soc-MOF and the construction of Fe-soc-MOF@polypyrrole core–shell nanohybrids for cancer therapy, Chem. Engineering J., 2018, vol. 358, p. 369.
Gao, X.W., Yang, J., Song, K., Luo, W.B., Dou, S.X., and Kang, Y.M., Robust FeCo nanoparticles embedded in a N-doped porous carbon framework for high oxygen conversion catalytic activity in alkaline and acidic media, J. Mater. Chem. A, 2018, vol. 46, no. 6, p. 23445.
Sun, Q., Zhai, W., Hou, G., Feng, J., Zhang, L., Si, P., Guo, S., and Ci, L., In Situ Synthesis of a Lithiophilic Ag-Nanoparticles-Decorated 3D Porous Carbon Framework toward Dendrite-Free Lithium Metal Anodes, ACS Sustainable Chem. Eng., 2018, vol. 11, no. 6, p. 15219.
Zhang, S., Wu, Q., Tang, L., Hu, Y., Wang, M., Zhao, J., Li, M., Han, J., Liu, X., and Wang, H., Individual High-Quality N-Doped Carbon Nanotubes Embedded with Nonprecious Metal Nanoparticles toward Electrochemical Reaction, ACS Appl. Mater. Interfaces, 2018, vol. 46, no. 10, p. 39757.
Wua, Y., Qiua, X., Lianga, F., Zhanga, Q., Kooc, A., Dai, Y., Lei, Y., and Sunc, X., A metal-organic framework-derived bifunctional catalyst for hybrid sodium-air batteries, Appl. Catal. B: Environmental., 2019, vol. 241, p. 407.
Wu, T., Ma, J., Wang, X., Liu, Y., Xu, H., Gao, J., Wang, W., Liu, Y., and Yan, J., Graphene oxide supported Au–Ag alloy nanoparticles with different shapes and their high catalytic activities, Nanotechnology, 2013, vol. 24, no. 12, p. 125301.
Gan, T., Wang, Z., Shi, Z., Zheng, D., Sun, J., and Liu, Y., Graphene oxide reinforced core–shell structured Ag@Cu2O with tunable hierarchical morphologies and their morphology–dependent electrocatalytic properties for bio-sensing applications, Biosensors and Bioelectronics., 2018, vol. 112, p. 23.
Wang, L., Wang, L., Zhang, J., Wang, H., and Xiao, F.-S., Enhancement of the activity and durability in CO oxidation over silica-supported Au nanoparticle catalys via CeOx modification, Chinese J. Catal., 2018, vol. 39, p. 1608.
Eremenko, A., Smirnova, N., Gnatiuk, I., Linnik, O., Vityuk, N., Mukha, Y.,and Korduban, A., Silver and Gold Nanoparticles on Sol–Gel TiO2, ZrO2, SiO2 Surfaces: Optical Spectra, Photocatalytic Activity, Bactericide Properties, In Nanocomposites and Polymers with Analytical Methods, Cuppoletti J., Ed., Croatia: InTech, 2011, p. 404.
An, K. and Somorjai, G.A., Nanocatalysis I: Synthesis of Metal and Bimetallic Nanoparticles and Porous Oxides and Their Catalytic Reaction Studies, Catal. Lett., 2015, vol. 145, p. 233.
Majhi, S.M., Naik, G.K., Lee, H.-J., Song, H.-G., Lee, C.-R., Lee, I.-H., and Yu, Y.-T., Au@NiO core-shell nanoparticles as a p-type gas sensor: Novelsynthesis, characterization, and their gas sensing properties withsensing mechanism, Sensors and Actuators B, 2018, vol. 268, p. 223.
Liu, J., Zou, S., Li, S., Liao, X., Hong, Y., Xiao, L., and Fan, J., A general synthesis of mesoporous metal oxides with well-dispersed metal nanoparticles via a versatile sol–gel process, J. Mater. Chem. A, 2013, vol. 1, p. 4038.
Padbury, R.P., Halbur, J.C., Krommenhoek, P.J., Tracy, J.B., and Jur, J.S., Thermal Stability of Gold Nanoparticles Embedded within Metal Oxide Frameworks Fabricated by Hybrid Modifications onto Sacrificial Textile Templates, Langmuir, 2015, vol. 31, no. 3, p. 1135.
Rajender Reddy, K., Kumar, N.S., Surendra Reddy, P., Sreedhar, B., and Lakshmi Kantam, M., Cellulose supported palladium(0) catalyst for Heck and Sonogashira coupling reactions, J. Molec. Catal. A: Chemical, 2006, vol. 252, p. 12.
Koga, H., Tokunaga, E., Hidaka, M., Umemura, Y., Saito, T., Isogai, A., and Kitaoka, T., Topochemical synthesis and catalysis of metal nanoparticles exposed on crystalline cellulose nanofibers, Chem. Commun., 2010, vol. 46. p. 8567.
Cirtiu, C.M., Dunlop-Brière, A.F., and Moores, A., Cellulose nanocrystallites as an efficient support for nanoparticles of palladium: application for catalytic hydrogenation and Heck coupling under mild conditions, Green Chem., 2011, vol. 13, no. 2, p. 288.
Lam, E., Hrapovic, S., Majid, E., Chong, J.H., and Luong, J.H.T., Catalysis using gold nanoparticles decorated on nanocrystalline cellulose, Nanoscale, 2012, vol. 4, no. 3, p. 997.
Tang, J., Shi. Z., Berry, R.M., and Tam, K.C., Mussel-Inspired Green Metallization of Silver Nanoparticles on Cellulose Nanocrystals and Their Enhanced Catalytic Reduction of 4-Nitrophenol in the Presence of β‑Cyclodextrin, Ind. Eng. Chem. Res., 2015, vol. 54, p. 3299.
Kaushik, M. and Moores, A., Review: nanocelluloses as versatile supports for metal nanoparticles and their applications in catalysis, Green Chem., 2016, vol. 18, p. 622.
Chen, L., Cao, W., Quinlan, P.J., Berry, R.M., and Tam, K.C., Sustainable Catalysts from Gold-Loaded Polyamidoamine Dendrimer-Cellulose Nanocrystals, ACS Sustain. Chem. Eng., 2015, vol. 3, p. 978.
Tang, J., Sisler, J., Grishkewich, N., and Tam, K.C., Functionalization of cellulose nanocrystals for advanced applications, J. Colloid and Interface Sci., 2017, vol. 494, p. 397.
Eisa, W.H., Abdelgawad, A.M., and Rojas, O.J., Solid-State Synthesis of Metal Nanoparticles Supported on Cellulose Nanocrystals and Their Catalytic Activity, ACS Sustain. Chem. Eng., 2018, vol. 6, no. 3, p. 3974.
Liu, H., Wang, D., Shang, S., and Song, Z., Synthesis and characterization of Ag–Pd alloy nanoparticles/carboxylated cellulose nanocrystals nanocomposites, Carbohydrate Polymers, 2011, vol. 83, no. 1, p. 38.
Liu, H., Wang, D., Song, Z., and Shang, S., Preparation of silver nanoparticles on cellulose nanocrystals and the application in electrochemical detection of DNA hybridization, Cellulose, 2011, vol. 18, no. 1, p. 67.
Schlesinger, M., Giese, M., Blusch, L.K., Hamad, W.Y., and MacLachlan, M.J., Chiral Nematic Cellulose-Gold Nanoparticle Composites from Mesoporous Photonic Cellulose, Chem. Commun., 2015, vol. 51, p. 530.
Zhang, T., Wang, W., Zhang, D., Zhang, X., Ma, Y., Zhou, Y., and Qi, L., Biotemplated Synthesis of Gold Nanoparticle–Bacteria Cellulose Nanofiber Nanocomposites and Their Application in Biosensing, Adv. Funct. Mater., 2010, vol. 20, p. 1152.
Wang, W., Zhang, T.J., Zhang, D.W., Li, H.Y., Ma, Y.R., Qi, L.M., Zhou, Y.L., and Zhang, X.X., Amperometric hydrogen peroxide biosensor based on the immobilization of heme proteins on gold nanoparticles-bacteria cellulose nanofibers nanocomposite, Talanta, 2011, vol. 84, p. 71.
Drogat, N., Granet, R., Sol, V., Memmi, A., Saad, N., Koerkamp, C.K., Bressollier, P., and Krausz, P., Antimicrobial silver nanoparticles generated on cellulose nanocrystals, J. Nanoparticle Res., 2011, vol. 13, no. 4, p. 1557.
Berndt, S., Wesarg, F., Wiegand, C., Kralisch, D., and Müller, F.A., Antimicrobial porous hybrids consisting of bacterial nanocellulose and silver nanoparticles, Cellulose, 2013, vol. 20, p. 771.
Padalkar, S., Capadona, J.R., Rowan, S.J., Weder, C., Won, Y.-H., Stanciu, L.A., and Moon, R.J., Natural Biopolymers: Novel Templates for the Synthesis of Nanostructures, Langmuir, 2010, vol. 26, no. 11, p. 8497.
Shin, Y., Bae, I.T., Arey, B.W., and Exarhos, G.J., Simple preparation and stabilization of nickel nanocrystals on cellulose nanocrystal, Mater. Letters, 2007, vol. 61, p. 3215.
Shin, Y., Bae, I.T., Arey, B.W., and Exarhos, G.J., Facile stabilization of gold-silver alloy nanoparticles on cellulose nanocrystal, J. Phys. Chem. C., 2008, vol. 112, no. 13, p. 4844.
Majoinen, J., Hassinen, J., Haataja, J.S., Rekola, H.T., Kontturi, E., Kostiainen, M. A., and Ikkala, O., Chiral Plasmonics Using Twisting along Cellulose Nanocrystals as a Template for Gold Nanoparticles, Advanced Mater., 2016, vol. 28, p. 5262.
Wei, H., Rodriguez, K., Renneckar, S., Lenga, W., and Vikesland, P.J., Preparation and evaluation of nanocellulose–gold nanoparticle nanocomposites for SERS Applications, Analyst, 2015, vol. 140, p. 5640.
Суздалев, И.П. Нанотехнология: физико-химия нанокластеров, наноструктур и наноматериалов (2‑е изд.). M.: КомКнига. 2006. 589 с. [Suzdalev, I.P., Nanotechnology. Physicochemistry of nanoclusters, nanostructures and nanomaterials. Moscow: KomKniga, 2006. 589 p.]
Kharisov, B.I., Kharissova, O.V., and Ortiz-Mendez, U., Handbook of less-common nanostructures. CRC Press, Taylor @ Francis Group, 2012, p. 828.
Hervés, P., Pérez-Lorenzo, M., Liz-Marzán, L.M., Dzubiella, J., Lu, Y., and Ballauff, M., Catalysis by metallic nanoparticles in aqueous solution: model reactions, Chem. Soc. Rev., 2012, vol. 41, p. 5577.
Gu, S., Wunder, S., Lu, Y., Ballauff, M., Rademann, K., Fenger, R., Jaquet, B., and Zaccone, A., Kinetic Analysis of the Catalytic Reduction of 4-Nitrophenol by Metallic Nanoparticles, J. Phys. Chem. C., 2014, vol. 118, p. 18618.
Yanilkin, V.V., Fazleeva, R.R., Nasretdinova, G.R., Osin, Yu.N., Gubaidullin, A.T., and Ziganshina, A.Yu., Two-step one-pot electrosynthesis and catalytic activity of the CoO–CoO•– H2O supported silver nanoparticles, J. Solid State Electrochem., 2019, vol. 24, p. 829.
Дополнительные материалы отсутствуют.