Электрохимия, 2021, T. 57, № 12, стр. 769-778
Электродиализное извлечение и электроосаждение меди(II) в системах с жидкими мембранами на основе ди(2-этилгексил)фосфорной кислоты
Институт неорганической химии Рижского технического университета
Рига, Латвия
* E-mail: sadyrbaeva@hotmail.com
** E-mail: Tatiana.Sadyrbaeva@rtu.lv
Поступила в редакцию 12.01.2021
После доработки 12.04.2021
Принята к публикации 05.05.2021
Аннотация
Представлен новый процесс извлечения ионов меди(II) из солянокислых растворов жидкими мембранами, содержащими ди(2-этилгексил)фосфорную кислоту с добавками три-н-октиламина, в условиях электродиализа с катодным электроосаждением металла. Изучено влияние концентрации соляной кислоты и меди(II) в исходном растворе, состава органической жидкой мембраны и катодного водного раствора, а также плотности тока электродиализа и материала электродов на скорость извлечения и электроосаждения ионов металла. Показано, что практически полное (96–100%) извлечение ионов меди(II) жидкими мембранами из исходного раствора, содержащего 0.01 М CuCl2, достигается за 0.5–3.0 ч электродиализа и сопровождается резким подъемом напряжения в гальваностатическом режиме процесса. Максимальная полученная степень реэкстракции меди в катодный раствор составляет 94%, а максимальная степень электроосаждения – 74%. Показано, что плотные, матовые или блестящие, хорошо сцепленные с электродом катодные осадки меди получаются при электроосаждении из разбавленных растворов серной, соляной, хлорной, азотной и уксусной кислот.
ВВЕДЕНИЕ
Медь обладает высокой электропроводностью и теплопроводностью и применяется для изготовления кабелей, проводов, теплообменников, радиаторов отопления, водопроводных труб, для покрытия крыш, а также в органическом синтезе в качестве катализатора [1]. В машиностроительной и энергетической промышленности широко используются сплавы меди: латуни, бронзы, медноникелевые сплавы, обладающие хорошей коррозионной стойкостью и высокой прочностью. Сульфат меди (медный купорос) применяется в гальванотехнике, в производстве ацетатного волокна, для дубления кожи, в сельском хозяйстве как антисептик, фунгицид и медно-серное удобрение, а также в качестве пищевой добавки. Хлорид меди получил широкое применение в качестве катализатора, в пиротехнике и производстве красок, в химической и фармацевтической промышленности. Хлоридные электролиты также использутся для меднения стали. Ацетат меди (ярь-медянка) – пигмент для масляной краски, фунгицид и катализатор полимеризации. Оксид меди используется для окраски стекла и эмалей в синий и зеленый цвета. Ионы меди(II) содержатся в сточных водах многих предприятий: гальванических производств, предприятий цветной металлургии, машиностроения и приборостроения, химической и лакокрасочной промышленности, производства стекла, а также в шахтных водах. Несмотря на то, что медь принадлежит к числу необходимых для человека микроэлементов, все соли этого металла токсичны, и сточные воды должны быть очищены от ионов меди(II) [2]. Предельно допустимая концентрация меди в питьевой воде по современным нормам составляет 1.0 мг/л.
Для извлечения тяжелых металлов из водных растворов применяют различные методы: осаждение, сорбцию, ионный обмен, экстракцию, обратный осмос, электродиализ, электроосаждение [2–6]. К недостаткам этих методов относится высокая стоимость реагентов, высокие эксплуатационные расходы, низкая селективность. В течение последних 30 лет развивается перспективный метод извлечения ионов металлов из разбавленных растворов – экстракция жидкими мембранами [7–10]. Жидкая мембрана – это слой органического растворителя с селективным переносчиком, разделяющий два водных раствора. Мембранная экстракция имеет ряд преимуществ по сравнению с жидкостной экстракцией: одновременная экстракция и реэкстракция в одну стадию процесса, высокая скорость переноса, минимальное количество органических реагентов и растворителей. Существует несколько типов жидких мембран: объемные, импрегнированные, эмульсионные, мембраны с полыми волокнами, а также гибридные системы.
В гидрометаллургических процессах для извлечения катионов различных тяжелых металлов из слабокислых и нейтральных растворов широко используется ди(2-этилгексил)фосфорная кислота (Д2ЭГФК) [11]. Этот экстрагент характеризуется быстрой кинетикой экстракции, низкой растворимостью в водной фазе и производится в промышленном масштабе. Процессы мембранной экстракции меди(II) с помощью Д2ЭГФК изучали многие исследователи в системах с объемными [12, 13], импрегнированными [14, 15], эмульсионными [16–19], половолоконными жидкими мембранами [20] и с гибридной жидкой мембраной непрерывного действия [21]. В этих процессах движущей силой переноса ионов меди(II) является градиент pH между отдающим и принимающим водными растворами. Авторами изучено влияние различных параметров на стабильность жидких мембран и кинетику извлечения.
Электродиализ с жидкими мембранами – комбинированный процесс, который объединяет мембранную экстракцию с электродиализом и электроосаждением, был изобретен Б.А. Пуриным [22, 23]. Движущей силой переноса ионов металла в данном процессе является градиент электрического поля. Наложение постоянного электрического поля интенсифицирует перенос ионов через мембрану и значительно облегчает реэкстракцию металлов из органической фазы. В отличие от традиционной мембранной экстракции при электродиализе не требуется высокая кислотность принимающего раствора, так как транспорт катионов металла сонаправлен с переносом ионов водорода. Ранее нами были изучены электродиализные процессы извлечения ионов меди(II) жидкими мембранами на основе Д2ЭГФК из индивидуальных сернокислых растворов [24], а также из бинарных солянокислых смесей с палладием(II) [25]. В этих работах использовали 5-камерную ячейку, состоящую из двух электродных камер, камер отдающего и принимающего растворов и жидкой мембраны. Жидкие мембраны, ограниченные целлофановыми пленками, стабильнее чем традиционные импрегнированные и эмульсионные жидкие мембраны, использующиеся в настоящее время. Продолжительность электродиализных экспериментов достигает 4–5 ч. Дополнительной возможностью повышения стабильности объемной жидкой мембраны является увеличение ее толщины. Компоненты жидкой мембраны, как правило, не выходят из органической фазы при электродиализе.
В последние годы метод электродиализа в системе с импрегнированной жидкой мембраной использовали для разделения катионов щелочных металлов [26]. Авторами [27] предложена жидкая мембрана сэндвичевого типа в процессе электродиализа для селективного извлечения катионов лития с отделением от магния.
Электродиализ с катодным осаждением металла в системах с жидкими мембранами успешно применялся нами ранее для извлечения ионов серебра(I) и свинца(II) из азотнокислых растворов [28, 29]. Выбором параметров электродиализа: плотности тока, времени, концентрации компонентов, можно достигнуть полного извлечения металла из исходного раствора и повысить степень реэкстракции и электроосаждения. Метод электродиализа имеет преимущество по сравнению с обычным электролизом: состав раствора для электроосаждения отличается по составу от исходного раствора соли металла.
Целью данной работы является изучение процесса извлечения меди(II) из солянокислых растворов жидкими мембранами, содержащими Д2ЭГФК, в условиях гальваностатического электродиализа с электроосаждением металла в катодном растворе.
МЕТОДИКА ЭКСПЕРИМЕНТА
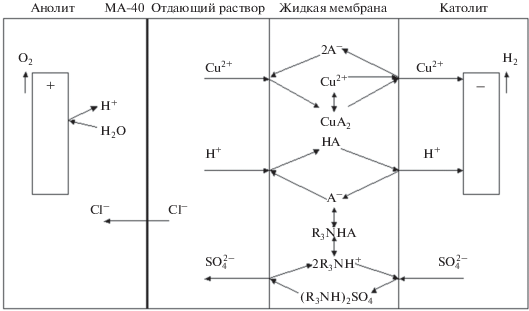
Процесс мембранной экстракции изучали с помощью сборной фторопластовой ячейки, в которой жидкая мембрана толщиной 0.2 см была заключена между двумя целлофановыми пленками площадью 7.1 см2. Катодная и анодная камеры имели объем 17 см3, объем камеры отдающего раствора – 13 см3, объем жидкой мембраны – 2 см3. Камера отдающего раствора была отделена от анодной камеры твердой анионообменной мембраной МА-40. Целлофановые пленки и анионообменные мембраны предварительно вымачивали в дистиллированной воде. Электродиализ проводили в гальваностатическом режиме с помощью источника постоянного тока AX-12001 DBL. Использовали плоские платиновые, графитовые, свинцовые и титановые электроды. Температура растворов в ходе экспериментов повышалась от комнатной температуры на 5–10°С, растворы не перемешивали.
Жидкие мембраны готовили растворением необходимого объема Д2ЭГФК и три-н-октиламина (ТОА) в 1,2-дихлорэтане. Использовали техническую Д2ЭГФК, содержащую ~63% основного вещества, ~16% моноалкилфосфорной кислоты, ~6% триалкилфосфорной кислоты, а также спирты. В большинстве экспериментов применяли 0.4 М (20 об. %) растворы Д2ЭГФК с добавкой 0.1 M ТОА. Отдающий раствор готовили растворением навески хлорида меди CuCl2⋅2H2O (марка “ч. д. а.”) в соляной кислоте нужной концентрации. Концентрацию соляной кислоты в отдающем растворе варьировали от 3 × 10–3 до 1.0 М при постоянной исходной концентрации соли меди 0.01 M. Концентрацию меди(II) изменяли от 0.01 до 0.3 М при постоянной концентрации соляной кислоты 0.01 M. Концентрацию ионов меди в водных растворах определяли спектрофотометрическим методом с рубеановодородной кислотой при 388 нм [30]. Измерения оптической плотности проводили на спектрофотометре Jenway 6300. Морфологию поверхности катодных осадков меди изучали с помощью оптического микроскопа Biolux NV (Bresser, Германия).
Для характеристики скорости экстракции ионов меди(II) из отдающего раствора в жидкую мембрану определяли степень извлечения Е (%):
где c0 и cf – начальная и текущая концентрации меди(II) в отдающем растворе (М).Степень электроосаждения меди D (%) рассчитывали в соответствии с выражением:
где m – масса катодного осадка (г), M – молярная масса меди (г/моль), Vf – объем отдающего раствора (л).Степень реэкстракции металла из жидкой мембраны R (%) вычисляли, учитывая концентрацию ионов меди(II) в катодном растворе и количество осажденного на катоде металла:
(3)
$R = (({{c}_{{\text{k}}}}{{V}_{{\text{k}}}}){\text{/}}({{c}_{0}}{{V}_{{\text{f}}}})\,\, \times \,\,100\% ) + D,$Для характеристики скорости переноса меди(II) через жидкую мембрану определяли величину потока J (моль/(м2 с)):
где S – видимая площадь жидкой мембраны (м2), t – продолжительность процесса (с).Выход по току W (%) для катионов меди(II) рассчитывали как:
где F – число Фарадея (96 485 Кл/моль), I – сила тока (А), t – продолжительность процесса (с).Число переноса ионов меди(II) nCu определяли по формуле:
МЕХАНИЗМ МЕМБРАННОЙ ЭКСТРАКЦИИ
Из литературных данных известно, что Д2ЭГФК существует в димерной форме в малополярных растворителях, образует мономеры в спиртах и промежуточные комплексы в хлороформе и ацетоне [31]. В данной работе использовался достаточно полярный растворитель 1,2-дихлорэтан (ε > 10). Можно предположить, что в фазе жидкой мембраны мономеры и димеры Д2ЭГФК существуют в сравнимых количествах. В присутствии в органическом растворе три-н-октиламина в результате реакции переноса протона образуется бинарный экстрагент – ионная пара R3NH+A− [32]:
(7)
${\text{HA}} + {{{\text{R}}}_{3}}{\text{N}} \leftrightarrow {{{\text{R}}}_{3}}{\text{N}}{{{\text{H}}}^{ + }}{{{\text{A}}}^{ - }},$В условиях избытка Д2ЭГФК часть меди(II) взаимодействует с индивидуальным экстрагентом HA. Таким образом, извлечение ионов меди(II) можно представить следующими уравнениями катионообменной экстракции (без учета частичной димеризации Д2ЭГФК):
(8)
${\text{Cu}}_{{({\text{в}})}}^{{2 + }} + {\text{ }}2{{{\text{R}}}_{3}}{\text{NH}}{{{\text{A}}}_{{({\text{o}})}}} \leftrightarrow {\text{Cu}}{{{\text{A}}}_{{2({\text{о}})}}} + 2{{{\text{R}}}_{3}}{\text{NH}}_{{({\text{о}})}}^{ + },$(9)
${\text{Cu}}_{{({\text{в}})}}^{{2 + }} + 2{\text{H}}{{{\text{A}}}_{{({\text{o}})}}} \leftrightarrow {\text{Cu}}{{{\text{A}}}_{{2({\text{о}})}}} + 2{\text{H}}_{{({\text{в}})}}^{ + },$Ионы меди(II) переносятся за счет диффузии и электромиграции из объема отдающего раствора к границе раздела отдающий раствор/жидкая мембрана и взаимодействуют с переносчиком HA (Д2ЭГФК), образуя экстрагируемый комплекс CuA2. Комплекс меди(II) в 1,2-дихлорэтане может частично диссоциировать:
(10)
${\text{Cu}}{{{\text{A}}}_{{2({\text{o}})}}}~ \leftrightarrow {\text{Cu}}_{{({\text{о}})}}^{{2 + }} + 2{\text{A}}_{{({\text{о}})}}^{ - }.$Ионы меди(II) и молекулы нейтрального экстрагируемого комплекса CuA2 транспортируются через слой жидкой мембраны за счет электромиграции и диффузии. На границе раздела жидкая мембрана/катодный раствор комплекс меди(II) разрушается по реакциям, обратным (8) и (9), и катионы меди(II) переходят в приграничный слой катодного раствора. Затем ионы Cu2+ достигают поверхности катода и восстанавливаются до металла. Молекулы переносчиков HA и R3NHA диффундируют обратно к границе раздела фаз отдающий раствор/жидкая мембрана по градиенту их концентрации. Ионы водорода из отдающего раствора взаимодействуют с переносчиком на межфазной границе отдающий раствор/жидкая мембрана по реакции катионного обмена и транспортируются через жидкую мембрану в катодный раствор в том же направлении, что и катионы меди(II):
(11)
${\text{H}}_{{({\text{в}})}}^{ + } + {{{\text{R}}}_{3}}{\text{NH}}{{{\text{A}}}_{{({\text{o}})}}} \leftrightarrow {\text{H}}{{{\text{A}}}_{{({\text{o}})}}} + 2{{{\text{R}}}_{3}}{\text{NH}}_{{({\text{о}})}}^{ + }.$Преимуществом электродиализа по сравнению с процессами мембранной экстракции без тока является возможность извлекать ионы металлов в слабокислые или нейтральные растворы. Известно, что в традиционных мембранных системах с Д2ЭГФК потоки ионов металла и катионов водорода направлены противоположно, и поэтому необходима высокая кислотность принимающего раствора и корректировка pH отдающего раствора [33].
Если в принимающем катодном растворе содержится кислота H2SO4, сульфат-ионы взаимодействуют с бинарным экстрагентом на границе раздела фаз жидкая мембрана/катодный раствор:
(12)
$\begin{gathered} {\text{SO}}_{{4\,\,({\text{в}})}}^{{2 - }} + ~2{{{\text{R}}}_{3}}{\text{NH}}{{{\text{A}}}_{{({\text{o}})}}} \leftrightarrow \\ \leftrightarrow {{({{{\text{R}}}_{3}}{\text{NH}})}_{2}}{\text{S}}{{{\text{O}}}_{{4\,\,({\text{o}})}}} + 2{\text{А}}_{{({\text{о}})}}^{ - }. \\ \end{gathered} $Затем образовавшийся сульфат триоктиламмония (R3NH)2SO4 переносится через органический слой в обратном направлении по отношению к катионам меди и водорода, и сульфат-ионы реэкстрагируются из жидкой мембраны в отдающий раствор по реакции, обратной (12).
Механизм мембранной экстракции, описанный выше, является наиболее вероятным и не противоречит экспериментальным данным. На рис. 1 схематически изображен процесс электродиализного извлечения меди(II) в системе с жидкой мембраной.
На инертных платиновых электродах протекают окислительно-восстановительные реакции, которые сопряжены с переносом ионов через жидкую мембрану и твердую анионообменную мембрану. На катоде в растворах серной кислоты, обычно использовавшихся в качестве католита, происходит электроосаждение меди и выделение водорода:
(14)
$2{{{\text{H}}}^{ + }} + {\text{ }}2{\text{e}} \to {{{\text{H}}}_{2}}{\kern 1pt} \uparrow {\kern 1pt} .$На инертном аноде в сернокислом растворе выделяется газообразный кислород в результате окисления молекул воды:
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние состава катодного раствора
В предварительных экспериментах было установлено, что в отсутствие электрического поля экстракция ионов меди(II) в жидкую мембрану незначительна (2% за 1 ч), а степень реэкстракции практически равна нулю. При наложении постоянного электрического поля на систему происходит перенос ионов меди(II) через жидкую мембрану в катодный сернокислый раствор, и в ходе электродиализа наблюдается электроосаждение меди на катоде. При умеренной плотности тока 2.8 мA/см2 полное извлечение меди(II) из отдающего раствора достигается за 3 ч электродиализа при использовании в качестве католита разбавленных (0.1 M) растворов серной, соляной или уксусной кислот (табл. 1). Наиболее высокая скорость переноса меди(II) через жидкую мембрану 14 мкмоль/(м2 с) была достигнута в системах с сернокислым и солянокислым катодным раствором. Максимальная степень реэкстракции металла из органической фазы получена при использовании сернокислого католита. Электродиализ в системе с уксусной кислотой, которая является слабым электролитом, отличается значительно более высоким напряжением. В случае использования хлорнокислого или азотнокислого католита, скорость извлечения ионов меди(II) и напряжение на электродиализной ячейке в гальваностатическом режиме снижаются по сравнению с другими системами. В дальнейших экспериментах в качестве католита применяли 0.1 M раствор H2SO4.
Таблица 1.
Влияние природы кислоты в катодном растворе на степень извлечения ионов меди(II) в жидкую мембрану (Е), в катодный раствор (R), степень электроосаждения (D) и поток (J)
| Кислота (c = 0.1 М) |
E | R | D | J, мкмоль/(м2 с) |
|---|---|---|---|---|
| % | ||||
| H2SO4 | 97 | 83 | 45 | 14 |
| HCl | 100 | 80 | 67 | 14 |
| CH3COOH | 100 | 70 | 68 | 12 |
| HClO4 | 69 | 62 | 37 | 11 |
| HNO3 | 63 | 62 | 18 | 10 |
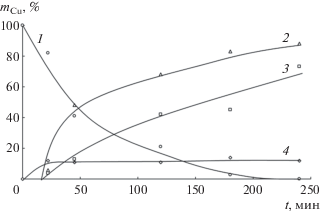
Кинетические зависимости извлечения и электроосаждения катионов меди(II) при плотности тока 2.8 мA/см2 приведены на рис. 2. В этих условиях за 4 ч электродиализа из отдающего раствора извлекается более 99.5% меди(II), степень реэкстракции в катодный раствор достигает 88%, и степень электроосаждения металла на катоде составляет 73%. Масса катодного осадка в ходе эксперимента непрерывно возрастает, в то время как содержание меди(II) в жидкой мембране незначительно изменяется в течение 0.5–4 ч процесса и составляет 11–12% (кривые 3, 4). Надо отметить, что после окончания электродиализа в органической фазе наблюдается образование водного слоя голубого раствора меди(II), объем которого составляет примерно 0.5 мл при общем объеме жидкой мембраны 2 мл. Электроосаждение металла начинается через 12–15 мин электродиализа на нижних углах прямоугольного платинового катода. В ходе процесса образуются плотные медные покрытия розового цвета, хорошо сцепленные с электродом, которые могут быть матовыми или блестящими в зависимости от плотности тока и продолжительности электродиализа. В экспериментах не наблюдалось падение частиц осадка меди с катода. Структура катодного осадка меди, полученного из раствора серной кислоты, показана на рис. 3. Покрытие имеет губчатую структуру, так как электроосаждение меди на электроде происходит одновременно с выделением водорода.
Влияние плотности тока и материала электродов
Повышение плотности тока от 0 до 4.2 мА/см2 приводит к пропорциональному росту степени экстракции меди(II) из отдающего раствора в органическую фазу, степени реэкстракции в катодный раствор, степени электроосаждения на катоде и величины потока ионов меди(II) через жидкую мембрану, а при увеличении плотности тока до 5.7 мА/см2 зависимости выходят на плато (рис. 4). При дальнейшем повышении плотности тока продолжительность процесса электродиализа сокращается из-за полного извлечения меди(II) из отдающего раствора. Наиболее высокая степень извлечения металла в жидкую мембрану, полученная при плотности тока 5.7 мА/см2, составляет 98%, а максимальная скорость трансмембранного переноса меди(II) достигает 53 мкмоль/(м2 с). Величина выхода по току для переноса ионов меди(II) через жидкую мембрану составляет примерно 25% при плотности тока 1.4 мА/см2 (cоответствующее число переноса катионов Cu2+, рассчитанное по формуле (6), равно 0.25). Увеличение плотности тока приводит к незначительному снижению выхода по току ионов меди(II). Ток через жидкую мембрану переносится в основном катионами водорода из отдающего раствора и сульфат-ионами из катодного раствора.
Рис. 4.
Зависимости степени извлечения меди(II) в жидкую мембрану Е (1), степени реэкстракции R (2), скорости переноса металла J (3), выхода по току W (4) и степени электроосаждения D (5) от плотности тока; t = 45 мин; католит – 0.1 M H2SO4.

В ходе гальваностатического электродиализа напряжение в системе может значительно изменяться в зависимости от условий эксперимента (рис. 5). При низкой плотности тока напряжение почти постоянно (кривая 4), в то время как при повышении плотности тока электродиализ заканчивается резким подъемом напряжения (кривые 1, 2). Подъем напряжения происходит тем раньше, чем выше плотность тока электродиализа. Было установлено, что резкое повышение напряжения и снижение электропроводности системы соответствуют практически полному (≥98%) извлечению меди(II) в жидкую мембрану. В результате экстракции катионов меди(II) и водорода в органическую фазу и переноса хлорид-ионов через твердую анионообменную мембрану в анодную камеру происходит обессоливание отдающего раствора. При низкой плотности тока количественное извлечение меди(II) из отдающего раствора во время эксперимента не достигается, и подъем напряжения не происходит. Таким образом, форма хронопотенциограмм может служить критерием полноты извлечения меди(II) из отдающего раствора.
Рис. 5.
Влияние плотности тока электродиализа на кинетические зависимости изменения напряжения; i (мА/см2): 1 – 7.1; 2 – 5.7; 3 – 4.2; 4 – 1.4.

Надо отметить, что сокращение продолжительности электродиализа при высокой плотности тока может приводить к снижению степени реэкстракции и электроосаждения металла по сравнению с более длительными экспериментами при умеренной плотности тока. Поэтому большинство экспериментов в данной работе проводили при плотностях тока 2.8–4.2 мА/см2.
Для изучения влияния материала электродов на процесс электродиализа использовали плоские платиновые, титановые, графитовые и свинцовые электроды. Было показано, что величина напряжения и форма хронопотенциограмм значительно изменяются в зависимости от материала электродов (рис. 6). При использовании титановых электродов напряжение значительно выше, чем в других изученных системах (кривая 1). Это связано с относительно низкой электропроводностью титана. После электродиализа на титановом аноде наблюдаются следы растворения – розового раствора хлорида титана(III). В случае свинцовых электродов на аноде также наблюдались следы растворения и образования белого осадка солей свинца. Было установлено, что графитовый катод мало пригоден для электроосаждения металла из-за плохого сцепления с осадком: наблюдалось падение части катодного осадка меди с электрода во время разборки электродиализной ячейки. Кроме того в ходе длительных экспериментов может происходить частичное разрушение обоих графитовых электродов. Таким образом, из четырех изученных материалов наиболее подходящим, инертным и стабильным электродным материалом является платина.
Рис. 6.
Влияние материала электродов на кинетические зависимости изменения напряжения: i = 2.8 мА/см2; электроды: 1 – Ti, 2 – C (графит), 3 – Pt, 4 – Pb.

Влияние состава исходного раствора
При повышении концентрации меди(II) в отдающем растворе от 1 × 10–2 до 0.3 М скорость переноса ионов металла через жидкую мембрану, а также масса катодного осадка возрастают, но степени извлечения и электроосаждения снижаются (рис. 7). Анализ рис. 7 позволяет заключить, что для электродиализного извлечения целесообразно использовать растворы меди(II) с концентрацией не выше 1 × 10–2 М. Максимальный полученный поток ионов меди(II) при исходной концентрации металла 0.3 М достигает 74 мкмоль/(м2 с). Надо отметить, что при увеличении исходной концентрации меди(II) повышается величина выхода по току для переноса ионов металла. При наиболее высокой исходной концентрации меди(II) выход по току составляет около 50%.
Рис. 7.
Зависимости степени извлечения меди(II) в жидкую мембрану Е (1), степени реэкстракции R (2), степени электроосаждения D (3), скорости переноса J (4) и выхода по току W (5) от исходной концентрации металла: i = 2.8 мА/см2; t = 2 ч; католит – 0.1 M H2SO4.

Повышение концентрации соляной кислоты в отдающем растворе от 3 × 10–3 до 1.0 М при постоянной концентрации меди(II) приводит к снижению степеней извлечения и электроосаждения металла, а также скорости переноса через жидкую мембрану (рис. 8). Негативное влияние избытка соляной кислоты в растворе меди(II) на эффективность электродиализного извлечения связано со снижением экстракционной способности Д2ЭГФК при повышении кислотности водной фазы [11]. Кроме того, при повышении концентрации соляной кислоты, которая при электродиализе является фоновым электролитом, возрастает поток катионов водорода через жидкую мембрану.
Рис. 8.
Зависимости степени извлечения меди(II) в жидкую мембрану Е (1), степени реэкстракции R (2), степени электроосаждения D (3) и скорости переноса J (4) от концентрации HCl в отдающем растворе. Условия см. рис. 7.

Оптимальная концентрация соляной кислоты в исходном растворе меди(II) – 3 × 10–3–0.01 М HCl. Надо отметить, что при низких концентрациях соляной кислоты сокращается продолжительность электродиализа, а в условиях высокой кислотности возможен электрический пробой – скачкообразное падение напряжения в системе.
Рисунок 9 иллюстрирует изменение формы хронопотенциограмм в зависимости от состава отдающего раствора. Если содержание меди(II) или соляной кислоты в растворе низкое (10–3 М), процесс электродиализа непродолжителен и заканчивается резким ростом напряжения, связанным с обессоливанием отдающего раствора и полным извлечением меди(II) (кривые 1, 2). При увеличении концентрации меди(II) или более высокой кислотности отдающего раствора напряжение в ходе электродиализа непрерывно понижается, при этом иногда наблюдаются скачкообразные падения напряжения (кривые 4–6), а в случае 0.003 М HCl хронопотенциограмма имеет вид кривой с максимумом. Повышение напряжения в интервале 60–80 мин электродиализа на кривой 3 можно объяснить извлечением меди(II) в жидкую мембрану и снижением концентрации электролита в отдающем растворе. Электропроводность системы с жидкой мембраной, как правило, определяется составом органической фазы. Снижение напряжения в ходе электродиализа связано с накоплением воды в жидкой мембране. Вода переносится в органическую фазу в составе гидратно-сольватных оболочек экстрагируемых ионов и за счет электроосмоса [34]. Накопление воды негативно влияет на транспортные свойства жидких мембран.
Измерения рН растворов
Экспериментально было показано, что электродиализное извлечение меди(II) сопровождается значительным повышением величины pH отдающего раствора и некоторым снижением pH анодного сернокислого раствора (табл. 2). Повышение величины pH отдающего раствора, содержащего медь(II), связано с извлечением ионов водорода в жидкую мембрану и обессоливанием отдающего раствора. Хлорид-ионы из отдающего раствора, а также сульфат-ионы, которые переносятся через жидкую мембрану в отдающий раствор из католита, транспортируются через твердую анионообменную мембрану МА-40 в анолит. Перенос хлорид-ионов и сульфат-ионов в анолит сопряжен с образованием ионов водорода в ходе анодной реакции (15). В ходе процесса снижается величина pH анодного сернокислого раствора в результате накопления в нем соляной кислоты. Кислотность катодного раствора за 40 мин электродиализа не изменяется, так как расход ионов водорода в катодной реакции (14) компенсируется притоком катионов H+ из отдающего раствора через жидкую мембрану.
Влияние состава жидкой мембраны
Повышение содержания технической Д2ЭГФК в жидкой мембране от 0.1 до 0.8 М (5–40 об. %) при постоянной концентрации три-н-октиламина 0.1 М приводит к увеличению степени извлечения меди(II) из отдающего раствора, степени реэкстракции металла и скорости переноса через мембрану (табл. 3). Значительное снижение степени электроосаждения и повышение потока меди(II) при максимальной концентрации Д2ЭГФК 0.8 М связано с сокращением продолжительности процесса. Оптимальная концентрация Д2ЭГФК – 0.4–0.6 М.
Таблица 3.
Влияние концентрации переносчика Д2ЭГФК и добавки ТОА в жидкой мембране на скорость извлечения и электроосаждения ионов меди(II) (i = = 2.8 мА/см2; t = 2 ч; катодный раствор – 0.1 М H2SO4)
| cД2ЭГФК, М | cТОА, М | Е | R | D | J, мкмоль/(м2 с) |
|---|---|---|---|---|---|
| % | |||||
| 0.1 | 0.1 | 69 | 69 | 31 | 18 |
| 0.2 | 0.1 | 91 | 84 | 29 | 22 |
| 0.4 | 0.1 | 88 | 76 | 41 | 19 |
| 0.6 | 0.1 | 95 | 82 | 44 | 21 |
| 0.8* | 0.1 | 99 | 84 | 17 | 42 |
| 0.4 | 0.05 | 99 | 99 | 53 | 26 |
| 0.4 | 0.2 | 96 | 88 | 32 | 22 |
| 0.4 | 0.4 | 64 | 61 | 29 | 16 |
Растворы технической Д2ЭГФК, которые использовались в качестве жидких мембран, имеют довольно низкую электропроводность. Это объясняется содержанием в них значительного количества сильно ассоциированной моноалкилфосфорной кислоты [11]. Поэтому индивидуальные растворы Д2ЭГФК в электродиализных экспериментах не применялись. Для повышения электропроводности органических растворов в них вводили добавки три-н-октиламина. Повышение содержания ТОА в жидкой мембране от 0.05 до 0.4 М при постоянной концентрации Д2ЭГФК 0.4 М приводит к снижению степени извлечения меди(II) из отдающего раствора, степени реэкстракции, степени электроосаждения металла и скорости переноса через мембрану (табл. 3). Избыток анионообменного переносчика ТОА способствует интенсификации переноса сульфат-ионов из катодного раствора через жидкую мембрану, и это приводит к снижению выхода по току для катионов меди(II). Оптимальная концентрация добавки ТОА – 0.05–0.1 М.
На рис. 10 представлены хронопотенциограммы систем с различным составом жидкой мембраны. Повышение концентрации Д2ЭГФК в органической фазе приводит к некоторому увеличению начального напряжения электродиализа (кривые 1, 2, 4), в то время как увеличение содержания ТОА повышает электропроводность системы и способствует снижению начального напряжения (кривые 2, 3, 5). При самой высокой концентрации Д2ЭГФК 0.8 М происходит непрерывный рост напряжения в ходе экспериментов, связанный с полным извлечением меди(II) из отдающего раствора (кривая 1). При самых низких концентрациях Д2ЭГФК (0.1 М) и ТОА (0.05 М) на хронопотенциограммах наблюдаются максимумы напряжения (кривые 2, 3). Рост напряжения и снижение электропроводности может быть связано с экстракцией меди(II) и образованием в органической фазе нейтрального комплекса CuA2. Понижение напряжения в ходе электродиализа, как уже было сказано выше, обусловлено накоплением воды в фазе жидкой мембраны.
ЗАКЛЮЧЕНИЕ
Метод электродиализа через жидкие мембраны позволяет осуществить одностадийную полную экстракцию ионов меди(II) из солянокислых растворов 0.01 М CuCl2, перенос через жидкие мембраны на основе Д2ЭГФК и катодное электроосаждение металла из разбавленных растворов серной, соляной, хлорной, азотной и уксусной кислот. Плотные, хорошо сцепленные с электродом, матовые или блестящие катодные осадки меди получены из раствора 0.1 М H2SO4. Степени извлечения и электроосаждения металла, а также скорость трансмембранного переноса возрастают при повышении плотности тока, продолжительности процесса и концентрации Д2ЭГФК в жидкой мембране. Увеличение исходной концентрации меди(II), соляной кислоты в отдающем растворе и содержания ТОА в органической фазе негативно влияют на эффективность извлечения. Резкий рост напряжения в системе может служить критерием полноты извлечения металла и обессоливания отдающего раствора. Оптимальным материалом для инертных электродов является платина.
Список литературы
Подчайнова, В.Н., Симонова, Л.Н. Медь. М.: Наука, 1990. 279 с. [Podchainova, V.N. and Simonova, L.N., The Copper (in Russian), M.: Nauka, 1990. 279 p.]
Al-Saydeh, S.A., El-Naas, M.H., and Zaidi, S.J., Copper removal from industrial wastewater: A comprehensive review, J. Industr. Engineer. Chem., 2017, vol. 56, p. 35.
Долина, Л.Ф. Современная техника и технологии для очистки сточных вод от солей тяжелых металлов. Днепропетровск: Континент, 2008. 254 с. [Dolina, L.F., Modern techniques and technologies for purification of wastewater from salts of heavy metals (in Russian), Dnepropetrovsk: Kontinent, 2008. 254 p.]
Carolin, C.F., Kumar, P.S., Saravanan, A., Joshiba, J., and Naushad, Mu., Efficient techniques for the removal of toxic heavy metals from aquatic environment: A review, J. Environ. Chem. Eng., 2017, vol. 5, no. 3, p. 2782.
Abdullah, N., Yusof, N., Lau, W.J., Jaafar, J., and Ismail, A.F., Recent trends of heavy metal removal from water/waste water by membrane technologies, J. Industr. Engineer. Chem., 2019, vol. 76, p. 17.
Chai, W.S., Cheun, J.,Y., Kumar, P.S., Mubashir, M., Majeed, Z., Banat, F., Ho, S.-H., and Show, P.L., A review on conventional and novel materials towards heavy metal adsorption in wastewater treatment application, J. Clean. Prod., 2021, no. 126589, in press.
Kislik, V.S. (Ed.), Liquid Membranes. Principles and Applications in Chemical Separations and Wastewater Treatment, Oxford: Elsevier, 2010. 462 p.
Мембраны и мембранные технологии, под ред. Ярославцева, А.Б. М.: Научный мир, 2013, 612 с. [Yaroslavtsev, A.B. (Ed.), Membranes and membrane technologies (in Russian), M.: Nauchnyi mir, 2013. 612 p.]
Hao, Z., Li, Q., Ho, W.S.W., and Li, N.N., Liquid Membranes, in Comprehensive Membrane Science and Engineering (2nd Ed.), Drioli, E., Giorno, L., and Fontananova, E. (Eds.), Amsterdam: Elsevier, 2017, vol. 2, p. 411.
Kolev, S.D., Membrane techniques / Liquid Membranes, in Encyclopedia of Analytical science (3rd Ed.), Worsfold, P., Townsheld, A., Poole, C., and Miro, M. (Eds.), Amsterdam: Elsevier, 2019, p. 1.
Ягодин, Г.А., Каган, С.З., Тарасов, В.В. и др. Основы жидкостной экстракции. М.: Химия, 1981. 400 с. [Yagodin, G.A., Kagan, S.Z., Tarasov, V.V. et al., Fundamentals of liquid-liquid extraction (in Russian), M.: Khimiya, 1981. 400 p.]
Chang, S.H., Teng, T.T., and Norli, I., Cu(II) transport through soybean oil-based bulk liquid membrane: Kinetic study, Chem. Eng. J., 2011, vol. 173, p. 352.
Kermiche, M. and Djerad, S., Facilitated transport of copper through bulk liquid membrane containing di-2-ethylhexylphosphoric acid, Desalin. Water Treat., 2011, vol. 36, p. 261.
Venkateswaran, P., Navaneetha Gopalakrishnan, A., and Palanivelu, K., Di(2-ethylhexyl)phosphoric acid – coconut oil supported liquid membrane for the separation of copper ions from copper plating wastewater, J. Environ. Sci. (China), 2007, vol. 19, no. 12, p. 1446.
Ncib, S., Barhoumi, A., Bouguerra, A., Larchet, C., Dammak, L., Hamrouni, B., and Elaloui, E., Copper(II) Removal from Synthetic Wastewater Solutions Using Supported Liquid Membrane and Polymer Inclusion Membrane, J. Environ. Eng., 2020, vol. 146, no. 2.
Fouad, E. A., Zinc and Copper Separation through an Emulsion Liquid Membrane Containing Di-(2-Ethylhexyl) Phosphoric Acid as a Carrier, Chem. Eng. Technol., 2008, vol. 31, no. 3, p. 370.
Chiha, M., Hamdaoui, O., Ahmedchekkat, F., and Pétrier, C., Study on ultrasonically assisted emulsification and recovery of copper(II) from wastewater using an emulsion liquid membrane process, Ultrason. Sonochem., 2010, vol. 17, p. 318.
Azarang, A., Rahbar-Kelishami, A., Norouzbeigi, R., and Shayesteh, H., Modelling and optimization of pertraction performance of heavy metal ion from aqueous solutions using M2EHPA/D2EHPA: Application of response surface methodology, Environ.Technol. Innov., 2019, vol. 15, no. 100432.
Zereshki, S., Shokri, A., and Karimi, A., Application of a green emulsion liquid membrane for removing copper from contaminated aqueous solution: extraction, stability and breakage study using response surface methodology, J. Molec. Liq., 2021, vol. 325, no. 115251.
Zhang, W., Cui, C., and Hao, Z., Transport Study of Cu(II) Through Hollow Fiber Supported Liquid Membrane, Chin. J. Chem. Eng., 2010, vol. 18, no.1, p. 48.
Chang, S.H., Parametric studies on an innovative waste vegetable oil-based continuous liquid membrane (WVCLM) for Cu(II) ion separation from aqueous solutions, J. Ind. Eng. Chem., 2017, vol. 50, p. 102.
Пурин, Б.А. Экстракционно-электрохимический метод получения особо чистых металлов и их соединений. Известия АН ЛатвССР. Сер. Хим. 1971. № 5. С. 31. [Purin, B.A., Electrochemical extraction method for obtaining highly pure metals and their compounds, Izvestiya AN LatvSSR. Ser. Chim. (in Russian), 1971, no. 5, p. 31.]
Кизим, Н.Ф. Работы Б.А. Пурина и его научной школы по электродиализу, в сб.: Экстракция и мембранные методы в разделении веществ: Тез. докл. междунар. конф., посвященной 90-летию со дня рождения академика Б.А. Пурина, под ред. Юртова, Е.В. М.: РХТУ им. Д.И. Менделеева, 2018, С. 7. [Kizim, N.F., The works of B.A. Purin and his scientific school on electrodialysis, in: Extraction and membrane methods in the separation of substances: Abstracts of the international conference dedicated to the 90th anniversary of the birth of academician B.A. Purin, Yurtov, E.V. (Ed.), (in Russian), M.: D.Mendeleev University of Chemical Technology of Russia, p. 7.]
Садырбаева, Т.Ж., Пурин, Б.А. Мембранная экстракция меди(II) ди(2-этилгексил)фосфорной кислотой в условиях электродиализа. Хим. технология. 2000. № 11. С. 23. [Sadyrbaeva, T.Zh. and Purin, B.A., Membrane extraction of copper(II) by di(2-ethylhexyl)phosphoric acid under electrodialysis conditions, Khimicheskaya Tekhnologiya (in Russian), 2000, no. 11, p. 23.]
Садырбаева, Т.Ж., Пурин, Б.А. Мембранная экстракция и разделение меди(II) и палладия(II) в условиях электродиализа. Хим. технология. 2001. № 10. С. 17. [Sadyrbaeva, T.Zh. and Purin, B.A., Membrane extraction and separation of copper(II) and palladium(II) under electrodialysis conditions, Khimicheskaya Tekhnologiya (in Russian), 2001, no. 10, p. 17.]
Qian, Z., Miedema, H., Sahin, S., de Smet, L.C.P.M., and Judholter, E.J.R., Separation of alkali metal cations by a supported liquid membrane (SLM) operating under electrodialysis (ED) conditions, Desalination, 2020, vol. 495, no. 114631.
Zhao, Z., Liu, G., Jia, H., and He, L., Sandwiched liquid-membrane electrodialysis: Lithium selective recovery from salt lake brines with high Mg/Li ratio, J. Membr. Sci., 2020, vol. 596, no. 117685.
Sadyrbaeva, T.Zh., Liquid membrane system for extraction and electrodeposition of silver(I), J. Electroanal. Chem., 2010, vol. 648, no. 2, p. 105.
Садырбаева, Т.Ж. Электродиализное извлечение и электроосаждение свинца(II) в системах с жидкими мембранами. Электрохимия. 2019. Т. 55. С. 70. [Sadyrbaeva, T.Zh., Electrodialysis Extraction and Electrodeposition of Lead(II) in Systems with Liquid Membranes, Russ. J. Electrochem., 2018, vol. 54, p. 922.]
Fornea, V., Trupina, S., Iosub, A.V., and Bulgariu, L., Spectrophotometric determination of Cu(II), Co(II) and Ni(II) ions in mono and multi-component systems, Bul. Inst. Polit. Iasi, 2016, vol. 62, p. 9.
Михайлов, В.А. Химия экстракции металлов диалкилфосфорными кислотами и их солями, в сб.: Современные проблемы химии и технологии экстракции. М.: РАН, 1999. Т. 1. С. 72. [Mikhailov, V.A., Chemistry of extraction of metals by dialkyl phosphoric acids and their salts, in: Modern problems of extraction chemistry and technology (in Russian), M.: RAN, 1999. vol. 1, p. 72.]
Kholkin, A.I., Belova, V.V., Pashkov, G.L. et al., Solvent binary extraction, J. Molec. Liq., 1999, vol. 82, nos. 1–2, p. 131.
Ивахно, С.Ю., Юртов, Е.В. Мембранная экстракция, М.: ВИНИТИ, 1990. 174 с. [Ivakhno, S.Yu. and Yurtov, E.V., Membrane extraction (in Russian), M.: VINITI, 1990. 174 p.]
Голубев, В.Н., Пурин, Б.А. Исследование электрического пробоя жидкостных мембран при переносе через них некоторых анионов. Докл. АН СССР. 1977. Т. 232. № 6. С. 1340. [Golubev, V.N. and Purin, B.A., Investigation of the Electrical Breakdown of the Liquid Membranes during Anions Transfer, Doklady AN SSSR (in Russian), 1977, vol. 232, no. 6, p. 1340.]
Дополнительные материалы отсутствуют.