Электрохимия, 2021, T. 57, № 12, стр. 743-755
Физико-химические и электрохимические свойства растворов бис-(оксалато)бората лития в сульфолане
Л. В. Шеина a, *, А. Л. Иванов a, Е. В. Карасева a, **, В. С. Колосницын a
a Уфимский Институт химии Уфимского федерального исследовательского центра РАН
Уфа, Россия
* E-mail: sheina.l.v@gmail.com
** E-mail: karaseva@anrb.ru
Поступила в редакцию 02.02.2021
После доработки 25.03.2021
Принята к публикации 25.03.2021
Аннотация
Изучены физико-химические, электрохимические и термические свойства растворов бис-(оксалато)бората лития (LiBOB) в сульфолане. Установлено, что сульфолановые растворы LiBOB обладают более низкой, по сравнению с растворами перхлората и гексафторфосфата лития, удельной электропроводностью и более высокой вязкостью. С увеличением концентрации LiBOB в сульфолане энергии активации электропроводности и вязкого течения увеличиваются. Константа ассоциации LiBOB в сульфолане меньше константы ассоциации LiClO4 и близка к константе ассоциации LiPF6. Из зависимости константы ассоциации от донорного числа (DN) анионов литиевых солей оценено значение DN аниона [B(C2O4)]–, которое соответствует значению ~3. Эффективное число переноса катиона лития в 1 М растворе LiBOB в сульфолане составляет 0.46 ± 0.03, что выше, чем в 1 М растворе LiClO4 в сульфолане (0.39 ± 0.02), и близко к эффективному числу переноса катиона лития в 1 М LiBF4 в сульфолане (0.42 ± 0.03). Показано, что сульфолановые растворы LiBOB склонны к переохлаждению и образованию термодинамически неравновесных состояний. Анодная устойчивость 1 М раствора LiBOB в сульфолане достигает 5.65 В отн. Li/Li+-электрода сравнения. По анодной устойчивости растворы литиевых солей в сульфолане располагаются в следующем порядке: LiPF6 ~ LiBF4 > LiBOB ~ LiClO4 > LiSO3CF3. Длительность циклирования металлического литиевого электрода в растворах LiBOB в сульфолане в 1.75 раза больше длительности циклирования в растворах LiClO4 и определяется не скоростью разложения электролита, а скоростью диспергации металлического лития.
ВВЕДЕНИЕ
Создание энергоемких литиевых и литий-ионных аккумуляторов (ЛИА) требует разработки электролитных систем, обладающих высокой электропроводностью, химической и электрохимической устойчивостью в широкой области электродных потенциалов, работоспособностью в широком температурном диапазоне (–40…+60°С) и пожаро- и взрывобезопасностью [1–3].
Свойства электролитных систем определяются свойствами индивидуальных компонентов – электролитных солей и растворителей. Наиболее широко используемой литиевой солью в электролитных растворах ЛИА до сих пор остается гексафторфосфат лития, основными недостатками которого являются низкие гидролитическая и термическая устойчивость и высокая реакционная способность продуктов деструкции (HF и POF3) по отношению к электродным материалам [4, 5]. Однако достойной альтернативы гексафторфосфату лития до сих пор не найдено. Среди перспективных и коммерчески доступных литиевых солей рассматривается бис-(оксалато)борат лития (LiBOB), положительными свойствами которого являются [3, 6–9]: электрохимическая устойчивость аниона BOB– в широком диапазоне электродных потенциалов; высокая термостабильность, низкая реакционность продуктов термодеструкции; гидролитическая устойчивость и отсутствие кислотных продуктов гидролиза [10]. Особенностью бис-(оксалато)бората лития является способность образовывать на поверхности активных материалов электродов ЛИА стабильные пленки, состоящие из олигомерных и полимерных боратов, обладающих высокими защитными свойствами [10–12]. Такие пленки защищают активные материалы положительного электрода [11, 12], углеродную структуру отрицательного электрода [13, 14] и металлический литиевый электрод [15] от нежелательных взаимодействий с компонентами электролитных растворов.
К недостаткам LiBOB относятся плохая растворимость в органических карбонатах, высокая вязкость и низкая электропроводность электролитных растворов, особенно при пониженных температурах [7–9]. Из-за низкой растворимости LiBOB используют лишь в качестве электролитной добавки [8, 16–18].
Выбор растворителя для электролитных систем также основывается на общих требованиях к электролитам. Растворители для электролитов ЛИА должны обладать высокой химической устойчивостью к активным компонентам электродных материалов, электрохимической стабильностью в широком диапазоне электродных потенциалов, хорошей растворяющей способностью по отношению к перспективным литиевым солям, высокими температурами кипения и вспышки, низкими температурами плавления. Известно, что существенным недостатком карбонатных электролитных растворов является невысокая электрохимическая стабильность (~4.5 В), что ограничивает применение высокопотенциальных активных материалов положительных электродов (≥5 В) ЛИА.
Высокой электрохимической устойчивостью обладают сульфоны, что делает их перспективными растворителями для высоковольтных электролитных систем [2, 19–23]. Среди сульфонов наиболее изученным является тетраметиленсульфон (сульфолан) [23–25]. Положительными свойствами сульфолана являются высокие диэлектрическая проницаемость (43.3), окислительная устойчивость (6.3 В относительно Li/Li+ [26]) и температура вспышки (166°С) [27], а также низкая токсичность. Однако высокие вязкость (10.28 мПа с при 25°С) и температура плавления (28.6°С) [28] ограничивают использование сульфолана в качестве индивидуального электролитного растворителя. Введение сульфонов, в том числе сульфолана, в качестве сорастворителей в карбонатные электролитные системы повышает окислительную устойчивость и термическую стабильность электролитных растворов [25, 29–32].
Сульфолан отличается высокой анодной устойчивостью, но его катодная устойчивость – недостаточно высокая, что приводит к плохой циклируемости отрицательных электродов (и графитового, и литиевого) в сульфолановых электролитах. Одним из способов повышения катодной устойчивости сульфолановых электролитных растворов может быть применение в качестве электролитной соли бис-(оксалато)бората лития [33].
В настоящее время широко исследуются физико-химические свойства растворов LiBOB в карбонатных растворителях [18, 34–37], ацетонитриле и диметоксиэтане [38], γ-бутиролактоне [39], в смесях сульфонов с сульфитами [20, 21, 40], в смесях сульфонов с γ-бутиролактоном [41] и с органическими карбонатами [31, 34, 36, 37]. Однако свойства электролитных растворов LiBOB в индивидуальном сульфолане практически не изучены.
Цель настоящей работы – изучение физико-химических свойств растворов бис-(оксалато)бората лития в сульфолане (СЛ) в широком концентрационном и температурном диапазонах и влияния LiBOB на электрохимические свойства металлического литиевого электрода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Сульфолан (тетраметиленсульфон) (99%, Sigma-Aldrich) очищали и осушали двойной вакуумной перегонкой. Бис-(оксалато)борат лития LiBOB (99.8%, Rockwood Lithium, Германия) использовали без дополнительной очистки и осушки.
Электролитные растворы готовили объемно-весовым методом в перчаточном боксе, заполненном сухим воздухом (точка росы –56°С).
Поскольку определение содержания воды в электролитных растворах, содержащих LiBOB, титрованием в традиционном реактиве Фишера приводит к завышенным результатам [42], содержание воды в растворах LiBOB в сульфолане контролировали методом ИК-спектроскопии. ИК-спектры электролитных растворов регистрировали на ИК-фурье-спектрометре Shimadzu IR Prestige 21 (Япония) в неразборных кюветах из KBr, которые заполняли анализируемыми растворами в атмосфере сухого бокса. Влажность растворов оценивали по интенсивности полос поглощения, соответствующим валентным колебаниям гидроксильной группы (3400–3600 см–1). ИК-спектры LiBOB (тв.), сульфолана и 1 М раствора LiBOB в сульфолане представлены на рис. S1 и S2 в разделе Supplementary Materials.
Физико-химические свойства электролитных растворов изучали по общепринятым методикам, изложенным в работе [43]. Удельную электропроводность определяли в стеклянных двухэлектродных ячейках с черненными платиновыми электродами, вязкость – в стеклянных вискозиметрах Убеллоде, модернизированных для исследований безводных систем. Относительную плотность растворов определяли пикнометрическим методом. Ошибки определения электропроводности и вязкости составляли 0.1–1.0%, относительной плотности ~0.02%. Предельную эквивалентную электропроводность (λ0) и константу ассоциации (Kасс) оценивали графическим методом Краусса–Брея из эквивалентной электропроводности (λ) разбавленных электролитных растворов (6.0 × 10–4–1.0 × 10–2 M).
Электрохимическую устойчивость электролитных растворов определяли методом циклической вольтамперометрии (ЦВА) в диапазоне потенциалов –0.2–6.0 В с помощью потенциостата/гальваностата SP-200 (BioLogic, Франция). Измерения проводили в стеклянной трехэлектродной ячейке с платиновым рабочим электродом (S = 0.1 см2) и литиевой фольгой в качестве вспомогательного электрода и электрода сравнения. Скорость развертки потенциала составляла 100, 10, 5 и 2 мВ/с (ЦВА при разных скоростях развертки потенциала представлены на рис. S3 в разделе Supplementary Materials).
Термические свойства электролитных растворов исследовали методами термогравиметрии и дифференциальной сканирующей калориметрии (ДСК). Термогравиметрический анализ (ТГА) осуществляли на модернизированном дериватографе марки МОМ-1000 (Венгрия). Измерения проводили при атмосферном давлении в закрытом платиновом тигле. Скорость нагрева исследуемых образцов составляла 5°С/мин. Термические свойства растворов исследовали с помощью сканирующего дифференциального калориметра DSC 214 Polyma (Netzsch, Германия) в атмосфере аргона в температурном диапазоне от –70 до +40°С при скорости охлаждения/нагревания 5 К/мин.
Изучение циклируемости литиевого электрода проводили в герметичных ячейках типа Swagelok® cell, изготовленных из нержавеющей стали, с плоскопараллельными дисковыми электродами. Рабочие (S = 6.35 cм2) и вспомогательные (S = 5 cм2) электроды были изготовлены из литиевой фольги толщиной 100 мкм (99.99%, China Energy Lithium, Китай). В качестве сепаратора использовали 2 слоя сепарационного материала Celgard®3501 (S = 6.35 cм2). Поскольку длительность циклирования литиевого электрода определяется не только свойствами электролитных систем, но и количеством электролита, объем электролита во всех ячейках был одинаковым и составлял 10 мкл/см2. Электролит в ячейки вводили с помощью микрошприца MICROLITERTM Syringe (Hamilton Company, USA) объемом 50 мкл. Точность дозирования электролита в ячейках составляла ±5%.
Гальваностатическую поляризацию ячеек осуществляли с помощью батарейного тестера BT2-100PG [44]. Диапазон потенциалов катодной и анодной поляризации ограничивали ±500 мВ, плотность тока составляла 0.2 мА/см2. Количество электричества при катодном осаждении и анодном растворении лития составляло 1.0 мА ч/см2.
Спектры электрохимического импеданса ячеек Li/электролит/Li регистрировали с помощью потенциостата/гальваностата с функцией импедансного спектрометра SP-200 (BioLogic, Франция) в частотном диапазоне 25 Гц–100 кГц. Разброс результатов не превышал ±10%. Эффективное число переноса иона лития $\left( {{{t}_{{{\text{L}}{{{\text{i}}}^{ + }}}}}} \right)$ оценивали методом, описанном в работах [45, 46].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Физико-химические свойства растворов LiBOB в сульфолане
Физико-химические свойства электролитной системы LiBOB-CЛ представлены на рис. 1 и в дополнительной информации (табл. S1 и S2 ). Изотермы удельной электропроводности растворов LiBOB в сульфолане проходят через максимум (рис. 1a). С повышением температуры положение максимума удельной электропроводности смещается в область более высоких концентраций соли (от ~0.8 M при 30°С к ~0.9 M при 60°С).
Рис. 1.
Изотермы удельной электропроводности (а), динамической вязкости (б) и коррегированной электропроводности (в) растворов бис-(оксалато)бората лития (LiBOB) в сульфолане.

Изотермы динамической вязкости растворов LiBOB в сульфолане выпуклы относительно оси состава (рис. 1б).
Изотермы электропроводности, исправленной на вязкость (коррегированной электропроводности), – не линейны относительно оси состава (рис. 1в). Наибольшее отклонение от линейности наблюдается при 30°С. С повышением температуры величина коррегированной электропроводности уменьшается. В бóльшей степени это проявляется в области высоких концентраций соли.
Предельная эквивалентная (молярная) электропроводность растворов LiBOB в сульфолане увеличивается с повышением температуры (табл. 1). Константа ассоциации (Kасс) бис-(оксалато)бората лития в сульфолане составляет 6.0 ± 0.2 дм3/моль при 30°С и незначительно уменьшается с повышением температуры (табл. 1).
Таблица 1.
Константы ассоциации и предельная молярная электропроводность растворов LiBOB в сульфолане
| Параметр | Температура, °С | |||
|---|---|---|---|---|
| 30 | 40 | 50 | 60 | |
| Kасс, дм3 моль–1 | 5.9 | 5.3 | 4.6 | 4.5 |
| λ0 × 104, Ом–1 м2 моль–1 | 7.9 | 9.9 | 11.9 | 14.5 |
| ПВ (λ0η0) | 80.9 | 79.3 | 78.2 | 77.9 |
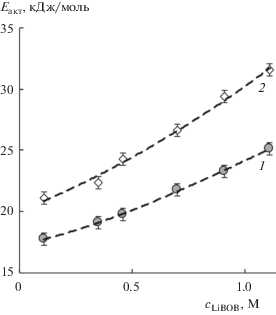
Из температурных зависимостей удельной электропроводности и динамической вязкости (30–60°С) были рассчитаны энергии активации электропроводности и вязкого течения растворов LiBOB в сульфолане (рис. 2). С увеличением содержания соли в растворе энергии активации электропроводности и вязкого течения увеличиваются.
Рис. 2.
Концентрационные зависимости энергий активации электропроводности Еакт(χ) (1) и вязкого течения Еакт(η) (2) растворов LiBOB в сульфолане (30–60°С).
Сравнение физико-химических свойств растворов литиевых солей в сульфолане [43] показывает, что растворы LiBOB в сульфолане обладают более низкой электропроводностью, по сравнению с растворами перхлората и гексафторфосфата лития (рис. 3а), но более высокой вязкостью (рис. 3б). Однако коррегированная электропроводность растворов LiBOB в сульфолане выше, чем растворов перхлората лития и уступает только растворам гексафторфосфата лития (рис. 3в). Низкая удельная электропроводность растворов LiBOB в сульфолане объясняется их высокой вязкостью. Известно [21], что бис-(оксалато)боратный анион склонен к образованию сложных структур с низкой подвижностью – ионных тройников и более сложных ассоциатов. Вероятно, и в сульфолане при высоких концентрациях LiBOB происходит образование сложных ионных ассоциатов.
Рис. 3.
Изотермы (30°С) удельной электропроводности (a), динамической вязкости (б) и коррегированной электропроводности (в) растворов литиевых солей в сульфолане: 1 – LiPF6, 2 – LiClO4, 3 – LiBOB, 4 – LiBF4, 5 – LiSO3CF3.

Константа ассоциации бис-(оксалато)бората лития в сульфолане ниже константы ассоциации перхлората лития и близка к Касс гексафторфосфата лития (табл. 2). Это указывает на то, что LiBOB хорошо диссоциирует в сульфолане, аналогично гексафторфосфату лития.
Таблица 2.
Свойства растворов литиевых солей в сульфолане (30°С) [43]
| Анион | Va, Å3 [47] | r*, Å | DN [48] |
λ0, ×104, Ом–1 м2 моль–1 |
Kасс, дм3 моль–1 | ${{t}_{{{\text{L}}{{{\text{i}}}^{ + }}}}}$ ±0.03 |
1 М (30 °С) | ||
|---|---|---|---|---|---|---|---|---|---|
| χ × 103, Ом–1 см–1 |
η × 103, Па с |
χη × 106, Ом–1 см–1 Па с |
|||||||
| ${\text{BF}}_{4}^{ - }$ | 58 | 2.40 | 6.0 | 10.7 | 17.5 | 0.42 | 1.66 | 23.6 | 39.2 |
| ${\text{ClO}}_{4}^{ - }$ | 83 | 2.71 | 8.4 | 9.5 | 24.7 | 0.39 | 2.22 | 27.4 | 60.8 |
| ${\text{PF}}_{6}^{ - }$ | 84 | 2.72 | 2.5 | 9.8 | 3.3 | 0.42 | 2.80 | 31.3 | 87.6 |
| ${\text{S}}{{{\text{O}}}_{3}}{\text{CF}}_{3}^{ - }$ | 107 | 2.95 | 16.9 | 10.1 | 50.9 | 0.62 | 0.87 | 25.1 | 21.8 |
| [B(C2O4)]– | 151 | 3.30 | ~3** | 8.0 | 6.0 | 0.46 | 1.60 | 44.6 | 71.4 |
Предельная эквивалентная электропроводность литиевых солей в сульфолане коррелирует с размерами аниона (табл. 2) – уменьшается с увеличением ван-дер-ваальсового объема аниона литиевой соли. Между константами ассоциации литиевых солей в сульфолане и размерами анионов нет четкой корреляции (табл. 2), поскольку константа ассоциации определяется не только размерами, но и геометрией анионов.
Константа ассоциации литиевых солей в сульфолане коррелирует с донорными свойствами анионов (табл. 2). С увеличением донорного числа (DN) аниона Kасс увеличивается. Из зависимости Kасс от DN литиевых солей [48] (в разделе Supplementary Materials, рис. S4 ) мы оценили значение DN аниона [B(C2O4)]–, которое соответствует значению ~3.
Эффективное число переноса иона лития в растворе LiBOB в сульфолане составляет 0.46 ± ± 0.03, т.е. выше, чем в растворе перхлората лития (0.39 ± 0.02), и близко к эффективному числу переноса катиона лития в растворе тетрафторбората лития (0.42 ± 0.03) (табл. 2).
Термические свойства растворов LiBOB в сульфолане
Термическое разложение бис-(оксалато)бората лития в твердом состоянии (рис. 4а) начинается при температуре ~300°С и протекает в две стадии. Потеря массы, соответствующая удалению газообразных продуктов деструкции (CO и CO2), сопровождается сильным экзо-эффектом (max DTA = 333°С). Вторая стадия разложения соли (образование B2O3) также сопровождается экзо-эффектом (max DTA = 435°С) небольшой интенсивности. Наши результаты ТГА-анализа, полученные в воздушной атмосфере при скорости нагрева 5°С/мин, хорошо согласуются с результатами J.L. Allen с соавт. [51] и L.S. You с соавт. [52], полученными в инертной атмосфере (Ar) при скорости нагрева 10°С/мин.
Рис. 4.
Термограммы LiBOB (тв.) (а) и 1 М раствора LiBOB в сульфолане (б). Условия: дериватограф МОМ-1000, закрытый платиновый тигель, скорость нагрева 5°С/мин.

Верхний температурный предел работоспособности жидких электролитов определяется главным образом свойствами индивидуальных компонентов электролитной системы. Температура начала потери массы электролитного раствора ~150°С соответствует начальной температуре потери массы индивидуального сульфолана (TG сульфолана выделена пунктирной линией на рис. 4б). Термостабильность раствора LiBOB в сульфолане несколько выше термической устойчивости индивидуального сульфолана. Так, потеря массы 1 М раствора LiBOB при 230°С составила 32 вес. %, а индивидуального сульфолана – 45 вес. %. Основной (эндо) пик на кривой DTA электролита наблюдается при температуре около 272°С (рис. 4б). Результаты термогравиметрических исследований указывают на то, что потеря массы электролитного раствора при нагревании обусловлена не термическим разложением электролита, а испарением растворителя.
Низкотемпературные свойства сульфолана и сульфолановых растворов LiBOB были изучены методом дифференциальной сканирующей калориметрии. Исследования показали, что плавление сульфолана происходит в две стадии. При нагреве первоначально происходит переход твердого тела I в твердое тело II, а при последующем нагреве – твердого тела II в жидкость. На кривых ДСК нагрева сульфолана наблюдается два эндотермических пика с температурами максимумов 28.6 и 17.7°С (рис. 5а и табл. 3). На кривой охлаждения сульфолана также наблюдаются два пика с максимумами при 23.6 и –18.6°С. Различие в температурах фазовых переходов при нагреве и охлаждении сульфолана указывает на его склонность к существованию в метастабильном состоянии. На кривых охлаждения разбавленных растворов LiBOB в сульфолане (c = 0.1 и 0.38 M) наблюдается по два экзо-пика, а на кривых нагревания этих растворов – по одному эндо-пику (рис. 5б и 5в).
Рис. 5.
ДСК термограммы сульфолана и растворов LiBOB в сульфолане (от +40 до –70°С), скорость охлаждения/нагревания 5 К/мин.

Таблица 3.
Результаты ДСК анализа растворов LiBOB в сульфолане
| cLiBOB, M |
Охлаждение | Нагревание | ||||
|---|---|---|---|---|---|---|
| t, °С начала пика | t, °С max пика |
∆H, Дж/г |
t, °С начала пика | t, °С max пика |
∆H, Дж/г |
|
| 0 | –23.0 | –18.6 | –57.28 | 14.6 | 17.7 | 52.83 |
| 21.6 | 23.6 | –8.79 | 26.4 | 28.6 | 4.31 | |
| 0.1 | –24.1 | –23.0 | –51.88 | 10.5 | 14.6 | 55.85 |
| –3.8 | –1.4 | –4.10 | ||||
| 0.38 | –28.2 | –27.0 | –47.53 | 5.9 | 11.7 | 39.03 |
| –20.7 | –18.7 | –3.73 | ||||
| 1.1 | Oтсутствует | –52.4 | –47.0 | –22.41 | ||
| –8.5 | –0.7 | 25.77 | ||||
На кривой ДСК охлаждения (рис. 5г) 1.1 М раствора LiBOB в сульфолане до –70°С отсутствуют какие-либо пики. При нагревании переохлажденного (выдержанного при –70°С в течение 0.5 ч) раствора на кривой ДСК нагревания (рис. 5г) появляется экзо-пик при –47°С и эндо-пик при температуре, близкой к 0°С. Температуры плавления растворов LiBOB в сульфолане снижаются с увеличением концентрации соли: 14.6°С (c = 0.1 М), 11.7°С (c = 0.38 М) и ~0°С (c = = 1.1 М).
Электрохимическая устойчивость
Электрохимическая устойчивость является важной характеристикой электролитных систем, особенно для источников тока с высокопотенциальными электродными материалами. Высокая окислительная устойчивость сульфолана и электролитных систем на его основе подтверждается как результатами электрохимических исследований [31, 38, 43, 53], так и квантовохимическими расчетами [21, 54]. Ранее [43] нами было показано, что анодная стабильность сульфолановых растворов литиевых солей составляет от 5.0 до 5.9 В (отн. Li/Li+) и определяется природой аниона литиевой соли. Анодная устойчивость раствора LiBOB в сульфолане составила около 5.65 В (отн. Li/Li+) (рис. 6). Это значение согласуется с экспериментальными данными, полученными S. Li с соавт. [40] в тройных системах LiBOB–сульфолан–диметилсульфит и LiBOB–сульфолан–диэтилсульфит. По анодной устойчивости растворы литиевых солей в сульфолане располагаются в следующем порядке: LiPF6 ~ LiBF4 > LiBOB ~ ~ LiClO4 > LiSO3CF3.
Электрохимические свойства Li-электрода в системе LiBOB–сульфолан
Годографы импеданса литий-литиевых ячеек с 1 М растворами LiClO4 и LiBOB в сульфолане в качестве электролитов подобны и представляют собой дуги полуокружностей с центрами, расположенными ниже оси абсцисс (рис. 7а). Годографы импеданса литий-литиевых ячеек наилучшим образом описываются эквивалентной схемой, представляющей собой последовательно соединенные сопротивление R1 c цепочкой параллельно соединенных сопротивления R2 и элемента постоянной фазы (CPE1).
Рис. 7.
Годографы импеданса симметричных ячеек Li|электролит|Li через 20 ч термостатирования при +30°С (а) и изменение средних значений напряжений на ячейках в процессе их циклической катодно-анодной поляризации (б): 1 – 1 M раствор LiClO4 в сульфолане; 2 – 1 M раствор LiBOB в сульфолане.

Сопротивление R1 определяется точкой пересечения высокочастотной части дуги с действительной осью и равно сопротивлению слоя электролита, находящегося в межэлектродном зазоре. Сопротивление R2 равно хорде дуги, отсекаемой на действительной оси, и относится к сопротивлению переноса заряда через фазовую границу электрод–электролит. Элемент постоянной фазы CPE1 отражает неоднородность границ электрод- электролит. Рассчитанные значение элементов эквивалентных схем литий-литиевых ячеек с различными электролитами суммированы в табл. 4 .
Из полученных значений сопротивлений переноса заряда через фазовую границу (R2) были рассчитаны токи обмена литиевого электрода (io, мА/см2) по уравнению:
где io – плотность тока обмена, мА/см2; R – универсальная газовая постоянная, 8.314 Дж К–1 моль–1; T – температура, К; z – количество электронов, принимающих участие в элементарном акте реакции; F – постоянная Фарадея, 96500 Кл моль–1; R2 – сопротивление переноса заряда, Ом; S – площадь электрода, см2.Исследования свойств литиевого электрода методом импедансной спектроскопии показали, что сопротивление поверхностной пленки на литиевом электроде (R2) в 1 М растворе LiBOB в сульфолане примерно в 8 раз больше сопротивления поверхностной пленки, образующейся в сульфолановом растворе LiClO4 (рис. 7а, табл. 4).
Таблица 4.
Элементы эквивалентных схем ячеек Li|электролит|Li с электролитами на основе сульфолановых растворов литиевых солей
| Элементы эквивалентных схем | Фоновая соль | |
|---|---|---|
| LiClO4 | LiBOB | |
| R1, Ом | 2.98 | 5.66 |
| R2, Ом | 17.0 | 137.6 |
| P1 | 3.73 × 10–5 | 2.66 × 10–5 |
| n1 | 0.853 | 0.778 |
| io, мА/см2 | 1.5 × 10–1 | 1.9 × 10–2 |
Длительность циклирования литиевого электрода в 1 М растворе LiBOB в сульфолане в 1.75 раза больше, чем в растворе LiClO4 (рис. 7б). Длительность циклирования литиевого электрода определяется одним из двух факторов – либо скоростью разложения электролита, либо скоростью диспергации лития. Обычно в электролитных системах, быстро пассивирующих свежеобразованный металлический литий, длительность циклирования литиевого электрода определяется скоростью его диспергации, а в электролитных системах, слабо пассивирующих металлический литий, – скоростью разложения электролита. О степени пассивации литиевого электрода можно судить по величине среднего напряжения на ячейках при их катодно-анодном циклировании: в сильно пассивирующих электролитах оно выше, чем в слабо пассивирующих. Сравнение средних значений напряжений на ячейках от количества циклов, полученных в сульфолановых растворах перхлората лития и бис-(оксалато)бората лития (рис. 7б), и результаты дефектации ячеек после циклирования свидетельствуют о том, что длительность циклирования ячеек с 1 М раствором LiClO4 в сульфолане определяется скоростью разложения электролита, а с 1 М раствором LiBOB в сульфолане – скоростью диспергации металлического литиевого электрода.
ЗАКЛЮЧЕНИЕ
Исследования физико-химических и электрохимических свойств растворов бис-(оксалато)бората лития в сульфолане показали, что их удельная электропроводность (1.60 × 10–3 Ом–1 см–1, 30°С, 1 М) сопоставима с удельной электропроводностью сульфолановых растворов литиевых солей с объемными анионами – тетрафторбората (1.66 × 10–3 Ом–1 см–1, 30°С, 1 М) и перхлората (2.22 × 10–3 Ом–1 см–1, 30°С, 1 М) лития, а динамическая вязкость – выше вязкости сульфолановых растворов литиевых солей (LiPF6, LiClO4, LiSO3CF3 и LiBF4).
Степень диссоциации и предельная эквивалентная электропроводность бис-(оксалато)бората лития и гексафторфосфата лития в сульфолане соизмеримы (Kасс = 6.0 дм3 моль–1 и λ0 = = 8 × 10–4 Ом–1 м2 моль–1 для LiBOB, Kасс = = 3.3 дм3/моль–1 и λ0 = 9.8 × 10–4 Ом–1 м2 моль–1 для LiPF6).
Оценка донорного числа аниона [B(C2O4)]– в сульфолане показала, что его значение ~3 и близко к значению донорного числа аниона ${\text{PF}}_{6}^{ - }$ (DN = 2.5).
Длительность циклирования литиевого электрода в сульфолановых растворах LiBOB выше, чем в сульфолановых растворах других литиевых солей и определяется не скоростью деструкции электролитной системы, а скоростью диспергации металлического лития.
Высокая анодная устойчивость сульфолановых растворов LiBOB (5.65 В отн. Li/Li+), их склонность к переохлаждению и длительному существованию в метастабильном состоянии при температурах, на 30–40°С ниже точек плавления, хорошая циклируемость литиевого электрода позволят создать на их основе электролитные системы для литиевых аккумуляторов с высокопотенциальными электродными материалами, работоспособных в широком температурном диапазоне.
Список литературы
Xu, K., Electrolytes and Interphases in Li-Ion Batteries and Beyond, Chem. Rev., 2014, vol. 114, p. 11503. https://doi.org/10.1021/cr500003w
Xu, K., Nonaqueous liquid electrolytes for lithium-based rechargeable batteries, Chem. Rev., 2004, vol. 104, no. 10, p. 4303. https://doi.org/10.1021/cr030203g
Jow, T.R., Xu, K., Borodin, O., and Ue, M., Electrolytes for Lithium and Lithium-Ion Batteries, Modern Aspects of Electrochemistry, N.Y.: Springer Science + Business Media, 2014, vol. 58. 476 p. https://doi.org/10.1007/978-1-4939-0302-3
Tebbe, J.L., Fuerst, T.F., and Musgrave, C.B., Mechanism of hydrofluoric acid formation in ethylene carbonate electrolytes with fluorine salt additives, J. Power Sources, 2015, vol. 297, p. 427. https://doi.org/10.1016/j.jpowsour.2015.07.104
Handel, P., Fauler, G., Kapper, K., Schmuck, M., Stangl, C., Fischer, R., Uhlig, F., and Koller, S., Thermal aging of electrolytes used in lithium-ion batteries – An investigation of the impact of protic impurities and different housing materials, J. Power Sources, 2014, vol. 267, p. 255. https://doi.org/10.1016/j.jpowsour.2014.05.080
Xu, K., Zhang, S.S., Lee, U., Allen, J.L., and Jow, T.R., LiBOB: Is it an alternative salt for lithium-ion chemistry? J. Power Sources, 2005, vol. 146, p. 79. https://doi.org/10.1016/j.jpowsour.2005.03.153
Younesi, R., Veith, G. M., Johansson, P., EdstroËmbe, K., and Vegge, T., Lithium salts for advanced lithium batteries: Li–metal, Li–O2, and Li–S (Review), Energy Environ. Sci., 2015, vol. 8, p. 1905. https://doi.org/10.1039/C5EE01215E
Liu, Z., Chai, J., Xu, G., Wang, Q., and Cui, G., Functional lithium borate salts and their potential application in high performance lithium batteries, Coord. Chem. Rev., 2015, vol. 292, p. 56. https://doi.org/10.1016/j.ccr.2015.02.011
Бушкова, О.В., Ярославцева, T.В., Добровольский, Ю.А. Новые соли лития в электролитах для литий-ионных аккумуляторов (обзор). Электрохимия. 2017. Т. 53. С. 763. [Bushkova, O.V., Yaroslavtseva, T.V., and Dobrovolsky, Y.A., New Lithium Salts in Electrolytes for Lithium-Ion Batteries (Review), Russ. J. Electrochem., 2017, vol. 53, p. 677. https://doi.org/10.7868/S0424857017070015]
Cui, X., Tang, F., Zhang, Y., Li, C., Zhao, D., Zhou, F., Li, S., and Feng, H., Influences of trace water on electrochemical performances for lithium hexafluoro phosphate- and lithium bis(oxalato)borate-based electrolytes, Electrochim. Acta, 2018, vol. 273, p. 191. https://doi.org/10.1016/j.electacta.2018.03.138
Wang, R., Li, X., Wang, Z., Guo, H., Su, M., and Hou, T., Comparative study of lithium bis(oxalato)borate and lithium bis(fluorosulfonyl)imide on lithium manganese oxide spinel lithium-ion batteries, J. Alloys Compd., 2015, vol. 624, p. 74. https://doi.org/10.1016/j.jallcom.2014.11.098
Haregewoin, A.M., Wotango, A.S., and Hwang, B.-J., Electrolyte additives for lithium ion battery electrodes: progress and perspectives, Energy Environ. Sci., 2016, vol. 9, p. 1955. https://doi.org/10.1039/C6EE00123H
Xu, K., Zhang, S., and Richard, J.T., Formation of the Graphite-Electrolyte Interface by Lithium Bisoxalatoborate, Electrochem. Solid-State Lett., 2003, vol. 6, no. 6, p. A117. https://doi.org/10.4028/www.scientific.net/KEM.519.156
Pieczonka, N.P.W., Yang, L., Balogh, M.P., Powell, B.R., Chemelewski, K., Manthiram, A., Krachkovskiy, S.A., Goward, G.R., Liu, M., and Kim, J.-H., Impact of Lithium Bis(oxalate)borate Electrolyte Additive on the Performance of High-Voltage Spinel/Graphite Li-Ion Batteries, J. Phys. Chem. C, 2013, vol. 117, p. 22603. https://doi.org/10.1021/jp408717x
Chen, F., Wang, B., Wang, F., Jiang, Y., Dong, B., Zhao, H., and Wang, D., Precast solid electrolyte interface film on Li metal anode toward longer cycling life, Ionics, 2020, vol. 26, p. 1711. https://doi.org/10.1007/s11581-019-03356-z
Xu, K., LiBOB as additive in LiPF6-based lithium-ion electrolytes, Electrochem. Solid-State Lett., 2005, vol. 8, no. 7, p. A365. https://doi.org/10.1149/1.1924930
Santee, S., Xiao, A., Yang, L., Gnanaraj, J., and Lucht, B. L., Effect of combinations of additives on the performance of lithium-ion batteries, J. Power Sources, 2009, vol. 194, p. 1053. https://doi.org/10.1016/j.jpowsour.2009.06.012
Zhang, S.S., An unique lithium salt for the improved electrolyte of Li-ion battery, Electrochem. Commun., 2006, vol. 8, p. 1423. https://doi.org/10.1016/j.elecom.2006.06.016
Flamme, B., Haddad, M., Phansavath, P., Ratovelomanana-Vidal, V., and Chagnes, A., Anodic Stability of New Sulfone-Based Electrolytes for Lithium-Ion Batteries, ChemElectroChem., 2018, vol. 5, p. 2279. https://doi.org/10.1002/celc.201701343
Abouimrane, A., Belharouak, I., and Amine, K., Sulfone-based electrolytes for high-voltage Li-ion batteries, Electrochem. Commun., 2009, vol. 11, p. 1073. https://doi.org/10.1016/j.elecom.2009.03.020
Wu, F., Zhou, H., Bai, Y., Wang, H., and Wu, C., Toward 5 V Li-Ion Batteries: Quantum Chemical Calculation and Electrochemical Characterization of Sulfone-Based High-Voltage Electrolytes, ACS Appl. Mater. Interfaces, 2015, vol. 7, no. 27, p. 15098. https://doi.org/10.1021/acsami.5b04477
Shao, N., Sun, X.-G., Dai, S., and Jiang D., Electrochemical Windows of Sulfone-Based Electrolytes for High-Voltage Li-Ion Batteries, J. Phys. Chem. B, 2011, vol. 115, p. 12120. https://doi.org/10.1021/jp204401t
Li, S., Zhao, W., Xiaoling, C., Zhao, Y., Li, B., Zhang, H., Li, Y., Li, G., Ye, X., and Luo, Y., An improved method for synthesis of lithium difluoro(oxalato) borate and effects of sulfolane on the electrochemical performances of lithium-ion batteries, Electrochim. Acta, 2013, vol. 91, p. 282. https://doi.org/10.1016/j.electacta.2013.01.011
Wu, F., Xiang, J., Li, L., Chen, J., Tan, G., and Chen, R., Study of the electrochemical characteristics of sulfonyl isocyanate/sulfone binary electrolytes for use in lithium-ion batteries, J. Power Sources, 2012, vol. 202, p. 322. https://doi.org/10.1016/j.jpowsour.2011.11.065
Zhang, T., de Meatza, I., Qi, X., and Paillard, E., Enabling steady graphite anode cycling with high voltage, additive-free, sulfolane-based electrolyte: Role of the binder, J. Power Sources, 2017, vol. 356, p. 97. https://doi.org/10.1016/j.jpowsour.2017.04.073
Wang, Y., Xing, L., Li, W., and Bedrov, D., Why Do Sulfone-Based Electrolytes Show Stability at High Voltages? Insight from Density Functional Theory, J. Phys. Chem. Lett., 2013, vol. 4, p. 3992. https://doi.org/10.1021/jz401726p
Lide, D.R., Handbook of chemistry and physics, 85th edition, N.Y.: CRC Press LLC, 2005. 1657 p.
Xu, K. and Angell, C. A., Sulfone-Based Electrolytes for Lithium-Ion Batteries, J. Chem. Soc., 2002, vol. 149, no. 7, p. A920. https://doi.org/10.1149/1.1483866
Xue, L., Lee, S.-Y., Zhao, Z., and Angell, C.A., Sulfone–carbonate ternary electrolyte with further increased capacity retention and burn resistance for high voltage lithium ion batteries, J. Power Sources, 2015, vol. 295, p. 190. https://doi.org/10.1016/j.jpowsour.2015.06.112
Demeaux, J., De Vito, E., Lemordant, D., Le Digabel, M., Galiano, H., Caillon-Caravanier, M., and Claude-Montigny, B., On the limited performances of sulfone electrolytes towards the LiNi0.4Mn1.6O4 spinel, J. Phys. Chem. Chem. Phys., 2013, vol. 15, p. 20900. https://doi.org/10.1039/c3cp53941e
Lee, S.-Y., Ueno, K., and Angell, C. A., Lithium Salt Solutions in Mixed Sulfone and Sulfone–Carbonate Solvents: A Walden Plot Analysis of the Maximally Conductive Compositions, J. Phys. Chem. C, 2012, vol. 116, p. 23915. https://doi.org/10.1021/jp3067519
Lewandowski, A., Kurc, B., Stepniak, I., and Swiderska-Mocek, A., Properties of Li–graphite and LiFePO4 electrodes in LiPF6–sulfolane electrolyte, Electrochim. Acta, 2011, vol. 56, p. 5972. https://doi.org/10.1016/j.electacta.2011.04.105
Li, C., Wang, P., Li, S., Zhao, D., Zhao, Q., Liu, H., and Cui, X.-L., Active Mechanism of the Interphase Film-Forming Process for an Electrolyte Based on a Sulfolane Solvent and a Chelato-Borate Complex, ACS Appl. Mater. Interfaces, 2018, vol. 10, no. 30, p. 25744. https://doi.org/10.1021/acsami.8b05125
Wan, S., Jiang, X., Guo, B., Dai, S., Goodenough, J.B., and Sun, X.-G., A stable fluorinated and alkylated lithium malonatoborate salt for lithium-ion battery application, Chem. Commun., 2015, vol. 51, p. 9817. https://doi.org/10.1039/C5CC01428J
Wang, S., Qiu, W., Guan, Y., Yu, B., Zhao, H., and Liu, W., Electrochemical characteristics of LiMxFe1 –xPO4 cathode with LiBOB based electrolytes, Electrochim. Acta, 2007, vol. 52, p. 4907. https://doi.org/10.1016/j.electacta.2007.01.052
Swiderska-Mocek, A. and Naparstek, D., Physical and electrochemical properties of lithium bis(oxalate) borate—organic mixed electrolytes in Li-ion batteries, Electrochim. Acta, 2016, vol. 204, p. 69. https://doi.org/10.1016/j.electacta.2016.03.127
Ли, С.Я., Куи, C.Л., Cу, C.Л., Ши, C.М., Ли, Г.C. Электрохимическое поведение двух типов тройных смесей электролитов с бис(оксалато) боратом лития. Электрохимия. 2012. Т. 48. С. 569. [Li, S.Y., Cui, X.L., Xu, X.L., Shi, X.M., and Li, G.X., Electrochemical performances of two kinds of ternary electrolyte mixtures with lithium bis (oxalate)borate, Russ. J. Electrochem., 2012, vol. 48, p. 518. https://doi.org/10.1134/S1023193511090126]
Xu, W. and Angell, C.A., LiBOB and Its Derivatives. Weakly Coordinating Anions, and the Exceptional Conductivity of Their Nonaqueous Solutions, Electrochem. Solid-State Lett., 2001, vol. 4, no. 1, p. E1. https://doi.org/10.1149/1.1347858
Aihara, Y., Bando, T., Nakagawa, H., Yoshida, H., Hayamizu, K., Akiba, E., and Price, W.S., Ion Transport Properties of Six Lithium Salts Dissolved in γ-Butyrolactone Studied by Self-Diffusion and Ionic Conductivity Measurements, J. Electrochem. Soc., 2004, vol. 151, no. 1, p. A119. https://doi.org/10.1149/1.1630592
Li, S., Li, B., Xu, X., Shi, X., Zhao, Y., Mao, L., and Cui, X., Electrochemical performances of two kinds of electrolytes based on lithium bis(oxalate)borate and sulfolane for advanced lithium-ion batteries, J. Power Sources, 2012, vol. 209, p. 295. https://doi.org/10.1016/j.jpowsour.2012.03.004
Cui, X., Zhang, H., Li, S., Zhao, Y., Mao, L., Zhao, W., Li, Y., and Ye, X., Electrochemical performances of a novel high-voltage electrolyte based upon sulfolane and γ-butyrolactone, J. Power Sources, 2013, vol. 240, p. 476. https://doi.org/10.1016/j.jpowsour.2013.04.063
Larsson, W., Panitz, J.-C., and Cedergren, A., Interference-free coulometric titration of water in lithium bis(oxalato)borate using Karl Fischer reagents based on N-methylformamide, Talanta, 2006, vol. 69, p. 276. https://doi.org/10.1016/j.talanta.2005.10.004
Колосницын, В.С., Шеина, Л.В., Мочалов, С.Э. Физико-химические и электрохимические свойства растворов литиевых солей в сульфолане. Электрохимия. 2008. Т. 44. С. 620. [Kolosnitsyn, V.S., Sheina, L.V., and Mochalov, S.E., Physicochemical and electrochemical properties of sulfolane solutions of lithium salts, Russ. J. Electrochem., 2008, vol. 44, p. 575. https://doi.org/10.1134/S102319350805011X]
Мочалов, С.Э., Антипин, А.В., Колосницын, В.С. Многоканальное устройство тестирования вторичных химических источников тока и электрохимических ячеек. Научное приборостроение. 2009. Т. 19. № 3. С. 88. [Mochalov, S.E., Antipin, A.V., and Kolosnitsyn, V.S., Multichannel test system for secondary chemical current sources and electrochemical cells, Scientific instrumentation, 2009, vol. 19, no. 3, p. 88. URL: http://213.170.69.26/en/magazine.php.]
Evans, J., Vincent, C.A., and Bruce, P.G., Electrochemical measurement of transference number in polymer electrolytes, Polymer., 1987, vol. 28, p. 2324. https://doi.org/10.1016/0032-3861(87)90394-6
Bruce, P.G., Evans, J., and Vincent, C.A., Conductivity and Transference Number Measurements on Polymer Electrolytes, Solid State Ionics, 1988, vol. 28–30, p. 918. https://doi.org/10.1016/0167-2738(88)90304-9
Johansson, P., Electronic structure calculations on lithium battery electrolyte salts, Phys. Chem. Chem. Phys., 2007, vol. 9, p. 1493. https://doi.org/10.1039/B612297C
Linert, W., Camard, A., Armand, M., and Michot, C., Anions of low Lewis basicity for ionic solid state electrolytes, Coord. Chem. Rev., 2002, vol. 226, p. 137.
Ue, M., Murakami, A., and Nakamura, S., A Convenient Method to Estimate Ion Size for Electrolyte Materials Design, J. Electrochem. Soc., 2002, vol. 149, p. A1385. https://doi.org/10.1149/1.1507593
Ue, M., Mobility and Ionic Association of Lithium and Quaternary Ammonium Salts in Propylene Carbonate and γ-Butyrolactone, J. Electrochem. Soc., 1994, vol. 141, no. 12, p. 3336. https://doi.org/10.1149/1.2059336
Allen, J.L., Han, S.-D., Boyle, P.D., and Henderson, W.A., Crystal structure and physical properties of lithium difluoro(oxalato)borate (LiDFOB or LiBF2Ox), J. Power Sources, 2011, vol. 196, p. 9737. https://doi.org/10.1016/j.jpowsour.2011.07.065
You, L.S., Hua, M.P., Ling, C.X., Du, R.Q., and Qiang, L.F., Studies on the thermal decomposition kinetics of LiPF6 and LiBC4O8, J. Chem. Sci., 2008, vol. 120, no. 2, p. 289.
Alvarado, J., Schroeder, M.A., Zhang, M., Borodin, O., Gobrogge, E., Olguin, M., Ding, M.S., Gobet, M., Greenbaum, S., Meng, Y.S., and Xu, K., A carbonate-free, sulfone-based electrolyte for high-voltage Li-ion batteries, Mater. Today, 2018, vol. 21, no. 4, p. 341. https://doi.org/10.1016/j.mattod.2018.02.005
Borodin, O., Behl, W., and Jow, T.R., Oxidative Stability and Initial Decomposition Reactions of Carbonate, Sulfone, and Alkyl Phosphate-Based Electrolytes, J. Phys. Chem. C, 2013, vol. 117, p. 8661. https://doi.org/10.1021/jp400527c
Дополнительные материалы
- скачать ESM.docx
- Таблица S1.
- скачать ESM_2.tiff
- Рисунок S1. - Рисунок S2.
- скачать ESM_3.tiff
- Рисунок S3.
- скачать ESM_4.tiff
- Рисунок S4.



