Электрохимия, 2022, T. 58, № 10, стр. 599-613
Нановолокна германия и фосфида германия в литий-ионных и натрий-ионных аккумуляторах (обзор)
Т. Л. Кулова a, *, А. М. Скундин a, **, И. М. Гаврилин a, b
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Россия
b Московский институт электронной техники
Зеленоград, Россия
* E-mail: tkulova@mail.ru
** E-mail: askundin@mail.ru
Поступила в редакцию 05.01.2022
После доработки 21.03.2022
Принята к публикации 23.03.2022
- EDN: EVCBBS
- DOI: 10.31857/S0424857022100085
Аннотация
Краткий обзор основных исследований по применению нановолокон германия, полученных электролизом водных растворов, а также нановолокон фосфида германия в качестве отрицательных электродов литий-ионных и натрий-ионных аккумуляторов, проведенных в ИФХЭ РАН.
ВВЕДЕНИЕ
Круг научных интересов О.А. Петрия был очень широк, и электрохимические свойства наноматериалов занимали там достойное место. Еще в одной из первых (и может быть, наиболее цитируемых) работ [1] рассматривались электролитические смешанные осадки платины и рутения, имеющие характерные размеры в единицы нанометров, и обладающие замечательными электрокаталитическими свойствами в процессе анодного окисления метанола. Сейчас такие осадки относят к категории наноматериалов. В то же время один из последних крупных обзоров [2] также посвящен методам получения наноматериалов.
В настоящей статье суммируются исследования электроосажденных нановолокон германия применительно к их использованию в отрицательных электродах литий-ионных и натрий-ионных аккумуляторов [3–10]. Хотя вообще применению германия в литий-ионных и натрий-ионных аккумуляторах уделяется в последнее время большое внимание [11], литература по нановолокнам германия, как активному электродному материалу, довольно ограничена [12–25]. В большинстве случаев нановолокна германия выращивали на подложках методами осаждения из паровой фазы (CVD-метод). Применение метода катодного осаждения германия осложняется его высокой активностью по отношению к воде (стандартный потенциал систем Ge/H2GeO3, Ge/GeO2 и Ge/GeO составляет, соответственно, –0.13, –0.15 и –0.29 В [26], следовательно, металлический германий способен восстанавливать воду по уравнениям: Ge + 3H2O → H2GeO3 + 2H2, Ge + 2H2O → GeO2 + 2H2 и Ge + H2O → GeO + H2). Для решения этой проблемы предлагалось проводить осаждение нановолокон германия из расплавов (в том числе, из ионных жидкостей), что также связано с определенными трудностями, в частности, с образованием аморфных осадков.
В работах [22, 27, 28] предлагалось проводить катодное осаждение нановолокон германия из водных растворов на затравки из жидких металлов (ртуть, галлий). В этом случае первичным продуктом восстановления является низкопроцентный раствор германия в жидком металле, не взаимодействующий с водой. Однако жидкометаллические затравки имеют склонность к коалесценции и растеканию по поверхности подложки. В [29] предлагалось заменить капли жидкого металла на наночастицы твердого, но легкоплавкого металла, в частности индия. Именно такой подход и был использован в настоящей работе при синтезе нановолокон германия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Конструктивной основой исследуемых электродов были пластинки из титана марки ВТ 1-0 толщиной 50 мкм. Вначале на эти подложки наносили массивы наночастиц индия, служащих впоследствии затравками (центрами кристаллизации) нановолокон германия. Предварительно поверхность подложек очищали в смеси H2O2 : : NH4OH : H2O (1 : 1 : 4) при температуре 80°C в течение 15 мин, промывали деионизованной водой и сушили в токе аргона. Затем проводили активацию поверхности в смеси HF : HNO3 : H2O (1 : 2 : 6), вновь промывали водой и вновь сушили в токе аргона. Полусферические наночастицы индия наносили вакуумным испарением по методике, разработанной в [29]. Остаточное давление в камере составляло 10–5 торр, расстояние от молибденового испарителя до мишени-подложки составляло 20 см. После нанесения индиевых затравок подожки отжигали в вакууме при температуре 150°С в течение 10 мин.
Массивы нановолокон германия наносили в трехэлектродной ячейке, как правило, в гальваностатическом режиме, но с контролем потенциала рабочего электрода. В качестве электрода сравнения использовали насыщенный каломельный электрод, вспомогательный электрод был изготовлен из платиновой пластины. Заданный ток осаждения поддерживали с использованием потенциостата/гальваностата Autolab PGSTAT302N (Metrohm, Нидерланды). Электролит для осаждения нановолокон готовили растворением GeO2 в водном растворе, содержащем 0.5 М сульфата калия и 0.5 М янтарной кислоты (в качестве буферирующей добавки). Концентрация растворенного Ge(IV) составляла 0.05 М. рН раствора доводили до 6.5 добавлением NH4OH. Осаждение проводили при температуре около 90°С, для термостатирования использовали термостат LAUDA Alpha (ФРГ). (В работе [30] показано, что температура оказывает решающее влияние на структуру осадков: нановолокна осаждаются только при температурах выше 60°С.)
Массу осажденных нановолокон определяли гравиметрически с использованием аналитических весов Metter Toledo XP 205 (Швейцария) с чувствительностью 10 мкг. Для исследования морфологии индиевых затравок и нановолокон германия использовали сканирующий электронный микроскоп Helios NanoLab 650 (FEI, США) и просвечивающий электронный микроскоп FEI Tecnai G2 20 S-Twin (США) с энерго-дисперсионным анализатором (EDAX). Информация о составе нановолокон была получена методами рентгеновской фотоэлектронной спектроскопии (спектрометр PHI 5000 VersaProbe II (ULVAC-PHI) на монохроматическом AlKα-излучении (hν = = 1486.6 эВ) мощностью 50 Вт с диаметром области анализа 200 мкм). Фазовый состав определяли методом микродифракции электронов.
Дифрактограммы фосфида германия были получены с помощью рентгеновского дифрактометра Радиан ДР-02. Использовалось излучение медного анода (CuKα) с никелевым фильтром. Идентификация GeP произведена с использованием базы данных Crystallography Open Database.
Электрохимические исследования электродов с нановолокнами германия проводили в трехэлектродных герметичных ячейках плоскопараллельной конструкции. Противоэлектроды и электроды сравнения были изготовлены из никелевой сетки с накатанными на нее литием или натрием. Электроды разделялись сепаратором из нетканого полипропилена (УФИМ, Россия). При измерениях при комнатной температуре электролитом служили 1 М LiPF6 или 1 M NaClO4 в смеси этиленкарбонат–диэтилкарбонат–диметилкарбонат (ЭК–ДЭК–ДМК 1 : 1 : 1). Для низкотемпературных измерений был использован 1 М раствор LiClO4 в смеси пропиленкарбоната (ПК) с диметоксиэтаном (ДМЭ) (7 : 3), температура замерзания которого ниже –60°С. Все реактивы были приобретены в Aldrich и имели квалификацию “Battery gradе”. Содержание воды в электролитах не превышало 20 ppm. Электрохимические ячейки собирали и заполняли электролитом в перчаточном боксе с атмосферой сухого аргона (ООО “Спектроскопические системы”, Россия). Содержание воды и кислорода в боксе не превышало 5 ppm. Гальваностатическое циклирование проводили с использованием компьютеризированного стенда (ЗАО “Бустер”, Россия). Циклические вольтамперометрические измерения проводили с использованием многоканального потенциостата Р-20Х (ООО “Элинс”, Россия). Спектры электрохимического импеданса регистрировали с использованием частотного анализатора “Solartron” (Model 1255 HF) и потенциостата “Solartron” (Model 1286) в диапазоне частот от 100 кГц до 100 мГц с амплитудой возмущающего сигнала 10 мВ. Анализ спектров импеданса проводили с использованием пакета программ ZView. Электрохимические измерения в широком температурном диапазоне проводили с использованием камеры тепла-холода КТХ-74-65/165 (Смоленское СКТБ СПУ, Россия). Температура в камере поддерживалась с точностью 0.2°С. Перед измерениями ячейки в камере выдерживались не менее 1 ч.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Структурные и морфологические измерения. Как следует из данных сканирующей электронной микроскопии, индиевые зародыши имели полусферическую форму с диаметром 10–30 нм. Поверхностная плотность зародышей имела порядок 1011 см–2, т.е. зародыши представляли плотный слой. На рис. 1 показано изображение нановолокон германия в сканирующем электронном микроскопе. Типичные размеры нановолокон: диаметр 20–40 нм, длина 0.2–0.8 мкм.
На концах нановолокон имелись сферические образования, являющиеся остатками индиевых затравок. Близкая форма нановолокон германия описана также в [13, 22].
На основании данных энергодисперсионного анализа и рентгеновской фотоэлектронной спектроскопии было установлено, что нановолокна содержали германий, индий и кислород. Среднее содержание индия составляло 8–10%. Кислород находился в форме GeO2 и нестехиометрического оксида GeOx, причем содержание последнего увеличивалось с ростом плотности тока осаждения нановолокон. GeO2 регистрировался только на самой поверхности нановолокон и легко удалялся кратковременной аргонной бомбардировкой. Предполагается, что этот оксид образовывался просто при контакте образцов с воздухом. GeOx регистрировался на всей глубине нановолокон. Предполагается, что при осаждении нановолокон при плотностях тока выше 1 мА/см2 происходит заметное подщелачивание прикатодного слоя электролита, разрушение комплекса германия с янтарной кислотой с высвобождением анионов ${\text{GeO}}_{3}^{{2 - }}{\text{.}}$ Эти анионы, в свою очередь, катодно восстанавливаются с образованием GeOx. При осаждении нановолокон с плотностью тока 0.2 мА/см2 подщелачивание прикатодного слоя было намного меньше, и GeOx не обнаруживался.
Исследования внедрения лития в нановолокна германия. На рис. 2 приведены типичные гальваностатические зарядные и разрядные кривые внедрения и экстракции лития в нановолокна германия при комнатной температуре. Приведены кривые для первых 5 циклов и для 35-го цикла.
Рис. 2.
Зарядно-разрядные кривые электрода из нановолокон германия. Электролит – 1 М LiPF6 в смеси ЭК–ДЭК–ДМК (1 : 1 : 1). Ток 0.9 А/г. Номера циклов указаны около кривых.
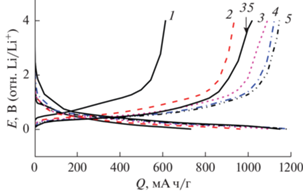
Как видно, при использованном токе циклирования 0.9 А/г, что примерно соответствует режиму 0.6 С, средний потенциал внедрения лития (потенциал, соответствующий половине катодной емкости) составляет около 0.2 В, а средний потенциал анодного извлечения лития составляет около 0.5 В. Такая разница анодного и катодного потенциалов близка к соответствующей величине для электродов из графита и примерно вдвое меньше, чем разница потенциалов при том же токовом режиме для электродов на основе кремния. В общем, форма и положение гальваностатических кривых, показанных на рис. 2, соответствует доложенным в литературе [21, 22].
Характерно, что на первом этапе циклических гальваностатических экспериментов (первые 6 циклов) происходило заметное уменьшение разницы средних анодного и катодного потенциалов и некоторое увеличение реализуемой емкости. При последующем циклировании емкость снижалась за счет естественной деградации со скоростью около 0.3% за цикл (рис. 3).
Рис. 3.
Изменение разрядной емкости (Q) и эффективности циклирования (k) для электрода с нановолокнами германия при токе 0.9 А/г.

Вообще рост емкости на первых циклах характерен для материалов, способных внедрять большое количество лития, что связано с некоторым разрушением (пульверизацией) материала и увеличением площади его поверхности. Подобный эффект для кремниевых электродов описан, например, в [31]. По отношению к германию (наноосадки германия на волокнах меди с углеродной сердцевиной) такой эффект описан в [32].
Особо следует отметить, что разрядная емкость в расчете на единицу площади поверхности электрода, полученная в настоящей работе, как правило, значительно превосходит величины, доложенные в литературе [33–35]. (Правда, в работе [36] для тонкопленочного макета получены емкости 0.4–0.7 мА ч/см2, что сопоставимо с результатами настоящего исследования.)
Как следует из анализа рис. 3, кулоновская эффективность циклирования (в данном случае отношение емкости при разряде к емкости при предыдущем заряде) на первом цикле составила всего около 84% (в некоторых экспериментах бывала и меньше), однако уже на втором и всех последующих циклах выросла до 97–98%, что свидетельствует о формировании надежной пассивной пленки (SEI, solid electrolyte interphase) на германии при первой катодной поляризации и качественно согласуется с данными работ [21, 22, 32, 33].
На рис. 4 приведены зарядные и разрядные кривые, полученные при разных плотностях тока. При каждой плотности тока регистрировали по пять последовательных циклов.
Рис. 4.
Зарядные и разрядные гальваностатические кривые, полученные в режимах от 1 до 24 С (1 С = 1500 мА/г).
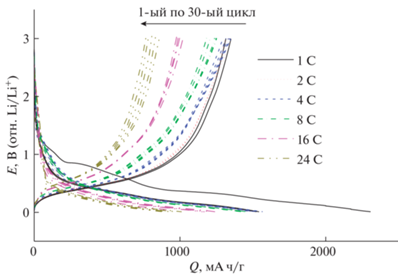
Рисунок 5 более наглядно показывает влияние плотности тока циклирования на емкость электрода на основе нановолокон германия.
Как видно, при циклировании в режимах до 4 С удельная емкость остается практически на первоначальном уровне и мало изменяется по мере циклирования. Даже при циклировании в режиме 24 С (полный разряд за 2–3 мин) удельная емкость сохраняется на уровне 700–800 мА ч/г, что является очень хорошим показателем для такого форсированного режима.
На рис. 6 приведены циклические вольтамперограммы, полученные на электроде с нановолокнами германия при разных скоростях развертки потенциала.
Рис. 6.
Циклические вольтамперограммы на электроде с нановолокнами германия при скоростях развертки потенциала: 0.05 (1), 0.1 (2), 0.2 (3), 0.4 (4) и 0.8 (5) мВ/c.

На катодных ветвях вольтамперограмм можно различить несколько максимумов, соответствующих внедрению лития, а на анодных ветвях различаются максимумы, соответствующие экстракции лития. В общем, потенциалы анодных максимумов более положительны, чем потенциалы соответствующих катодных максимумов, что является мерой замедленности процессов внедрения-экстракции лития. В целом форма вольтамперограмм, показанных на рис. 6, согласуется с данными литературы для разных электродов на основе наноструктур и нанокомпозитов германия [37–44].
Интегрированием анодных ветвей были рассчитаны емкости, соответствующие экстракции лития при разных скоростях развертки потенциала, и оказалось, что при скоростях развертки от 0.05 д 0.4 мВ/с емкость не зависит от скорости развертки, и лишь при развертке потенциала со скоростью 0.8 мВ/с несколько снижается и составляет 1284, 1295, 1270, 1285 и 1100 мАч/г при скоростях развертки потенциала 0.05, 0.1, 0.2, 0.4 и 0.8 мВ/с. Практическая независимость емкости от скорости развертки потенциала объясняется скорее всего условиями ограниченной диффузии. Критерием перехода от конечной диффузии к полубесконечной при диффузии в цилиндр радиусом r служит соотношение DΔE/v > r2, где D – коэффициент диффузии, ΔE – интервал потенциалов, v – скорость развертки потенциала [45]. В данном случае коэффициент диффузии может быть оценен (по порядку величины) как 10–15–10–14 см2/с. Такие же значения коэффициента диффузии были получены и из импедансных измерений.
Как известно, обычные литий-ионные аккумуляторы работоспособны при температурах от 0 до +50°С (иногда в качестве нижней температуры работоспособности указывают –20°С, но при этом энергия аккумуляторов составляет не более 5% от энергии, отдаваемой при комнатной температуре). Большинство коммерческих литий-ионных аккумуляторов основано на так называемой традиционной электрохимической системе с отрицательным электродом (анодом), изготовленным из углеродного материала. Общепризнано, что именно такой электрод теряет свою работоспособность при снижении температуры. Поэтому при исследованиях новых электродных материалов представляет интерес оценить их работоспособность при низких температурах.
В настоящей работе проводили гальваностатическое циклирование ячеек с электродами на основе нановолокон германия при плотности тока 1500 мА/г (что близко к режиму 1 С) и температурах от +20 до –50°С. При каждой температуре проводили последовательно по 5 зарядно-разрядных циклов. Как уже указывалось, в этой серии экспериментов обычный этиленкарбонатный электролит был заменен на 1 М раствор LiClO4 в смеси пропиленкарбоната (ПК) с диметоксиэтаном (ДМЭ) (7 : 3).
На рис. 7 показаны зарядные и разрядные кривые, полученные при разных температурах. Важно отметить, что здесь заряд и разряд всегда проводился при одной и той же температуре.
Рис. 7.
Зарядные и разрядные гальваностатические кривые электрода с нановолокнами германия при температурах от +20 до –50°С.

При наиболее низкой из исследованных температур обратимая емкость электрода на основе нановолокон германия составляет около 255 мА ч/г, что составляет 22% от емкости, реализуемой при комнатной температуре. Работоспособность при столь низкой температуре представляет еще одно достоинство электродов на основе нановолокон германия. Наглядное представление о количественном влиянии температуры на обратимую емкость германиевых электродов дает рис. 8.
Рис. 8.
Изменение удельной емкости электрода на основе нановолокон германия при изменении температуры.
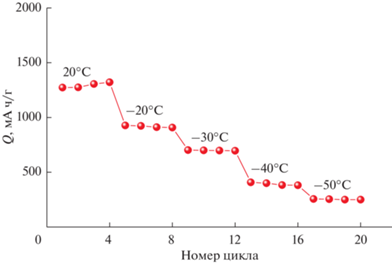
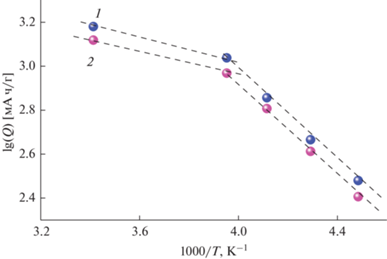
На рис. 9 температурная зависимость зарядной и разрядной емкости представлена в аррениусовских координатах. Смысл такого представления подробно обсужден в [46, 47] и связан с влиянием температуры на коэффициент твердофазной диффузии лития. При температурах ниже некоторой коэффициент диффузии снижается настолько, что диффузия в нановолокне переходит в условия полубесконечной. Таким образом, температурная зависимость емкости (в данном случае при температурах –20°С и ниже) отражает температурную зависимость коэффициента диффузии лития. Наклон низкотемпературных участков на рис. 9 соответствует энергии активации диффузии около 20 кДж/моль. Такие же значения были получены из импедансных измерений.
Использование электролитов на основе пропиленкарбоната вместо этиленкарбонатных электролитов позволяет существенно расширить температурный интервал работоспособности электродов из нановолокон германия, но приводит также к заметному росту необратимой емкости в начальный период циклирования. Как известно, основным источником необратимых потерь емкости являются процессы восстановления электролита на отрицательном электроде. Продукты необратимого восстановления электролита (как растворителя, так и аниона соли) могут быть газообразными, частично растворимыми в электролите и нерастворимыми в электролите. В последнем случае они осаждаются на поверхности электрода и образуют пассивную пленку, известную как SEI. Огромное влияние на состав и свойства SEI оказывают различные добавки в электролит, из которых наибольшей популярностью пользуется виниленкарбонат (ВК). Влиянию ВК на образование SEI на углеродистых материалах и материалах на основе кремния посвящено большое количество исследований, но только в одной работе [18] указано на его роль при образовании SEI на нановолокнах германия. В настоящей работе впервые исследован электролит состава 1 М LiClO4 в смеси ПК-ДМЭ (7 : 3) с 2 мас. % ВК для электродов на основе нановолокон германия.
На рис. 10 приведены гальваностатические зарядно-разрядные кривые германиевых электродов для первого и второго циклов при циклировании в вышеуказанном электролите с добавкой ВК и без добавки. Из рис. 10 хорошо видно, что добавка ВК в электролит приводит к существенному изменению формы катодной кривой первого цикла, а именно к исчезновению продолжительного плато в области потенциалов 1.5–0.45 В, т.е. к снижению необратимой емкости 1-го цикла германиевого электрода. Так, необратимая емкость в электролите без добавки ВК составила около 1900 мА ч/г, добавка 2% ВК к электролиту привела к снижению необратимой емкости до 360 мА ч/г. Кроме того, обратимая (анодная) емкость нановолокон германия в электролите с добавкой ВК оказалась выше, чем в электролите без добавок.
Рис. 10.
Зарядные и разрядные кривые электродов на основе нановолокон германия для первого (1, 1 ') и второго (2, 2 ') циклов в электролитах без добавки (1, 2) и с добавкой 2% ВК (1 ', 2 ').

Рисунок 11 показывает динамику изменения катодной и анодной емкостей, а также кулоновской эффективности циклирования нановолокон германия в электролитах с добавкой 2% ВК и без добавки. В обоих электролитах наблюдается уже отмечавшийся выше рост емкости на первых 10–15 циклах, что связано с пульверизацией частиц германия.
Рис. 11.
Изменение анодной (1, 1 ') и катодной (2, 2 ') емкостей (Q) и кулоновской эффективности (k) электродов (3, 3 ') на основе нановолокон германия в электролитах без добавки (1, 2, 3) и с добавкой 2% ВК (1 ', 2 ', 3 ').

После 15-го цикла заряда–разряда (рис. 11) удельная емкость нановолокон германия в электролите без добавок начинает постепенно снижаться от цикла к циклу, в то время как удельная емкость германия в электролите с добавкой ВК остается практически постоянной, по крайней мере в течение 80 циклов. Потеря емкости нановолокон германия в электролите без добавки ВК составила 65% за первые 50 циклов.
Улучшение электрохимических характеристик нановолокон германия в электролите с добавкой ВК однозначно связано с формированием SEI, влияющей на ионную проводимость по литию, а также деградацию при циклировании. Этот вывод был подтвержден также исследованиями методом спектроскопии электрохимического импеданса.
Исследования внедрения натрия в нановолокна германия. Германий, в принципе, способен образовывать интерметаллические соединения с натрием вплоть до состава Na3Ge (что соответствует теоретической удельной емкости 1107 мАч/г) [48], и это делает его привлекательным кандидатом на материал отрицательного электрода натрий-ионных аккумуляторов. Однако в литературе встречается очень мало работ, посвященных обратимому внедрению натрия в нановолокна германия. Исключение представляет работа [49], в которой для нановолокон германия доложены значения емкости, соответствующие составу Na1.6Ge.
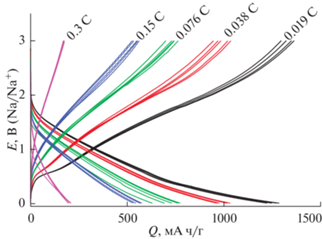
В настоящей работе исследовали процесс обратимого внедрения натрия в вышеописанные электроды с нановолокнами германия. На рис. 12 показаны зарядные и разрядные гальваностатические кривые, полученные при плотностях тока от 90 до 1800 мА/г (что примерно соответствует режимам от 0.15 до 3 С).
Рис. 12.
Зарядные и разрядные кривые при внедрении натрия при плотностях тока, мА/г: 90 (1), 450 (2), 900 (3) и 1800 (4).

Видно, что обратимая емкость электрода на основе нановолокон германия, реализуемая при внедрении натрия, заметно уступает емкости при внедрении лития, а главное, скорость внедрения натрия почти на порядок меньше, чем при внедрении лития. Это различие в скорости внедрения и экстракции натрия обусловлено, скорее всего, различием в коэффициентах диффузии натрия и лития.
Зависимость обратимой емкости при внедрении натрия от тока циклирования наглядно видна на рис. 13, где приведены данные о циклировании при плотностях тока до 7200 мА/г (примерно 12 С). Из данных рис. 13 следует, что темп деградации при циклировании (насколько можно судить по 20 последовательным циклам) почти не изменяется с ростом плотности тока, что отличает процесс внедрения натрия от внедрения лития, где характер деградации более сложный, а именно на первых 15 циклах происходит постепенное увеличение разрядной емкости вследствие так называемой “разработки электрода”, и, как следствие этого, деградация отсутствует. При дальнейшем циклировании и увеличении плотности тока темп деградации при внедрении лития превышает темп деградации при внедрении натрия. На рис. 13 видно также, что кулоновская эффективность циклирования на 1-м цикле составляет около 61%, а затем постепенно увеличивается, и, начиная примерно с 12-го цикла, держится на уровне 98–99%.
Рис. 13.
Зависимость обратимой емкости и кулоновской эффективности (k) при внедрении натрия в нановолокна германия от плотности тока (мА/г).

Рисунок 14 представляет результаты вольтамперометрического исследования внедрения натрия.
Рис. 14.
Циклические вольтамперограммы на электроде с нановолокнами германия при внедрении натрия при скоростях развертки потенциала 0.025 (1), 0.05 (2) и 0.4 (3) мВ/с.
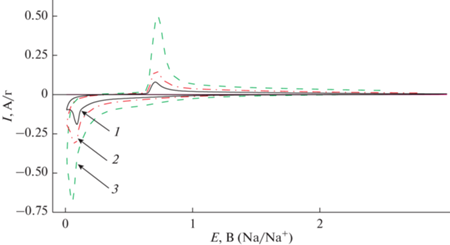
Видно, что вольтамперограммы внедрения натрия заметно отличаются от вольтамперограмм внедрения лития (рис. 6). Процесс внедрения натрия в германий регистрируется в виде довольно узкого пика при потенциалах 50–60 мВ (Na+/Na), а обратный процесс экстракции натрия – в виде узкого пика при потенциалах 700–710 мВ. Разница потенциалов внедрения и экстракции натрия значительно больше, чем для процессов с участием лития. Токи в максимумах внедрения и экстракции натрия пропорциональны корню из скорости развертки потенциала, что подтверждает диффузионную природу лимитирующей стадии и свидетельствует о реализации условий полубесконечной диффузии. Этот факт подтверждает вывод о том, что коэффициент диффузии натрия в германии заметно меньше, чем коэффициент диффузии лития.
Исследования внедрения лития и натрия в наностержни фосфида германия. Способностью обратимо внедрять литий и натрий обладают не только наноструктуры металлического германия, но и некоторые из его соединений, из которых наибольший интерес представляют фосфиды. Германий способен образовывать соединения с фосфором состава GeP, GeP3 и GeP5, и их принципиальная способность к внедрению лития и натрия была многократно подтверждена [3–8, 17]. Основная проблема высокоемких интеркаляционных материалов – низкая стабильность при циклировании, связанная с разрушением функционального материала. Детальный механизм обратимого внедрения лития и натрия в фосфиды германия до сих пор является предметом дискуссий, но большинство исследователей склоняется к тому, что в этих процессах происходит распад фосфидов на элементы, каждый из которых способен к обратимому внедрению щелочных металлов. Например, при внедрении лития в GeP [50] вначале происходит образование соединений внедрения LixGeP, а при дальнейшей катодной поляризации происходит конверсия с образованием фосфида лития и элементарного германия:
Наконец, при более отрицательных потенциалах происходит образование сплавов германия с литием.
В настоящей работе предложен новый способ синтеза фосфида германия, стабильного при обратимом внедрении лития и натрия. Способ основан на использовании нановолокон германия, описанных в предыдущих разделах. Заготовки в виде титановых пластин с нанесенным массивом нановолокон германия переносили в перчаточный бокс с атмосферой аргона и там помещали в герметичные ампулы из нержавеющей стали. В эти же ампулы добавляли избыток порошка красного фосфора. Затем эти ампулы помещали в трубчатую печь, где нагревали до температуры 600–650°С, выдерживали при этой температуре в течение 30 мин и затем охлаждали естественным образом. При этом фосфор вначале сублимировался, а затем конденсировался на поверхности нановолокон германия, так что получался композит, армированный нановолокнами. Схема синтеза наглядно показана на рис. 15.
Рис. 15.
Схема синтеза фосфида германия: 1 – ампула из нержавеющей стали, 2 – красный фосфор, 3 – титановая пластина с нановолокнами германия, 4 – трубчатая печь.

Синтезированные образцы были охарактеризованы с помощью рентгенофазового анализа, сканирующей электронной микроскопии, электронно-дисперсионного анализа и рамановской спектроскопии.
Электронно-микроскопическое изображение, характеризующее морфологию синтезированного материала, приведено на рис. 16. Как видно, в результате описанного синтеза нановолокна германия преобразовались в наностержни фосфида германия с диаметром от 250 до 500 нм и длиной от 0.2 до 10 мкм. Электронно-димперсионным анализом в составе образцов были обнаружены германий, фосфор, титан и кислород. Рентгенофазовый анализ подтвердил, что фосфид германия имел состав GeP (рис. 17). Образование GeP было подтверждено также результатами спектроскопии комбинационного рассеяния.
На рис. 18 показаны гальваностатические зарядные и разрядные кривые для процессов внедрения-экстракции лития в образец GeP, полученные при разных плотностях тока от 0.8 до 12.8 А/г, что соответствует режимам от С/2.5 до 6.4 С. Электролитом в данных экспериментах служил 1 М раствор LiClO4 в смеси ПК–ДМЭ (7 : 3). При малых нагрузках (в режиме С/2.5) разрядная емкость электрода с фосфидом германия близка к теоретической (1915 мА ч/г). При малых нагрузках регистрировалась некоторая деградация электрода по мере циклирования, при увеличении нагрузки темп деградации резко снизился. Более наглядно изменение емкости электрода на основе фосфида германия при обратимом внедрении лития показано на рис. 19.
Рис. 18.
Гальваностатические зарядные и разрядные кривые внедрения и экстракции лития в образец фосфида германия в режимах от С/2.5 до 6.4 С (6.4 С соответствует плотности тока 12.8 А/г).

Рис. 19.
Изменение емкости фосфида германия при обратимом внедрении лития при изменении токовой нагрузки.

Синтезированный в настоящей работе фосфид германия обладает способностью и к обратимому внедрению натрия. На рис. 20 приведены гальваностатические зарядные и разрядные кривые, полученные на таком электроде в 1 М растворе NaClO4 в смеси ПК–ЭК (1 : 1) при разных плотностях тока. Обращает на себя внимание тот факт, что и в этом случае токи обратимого внедрения натрия были меньше, чем при обратимом внедрении лития. Рисунок 21 дает количественное представление о влиянии тока нагрузки на обратимую емкость фосфида германия по внедрению натрия.
ЗАКЛЮЧЕНИЕ
Нановолокна германия с характерным диаметром 20–40 мкм были осаждены на титановые подожки с затравками из наночастиц индия из водного комплексного электролита. Электроды с такими нановолокнами обладают способностью к обратимому внедрению лития, при этом их емкость при комнатной температуре составляет около 1500 мА ч/г в режиме до 2 С и около 800 мА ч/г в режиме 24 С. При снижении температуры до –50°С емкость по внедрению лития уменьшается менее чем впятеро по сравнению с данными при комнатной температуре. Такие же электроды способны к обратимому внедрению натрия, при этом емкость составляет около 600 мА ч/г при нагрузке 0.15 С и около 180 мАч/г при нагрузке 12 С.
Методом испарения–конденсации синтезированы наностержни фосфида германия состава GeP, способные к обратимому внедрению лития с емкостью до 1900 мА ч/г и к обратимому внедрению натрия с емкостью до 1300 мА ч/г.
Все исследованные материалы имеют хорошие перспективы для использования в отрицательных электродах литий-ионных и натрий-ионных аккумуляторов.
Список литературы
Петрий, О.А. Об активности электролитически смешанных осадков платины и рутения в реакции электроокисления метанола. ДАН СССР. 1965. Т. 160. С. 871. [Petrii, O.A., Activity of electrolytically deposited platinum and ruthenium by the electrooxidation of methanol, Dokl. Akad. Nauk, 1965, vol. 160, p. 871.]
Петрий, О.А. Электросинтез наноструктур и наноматериалов. Успехи химии. 2015. Т. 84. С. 159. [Petrii, O.A., Electrosynthesis of nanostructures and nanomaterials, Russ. Chem. Rev., 2015, vol. 84, p. 159.]
Gavrilin, I.M., Smolyaninov, V.A., Dronov, A.A., Gavrilov, S.A., Trifonov, A.Yu., Kulova, T.L., Kuz’mina, A.A., and Skundin, A.M., Electrochemical insertion of sodium into nanostructured materials based on germanium, Mendeleev Commun., 2018, vol. 28, p. 659.
Гаврилин, И.М., Смолянинов, В.А., Дронов, А.А., Гаврилов, С.А., Трифонов, А.Ю., Кулова, Т.Л., Кузьмина, А.А., Скундин, А.М. Исследование процесса обратимого внедрения лития в наноструктурированные материалы на основе германия. Электрохимия. 2018. Т. 54. С. S31. [Gavrilin, I.M., Smolyaninov, V.A., Dronov, A.A., Gavrilov, S.A., Trifonov, A.Yu., Kulova, T.L., Kuz’mina, A.A., and Skundin, A.M., Study of the Process of Reversible Insertion of Lithium into Nanostructured Materials Based on Germanium. Russ. J. Electrochem., 2018, vol. 54, p. 907.]
Kulova, T.L., Gavrilin, I.M., Kudryashova, Yu.O., and Skundin, A.M., A LiNi0.8Co0.15Al0.05O2/Ge electrochemical system for lithium-ion batteries, Mendeleev Commun., 2020, vol. 30, p. 775.
Gavrilin, I.M., Kudryashova, Yu.O., Kulova, T.L., Skundin, A.M., and Gavrilov, S.A., The effect of growth temperature on the process of insertion/extraction of sodium into germanium nanowires formed by electrodeposition using indium nanoparticles, Mater. Lett., 2021, vol. 287, March 15. Article no. 129303.
Gavrilin, I.M., Kudryashova, Yu.O., Kuz’mina, A.A., Kulova, T.L., Skundin, A.M., Emets, V.V., Volkov, R.L., Dronov, A.A., Borgardt, N.I., and Gavrilov, S.A., High-rate and low-temperature performance of germanium nanowires anode for lithium-ion batteries, J. Electroanalyt. Chem., 2021, vol. 888, Article no. 115209.
Emets, V.V., Gavrilin, I.M., Kulova, T.L., Skundin, A.M., Sharafutdinova, A.M., and Gavrilov, S.A., Dynamics of changes in the kinetic parameters of germanium nanowires during lithiation/delithiation in a wide temperature range, J. Electroanalyt. Chem., 2021, vol. 902, Article no. 115811.
Kulova, T.L., Gavrilin, I.M., Kudryashova, Yu.O., Skundin, A.M., and Gavrilov, S.A., Cyclability enhancement and decreasing the irreversible capacity of anodes based on germanium nanowires for lithium-ion batteries, Mendeleev Commun., 2021, vol. 31, p. 842.
Кулова, Т.Л., Кудряшова, Ю.О., Гаврилин, И.М., Скундин, А.М., Гаврилов, С.А. Анод литий-ионного аккумулятора для работы при пониженных температурах и способ его изготовления. Патент № 2743576 (РФ), 2021. (Бюллетень № 5) по заявке 2020127043 от 12.08.2020.
Кулова, Т.Л., Скундин, А.М. Применение германия в литий-ионных и натрий-ионных аккумуляторах (обзор). Электрохимия. 2021. Т. 57. С. 709. [Kulova, T.L. and Skundin, A.M., Germanium in Lithium-Ion and Sodium-Ion Batteries (A Review), Russ. J. Electrochem., 2021, vol. 57, p. 1105.]
Chan, C.K., Zhang, X.F., and Cui, Y., High Capacity Li Ion Battery Anodes Using Ge Nanowires, Nano Lett., 2008, vol. 8, p. 307.
Farbod, B., Cui, K., Kupsta, M., Kalisvaart, W.P., Memarzadeh, E., Kohandehghan, A., Zahiri, B., and Mitlin, D., Array geometry dictates electrochemical performance of Ge nanowire lithium ion battery anodes, J. Mater. Chem. A, 2014, vol. 2, p. 16770.
Liu, X.H., Huang, S., Picraux, S.T., Li, J., Zhu, T., and Huang, J.Y., Reversible Nanopore Formation in Ge Nanowires during Lithiation–Delithiation Cycling: An In Situ Transmission Electron Microscopy Study, Nano Lett., 2011, vol. 11, p. 3991.
Mullane, E., Kennedy, T., Geaney, H., Dickinson, C., and Ryan, K.M., Synthesis of Tin Catalyzed Silicon and Germanium Nanowires in a Solvent–Vapor System and Optimization of the Seed/Nanowire Interface for Dual Lithium Cycling, Chem. Mater., 2013, vol. 25, p. 1816.
Kim, G.-T., Kennedy, T., Brandon, M., Geaney, H., Ryan, K.M., Passerini, S., and Appetecchi G.B., Behavior of Germanium and Silicon Nanowire Anodes with Ionic Liquid Electrolytes, ACS Nano, 2017, vol. 11, p. 5933.
Pandres, E.P., Olson, J.Z., Schlenker, C.W., and Holmberg, V.C., Germanium Nanowire Battery Electrodes with Engineered Surface-Binder Interactions Exhibit Improved Cycle Life and High Energy Density without Fluorinated Additives, ACS Appl. Energy Mater., 2019, vol. 2, p. 6200.
Kennedy, T., Mullane, E., Geaney, H., Osiak, M., O’Dwyer, C., and Ryan, K.M., High-Performance Germanium Nanowire-Based Lithium-Ion Battery Anodes Extending over 1000 Cycles Through in Situ Formation of a Continuous Porous Network, Nano Lett., 2014, vol. 14, p. 716.
Silberstein, K.E., Lowe, M.A.,Richards, B., Gao, J., Hanrath, T., and Abruña, H.D., Operando X-ray Scattering and Spectroscopic Analysis of Germanium Nanowire Anodes in Lithium Ion Batteries, Langmuir, 2015, vol. 31, p. 2028.
Yuan, F.-W., Yang, H.-J., and Tuan, H.-Y., Alkanethiol-Passivated Ge Nanowires as High-Performance Anode Materials for Lithium-Ion Batteries: The Role of Chemical Surface Functionalization, ACS Nano, 2012, vol. 6, p. 9932.
Gu, J., Collins, S.M., Carim, A.I., Hao, X., Bartlett, B.M., and Maldonado, S., Template-free preparation of crystalline Ge nanowire film electrodes via an electrochemical liquid–liquid–solid process in water at ambient pressure and temperature for energy storage, Nano Lett., 2012, vol. 12, p. 4617.
Ma, L., Fahrenkrug, E., Gerber, E., Crowe, A.J., Venable, F., Bartlett, B.M., and Maldonado, S., High-Performance Polycrystalline Ge Microwire Film Anodes for Li Ion Batteries, ACS Energy Lett., 2017, vol. 2, p. 238.
Hao, J., Yang, Y., Zhao, J., Liu, X., Endres, F., Chi, C., Wang, B., Liu, X., and Li, Y., Ionic liquid electrodeposition of strain-released Germanium nanowires as stable anodes for lithium ion batteries, Nanoscale, 2017, vol. 9, p. 8481.
Chi, C., Hao, J., Liu, X., Ma, X., Yang, Y., Liu, X., Endres, F., Zhao, J., and Li, Y., UV-assisted, Template-free Electrodeposition of Germanium Nanowire Cluster Arrays from an Ionic Liquid for Anodes in Lithium-ion batteries, New J. Chem., 2017, vol. 41, p. 15210.
Mullane, E., Kennedy, T., Geaney, H., and Ryan, K.M., A Rapid, Solvent-Free Protocol for the Synthesis of Germanium Nanowire Lithium-Ion Anodes with a Long Cycle Life and High Rate Capability, ACS Appl. Mater. Interfaces, 2014, vol. 6, p. 18800.
Purbaix M. Atlas d’équilibres electrochimiques, Paris: Gauthier-Villars, 1963.
Carim, A.I., Collins, S.M., Foley, J.M., and Maldonado, S., Benchtop Electrochemical Liquid–Liquid–Solid Growth of Nanostructured Crystalline Germanium, J. Amer. Chem. Soc., 2011, vol. 133, p. 13292.
Fahrenkrug, E., Gu, J., Jeon, S., Veneman, P.A., Goldman, R.S., and Maldonado, S., Room-Temperature Epitaxial Electrodeposition of Single-Crystalline Germanium Nanowires at the Wafer Scale from an Aqueous Solution, Nano Lett., 2014, vol. 14, p. 847.
Громов, Д.Г., Павлова, Л.М., Савицкий, А.И., Трифонов, А.Ю. Исследование начальных стадий конденсации Ag и Au на поверхности аморфного углерода при термическом испарении в вакууме. ФТТ. 2015. Т. 57. С. 163. [Gromov, D.G., Pavlova, L.M., Savitskii, A.I., and Trifonov, A.Yu., Investigation of the early stages of condensation of Ag and Au on the amorphous carbon surface during thermal evaporation under vacuum, Phys. Solid State, 2015, vol. 57, p. 173.]
Гаврилин, И.М., Громов, Д.Г., Дронов, А.А., Дубков, С.В., Волков, Р.Л., Трифонов, А.Ю., Боргардт, Н.И., Гаврилов, С.А. Влияние температуры электролита на процесс катодного осаждения нитевидных наноструктур Ge из водных растворов на частицах In и Sn. ФТП. 2017. Т. 51. С. 1110. [Gavrilin, I.M., Gromov, D.G., Dronov, A.A., Dubkov, S.V., Volkov, R.L., Trifonov, A.Yu., Borgardt, N.I., and Gavrilov, S.A., Effect of electrolyte temperature on the cathodic deposition of Ge nanowires on in and Sn particles in aqueous solutions, Semiconductors, 2017, vol. 51, p. 1067.]
Kulova, T.L., Mironenko, A.A., Skundin, A.M., Rudy, A.S., Naumov, V.V., and Pukhov, D.E., Study of Silicon Composite for Negative Electrode of Lithium-Ion Battery, Int. J. Electrochem. Sci., 2016, vol. 11, p. 1370.
Lee, G.H., Shim, H.W., and Kimn, D.W., Superior long-life and high-rate Ge nanoarrays anchored on Cu/C nanowire frameworks for Li-ion battery electrodes, Nano Energy, 2015, vol. 13, p. 218.
Guo, W., Mei, L., Feng, Q., and Ma, J., Facile synthesis of Ge/C nanocomposite as superior battery anode material, Mater. Chem. Phys., 2015, vol. 168, p. 6.
Rudawski, N.G., Yates, B.R., Holzworth, M.R., Jones, K.S., Elliman, R.G., and Volinsky, A.A., Ion beam-mixed Ge electrodes for high capacity Li rechargeable batteries, J. Power Sources, 2013, vol. 223, p. 336.
Al-Obeidi, A., Kramer, D., Thompson, C.V., and Monig, R., Mechanical stresses and morphology evolution in germanium thin film electrodes during lithiation and delithiation, J. Power Sources, 2015, vol. 297, p. 472.
Laforge, B., Levan-Jodin, L., Salot, R., and Billard, A., Study of Germanium as Electrode in Thin-Film Battery, J. Electrochem. Soc., 2008, vol. 155, p. A181.
Yoon, T., Song, G., Harzandi, A.M., Ha, M., Choi, S., Shadman, S., Ryu, J., Bok, T., Park, S., and Kim, K.S., Intramolecular deformation of zeotype-borogermanate toward three-dimensional porous germanium anode for high-rate lithium storage, J. Mater. Chem. A, 2018, vol. 6. p. 15961. https://doi.org/10.1039/c8ta04626c
Yan, S., Song, H., Lin, S., Wu, H., Shi, Y.i., and Yao, J., GeO2 Encapsulated Ge Nanostructure with Enhanced Lithium-Storage Properties, Adv. Funct. Mater., 2019, vol. 29, p. 1807946. https://doi.org/10.1002/adfm.v29.810.1002/adfm.201807946
Zhang, S., Zheng, Y., Huang, X., Hong, J., Cao, B., Hao, J., Fan, Q., Zhou, T., and Guo, Z., Structural engineering of hierarchical micro-nanostructured Ge–C framework by controlling the nucleation for ultralong-life Li storage, Adv. Energy Mater., 2019, vol. 9, p. 1900081. https://doi.org/10.1002/aenm.v9.19
Fang, S., Shen, L., Li, S., Kim, G.-T., Bresser, D., Zhang, H., Zhang, X., Maier, J., and Passerini, S., Alloying reaction confinement enables high-capacity and stable anodes for lithium-ion batteries, ACS Nano, 2019, vol. 13, p. 9511. https://doi.org/10.1021/acsnano.9b04495
Shang, D., Wub, W., Guo, Y., Gu, J., Hua, F., Cao, Z., Li, B., and Yang, S., Room-temperature sodium thermal reaction towards electrochemically active metals for lithium storage, J. Colloid Interface Sci., 2019, vol. 551, p. 10. https://doi.org/10.1016/j.jcis.2019.04.100
Chen, Y., Ma, L., Shen, X., Ji, Z., Yuan, A., Xu, K., and Shah, S.A., In-situ synthesis of Ge/reduced graphene oxide composites as ultra high rate anode for lithium-ion battery, J. Alloys Comp., 2019, vol. 801, p. 90. https://doi.org/10.1016/j.jallcom.2019.06.074
Liu, F., Wang, Y., Shi, J., Lin, J., Zhou, W., and Pan, A., A new strategy to prepare Ge/GeO2-reduced graphene oxide microcubes for high-performance lithium-ion batteries, Electrochim. Acta, 2019, vol. 318, p. 314. https://doi.org/10.1016/j.electacta.2019.06.076
Fang, Y., Liu, R., Zeng, L., Liu, J., Xu, L., He, X., Huang, B., Chen, Q., Wei, M., and Qian, Q., Preparation of Ge/N, S co-doped ordered mesoporous carbon composite and its long-term cycling performance of lithium-ion batteries, Electrochim. Acta, 2019, vol. 318, p. 737. https://doi.org/10.1016/j.electacta.2019.06.123
Чуриков, А.В. Математика диффузии в приложении к литиевым электрохимическим системам. М.: Наука, 2015.
Тусеева, Е.К., Кулова, Т.Л., Скундин, А.М. Влияние температуры на поведение электродов из титаната лития. Электрохимия. 2018. Т. 54. С. 1135. [Tuseeva, E.K., Kulova, T.L., and Skundin, A.M., Temperature Effect on the Behavior of a Lithium Titanate Electrode Russ. J. Electrochem., 2018, vol. 54, p. 1186.]
Skundin, A., Kulova, T., Novikova, S., Chekannikov, A., and Kudryashova, Yu., Temperature effect on behavior of electrodes based on sodium vanadophosphate, Int. J. Electrochem. Sci., 2018, vol. 13, p. 12118. https://doi.org/10.20964/2018.12.87
Wang, Y., Wang, P., Zhao, D., Hu B., Du, Y., Xu, H., and Chang, K., Thermodynamic description of the Ge–Na and Ge–K systems using the CALPHAD approach supported by first-principles calculations, CALPHAD: Computer Coupling of Phase Diagrams and Thermochemistry, 2012, vol. 37, p. 72.
Lu, X., Adkins, E.R., He, Y., Zhong, L., Luo, L., Mao, S.X., Wang, C.-M., and Korgel, B.A., Germanium as a Sodium Ion Battery Material: In Situ TEM Reveals Fast Sodiation Kinetics with High Capacity, Chem. Mater., 2016, vol. 28, p. 1236.
Li, W., Li, X., Yu, J., Liao, J., Zhao, B., Huang, L., Abdelhafiz, A., Zhang, H., Wang, J.-H., Guo, Z., and Liu, M., A self-healing layered GeP anode for high performance Li-ion batteries enabled by low formation energy, Nano Energy, 2019, vol. 61, p. 594.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия