Электрохимия, 2022, T. 58, № 11, стр. 723-733
Эффекты специфического взаимодействия (In–Ga)-электрода с молекулами 1-пропанола в плотной части двойного электрического слоя
В. В. Емец *
Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, корп. 4, Россия
* E-mail: Victoremets@mail.ru
Поступила в редакцию 14.02.2022
После доработки 22.04.2022
Принята к публикации 26.04.2022
- EDN: DYZTHY
- DOI: 10.31857/S0424857022110068
Аннотация
На жидких обновляющихся (In–Ga)- (14.2 ат. % In) и Hg-электродах с помощью моста переменного тока и методом струйчатого электрода получены кривые дифференциальной емкости и потенциалы нулевого заряда (ПНЗ) в растворах с различной концентрацией поверхностно-неактивного электролита в 1-пропаноле (1-PrOH) при 32°С. Показано, что структура двойного электрического слоя (ДЭС) на границах раздела (In–Ga)/(1-PrOH) и Hg/(1-PrOH) различается, что связано с влиянием природы металла как на хемосорбционное, так и на “физическое” взаимодействие металл–(1-PrOH). Переход от Hg к (In–Ga) сопровождается снижением расстояния ближайшего подхода диполей PrOH к поверхности металла и ростом хемосорбционного взаимодействия металл–(1-PrOH). Хемосорбция (1-PrOH) на (In–Ga)-электроде смещает ПНЗ в отрицательную сторону, что указывает на ориентацию хемосорбированных молекул (1-PrOH) отрицательным (кислородным) концом диполя к поверхности металла. Сопоставление экспериментальных результатов на (In–Ga)- и Hg-электродах в воде, MeOH, EtOH и (1-PrOH) показало, что замена одного из атомов водорода в молекуле воды на алифатический радикал при переходе к MeOH и последующее увеличение длины радикала при переходе к EtOH и (1-PrOH) влияют на форму зарядовой зависимости параметров, отражающих хемосорбционную специфику контакта металл–растворитель. С ростом длины алифатического радикала хемосорбционное взаимодействие (In–Ga)–спирт проявляется при менее отрицательных значениях плотности заряда, а значения хемосорбционного скачка потенциала растворителя нарастают в ряду H2O < MeOH < EtOH < (1-PrOH) с ростом донорного числа растворителя. Установлено, что длина алифатического радикала в молекуле спирта не влияет на параметры, характеризующие “физическую” специфику контакта металл–растворитель, но изменяет окно зарядов, в котором эти параметры регистрируются. Получены кривые дифференциальной емкости и потенциалы нулевого заряда (In–Ga)-электрода в 0.1М растворах LiCl, LiBr и LiI в 1-пропаноле. Показано, что специфическая адсорбция галогенид-анионов на границе раздела (In–Ga)/(1-PrOH) растет в последовательности Cl– < Br– < I–.
ВВЕДЕНИЕ
Исследования структуры двойного электрического слоя (ДЭС) на различных металлических электродах в алифатических спиртах представляют значительный интерес для фундаментальной электрохимии, так как позволяют подробно исследовать закономерности некулоновского (специфического) взаимодействия металл–растворитель не только вблизи потенциала нулевого заряда (ПНЗ), но и в области больших отрицательных зарядов. Такая возможность в случае спиртов возникает из-за быстрого нарастания емкости плотного слоя по мере сдвига в область больших отрицательных зарядов. В ряду растворителей такое поведение емкости является редким. Ранее структура ДЭС на жидких капающих Hg- и (In–Ga)-электродах (14.2 ат. % In) была изучена в метанольных (MeOH) и этанольных (EtOH) растворах поверхностно-неактивного электролита [1–3]. Данная работа продолжает рассмотрение контакта металл/алифатический спирт и посвящена исследованию структуры ДЭС на указанных электродах в 1-пропиловом спирте (1-РrОН). Ранее структура ДЭС в (1-РrОН) исследовалась только на Hg- [4] и Вi- [5] электродах. По своим двойнослойным характеристикам Hg- и Вi-электроды близки и проявляют слабое хемосорбционное взаимодействие с молекулами (1-РrОН) в плотной части ДЭС. Это не позволяет проследить за влиянием природы металла на структуру ДЭС. Исследование двойнослойных характеристик границ раздела Hg/(1-PrOH) и (In–Ga)/(1-PrOH) представляет интерес из-за существенно различной лиофильности этих электродов. Сопоставление результатов по структуре ДЭС в (1-РrОН) с соответствующими результатами, полученными для границ с MeOH и EtOH, позволит проследить также за влиянием длины радикала в молекуле спирта на характер зависимости параметров, характеризующих специфическое взаимодействие металл–растворитель, от плотности заряда электрода. Отметим, что In в сплаве с Ga является поверхностно-активным компонентом, формирует поверхностный слой электрода, и эвтектический сплав (In–Ga) (14.2 ат. % In) по своим электрохимическим свойствам близок к свойствам чистого In [6].
МЕТОДИКА ЭКСПЕРИМЕНТА
В целом методика эксперимента в (1-РrОН) не отличалась от методики, использованной при изучении ДЭС в метаноле (МеОН) [1, 2] и этаноле (EtOH) [3]. 1-Пропанол марки “х. ч.” осушался свежепрокаленными при 350°С молекулярными ситами 4Å и перегонялся при пониженном давлении (50–60 мм рт. ст.) в атмосфере гелия высокой чистоты. Средняя фракция растворителя повторно перегонялась над свежепрокаленной при 1000°С окисью кальция. Непосредственно перед электрохимическими измерениями (1-PrOH) перегонялся третий раз. Исследование ДЭС проводились на капающих электродах методом дифференциальной емкости с помощью моста переменного тока. Время баланса моста задавали и определяли с точностью 10–4 с с помощью прибора, разработанного в ИФХЭ им. А.Н. Фрумкина РАН. Для приготовления (In–Ga)-сплава использовали Ga марки ГЛ000 (99.9999 вес. % Ga) и In марки ИН 000 (99.9999 вес. % In). Для приготовления растворов использовали безводные соли LiC1O4, LiCl, LiBr и LiI фирмы Aldrich чистотой 99.99 мас. %. Перед измерениями из растворов удаляли кислород путем продувки чистым сухим водородом, дополнительно осушенным пропусканием через ловушку с жидким азотом. Капающий и струйчатый электроды находились в одной ячейке. Одновременно с измерением С,Е-кривых (С – дифференциальная емкость, Е – потенциал) с помощью струйчатого электрода определялся потенциал нулевого заряда, Еq =0. Значения потенциала струйчатого электрода, Ej, полученные до и после записи C,E-кривой, совпадали. На (In–Ga) и Hg измерения Еj и запись С,Е-кривых проводились в абсолютно одинаковых экспериментальных и методических условиях. Экспериментальные данные хорошо воспроизводились. Электродом сравнения служил водный насыщенный каломельный электрод (нас. к. э). Скачок потенциала на границе вода/(1-РrОН) был одинаковым и не учитывался. С,Е-кривые в 0.25 М растворах LiClO4 в (1-РrОН) на каждом из металлов измеряли при разных частотах переменного тока (в интервале 220–2200 Гц). Измерения показали, что в (1-РrОН), так же как и в МеOH [1, 2] и EtOH [3], вблизи Ej и в широкой области потенциалов отрицательнее Еj частотная дисперсия емкости на исследованных электродах отсутствует. При потенциалах на 60–70 мВ положительнее Еj на (In–Ga) (в отличие от Hg-электрода) появляется дисперсия емкости, обусловленная растворением электрода.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Характеристики ДЭС Hg- и (In–Ga)-электродов в 1-пропанольных растворах поверхностно-неактивного электролита
Параметры специфического взаимодействия (In–Ga)–(1-PrOH) удобно оценивать относительно Hg-электрода, обладающего минимальным хемосорбционным взаимодействием с различными растворителями [1–3]. На (In–Ga)- и Hg-электродах в одинаковых экспериментальных условиях при 32°С были определены потенциалы струйчатого электрода и записаны С,Е-кривые в 1-пропанольных растворах с различной концентрацией LiClO4 (рис. 1 и 2). В разбавленных растворах вблизи Еj на С,Е-кривых обоих металлов наблюдается минимум, глубина которого увеличивается по мере разбавления раствора. На (In–Ga)-электроде четкий минимум на С,Е-кривых проявляется в 0.02 и 0.012 М растворах LiClO4 (рис. 2). Потенциал минимума, Еmin, практически совпадает с Еj. Обе величины не зависят от концентрации электролита. На Hg-электроде, в отличие от (In–Ga), в 0.02 М растворе LiClO4 минимум слабо выражен и размыт. Четкий минимум проявляется только в 0.012 М растворе LiClO4. Потенциал этого минимума практически совпадает с Еj. Величина Еj Hg-электрода не зависит от концентрации электролита и для 0.1, 0.05, 0.02 и 0.012 М LiClO4 составляет 0.272, 0.272, 0.273 и 0.273 В соответственно. Из полученных данных следует, что на (In–Ga)- и Hg-электродах анион ${\text{ClO}}_{4}^{ - }$ поверхностно-неактивен и что минимум на С,Е-кривых вблизи Еj обусловлен диффузностью ДЭС, а совпадающие значения Еmin и Еj соответствуют потенциалу нулевого заряда металла, Еq = 0 (ПНЗ), не искаженному специфической адсорбцией ионов. Сопоставление рис. 1 и 2 показывает, что влияние концентрации раствора на форму С,Е-кривых вблизи Еj зависит от природы металла и его взаимодействия с растворителем в плотной части ДЭС. То как изменяется форма С,Е-кривых Hg-электрода на рис. 1 при разбавлении раствора можно связать с влиянием 2х факторов: 1) с низкими значениями емкости плотной части ДЭС и 2) с ее быстрым ростом вблизи q = 0. Тот факт, что на (In–Ga)-электроде диффузный минимум на С,Е-кривых начинает проявляться при более высоких концентрациях электролита и оказывается более ярко выраженным (рис. 2), чем на Hg-электроде (рис. 1), указывает на более высокие значения емкости плотной части ДЭС на границе (In‒Ga)/(1-PrOH) вблизи ПНЗ по сравнению с границей Hg/(1-PrOH).
Рис. 1.
Кpивые диффеpенциальной емкости на Hg-электроде в 1-пропанольных pаствоpах LiClO4 pазличных концентpаций, M: 1 – 0.1; 2 – 0.05; 3 – 0.02; 4 – 0.012. Пунктиp – pасчет по теоpии ГЧГ на основе данных по емкости в 0.1 М pаствоpе LiClO4. Вертикальная пунктирная линия соответствует Еj.

Рис. 2.
Кpивые диффеpенциальной емкости на (In–Ga)-электроде в 1-пропанольных pаствоpах LiClO4 pазличных концентpаций, M: 1 – 0.25; 2 – 0.1; 3 – 0.05; 4 – 0.02; 5 – 0.012. Пунктиp – pасчет по теоpии ГЧГ на основе данных по емкости в 0.1 М pаствоpе LiClO4. Вертикальная пунктирная линия соответствует Еj.

В области ${{E}_{{q \ll 0}}}$ на обоих электродах при уменьшении концентрации LiClO4 величина дифференциальной емкости немного снижается на 0.2–0.3 мкФ/см2 (рис. 1 и 2). Такое поведение дифференциальной емкости непосредственно вытекает из теории ГЧГ при отсутствии специфической адсорбции ионов и впервые было продемонстрировано Грэмом [7]. Таким образом, на исследованных границах раздела катионы Li+, как и анионы ${\text{ClO}}_{4}^{ - },$ являются поверхностно-неактивными.
На рис. 1 и 2 также видно, что на обоих электродах в (1-PrOH), по мере отклонения от Еj в сторону более отрицательных потенциалов, на С,Е-кривых емкость сначала снижается, проходит через минимальное значение, а затем начинает возрастать. Рост емкости на Hg-электроде наблюдается при потенциалах отрицательнее –0.7 В, а на (In–Ga)-электроде при потенциалах отрицательнее –1.3 В. Аналогичное поведение емкости наблюдалось на этих электродах в MeOH [1, 2] и EtOH [3]. Природу этого явления можно объяснить электрострикцией диполей спиртов в плотной части ДЭС. Электрострикция связана с тем, что электрическое поле, напряженность которого увеличивается по мере увеличения отрицательного значения заряда, стремится уменьшить расстояние между разноименно заряженными обкладками в плотной части ДЭС. В результате диполи (1-PrOH) начинают переходить от преимущественно вертикальной к более горизонтальной ориентации, толщина плотного слоя уменьшается, что приводит к росту емкости.
Из-за относительно невысокой диэлектрической постоянной (1-РrОН), значение которой при 25°С составляет 20.1 [8], при расчете характеристик диффузного слоя в (1-РrОН), так же как и в EtOH [3], необходим учет степени диссоциации электролита α. Отклонение α от единицы связано с образованием ионных пар. В настоящей работе для расчета α была использована термодинамическая константа ассоциации Kas, определенная для 1-пропанольных растворов LiClO4 в работе [9] и равная 128. Значение α для каждой концентрации электролита, с, рассчитывалось из уравнения
(1)
${{K}_{{{\text{as}}}}} = {{\left( {1 - \alpha } \right)} \mathord{\left/ {\vphantom {{\left( {1 - \alpha } \right)} {{{\alpha }^{2}}\gamma _{ \pm }^{2}}}} \right. \kern-0em} {{{\alpha }^{2}}\gamma _{ \pm }^{2}}}c.$Все измерения в настоящей работе проведены при температуре 32°С. Значения диэлектрической постоянной (ε) при 32°С, необходимые при расчете емкости диффузной части ДЭС, были оценены исходя из эмпирической зависимости ε от температуры, которая для (1-PrOH) имеет вид [8]:
Рассчитанное по уравнению (2) значение ε при 32°С в (1-PrOH) равняется 19.2 (здесь Т – температура в градусах Кельвина).
Для обоих электродов была проведена проверка применимости теории Гуи–Чапмена–Грэма [11–13] (ГЧГ). Из рис. 1 и 2 видно, что для (In–Ga)- и Hg-электродов рассчитанные из С,Е-кривых в 0.1 М растворах LiClO4 по методу Грэма [13] С,Е-кривые в растворах различной концентрации близки к соответствующим экспериментальным кривым как вблизи ПНЗ, так и в области больших отрицательных потенциалов. Применимость теории ГЧГ к исследованным границам раздела является дополнительным доказательством поверхностной неактивности ${\text{ClO}}_{4}^{ - }$- и Li+-ионов. Отсюда следует, что рассчитанные по теории ГЧГ Ci,q-кривые (In–Ga)- и Hg-электродов (Ci – емкость плотной части ДЭС, q – плотность заряда) не искажены адсорбцией ионов, а их различие отражает специфику контакта этих металлов с молекулами (1-PrOH) в плотной части ДЭС.
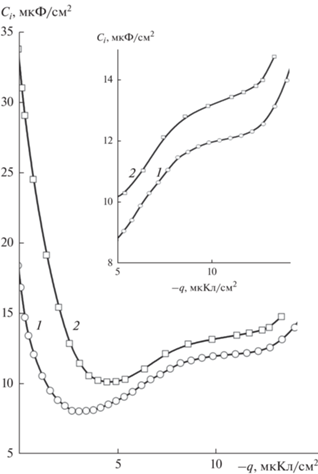
На рис. 3 сопоставлены Ci,q-кривые (In–Ga)- и Hg-электродов в (1-РrОН), рассчитанные по теории ГЧГ [11–13] из соответствующих С,Е-кривых в 0.1 М LiClO4. Плотность заряда рассчитывали интегрированием С,Е-кривых от ПНЗ. Видно, что емкость на (In–Ga)-электроде выше емкости Hg-электрода как вблизи q = 0, так и в области q $ \ll $ 0. Врезка на рис. 3 показывает область q $ \ll $ 0 более подробно. Разность емкостей плотного слоя между (In–Ga)- и Hg-электродами при q = = ‒13 мкКл/см2 составляет 1.6 мкФ/см2, по мере уменьшения отрицательного заряда постепенно снижается и при q = –6 мкКл/см2 составляет около 1 мкФ/см2, а далее по мере приближения к q = 0 резко увеличивается. Зависимость емкости плотной части ДЭС от природы металла свидетельстивует о специфическом взаимодействии металл–(1-PrOH). Отметим, что наблюдаемая на рис. 3 в области q $ \ll $ 0 наклонная площадка является отличительной особенностью Ci,q-кривых в (1-PrOH) по сравнению с MeOH и EtOH, где такая площадка отсутствует и емкость по мере увеличения отрицательного значения q нарастает более быстро [1, 2].
Специфическое взаимодействие (In–Ga)-электрода с молекулами 1-пропанола в плотной части ДЭС
В работах [14–19] нами было установлено, что зависимость Ci,q-кривых от природы металла в общем случае отражает 2 вклада в специфическое взаимодействие металл–растворитель: хемосорбционный и “физический”. Для количественной оценки параметров хемосорбционного взаимодействия необходимо разделить эти вклады.
В рамках современных представлений о структуре ДЭС, развитых в работах [20–22], емкость плотной части ДЭС Сi содержит две составляющие. Первая – вклад металла Сm, обусловленный выходом электронной плотности металла за пределы ионного остова и зазором между ионным остовом и молекулами растворителя. Вторая составляющая – это вклад со стороны раствора Сs, обусловленный диполями растворителя в плотной части ДЭС и зависимостью их ориентации от q. Величины Сi, Сm и Сs связаны уравнением
Согласно [14–19], в ряду металлов, контактирующих с одним и тем же раствором, разность обратных емкостей между Hg и металлом М при q = = const, $\Delta _{{\text{M}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}}$ = ${{\left( {С_{i}^{{--1}}} \right)}^{{{\text{Hg}}}}}$ – ${{\left( {С_{i}^{{--1}}} \right)}^{{\text{M}}}},$ с учетом уравнения (3) можно представить в виде
(4)
$\Delta _{{\text{M}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}} = {{\left[ {\Delta _{{\text{M}}}^{{{\text{Hg}}}}C_{{\text{m}}}^{{ - 1}} + \Delta _{{\text{M}}}^{{{\text{Hg}}}}C_{{\text{s}}}^{{ - 1}}} \right]}_{{{\text{chem}}}}} + {{\left( {\Delta _{{\text{M}}}^{{{\text{Hg}}}}C_{{\text{m}}}^{{ - 1}}} \right)}_{{{\text{phys}}}}}.$Следует отметить, что для расчета $\Delta _{{\text{M}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}},$q-кривых не требуется предварительно рассчитывать соответствующие Ci,q-кривые по теории ГЧГ [11–13], а достаточно использовать экспериментальные C,q-кривые металлов в 0.1 М растворах поверхностно-неактивного электролита. При вычитании из C–1,q-кривой Hg C–1,q-кривой металла М вклад емкости диффузной части ДЭС сокращается и $\Delta _{{\text{M}}}^{{{\text{Hg}}}}{{C}^{{ - 1}}}$ = $\Delta _{{\text{M}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}}.$ Анализ $\Delta _{{\text{M}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}},$q-кривых для растворителей с невысокой диэлектрической постоянной имеет преимущество перед анализом Ci,q-кривых, так как позволяет избежать ошибок при расчете Ci,q-кривых по теории ГЧГ, связанных с возможными неточностями оценки спепени диссоциации электролита.
На рис. 4 представлена $\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}},$q-кpивая, характеризующая специфику контакта (1-РrОН) с (In–Ga) относительно Hg-электрода (кривая 4). Видно, что величина $\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}}$ в области отрицательных зарядов от –14 до q1 = –6 мкКл/см2 практически не зависит от величины заряда. В рамках модельного подхода [16–18] это указывает на отсутствие хемосорбционной специфики контакта Hg и (In–Ga) с (1-PrOH). Диполи (1-PrOH) в интервале зарядов –14 до –6 мкКл/см2 ориентированы на Hg и (In–Ga) одинаковым образом. В этой области зарядов ${{\left( {\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}}} \right)}_{{{\text{chem}}}}}$ = 0 и, следовательно, в соответствии с уравнением (2), ${{\left( {\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}}} \right)}_{{q \leqslant q1}}}$ = ${{\left( {\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}C_{{\text{m}}}^{{ - 1}}} \right)}_{{{\text{phys}}}}}$ = 0.008 см2/мкФ. Эта величина пропорциональна разности расстояний ближайшего подхода диполей (1-РrОН) к поверхности Hg и (In–Ga) и характеризует “физическую” специфику контакта этих металлов с молекулами (1-РrОН) в плотной части ДЭС. Тот факт, что в области q $ \ll $ 0 значения Ci на (In–Ga) выше, чем на Hg (рис. 3), показывает, что диполи (1-PrOH) в плотном слое подходят к поверхности (In–Ga) на более близкое расстояние, чем к поверхности Hg. Как уже отмечалось, природа этого эффекта может быть связана с неодинаковым выходом электронной плотности Hg и (In–Ga) за пределы их ионных остовов, что влияет на некулоновский потенциал взаимодействия металла с молекулами растворителя в плотном слое [14–22].
Рис. 4.
$\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}},$q-кpивые в (1-PrOH), H2O, MeOH, EtOH.

В области q > q1 = –6 мкКл/см2 по мере уменьшении отрицательного значения q величина $\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}}$ превышает значение ${{\left( {\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}}} \right)}_{{q \leqslant q1}}}$ и начинает существенно зависеть от величины q: быстро возрастает, проходит через максимум, а затем снижается (рис. 4). Это в рамках модельного подхода [16–18] однозначно свидетельствует о хемосорбционном взаимодействии (In–Ga)-(1-РrОН), энергия которого увеличивается по мере приближения к q = 0 и далее с ростом положительного значения q. Хемосорбция растворителя связана с донорно-акцепторным взаимодействием кислородного атома в молекуле (1-РrОН), на котором сосредоточен отрицательный заряд с акцепторными уровнями (In–Ga). Таким образом, q1 = –6 мкКл/см2 – это заряд, положительнее которого появляется хемосорбционное взаимодействие (In–Ga)–(1-РrОН). По мере уменьшения отрицательного значения q в интервале q > q1 это взаимодействие приводит к дополнительной переориентации молекул (1-РrОН) отрицательным концом диполя к поверхности металла и к возмущению (изменению) поверхностного потенциала металла [14–22]. Специфика контакта (In–Ga)-(1-PrOH) по сравнению с Hg–(1-PrOH) в области плотностей заряда q < q1 связана со специфическим “физическим” взаимодействием, а в области q > q1 одновременно и c “физическим” и с хемосорбционным взаимодействием металл–растворитель.
Таким образом, наблюдаемые на рис. 3 в области –6 мкКл/см2 < q ≤ 0 более высокие значения Ci на (In–Ga), по сравнению с Hg, отражают более близкий подход диполей (1-PrOH) к поверхности (In–Ga) и дополнительную переориентацию диполей растворителя в плотном слое за счет более сильного хемосорбционного взаимодействия (In–Ga)–(1-РrОН).
На рис. 5 сопоставлены q,Е-кривые (In–Ga)- и Hg-электродов в 0.1 М растворе LiClO4 в (1-PrOH) в широкой области q ≤ 0. Видно, что q,Е-кривая (In–Ga)-электрода смещена в сторону более отрицательных потенциалов по отношению к q,Е-кривой Hg-электрода. Смещение ПНЗ и связанное с ним смещение q,E-кривой по оси потенциалов при переходе от Hg к (In–Ga) вызвано изменением работы выхода электрона из металла и скачком потенциала, связанным с хемосорбционным взаимодействием (In–Ga)–(1-PrOH).
Рис. 5.
Зависимости плотности заpяда q от потенциала Е в 0.1 М растворе LiClO4 в (1-PrOH) на 1 – Hg и 2 – (In–Ga), 3 – q,Е-кривая (In–Ga) при отсутствии хемосорбции (1-PrOH).

Из q,E-кривых были определены скачки потенциала, количественно характеризующие специфику контакта металл–растворитель на границе (In–Ga)/(1-РrОН) относительно границы Hg/(1-РrОН): 1) разность потенциалов между Hg и (In–Ga) при q = 0, $\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}{{E}_{{q\,\, = \,\,0}}}$ = $E_{{q\,\, = \,\,0}}^{{{\text{Hg}}}}$ – $E_{{q\,\, = \,\,0}}^{{{\text{(In--Ga)}}}}$ (разность ПНЗ), и при q* = –10 мкКл/см2, $\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}{{E}_{{q*}}}$ = $E_{{q*}}^{{{\text{Hg}}}}$ – $E_{{q*}}^{{{\text{(In}} - {\text{Ga)}}}},$ где q* – выбранный заряд в области q ≤ q1, отвечающий отсутствию хемосорбционного взаимодействия металл–растворитель; 2) разность потенциалов между металлами при q = 0 при отсутствии хемосорбционого взаимодействия (In–Ga)–(1-РrОН): ${{(\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}{{E}_{{q\,\, = \,\,0}}})}^{\# }}$ = = $\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}{{E}_{{q*}}}$ + $q{\text{*}}{{\left( {\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}C_{m}^{{ - 1}}} \right)}_{{{\text{phys}}}}};$ 3) хемосорбционный скачок потенциала на границе (In–Ga)/(1-РrОН), ($\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}$Echem)q= 0 = $\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}{{E}_{{q\,\, = \,\,0}}}$ – ‒ ${{\left( {\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}{{E}_{{q\,\, = \,\,0}}}} \right)}^{\# }}.$ Полученные параметры приведены в табл. 1, где видно, что ПНЗ (In–Ga) за счет хемосорбционного скачка потенциала ${{(\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}{{E}_{{{\text{chem}}}}})}_{{q\,\, = \,\,0}}}$ сдвигается на 0.155 В в отрицательную сторону, что указывает на ориентацию хемосорбированных молекул (1-РrОН) отрицательным (кислородным) концом диполя к поверхности металла. Хемосорбированные диполи (1-РrОН) появляются в плотной части ДЭС при зарядах положительнее q1 = –6 мкКл/см2, а следовательно, в интервале –6 мкКл/см2 < q < 0 они ориентированы отрицательным концом диполя к отрицательно заряженной поверхности (In–Ga)-электрода, что подтверждает некулоновскую природу их взаимодействия с поверхностью металла. На рис. 5 приведена q,Е-кривая (In–Ga) при отсутствии хемосорбции (1-PrOH) (кривая 3). Отклонение кривой 3 от кривой 1 по оси потенциалов вызвано изменением работы выхода электрона из металла при переходе от Hg к (In–Ga). Отклонение экспериментальной q,Е-кривой (In–Ga) (кривая 2) от кривой 3 характеризует изменение хемосорбционного скачка потенциала растворителя с изменением плотности заряда электрода. Согласно [14–17, 19], величина ${{\left( {\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}{{E}_{{q\,\, = \,\,0}}}} \right)}^{\# }}$ соответствует величине “исправленной разности электрохимических работ выхода электрона” из Hg и (In–Ga) ${{\left( {{{\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}{{W}_{e}}} \mathord{\left/ {\vphantom {{\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}{{W}_{e}}} {{{{\text{e}}}_{{\text{0}}}}}}} \right. \kern-0em} {{{{\text{e}}}_{{\text{0}}}}}}} \right)}_{{{\text{el}}}}}$ (где e0 – заряд электрона). Значение ${{\left( {\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}{{W}_{e}}} \right)}_{{{\text{el}}}}}$ не зависит от природы растворителя (табл. 1) и близко к величине разности работ выхода электрона из Hg и In в вакуум, которая составляет 0.42 эВ [24].
Таблица 1.
Сопоставление параметров ДЭС на (In–Ga)-электроде в растворе поверхностно-неактивного электролита в (1-PrOH), воде, MeOH и EtOH
| Растворитель | $\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}{{E}_{{q\,\, = \,\,0}}}$, В | $\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}{{E}_{{q*}}}$, В | ${{{\text{(}}\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}C_{{\text{m}}}^{{ - {\text{1}}}}{\text{)}}}_{{{\text{phys}}}}}$, см2/мкФ |
${{(\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}{{E}_{{q\,\, = \,\,0}}})}^{\# }}$ = = ${{{\text{(}}\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}{{W}_{e}}{\text{/}}{{{\text{e}}}_{{\text{0}}}}{\text{)}}}_{{e{\text{l}}}}}$, В | ($\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}$Echem)q = 0, В |
|---|---|---|---|---|---|
| (1-PrOH) | 0.545 | 0.31 | 0.008 | 0.39 | 0.155 |
| H2O [16] | 0.48 | 0.28 | 0.0075 | 0.39 | 0.09 |
| MeOH [2] | 0.53 | 0.31 | 0.008 | 0.39 | 0.14 |
| EtOH [3] | 0.54 | 0.31 | 0.008 | 0.39 | 0.15 |
Специфическое взаимодействие (In–Ga)–растворитель в ряду вода, MeOH, EtOH и (1-PrOH)
На рис. 4 $\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}},$q-кpивая в (1-PrOH) сопоставлена с аналогичными кривыми в воде, MeOH [2] и EtOH [3]. Видно, что замена водородного атома на радикал при переходе от воды к MeOH и дальнейшее увеличение длины радикала в ряду спиртов смещает окно зарядов q ≤ q1, в котором отсутствует хемосорбционное взаимодействие металл–растворитель, в область менее отрицательных q. Для воды это интервал плотностей зарядов от –19 до –13 мкКл/см2, для MeOH от –14 до –9 мкКл/см2 для EtOH от –14 до –7 мкКл/см2 для (1-PrOH) от –13 до –6 мкКл/см2. Интервалы не только смещаются, но и перекрываются, что позволяет проследить за поведением величины ${{\left( {\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}C_{{\text{m}}}^{{ - 1}}} \right)}_{{{\text{phys}}}}}$ в широкой области плотностей зарядов. Из табл. 1 и рис. 4 видно, что значения ${{\left( {\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}C_{{\text{m}}}^{{ - 1}}} \right)}_{{{\text{phys}}}}}$ = ${{\left( {\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}}} \right)}_{{q \leqslant q1}}},$ полученные в (1-РrОН), близки к соответствующим значениям в воде, МеОН [2] и EtOH [3]. Таким образом, величина ${{\left( {\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}C_{{\text{m}}}^{{ - 1}}} \right)}_{{{\text{phys}}}}}$ практически не меняется в интервале зарядов от –19 до –6 мкКл/см2. Горизонтальная пунктирная линия на рис. 4 показывает среднее значение ${{\left( {\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}C_{{\text{m}}}^{{ - 1}}} \right)}_{{{\text{phys}}}}}$ в воде и спиртах. Совокупность результатов, полученных нами на (In–Ga) в воде, MeOH [2], EtOH [3] и (1‑PrOH), подтверждает вывод о том, что величина ${{\left( {\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}C_{{\text{m}}}^{{ - 1}}} \right)}_{{{\text{phys}}}}}$ является характеристикой металла, которая слабо зависит как от плотности заряда, так и от химической природы растворителя, и в первом приближении может рассматриваться как константа (табл. 1). Учет ${{\left( {\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}C_{{\text{m}}}^{{ - 1}}} \right)}_{{{\text{phys}}}}}$ необходим для правильного расчета хемосорбционного скачка потенциала в плотном слое, который является количественной мерой лиофильности металла по отношению к растворителю.
Из табл. 1 также следует, что полученные в (1‑РrОН) значения скачков потенциала, характеризующих физическую специфику контакта металл/растворитель: $\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}{{E}_{{q*}}}$ и ${{\left( {\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}{{E}_{{q\,\, = \,\,0}}}} \right)}^{\# }},$ близки к соответствующим значениям в воде [16], MeOH [2] и ЕtOН [3]. Это подтверждает отсутствие хемосорбционного взаимодействия (In–Ga) с этими растворителями в области q ≤ q1 и показывает, что величины $\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}{{E}_{{q*}}}$ и ${{\left( {\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}{{E}_{{q\,\, = \,\,0}}}} \right)}^{\# }},$ как и ${{\left( {\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}C_{{\text{m}}}^{{ - 1}}} \right)}_{{{\text{phys}}}}},$ зависят только от химической природы (In–Ga). Отметим, что величина ${{\left( {\Delta _{{\text{M}}}^{{{\text{Hg}}}}{{E}_{{q\,\, = \,\,0}}}} \right)}^{\# }}$ является важной характеристикой металла и соответствует величине “исправленной разности электрохимических работ выхода электрона” из Hg и металла М ${{\left( {{{\Delta _{{\text{M}}}^{{{\text{Hg}}}}{{W}_{e}}} \mathord{\left/ {\vphantom {{\Delta _{{\text{M}}}^{{{\text{Hg}}}}{{W}_{e}}} {{{e}_{0}}}}} \right. \kern-0em} {{{e}_{0}}}}} \right)}_{{{\text{el}}}}}$ [16, 17, 23]. Высокая точность определения величины работы выхода электрона из Hg в вакуум, ${{W_{e}^{{{\text{Hg}}}}} \mathord{\left/ {\vphantom {{W_{e}^{{{\text{Hg}}}}} {{{e}_{0}}}}} \right. \kern-0em} {{{e}_{0}}}}$ = 4.5 В [24, 25], и величины ${{\left( {{{\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}{{W}_{e}}} \mathord{\left/ {\vphantom {{\Delta _{{{\text{(In--Ga)}}}}^{{{\text{Hg}}}}{{W}_{e}}} {{{e}_{{\text{0}}}}}}} \right. \kern-0em} {{{e}_{{\text{0}}}}}}} \right)}_{{e{\text{l}}}}}$ = ${{\left( {\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}{{E}_{{q\,\, = \,\,0}}}} \right)}^{\# }}$ (табл. 1) позволяет с высокой точностью определять значение работы выхода электрона из (In‒Ga) по соотношению ${{W_{e}^{{{\text{(In}} - {\text{Ga)}}}}} \mathord{\left/ {\vphantom {{W_{e}^{{{\text{(In}} - {\text{Ga)}}}}} {{{e}_{0}}}}} \right. \kern-0em} {{{e}_{0}}}}$ = ${{W_{e}^{{{\text{Hg}}}}} \mathord{\left/ {\vphantom {{W_{e}^{{{\text{Hg}}}}} {{{e}_{0}}}}} \right. \kern-0em} {{{e}_{0}}}}$ + ${{\left( {{{\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}{{W}_{e}}} \mathord{\left/ {\vphantom {{\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}{{W}_{e}}} {{{e}_{{\text{0}}}}}}} \right. \kern-0em} {{{e}_{{\text{0}}}}}}} \right)}_{{e{\text{l}}}}}$ = = 4.11 В. Полученный результат хорошо согласуется с величиной работы выхода электрона из индия в вакуум, которая составляет 4.08 эВ [26].
Как видно из рис. 4, в области зарядов q > q1 в воде, MeOH, EtOH, как и в (1-PrOH), наблюдается быстрый рост значений $\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}}$ по сравнению с значениями ${{\left( {\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}}} \right)}_{{q \leqslant q1}}},$ что указывает на хемосорбционное взаимодействие (In–Ga)–растворитель в плотной части ДЭС. Значения q1 зависят от природы растворителя и в ряду вода, MeOH, EtOH и (1-PrOH) составляют –13, –9, –7 и –6 мкКл/см2 соответственно. Из $\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}},$q-кривых можно рассчитать хемосорбционный скачок потенциала по соотношению ($\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}$Echem)q = 0 = = $\int_{q1}^{q = 0} {\left[ {\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}} - {{{\left( {\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}}} \right)}}_{{q \leqslant q1}}}} \right]} {\text{d}}q.$ Полученные таким способом значения ($\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}$Echem)q= 0 в воде, MeOH, EtOH и (1-PrOH) находятся в хорошем согласии с соответствующими значениями, полученными из q,E-кривых (табл. 1). Из табл. 1 видно, что переход от воды к спиртам при q = 0 сопровождается ростом величины ($\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}$Echem)q= 0, что коррелирует с ростом донорного числа растворителя (${\text{Д}}{\text{.Ч}}{{{\text{.}}}^{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = 18, Д.Ч.MeOH = 19, Д.Ч.EtOH = = 19.6, Д.Ч.PrOH = 19.8 [27]). При переходе от воды к MeOH наблюдается более значительный рост величины ($\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}$Echem)q= 0 с ростом Д.Ч. Углеводородный радикал в молекуле MeOH, являясь донором электронной плотности, увеличивает электронную плотность на кислородном атоме, что способствует усилению хемосорбционного взаимодействия (In–Ga)–растворитель. С ростом длины алифатического радикала в ряду спиртов вклад этого эффекта нарастает медленно, что приводит к медленному росту величины ($\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}$Echem)q= 0. С ростом длины радикала могут также усиливаться эффекты, препятствующие хемосорбции растворителя на поверхности металла.
Из рис. 4 видно, что в ряду рассмотренных растворителей при замене водородного атома на радикал и увеличении его длины закономерно сдвигается заряд q1, соответствующий началу хемосорбции растворителя на (In–Ga), и меняется характер $\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}},$q-зависимости. В водных растворах хемосорбция растворителя на (In–Ga) начинает проявляться уже при зарядах положительнее q1 = –13 мкКл/см2, а $\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}},$q-кривая в области хемосорбции имеет пологий характер. При переходе к MeOH заряд начала хемосорбции q1 сильно сдвигается в сторону менее отрицательных зарядов, составляет –9 мкКл/см2, при этом $\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}},$q-кривая в области хемосорбции становится более крутой и проходит через максимум. Увеличение длины радикала при переходе к EtOH и далее к (1-PrOH) еще сильнее сдвигает заряд q1 в сторону менее отрицательных зарядов, при этом крутизна $\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}},$q-зависимости и значение в максимуме возрастает.
Такое поведение $\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}C_{i}^{{ - 1}},$q-кривых, по-видимому, связано с тем, что при переходе от воды к спиртам существенно снижается интермолекулярное взаимодействие диполей плотного слоя с ближайшими диполями объема раствора. Замена H-атома в молекуле воды на радикал при переходе к спиртам приводит к существенному снижению количества водородных связей в единице объема. Неспособность радикала в молекуле спирта к образованию интермолекулярной водородной связи обуславливает стремление объема раствора ориентировать поверхностные диполи спирта положительным концом по направлению к металлу, что препятствуют хемосорбционному взаимодействию металл–растворитель. Поэтому хемосорбция МеОН начинает проявляться при значительно менее отрицательных плотностях заряда, чем в воде. Увеличение длины радикала при переходе от МеОН к EtOH и далее к (1-РrОН) усиливает ориентирующее влияние диполей объема раствора по отношению к поверхностным диполям и способствует дальнейшему сдвигу q1 в сторону менее отрицательных значений. Это замедляет рост величины ($\Delta _{{{\text{(In}} - {\text{Ga)}}}}^{{{\text{Hg}}}}$Echem)q= 0 с ростом Д.Ч. в ряду спиртов (табл. 1) по мере увеличения длины радикала.
Специфическая адсорбция галогенид ионов из 0.1 М растворов на границе (In–Ga)/(1-PrOH)
С,Е-кривые и потенциалы струйчатого электрода для границы (In–Ga)/(1-PrOH) в 0.1 М растворах LiC1O4, LiCl, LiBr и LiI приведены на рис. 6. При переходе от поверхностно-неактивного электролита к LiCl, LiBr и LiI потенциал струйчатого электрода смещается в отрицательную сторону, а дифференциальная емкость возрастает, что указывает на специфическую адсорбцию анионов Hal– (Cl–, Br– и I–).
Рис. 6.
Кривые дифференциальной емкости на (In‒Ga)-электроде в 0.1 М (1-PrOH)-растворах: 1 – LiClO4, 2 – LiCl, 3 – LiBr, 4 – LiI. Вертикальные пунктирные линии соответствуют Еj.

Зная заряд в растворе LiC1O4 при потенциале слияния С,Е-кривых, методом обратного интегрирования были рассчитаны q,E-кривые в растворах, содержащих ионы Cl–, Br– и I– (рис. 7). Из q,E-кривых были определены значения (Eq = 0)Hal, которые находятся в хорошем согласии с соответствующими значениями Еj.
Рис. 7.
Зависимости плотности заpяда q от потенциала Е для (In–Ga)-электрода в (1-PrOH)-растворах: 1 – LiClO4, 2 – LiCl, 3 – LiBr, 4 – LiI.

Количественно об адсорбции Hal– на границе (In–Ga)/(1-PrOH) судили по смещению ПНЗ в 0.1 М растворах LiCl, LiBr и LiI (Eq = 0)Hal относительно ПНЗ в 0.1 М растворе поверхностно-неактивного электролита (Eq = 0)inact:
(5)
${{\left( {{{E}_{{{\text{ads}}}}}} \right)}_{{q\,\, = \,\,0}}} = {{\left( {{{E}_{{q\,\, = \,\,0}}}} \right)}^{{{\text{inact}}}}} - {{\left( {{{E}_{{q\,\, = \,\,0}}}} \right)}^{{{\text{Hal}}}}}.$Значения (Eads)q= 0, рассчитанные по уравнению (5), приведены в табл. 2. Видно, что на границе (In–Ga)/(1-PrOH) поверхностная активность галоидных ионов растет в последовательности Cl– < Br– < I–.
ЗАКЛЮЧЕНИЕ
Показано, что изменение химической природы электрода при переходе от границы раздела Hg/(1-PrOH) к (In–Ga)/(1-PrOH) сопровождается ростом емкости плотной части ДЭС как в области больших отрицательных плотностей заряда (q < q1 = –6 мкКл/см2), так и вблизи q = 0.
В области q ≤ –6 мкКл/см2 (от –14 до ‒6 мкКл/см2) проявляется “физическая” специфика контакта, связанная с различным некулоновским взаимодействием Hg и (In–Ga) с поверхностными диполями (1-PrOH) из-за неодинакового выхода электронной плотности металлов за пределы их ионных остовов. Это приводит к более близкому подходу диполей (1-PrOH) к поверхности (In–Ga), по сравнению с Hg, в плотной части ДЭС и вносит дополнительный вклад в “металлическую” составляющую емкости Сm.
В области q > –6 мкКл/см2 к “физической” специфике контакта добавляется хемосорбционное взаимодействие (In–Ga)–(1-PrOH), приводящее к дополнительной (по сравнению с Hg) переориентации диполей (1-PrOH) в плотном слое отрицательным концом диполя к поверхности металла за счет донорно-акцепторного взаимодействия кислородного атома в молекуле (1‑PrOH) с (In–Ga).
Показано, что замена водородного атома на радикал и увеличение его длины при переходе от воды к алифатическим спиртам меняет характер зарядовой зависимости параметров ДЭС, отражающих хемосорбционную специфику контакта металл–растворитель. Причина этого связана со стремлением диполей объема раствора ориентировать поверхностные диполи спиртов положительным концом к поверхности металла. Показано также, что длина радикала в молекуле алифатического спирта не влияет на параметры, характеризующие “физическую” специфику контакта металл/растворитель, но изменяет окно зарядов, в котором эти параметры регистрируются.
Получены параметры, характеризующие специфическую адсорбцию галоид-анионов на границе (In–Ga)/(1-PrOH). Показано, что поверхностная активность анионов растет в последовательности Cl– < Br– < I–.
Список литературы
Емец, В.В. Структура двойного электрического слоя на металлах подгруппы галлия в метанольном растворе поверхностно-неактивного электролита. Электрохимия. 1997. Т. 33. С. 1183. [Emets, V.V., Electrical double layer structure at the gallium metals in a methanol solution of a surface-inactive electrolyte, Russ. J. Eleсtrochem., 1997, vol. 33, p. 1097.]
Емец, В.В., Дамаскин, Б.Б., Казаринов, В.Е. Эффекты неодинакового подхода диполей метанола к поверхности ртути и к поверхности металлов подгруппы галлия. Электрохимия. 1997. Т. 33. С. 1104. [Emets, V.V., Damaskin, B.B., and Kazarinov, V.E., The effects of unequal approach of the methanol dipoles to the surfaces of mercury and the gallium group metals, Russ. J. Eleсtrochem., 1997, vol. 33, p. 1025.]
Емец, В.В. Модельное описание структуры двойного электрического слоя на ртути и металлах подгруппы галлия в этанольном растворе поверхностно–неактивного электролита. Электрохимия. 1997. Т. 33. С. 1189. [Emets, V.V., Modeling description of the electrical double layer structure at mercury and the gallium metals in an ethanol solution of a surface-inactive electrolyte, Russ. J. Eleсtrochem., 1997, vol. 33, p. 1103.]
Jurkiewicz-Herbich, M., Muszalska, A., Mohamed, M., and Jastrzebska, J., Analysis of the differential capacity of the mercury | simple alcohol solution interface, J. Electroanal. Chem., 1994, vol. 370, p. 165.
Вяэртныу, М.Г., Пальм, У.В. Изучение строения двойного электрического слоя на висмуте в 1-пропаноле. Электрохимия. 1978. Т. 14. С. 311.
Григорьев, Н.Б., Фатеев, С.А., Багоцкая, И.А. Строение двойного электрического слоя на эвтектическом сплаве In–Ga в воде и ацетонитриле. I. Влияние состава раствора на строение двойного электрического слоя в воде. Электрохимия. 1972. Т. 8. С. I525.
Grahame, D.C., Differential Capacity of Mercury in Aqueous Sodium Fluoride Solutions. I. Effect of Concentration at 25°, J. Amer. Chem. Soc., 1954, vol. 76, p. 4819.
Barthel, J., Wachter, R., and Gores, H.J., Modern Aspects of Electrochemistry, Ed. by B.E. Conway and J.O’M.Bockris. N.Y.: Plenum. Publ. Corp., 1979. no. 13, p. 1.
Вяэртныу, М.Г., Пальм, У.В. Строение двойного электрического слоя на висмуте в алифатических спиртах. Электрохимия. 1979. Т. 15. С. 591.
Измайлов, Н.А. Электрохимия растворов. М.: Химия, 1976. 488 с. [Izmailov, N.A., Electrochemistry of solutions (in Russian), M.: Khimiya, 1976. 488 p.]
Gouy, G., Sur la contribution de la charge electrique a la surface d’electrolyte, J. Phys. et radium., 1910, vol. 9, p. 457.
Chapman, D., A contribution of the charge to the theory of electrocapillarity, Phil. Mag., 1913, vol. 25, p. 475.
Grahame, D., The Electrical Double Layer and the Theory of Electrocapillarity, Chem. Rev., 1947, vol. 41, p. 441.
Emets, V.V. and Damaskin, B.B., Chemisorbtion interaction of liquid electrodes of gallium and In–Ga, Cd–Ga and Tl–Ga alloys with solvents in a wide range of their donor numbers, J. Electroanal. Chem., 2007, vol. 600, p. 191.
Емец, В.В., Дамаскин, Б.Б., Казаринов, В.Е. Строение двойного электрического слоя на металлах подгруппы галлия в различных растворителях с учетом электронной модели металлов. Электрохимия. 1995. Т. 31. С. 117. [Emets, V.V., Damaskin, B.B., and Kazarinov, V.E., Electrical double-layer structure on metals of the gallium subgroup in various solvents that takes into account the metal electronic configuration, Russ. J. Eleсtrochem., 1995, vol. 31, p. 103.]
Емец, В.В., Дамаскин, Б.Б., Казаринов, В.Е. Эффекты специфического взаимодействия металла с растворителем и составляющие адсорбционного скачка потенциала. Электрохимия. 1995. Т. 31. С. 787. [Emets, V.V., Damaskin, B.B., and Kazari-nov, V.E., Phenomenon of the specific interaction of metal with solvent and constituents of the adsorption potential drop, Russ. J. Eleсtrochem., 1995, vol. 31, p. 722.]
Емец, В.В., Дамаскин, Б.Б., Казаринов, В.Е. Составляющие адсорбционного скачка потенциала на Ga- и In–Ga-электродах в трех растворителях с учетом гидрофильности монокристаллической грани Ag(111). Электрохимия. 1996. Т. 32. С. 1146. [Emets, V.V., Damaskin, B.B., and Kazarinov, V.E., The components of the adsorption potential drop at the Ga and In–Ga electrodes in three solvents: A calculation with allowance for hydrophilicity of the Ag(111) single crystal face, Russ. J. Eleсtrochem., 1996, vol. 32, p. 1062.]
Емец, В.В., Дамаскин, Б.Б., Казаpинов, В.Е. Модифицированная модель контакта металл/растворитель с учетом гидрофильности монокристаллической грани Ag(111). Анализ емкости плотной части двойного электрического слоя на ртути, галлии и сплаве индий–галлий в трех различных растворителях. Электpохимия. 1996. Т. 32. С. 1424. [Emets, V.V., Damaskin, B.B., and Kazarinov, V.E., A modified model for the metal/solution interface, allowing for hydrophilicity of the Ag(111) single crystal face: An analysis of the capacitance intrinsic to the compact part of the electrical double layer at mercury, gallium, and an indium-gallium alloy in three different solvents, Russ. J. Eleсtrochem., 1996, vol. 32, p. 1313.]
Емец, В.В., Дамаскин, Б.Б., Казаринов, В.Е. Разность обратных емкостей между ртутью и металлами подгуппы галлия (Ga, In–Ga, Tl–Ga) при отсутствии хемосорбционного взаимодействия металл–растворитель в водных растворах сульфатов лития, натрия и калия. Электрохимия. 1999. Т. 35. С. 551. [Emets, V.V., Damaskin, B.B., and Kazari-nov, V.E., Difference between reciprocal capacitances on mercury and the gallium subgroup metals (Ga, In–Ga, Tl–Ga) in the absence of the metal-solvent chemisorption interaction in aqueous solutions of sulfates of lithium, sodium, and potassium, Russ. J. Eleсtrochem., 1999, vol. 35, p. 499.]
Amokrane, S. and Badiali, J.P., A new analysis of the differential capacitance of an ideally polarized electrode, J. Electroanal. Chem., 1989, vol. 266, p. 21.
Amokrane, S. and Badiali, J.P., A model for the determination of the distance of closest approch of a solvent molecule to a metal surface – application to a silver electrode, Electrochim. Acta, 1989, vol. 34, p. 39.
Amokrane, S. and Badiali, J.P., A new analysis of the differential capacitance of an ideally polarized electrode. Part II. Non aqueous solvents, J. Electroanal. Chem., 1991, vol. 297, p. 377.
Емец, В.В., Дамаскин, Б.Б., Казаpинов, В.Е. Разность потенциалов нулевого заряда при отсутствии хемосорбционного взаимодействия металл–растворитель между ртутью и металлами подгуппы галлия в различных растворителях. Электpохимия. 1999. Т. 35. С. 558. [Emets, V.V., Damaskin, B.B., and Kazarinov, V.E., Difference between potentials of zero charge in the absence of the metal-solvent chemisorption interaction of mercury and metals of the gallium subgroup in different solvents, Russ. J. Eleсtrochem., 1999, vol. 35, p. 505.]
Фрумкин, А.Н. Потенциалы нулевого заряда, М.: Наука, 1982. 259 с. [Frumkin, A.N., Zero-Charge Potentials (in Russian), M.: Nauka, 1982. p. 259.]
Дамаскин, Б.Б., Петрий, О.А., Цирлина, Г.А. Электрохимия. М.: Химия, 2001. 623 с. [Damaskin, B.B., Petrii, O.A., and Tsirlina, G.A. Electrochemistry (in Russian), M.: Khimiya, 2001. 623 p.]
Trasatti, S., Work function, electronegativity, and electrochemical behavior of metals. II. Potential of zero charge and “electrochemical” work function, J. Electroanal. Chem., 1971, vol. 33, p. 351.
Каpапетьян, Ю.А., Эйчис, В.Н. Физико-химические свойства электpолитных неводных pаствоpов, М.: Химия, 1989. С. 252. [Karapetyan, Yu.A. and Eichis, V.N. Physical and chemical properties of electrolyte non-aqueous solutions (in Russian), M.: Khimiya, 1989. p. 252.]
Дополнительные материалы отсутствуют.