Электрохимия, 2022, T. 58, № 6, стр. 314-322
Компакты из легированного бором синтетического алмаза: ускорение катодных реакций путем плазменной и электрохимической обработки электродов
А. Г. Кривенко a, *, Р. А. Манжос a, В. К. Кочергин a, А. С. Коткин a, Ю. В. Плесков b, М. Д. Кротова b, Е. А. Екимов c
a Институт проблем химической физики РАН
142432 Черноголовка, Россия
b Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, Россия
c Институт физики высоких давлений им. Л.Ф. Верещагина РАН
142190 Троицк, Россия
* E-mail: krivenko@icp.ac.ru
Поступила в редакцию 08.10.2021
После доработки 12.11.2021
Принята к публикации 26.11.2021
- EDN: COQXAJ
- DOI: 10.31857/S0424857022050073
Аннотация
Образцы алмазных компактов получали термобарической обработкой смесей графита и карбида бора в области термодинамической стабильности алмаза (при давлении 8–9 ГПа и температурах ∼2500 K). Поверхность легированного бором алмазного электрода-компакта модифицировали путем воздействия катодной, анодной и катодно-анодной электролизной плазмы, образующейся при подаче импульсов напряжения амплитудой до 300 В в водном растворе Na2SO4. Методом вращающегося дискового электрода установлено, что одна только обработка катодно-анодной плазмой приводит к незначительному каталитическому эффекту по отношению к реакции восстановления кислорода. Однако после катодного восстановления обработанного таким образом электрода он приобретает существенную электрокаталитическую активность, заключающуюся в преимущественном протекании восстановления O2 до H2O по четырехэлектронному механизму. В то же время катодная обработка модифицированных плазмой электродов не оказывает заметного влияния на константы скорости переноса электрона в окислительно-восстановительной системе [Ru(NH3)6]2+/3+, но приводит к заметному ее увеличению в системе [Fe(CN)6]4–/3–. Установлено, что наблюдаемый электрокаталитический эффект в реакции восстановления кислорода обусловлен образованием на поверхности легированного бором алмаза при комбинированном воздействии катодно-анодной плазмы и катодного потенциала хинонных групп, являющихся активными центрами для четырехэлектронного восстановления кислорода.
ВВЕДЕНИЕ
Легированный бором алмаз (BDD) был введен в качестве электродного материала в электрохимическую практику в 1987 г. [1]. Последующий прогресс в разработке высокоэффективных методов получения легированных алмазов позволил создать новую область электрохимии – электрохимию алмазных электродов. Проводящий алмаз с уровнем легирования бором ~5 × 1020 см–3 обладает рядом уникальных особенностей по сравнению с металлическими и другими углеродными электродами: широкое окно рабочих потенциалов (~3.2 В в водном растворе), низкий и стабильный емкостный ток, высокая устойчивость в кислой и щелочной среде при больших напряжениях и плотностях тока, биосовместимость и т.д. (см., например, обзоры [2–4]). В настоящее время ассортимент различных вариантов таких материалов весьма обширен и включает алмазные пленки и алмазные нанонити, пористые алмазы, алмазную пену, легированные и нелегированные детонационные наноалмазы. Недавно к ним были добавлены высоколегированные бором электродные материалы нового сорта, так называемые алмазные компакты, представляющие из себя таблетки поликристаллического алмаза, получаемые путем термобарического превращения графита в алмаз при высоких давлениях и температурах [5]. При этом бор вводится в компакт в ходе синтеза путем его добавки в шихту; атомы бора в решетке алмаза являются акцепторами электронов и обеспечивают проводимость р-типа. Приведенные выше уникальные характеристики и разнообразие номенклатуры обусловили широкое использование алмазных электродных материалов в таких областях, как электрокаталитическая деградация загрязняющих веществ, суперконденсаторы, электроанализ, биоэлектрохимия, электросинтез. Что касается электрокаталитических применений, то, по общепринятому мнению, sp3-гибридизация углерода не обладает электрохимической активностью по отношению к необратимым реакциям, сопровождающимся внутрисферным переносом электронов. По этой причине и с учетом высокой электрохимической стабильности BDD в многочисленных публикациях, посвященных электрокатализу реакций выделения кислорода и водорода, окисления метанола и т.д., чаще всего его используют в качестве высокостабильной подложки для нанесения мелкодисперсных металлических или металлоксидных катализаторов (см., например, [6–9]). Например, для реакций окисления метанола и восстановления кислорода каталитическая активность и стабильность BDD-электрода, декорированного PtNi-структурой типа core/shell, оказалась выше, чем для BDD, декорированного мелкодисперсной Pt [10]. В то же время имеется и достаточно много работ по исследованию каталитической активности собственно легированных алмазных электродов, не содержащих на поверхности нанесенных металлов и/или их оксидов. В частности, более высокая электрокаталитическая активность компактов, содержащих ≤0.1 ат. % Co и Ni по сравнению с аналогичными электродами без металлических примесей была отмечена в [10, 11]. В работе [12] были продемонстрированы высокие электрокаталитические характеристики восстановления CO2 до этанола на наноалмазе, легированном бором и азотом. Что касается исследования реакции восстановления кислорода на BDD-электродах, то таких работ немного. Работы [13‒15] содержат только упоминания об отсутствии тока реакции восстановления кислорода после очистки поверхности алмазного электрода от графитовых примесей. В работе [16] было показано наличие симбатной корреляции между относительным количеством примеси “неалмазного” углерода sp2-гибридизации, определяемой по данным спектроскопии комбинационного рассеяния, и перенапряжением реакции восстановления кислорода. Чем больше такого углерода на поверхности BDD, тем ниже перенапряжение восстановления кислорода и выше плотность тока. Авторы предположили, что поверхность алмаза демонстрирует замедленную кинетику электронного переноса в этой реакции из-за слабой адсорбции O2 или интермедиата $ \bullet {\text{O}}_{2}^{ - },$ образующегося при переносе первого электрона. В работах [17, 18] восстановление кислорода было исследовано в растворах 0.1 М KOH и 0.5 M H2SO4 с использованием линейной развертки потенциала на тонких пленках поликристаллического алмаза, легированного бором. Ток восстановления кислорода был зарегистрирован на циклических вольтамперограммах только в случае достижения потенциалов ~1.0 и ~1.7 В относительно Ag/AgCl-электрода сравнения на анодной границе циклирования для щелочных и кислых растворов, соответственно. Однако, протекание реакции восстановления кислорода на таких электродах оказалось сильно ингибированным – катодный пик тока наблюдался при потенциалах заметно отрицательнее аналогичных величин для электродов из стеклоуглерода и высокоориентированного пирографита. Дополнительно методом вращающегося дискового электрода было установлено, что при восстановлении кислорода происходит перенос только двух электронов, т.е. реакция завершается образованием H2O2 либо ${\text{HO}}_{2}^{ - }$ в кислых и щелочных растворах, соответственно. По предположению авторов, предварительная анодная обработка может окислить как sp2-углерод, так и графитоподобный углерод, имеющийся на алмазной поверхности или на границах зерен, и таким образом на поверхности электрода могут быть образованы кислородсодержащие функциональные группы, такие как хинонные, являющиеся активными центрами для реакции восстановления кислорода.
До настоящего времени BDD-электроды использовались главным образом для исследования анодных реакций, с тем чтобы в наибольшей степени использовать коррозионную стойкость алмаза, как электродного материала. В то же время катодные реакции на алмазных электродах исследованы сравнительно мало. В настоящей работе мы в некоторой степени восполняем этот пробел. Методами циклической вольтамперометрии и вращающегося дискового электрода исследовано влияние плазмоэлектрохимической модификации поверхности высоколегированного бором поликристаллического алмазного электрода-компакта на термодинамические и кинетические характеристики реакции восстановления кислорода и скорость электронного переноса ряда редокс-систем.
МЕТОДИКА ЭКСПЕРИМЕНТА
Образцы (компакты) легированного бором поликристаллического алмаза в форме таблеток получали при высоких давлениях и температурах в результате превращения графита в алмаз в ростовой среде C–B. Исходными материалами для синтеза служили порошки аморфного бора (99.99%, Alfa Aesar) и графита марки МГОСЧ, (99.9999%). Эти порошкообразные реагенты смешивали в агатовой ступке в течение 15 мин, а затем помещали в графитовом тигле в нагреватель высокого давления [19]. Полная продолжительность термообработки под высоким давлением – около 10 с. После термообработки образцы охлаждали под давлением до комнатной температуры; температура при этом снижалась с 2500 до 700 K в течение 3–5 с. В результате синтеза получали образцы цилиндрической формы диаметром 3.4–4.0 мм и высотой ~2.0 мм; их торцы шлифовали. Графит и обогащенные бором фазы удаляли с поверхности образцов кипячением в HClO4 и смеси H2SO4 + + HNO3 (3 : 1). По данным энергодисперсионного рентгено-спектрального анализа, синтезированные образцы не содержали примесей металлов в концентрации выше 0.1 мас. % [20].
Таким образом, BDD-электрод для исследований представлял собой диск диаметром ~3.4 мм и толщиной ~2.0 мм, заполимеризованный в цилиндре из эпоксидной смолы. Содержание бора, по данным энергодисперсионного рентгено-спектрального микроанализа, составляло ~3 ат. %. Перед каждым экспериментом электрод полировали алмазным порошком (0.3 мкм) до зеркального блеска, после чего активировали в растворе 0.5 M H2SO4 с помощью поляризации при потенциале –1.8 В в течение 20 мин и затем при 3 В в течение 20 мин (электрохимическая активация I). Плазмоэлектрохимическую обработку электрода проводили в двухэлектродной термостатируемой ячейке при перемешивании и охлаждении до 14°C (противоэлектрод – пластина графита ГР-280 площадью ~10 см2) путем наложения последовательности 5 пакетов чередующихся катодных и анодных импульсов напряжения амплитудой –150 и 300 В длительностью 10 мс и временем нарастания ~0.5 мкс в растворе 1 М Na2SO4 с частотой повторения 2 пакета в минуту. Экспериментальная установка и основные физические и химические процессы, протекающие при образовании электролизной плазмы, подробно описаны в работах [21, 22]. В ряде случаев после плазмоэлектрохимической обработки электрода проводили дополнительную электрохимическую активацию в 0.5 M растворе H2SO4 при потенциале –1.8 В в течение 20 мин (электрохимическая активация II). Таким образом, обратимые и необратимые электродные реакции исследовали на BDD-электродах, поверхность которых была подготовлена тремя различными способами: 1) электрохимическая активация I – исходный BDD (и-BDD), 2) электрохимическая активация I и плазмоэлектрохимическая обработка – BDD-электрод после обработки плазмой (пл-BDD) и 3) электрохимическая активация I и плазмоэлектрохимическая обработка с последующей электрохимической активацией II – BDD-электрод после обработки плазмой и дополнительной активации (акт-BDD).
Электронно-микроскопические (SEM) микрофотографии образцов получали на электронном сканирующем микроскопе Zeiss SUPRA 25 (Carl Zeiss, Германия). Рентгеновские фотоэлектронные спектры снимали на спектрометре Specs PHOIBOS 150 MCD (Specs, Германия) с MgKα-излучением (1253.6 эВ). Давление в рабочей камере спектрометра не превышало 4 × 10–8 Пa. Исследуемая площадь составляла 300–700 мкм2, глубина анализируемого слоя – 1–2 нм.
Вольтамперограммы с линейной разверткой потенциала регистрировали в трехэлектродной ячейке с использованием установки с вращающимся дисковым электродом (ВДЭ) ВЭД-06 (Volta, Россия) и потенциостата IPC Pro-L (Институт физической химии и электрохимии им. А.Н. Фрумкина, Россия). Рабочим электродом служил диск из легированного бором алмаза диаметром ~3.4 мм, заполимеризованный в цилиндре из эпоксидной смолы; противоэлектродом – платиновая фольга размером 10 × 30 мм; электродом сравнения – Ag/AgCl-электрод (насыщ. KCl), относительно которого приведены все значения потенциала (E) в статье. Измерения циклических вольтамперограмм (ЦВА) проводили в трехэлектродной кварцевой ячейке, фоновым электролитом во всех случаях был 0.1 М Na2SO4. Концентрация [Ru(NH3)6]Cl3 и K3[Fe(CN)6], составляла 5 мМ. Вольт-амперные кривые, регистрируемые методом ВДЭ, снимали в 0.1 M водном растворе KOH, насыщенном воздухом или кислородом, при скорости развертки потенциала v = 10 мВ с–1 и скорости вращения электрода 900‒6400 об/мин. Число электронов n, участвующих в электродной реакции, определяли по этим кривым, используя уравнение Коутецкого–Левича [23]:
(3)
${{j}_{{\text{d}}}} = 0.62nF{{D}^{{{2 \mathord{\left/ {\vphantom {2 3}} \right. \kern-0em} 3}}}}{{\omega }^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{{\nu }^{{ - {1 \mathord{\left/ {\vphantom {1 6}} \right. \kern-0em} 6}}}}{{c}^{0}},$РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 приведены электронно-микроскопические изображения поверхности электродов и-BDD и акт-BDD. Как видно из рисунка, для акт-BDD характерны более закругленные края структурных элементов поверхности электрода, чем для и-BDD. Вероятно, в результате плазмоэлектрохимического воздействия поверхность BDD подвергается травлению с частичным растворением краевых участков кристаллитов, сопровождающимся сглаживанием острых углов. Уменьшение шероховатости поверхности при анодной поляризации BDD-электродов было отмечено и в работах [13, 26].
Каталитическая активность BDD-электродов была исследована методом вращающегося дискового электрода. Вольт-амперные измерения были проведены в насыщенном кислородом 0.1 M растворе KOH (рис. 2а). Согласно уравнению Левича (3) плотность предельного тока четырехэлектронного восстановления кислорода составляет 6.4 мA/см2. С учетом этой величины, представленные поляризационные кривые были пересчитаны в зависимости числа электронов n, принимающих участие в реакции восстановления кислорода, от потенциала (рис. 2б). Как видно из рисунков, для исходного электрода характерен незначительный ток восстановления кислорода с крайне низкой величиной n (кривые 1 рис. 2а и 2б). После плазмоэлектрохимической обработки электрода наблюдается увеличение тока реакции восстановления кислорода, и на вольт-амперной кривой 2 (рис. 2а) появляется ярко выраженная волна восстановления кислорода с формальной величиной n ≈ 0.5, однако величина n не превышает ~1.0 при потенциалах –0.6…–0.9 В (кривая 2 рис. 2б). После электрохимической активации II происходит значительное увеличение активности обработанного плазмой BDD-электрода. Так, на кривой 3 (рис. 2а) наблюдается одна волна восстановления кислорода, что соответствует преимущественному протеканию реакции по четырехэлектронному пути (n ≈ 3.8, кривая 3 рис. 2б). Необходимо подчеркнуть, что четырехэлектронное восстановление кислорода на поверхности BDD, не содержащей каталитически активных металлов или их оксидов, наблюдается впервые.
Рис. 2.
Вольт-амперные кривые, измеренные в насыщенном кислородом 0.1 M растворе KOH (а), и зависимости числа электронов, переносимых в РВК, от потенциала (б) на различных электродах: и-BDD (1), пл-BDD (2) и акт-BDD (3), v = 10 мВ/с, скорость вращения электрода 2000 об/мин.

С целью установления влияния модифицирования поверхности BDD-электродов на константы скоростей электронного переноса были проведены измерения циклических вольтамперограмм в растворах 5 мM [Ru(NH3)6]Cl3 + 1 M Na2SO4 и 5 мM K3[Fe(CN)6] + 1 M Na2SO4. На рис. 3а, 3б, 3г и 3д приведены циклические вольтамперограммы для и-BDD и пл-BDD. Необходимо отметить, что на всех электродах в использованном диапазоне скорости развертки потенциала v для указанных выше окислительно-восстановительных систем наблюдались симметричные, близкие к линейным зависимости токов катодного и анодного пиков от v0.5, экстраполяция которых проходила через 0, при отсутствии влияния числа циклов на форму вольтамперограмм. При этом для всех окислительно-восстановительных систем значения формального потенциала (E*) оставались постоянными при переходе от исходного к модифицированным BDD-электродам. Величины констант k0 скорости электронного переноса окислительно-восстановительных реакций оценивались из анализа зависимостей разности потенциалов пиков тока на вольтамперограммах от скорости развертки потенциала (рис. 3в, 3е). Было установлено, что в случае окислительно-восстановительной системы [Ru(NH3)6]2+/3+ величина k0 = = 0.01–0.02 см/с для исходного BDD ожидаемо близка к полученной ранее для стеклоуглеродных электродов [27] и несколько увеличивается после обработки катодно-анодной плазмой, что не является удивительным, с учетом внешнесферного характера электронного переноса для этой системы. Незначительное влияние анодной поляризации поликристаллического BDD-электрода на скорость электронного переноса этой системы было отмечено в [28].
Рис. 3.
Циклические вольтамперограммы, измеренные в растворах 5 мM [Ru(NH3)6]Cl3 + 1 M Na2SO4 (а, б) и K3[Fe(CN)6] + 1 M Na2SO4 (г, д) на и-BDD- (а, г) и акт-BDD- (б, д) электродах, и соответствующие зависимости (в, е) разности потенциалов анодных и катодных пиков тока вольтамперограмм от скорости развертки потенциала для и‑BDD, пл-BDD и акт-BDD-электродов.

Несколько иная ситуация наблюдается для окислительно-восстановительной системы [Fe(CN)6]4–/3–. После плазмоэлектрохимической обработки происходит заметное увеличение величины k0 от 0.002 до 0.005 см/с, превышающее экспериментальную ошибку измерения. Следует отметить, что электрохимическая активация II обработанных плазмой электродов не оказывает кардинального влияния на скорость электронного переноса для рассматриваемых окислительно-восстановительных реакций, т.е. для пл-BDD и акт-BDD наблюдаемые величины k0 различаются не более, чем на порядок (рис. 3в, 3е). Обращает на себя внимание и фактическое равенство токов циклических вольтамперограмм для всех электродов, указывающее на отсутствие заметного изменения поверхности BDD-компакта, доступной раствору электролита, при плазмоэлектрохимическом модифицировании.
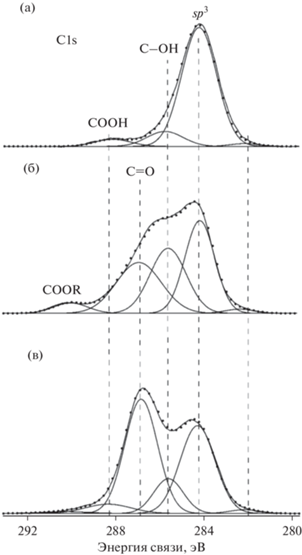
На рис. 4 приведены рентгеновские фотоэлектронные спектры высокого разрешения С1s образцов и-BDD, пл-BDD и акт-BDD с поверхностным содержанием кислорода 17, 20 и 22 ат. %, соответственно, и их декомпозиции на отдельные пики. Как было отмечено ранее [2], для высоколегированного бором алмаза основная линия спектра, отвечающая sp3-гибридизации углерода, смещена в сторону меньших энергий по сравнению с низколегированным, и, в нашем случае, для всех образцов находится в районе 284.4 ± 0.2 эВ. В работе [29] высказано утверждение о приблизительной одинаковости сдвигов энергий связи всех функциональных групп BDD в зависимости от концентрации бора и кристаллической структуры алмаза. Исходя из этого, отнесение линий рентгеновского фотоэлектронного спектра электрода-компакта будем производить по сдвигу энергии пика функциональной группы по отношению к основному пику с энергией 284.4 ± 0.2 эВ. Линии спектра с энергиями, большими на ~ +1.4 ± ± 0.2 эВ, присутствующие во все спектрах, можно отнести к гидроксильным (С–ОН) группам [29, 30], максимальная концентрация которых достигается на поверхности электрода, обработанного катодно-анодной плазмой. Ранее было отмечено, что аналогичный пик становится преобладающим в рентгеновском фотоэлектронном спектре поликристаллического BDD-электрода после его анодной поляризации в 0.1 М растворе H2SO4 [14]. Также во всех спектрах присутствует небольшая компонента с энергией 282.3 ± 0.3 эВ, наличие которой характерно для высоколегированных алмазов [10], и относится, по-видимому, к энергии связи C–B для атомов углерода, окружающих внедренный в решетку компакта атом бора [31]. Компонента спектра, смещенная по энергии на +2.6 ± 0.2 эВ, появляется в рентгеновских фотоэлектронных спектрах только для модифицированных плазмой электродов, причем становится доминирующей в случае акт-BDD-электрода (рис. 4в). Этот пик можно отнести к карбонильным группам (C=O) [13, 26]. Необходимо отметить, что электрохимическая активация II обработанного плазмой BDD-электрода приводит только к незначительному увеличению количества кислорода, что согласуется с данными работ [32, 33], т.е. можно предположить, что происходит преобразование части гидроксильных групп в карбонильные. Небольшие пики при энергиях связи, больших основного на 3.8–4.6 эВ, можно отнести к карбоксильным и сложноэфирным группам.
Рис. 4.
Рентгеновские фотоэлектронные спектры высокого разрешения образцов и-BDD (a), пл-BDD (б), акт-BDD (в) и их декомпозиции на отдельные пики.
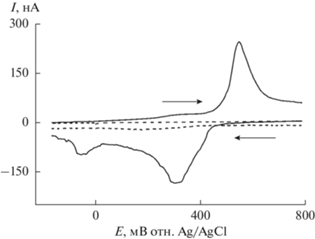
Неожиданным эффектом, не отмеченным ранее в литературе, является обнаруженное практически четырехэлектронное восстановление кислорода на BDD-электроде, подвергнутом комбинированному модифицированию катодно-анодной плазмой с последующей поляризацией в растворе 0.5 M H2SO4 при потенциале –1.8 В. При этом катодная поляризация и-BDD не приводила к заметному увеличению токов реакции восстановления кислорода. Отметим, что, по мнению многих авторов, в частности [13, 16], протекание этой реакции в водном растворе на BDD, не содержащем на поверхности sp2-гибридизованного углерода, невозможно. В нашем случае, по данным рентгеновской фотоэлектронной спектроскопии, sp2-углерод был, в основном, удален еще на стадии кислотной предобработки и-BDD и его остаточное количество на поверхности пл-BDD и акт-BDD не увеличивалось в результате их модифицирования. Как отмечено выше, наиболее существенное различие по содержанию кислородсодержащих функциональных групп на поверхности пл-BDD и акт-BDD заключалось в значительном увеличении количества карбонильных групп в последнем случае. Можно предположить, что наиболее вероятным типом карбонильных фрагментов на поверхности акт-BDD-электрода являются хинонные группы, которые могут служить активными центрами четырехэлектронного восстановления кислорода [34]. В пользу этого предположения говорит появление пиков тока с формальным потенциалом E* ≈ 400 ± ± 20 мВ на циклической вольтамперограмме акт-BDD в 0.1 М растворе Na2SO4 (рис. 5). Форма и положение этих пиков близки к зарегистрированным на поверхности BDD-электродов после лазерного воздействия [35], на поверхности стеклоуглеродного электрода после плазмоэлектрохимической обработки [27] и на поверхности малослойных графеновых структур, полученных расщеплением графита электролизной плазмой [36]. Ранее наличие хинонных групп с подобными характеристиками на поверхности различных графитовых электродов было однозначно установлено в [37]. Близкие по форме ЦВА были зарегистрированы в водных небуферных электролитах с добавлением гидрохинона на стеклоуглеродном электроде [38]. С учетом совокупности приведенных выше фактов можно констатировать, что образование хинонных групп в результате комбинированной плазмоэлектрохимической обработки и катодной поляризации является ключевым фактором реализации четырехэлектронного механизма восстановления кислорода на поверхности легированного бором алмазного электрода.
ЗАКЛЮЧЕНИЕ
Поверхность легированного бором алмазного электрода-компакта в водном растворе Na2SO4 модифицировали с помощью воздействия катодной, анодной и катодно-анодной электролизной плазмы. Установлено, что одна только обработка катодно-анодной плазмой приводит к незначительному каталитическому эффекту по отношению к реакции восстановления кислорода. Однако после катодного восстановления обработанного таким образом электрода он приобретает существенную электрокаталитическую активность, заключающуюся в преимущественном протекании восстановления O2 до H2O по четырехэлектронному пути. Показано, что наблюдаемый электрокаталитический эффект в реакции восстановления кислорода обусловлен образованием на поверхности легированного бором алмаза при комбинированном воздействии катодно-анодной плазмы и катодного потенциала хинонных групп, являющихся активными центрами четырехэлектронного восстановления кислорода.
Список литературы
Плесков, Ю.В., Сахарова, А.Я., Кротова, М.Д., Буйлов, Л.Л., Спицын, Б.В. Фотоэлектрохимическое поведение полупроводникового алмаза. Электрохимия. 1987. Т. 24. С. 69. [Pleskov, Y.V., Sakharova, A.Y., Krotova, M.D., Bouilov, L.L., and Spitsyn, B.V., Photoelectrochemical properties of semiconductor diamond, Sov. Electrochem., 1987, vol. 24, p. 69.]
Yang, N., Foord, J.S., and Jiang, X., Diamond electrochemistry at the nanoscale: A review, Carbon, 2016, vol. 99, p. 90. https://doi.org/10.1016/j.carbon.2015.11.061
Cobb, S.J., Ayres, Z.J., and Macpherson, J.V., Boron Doped Diamond: A Designer Electrode Material for the Twenty-First Century, Ann. Rev. Anal. Chem., 2018, vol. 11, p. 463. https://doi.org/10.1146/annurev-anchem-061417-010107
Yang, N., Yu, S., Macpherson, J.V., Einaga, Y., Zhao, H., Zhao, G., Swain, G.M., and Jiang, X., Conductive diamond: synthesis, properties, and electrochemical applications, Chem. Soc. Rev., 2019, vol. 48, p. 157. https://doi.org/10.1039/c7cs00757d
Pleskov, Y.V., Krotova, M.D., Elkin, V.V., and Ekimov, E.A., Electrochemical Behaviour of Boron-doped Diamond Compacts—a New Electrode Material, Electrochim. Acta, 2016, vol. 201, p. 268. https://doi.org/10.1016/j.electacta.2015.09.075
Gao, F., Thomann, R., and Nebel, C.E., Aligned Pt-diamond core–shell nanowires for electrochemical catalysis, Electrochem. Commun., 2015, vol. 50, p. 32. https://doi.org/10.1016/j.elecom.2014.11.006
Bian, L.Y., Wang, Y.H., Zang, J.B., Yu, J.K., and Huang, H., Electrodeposition of Pt nanoparticles on undoped nanodiamond powder for methanol oxidation electrocatalysts, J. Electroanal. Chem., 2010, vol. 644, p. 85. https://doi.org/10.1016/j.jelechem.2010.04.001
Salazar-Banda, G.R., Eguiluz, K.I.B., and Avaca, L.A., Boron-doped diamond powder as catalyst support for fuel cell applications, Electrochem. Commun., 2007, vol. 9, p. 59. https://doi.org/10.1016/j.elecom.2006.08.038
Wang, Y., Zang, J., Dong, L., Pan, H., Yuan, Y., and Wang, Y., Graphitized nanodiamond supporting PtNi alloy as stable anodic and cathodic electrocatalysts for direct methanol fuel cell, Electrochim. Acta, 2013, vol. 113, p. 583. https://doi.org/10.1016/j.electacta.2013.09.091
Ekimov, E.A., Sidorov, V.A., Maslakov, K.I., Sirotinkin, B.P., Krotova, M.D., and Pleskov Yu.V., Influence of growth medium composition on the incorporation of boron in HPHT diamond, Diamond Related Mater., 2018, vol. 89, p. 101. https://doi.org/10.1016/j.diamond.2018.08.010
Плесков, Ю.В., Кротова, М.Д., Елкин, В.В., Екимов, Е.А. Компакты из легированного бором синтетического алмаза: снижение температуры синтеза и его влияние на степень легирования и электрохимическое поведение. Электрохимия. 2017. Т. 53. С. 1529. [Pleskov, Y.V., Krotova, M.D., Elkin, V.V., and Ekimov, E.A., Compacts of Boron-Doped Synthetic Diamond: Lowering of Synthesis Temperature and Its Effect on the Doping Level and Electrochemical Behavior, Russ. J. Electrochem., 2017, vol. 53, p. 1345.] https://doi.org/10.1134/s1023193517120084
Liu, Y., Zhang, Y., Cheng, K., Quan, X., Fan, X., Su, Y., Chen, S., Zhao, H., Zhang, Y., Yu, H., and Hoffmann, M.R., Selective Electrochemical Reduction of Carbon Dioxide to Ethanol on a Boron- and Nitrogen–Co-doped Nanodiamond, Angew. Chem. Int. Ed., 2017, vol. 56, p. 15607. https://doi.org/10.1002/anie.201706311
Hutton, L.A., Iacobini, J.G., Bitziou, E., Channon, R.B., Newton, M.E., and Macpherson, J.V., Examination of the Factors Affecting the Electrochemical Performance of Oxygen-Terminated Polycrystalline Boron-Doped Diamond Electrodes, Anal. Chem., 2013, vol. 85, p. 7230. https://doi.org/10.1021/ac401042t
Granger, M.C., Witek, M., Xu, J., Wang, J., Hupert, M., Hanks, A., Koppang, M.D., Butler, J.E., Lucazeau, G., Mermoux, M., Strojek, J.W., and Swain, G.M., Standard Electrochemical Behavior of High-Quality, Boron-Doped Polycrystalline Diamond Thin-Film Electrodes, Anal. Chem., 2000, vol. 72, p. 3793. https://doi.org/10.1021/ac0000675
Martin, H.B., Hydrogen and Oxygen Evolution on Boron-Doped Diamond Electrodes, J. Electrochem. Soc., 1996, vol. 143, p. L133. https://doi.org/10.1149/1.1836901
Bennett, J.A., Wang, J., Show, Y., and Swain, G.M., Effect of sp2-Bonded Nondiamond Carbon Impurity on the Response of Boron-Doped Polycrystalline Diamond Thin-Film Electrodes, J. Electrochem. Soc., 2004, vol. 151, p. E306. https://doi.org/10.1149/1.1780111
Yano, T., Popa, E., Tryk, D.A., Hashimoto, K., and Fujishima, A., Electrochemical Behavior of Highly Conductive Boron-Doped Diamond Electrodes for Oxygen Reduction in Alkaline Solution, J. Electrochem. Soc., 1998, vol. 145, p. 1870. https://doi.org/10.1149/1.1838569
Yano, T., Popa, E., Tryk, D.A., Hashimoto, K., and Fujishima, A., Electrochemical Behavior of Highly Conductive Boron-Doped Diamond Electrodes for Oxygen Reduction in Acid Solution, J. Electrochem. Soc., 1999, vol. 146, p. 1081. https://doi.org/10.1149/1.1391724
Dubrovinskaia, N., Wirth, R., Wosnitza, J., Papageorgiou, T., Braun, H.F., Miyajima, N., and Dubrovinsky, L., An insight into what superconducts in polycrystalline boron-doped diamonds based on investigations of microstructure, Proc. Nat. Acad. Sci., 2008, vol. 105, p. 11619. https://doi.org/10.1073/pnas.0801520105
Ekimov, E.A., Ralchenko, V., and Popovich, A., Synthesis of superconducting boron-doped diamond compacts with high elastic moduli and thermal stability, Diamond Related Mater., 2014, vol. 50, p. 15. https://doi.org/10.1016/j.diamond.2014.09.001
Vasiliev, V.P., Kotkin, A.S., Kochergin, V.K., Manzhos, R.A., and Krivenko, A.G., Oxygen reduction reaction at few-layer graphene structures obtained via plasma-assisted electrochemical exfoliation of graphite, J. Electroanal. Chem., 2019, vol. 851, p. 113440. https://doi.org/10.1016/j.jelechem.2019.113440
Belkin, P.N., Yerokhin, A., and Kusmanov, S.A., Plasma electrolytic saturation of steels with nitrogen and carbon, Surf. Coat. Technol., 2016, vol. 307, p. 1194. https://doi.org/10.1016/j.surfcoat.2016.06.027
Плесков, Ю.В., Филиновский, В.Ю., Вращающийся дисковый электрод, Москва: Наука, 1972.
Qu, L.T., Liu,Y., Baek, J.B., and Dai, L.M., Nitrogen-doped graphene as efficient metal-free electrocatalyst for oxygen reduction in fuel cells, ACS Nano, 2010, vol. 4, p. 1321. https://doi.org/10.1021/nn901850u
Jürmann, G. and Tammeveski, K., Electroreduction of oxygen on multi-walled carbon nanotubes modified highly oriented pyrolytic graphite electrodes in alkaline solution, J. Electroanal. Chem., 2006, vol. 597, p. 119. https://doi.org/10.1016/j.jelechem.2006.09.002
Duo, I., Levy-Clement, C., Fujishima, A., and Comninellis, C., Electron Transfer Kinetics on Boron-Doped Diamond Part I: Influence of Anodic Treatment, J. Appl. Electrochem., 2004, vol. 34, p. 935. https://doi.org/10.1023/b:jach.0000040525.76264.16
Кривенко, А.Г., Манжос, Р.А., Кочергин, В.К. Влияние плазмоэлектрохимической обработки стеклоуглеродного электрода на обратимые и необратимые электродные реакции. Электрохимия. 2019. Т. 55. С. 854. [Krivenko, A.G., Manzhos, R.A., and Kochergin, V.K., Efect of Plasma-Assisted Electrochemical Treatment of Glassy Carbon Electrode on the Reversible and Irreversible Electrode Reactions, Russ. J. Electrochem., 2019, vol. 55, p. 663.] https://doi.org/10.1134/S102319351907005X10.1134/S102319351907005Xhttps://doi.org/10.1134/S0424857019070053
Ivandini, T.A., Watanabe, T., Matsui, T., Ootani, Y., Iizuka, S., Toyoshima, R., and Einaga, Y., Influence of the Surface Orientation on the Electrochemical Properties of Boron-Doped Diamond, J. Phys. Chem. C, 2019, vol. 123, p. 5336. https://doi.org/10.1021/acs.jpcc.8b10406
Ghodbane, S., Ballutaud, D., Omnès, F., and Agnès, C., Comparison of the XPS spectra from homoepitaxial {111}, {100} and polycrystalline boron-doped diamond films, Diamond Related Mater., 2010, vol. 19, p. 630. https://doi.org/10.1016/j.diamond.2010.01.014
Ryl, J., Cieslik, M., Zielinski, A., Ficek, M., Dec, B., Darowicki, K., and Bogdanowicz, R., High-Temperature Oxidation of Heavy Boron-Doped Diamond Electrodes: Microstructural and Electrochemical Performance Modification, Materials, 2020, vol. 13, p. 964. https://doi.org/10.3390/ma13040964
Goeting, C.H., Marken, F., Gutiérrez-Sosa, A., Compton, R.G., and Foord, J.S., Electrochemically induced surface modifications of boron-doped diamond electrodes: an X-ray photoelectron spectroscopy study, Diamond Related Mater., 2000, vol. 9, p. 390. https://doi.org/10.1016/s0925-9635(99)00267-8
Yokoya, T., Ikenaga, E., Kobata, M., Okazaki, H., Kobayashi, K., Takeuchi, A., Kobayashi, K., Kawarada, H., and Oguchi, T., Core-level electronic structure evolution of heavily boron-doped superconducting diamond studied with hard X-ray photoemission spectroscopy, Phys. Rev. B, 2007, vol. 75, p. 205117. https://doi.org/10.1103/physrevb.75.205117
Girard, H., Simon, N., Ballutaud, D., Herlem, M., and Etcheberry, A., Effect of anodic and cathodic treatments on the charge transfer of boron doped diamond electrodes, Diamond Related Mater., 2007, vol. 16, p. 316. https://doi.org/10.1016/j.diamond.2006.06.009
Mooste, M., Kibena-Põldsepp, E., Matisen, L., and Tammeveski, K., Oxygen Reduction on Anthraquinone Diazonium Compound Derivatised Multi-walled Carbon Nanotube and Graphene Based Electrodes, Electroanalysis, 2016, vol. 29, p. 548. https://doi.org/10.1002/elan.201600451
Ayres, Z.J., Cobb, S.J., Newton, M.E., and Macpherson, J.V., Quinone electrochemistry for the comparative assessment of sp2 surface content of boron doped diamond electrodes, Electrochem. Commun., 2016, vol. 72, 59. https://doi.org/10.1016/j.elecom.2016.08.024
Кривенко, А.Г., Манжос, Р.А., Комарова, Н.С., Коткин, А.С., Кабачков, Е.Н., Шульга Ю.М. Сравнительное исследование графита и продуктов его электрохимического расщепления. Электрохимия. 2018. Т. 54. ПРИЛОЖЕНИЕ, С. S32–S41. [Krivenko, A.G., Manzhos, R.A., Komarova, N.S., Kotkin, A.S., Kabachkov, E.N., and Shul’ga, Yu.M., Comparative Study of Graphite and the Products of Its Electrochemical Exfoliation, Russ. J. Electrochem., 2018, vol. 54, p. S32–S41.] https://doi.org/10.1134/S102319351811005810.1134/S1023193518110058https://doi.org/10.1134/S0424857018110051
Regisser, F., Lavoie, M.-A., Champagne, G.Y., and Belanger, D., Randomly oriented graphite electrode. Part 1. Effect of electrochemical pretreatment on the electrochemical behavior and chemical composition of the electrode, J. Electroanal. Chem., 1996, vol. 415, p. 47. https://doi.org/10.1016/S0022-0728(96)04636-0
Quan, M., Sanchez, D., Wasylkiw, M.F., and Smith, D.K., Voltammetry of Quinones in Unbuffered Aqueous Solution: Reassessing the Roles of Proton Transfer and Hydrogen Bonding in the Aqueous Electrochemistry of Quinones, J. Am. Chem. Soc., 2007, vol. 129, p. 12847. https://doi.org/10.1021/ja0743083
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия