Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 1, стр. 23-27
АКТИВАЦИЯ СЕРОТОНИНЕРГИЧЕСКОЙ СИСТЕМЫ СПОСОБСТВУЕТ ВЫЖИВАНИЮ ЖИВОТНЫХ РАЗНЫХ ВИДОВ ПРИ ВОЗДЕЙСТВИИ БАКТЕРИАЛЬНЫХ И ХИМИЧЕСКИХ ТОКСИНОВ
Т. Н. Аллахвердиева 1, Х. Ш. Мехтиев 2, А. А. Гайсина 3, А. А. Мехтиев 3, *
1 Азербайджанский государственный аграрный университет, МСХ
Гянджа, Азербайджан
2 Институт медицинской профилактики им. В.Ю. Ахундова МЗ
Баку, Азербайджан
3 Институт физиологии им. А.И. Караева НАН Азербайджана
Баку, Азербайджан
* E-mail: arifmekht@yahoo.com
Поступила в редакцию 10.10.2017
После доработки 31.07.2018
Принята к публикации 15.08.2018
Аннотация
В статье анализируется участие серотонин-модулируемого антиконсолидационного белка (СМАБ) в защите организма животных разных видов (мыши, рыбы) от воздействия летальных доз токсинов бактериальной и химической природы. В 1-й серии исследований путем внутрибрюшинного (в.б.) введения патогенной формы кишечной палочки (Escherichia coli) у мышей создавали перитонит. Внутримышечное (в.м.) введение мышам серотонин-модулируемого антиконсолидационного белка (СМАБ) значительно повышало их выживаемость (75% против 30%, p < 0.05). Во 2-й серии методом вестерн блоттинга было показано, что в.м. введение мышам СМАБ через 5 ч приводит к резкому усилению синтеза белка теплового шока с мол. массой 70 кДа (БТШ70) в печени. В 3-й серии исследований, выполненной на сазанах, было обнаружено, что в.м. введение СМАБ животным перед помещением в воду, содержавшую высокую концентрацию инсектицида актары, приводит к выживанию всех особей из опытной группы в течение 5 сут, тогда как в контрольной группе за этот период выжило лишь 35% животных (p < 0.001). В 4-й серии исследований было выявлено, что введение сазанам опытной группы поликлональных антител к СМАБ вызывало гибель 75% особей, помещенных в воду, содержавшую сублетальную концентрацию актары в течение 5 сут, тогда как в интактной и контрольной группах в идентичных условиях выжили все животные (p < 0.001).
ВВЕДЕНИЕ
В настоящее время токсины бактериальной (вследствие инфекционного заболевания) и химической природы опасны тем, что их воздействия на организм человека и животных могут завершиться развитием тяжелой патологии, вплоть до летального исхода. К сожалению, имеющиеся в арсенале врачей и ветеринаров терапевтические средства не всегда достаточно эффективны для противодействия патогенетическим эффектам этих токсинов. Вместе с тем организм животных и человека наделен собственными достаточно мощными защитными ресурсами, способными обезвредить действие токсинов и предотвратить возможное развитие тяжелых осложнений. В частности, к таким защитным системам относятся белки теплового шока (БТШ) или белки-шапероны, обеспечивающие защиту клеток организма животных от целого ряда неблагоприятных воздействий [1, 7, 8]). Целью данного исследования было изучение влияния активации серотонинергической системы на субклеточном уровне на уровень выживания животных разных видов, подвергнутых воздействию летальных доз бактериальных и химических токсинов.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Выделение СМАБ осуществляли из головного мозга быка, который гомогенизировали в экстрагирующем буфере, содержавшем 0.05 М фосфатного буфера (рН 7.2), 0.3 М NaCl, 5 мМ ЭДТА и 0.1%‑ный тритон Х-100, в объемном соотношении ткани и буфера 1:4. Основными этапами фракционирования были: 1) осаждение сульфатом аммония в интервале 0-40%-ного насыщения; 2) гель-хроматография на колонке (3 × 60 см) сефадекса G-150 [2]. Процесс фракционирования и отбора иммунопозитивных фракций находился под контролем ТНИФА с применением поликлональных иммуноглобулинов к СМАБ. Гомогенность выделенного белка оценивали методом электрофореза в полиакриламидном геле в трис-глициновой буферной системе (рН 8.3).
Иммуноглобулины к СМАБ получали в результате 5–6-месячной иммунизации кроликов, вводя подкожно по 300 мкг очищенного белка всегда в смеси с равным объемом полного адъюванта Фрейнда (Sigma, Германия). Схема иммунизации была следующей: первые три инъекции с интервалом в 14 дней, затем по одной инъекции в месяц. Кровь забирали из ушной вены кролика через 10 дней после 3-й и последующих инъекций, выделяли сыворотку и осаждали иммуноглобулины равным объемом 100%-ного раствора сульфата аммония.
Поликлональные антитела к СМАБ очищали из раствора кроличьих иммуноглобулинов к СМАБ методом аффинной хроматографии на колонке CNBr-сефарозы с предварительно иммобилизованным белком. После нанесения на аффинную колонку иммуноглобулинов к СМАБ ее тщательно отмывали 20-кратным объемом 0.01 М раствора фосфатного буфера (рН 7.2) и под контролем спектрофотометра осуществляли элюцию специфически связавшихся антител хаотропным соединением – 3 М раствором роданистого калия. Элюированные антитела диализовали на холоде против 0.15 М хлористого натрия, забуференного до значения рН 7.2 с помощью двузамещенного фосфата натрия, и замораживали. За один цикл с аффинной колонки элюировали до 12 мг антител (концентрацию антител определяли по методу Бредфорда).
В 1-й серии опыты были выполнены на белых мышах массой 18–28 г. Были сформированы 3 группы: 1) группа отрицательного контроля (n = = 10) – животных содержали в стандартных клетках; 2) группа положительного контроля (n = 10) – у животных вызывали перитонит; 3) опытная группа (n = 12) – у животных вызывали перитонит и вводили СМАБ. Перитонит создавали в результате интраперитонеального введения патогенной формы кишечной палочки (Ecsherichia coli), полученной от больных с урогенитальной инфекцией и выращенной предварительно в агарах Endo, MacConkey, ChromID CPS и среде Levin в термостате при температуре 37°С. Для получения чистой культуры штаммы дополнительно пересевали в питательную среду Kligler. Для индукции перитонита выбирали наиболее патогенные штаммы кишечной палочки, патогенность которых определяли путем измерения у них активности ДНК-азы, протеолитической и гемолитической активностей. Кроме того, дополнительным критерием для отбора штаммов служила их полирезистентность по отношению к широкому спектру антибиотиков, которую выявляли в культуральных средах Müller-Xinton и AQV. СМАБ вводили мышам внутримышечно каждый раз по 0.3, 0.6 и 1 мг (концентрацию белка определяли по методу Бредфорда) в физиологическом растворе трижды: в 11.00, 18.00 и 11.00 ч следующего дня. Выживаемость мышей в контрольной и опытной группах регистрировали на протяжении 4 сут.
Во 2-й серии исследования для изучения влияния СМАБ на индукцию синтеза БТШ70 были сформированы 2 группы животных: 1) контрольным животным (белые мыши массой 20 г) вводили СМАБ, инактивированный прогреванием на водяной бане при 55°С в течение 35 мин, в количестве 1 мг; 2) животным опытной группы внутримышечно вводили СМАБ – 1 мг. Через 5 ч животных умерщвляли и извлекали образцы печени, из которых экстрагировали водорастворимые белки в экстрагирующем буфере, содержавшем 0.05 М фосфатный буфер (рН 7.2), 0.3 М NaCl, 5 мМ ЭДТА и 0.1% тритон Х-100. Эти белки фракционировали методом электрофореза в градиенте плотности полиакриламидного геля (4–12%). После завершения электрофореза осуществляли перенос белковых полос на нитроцеллюлозную мембрану с размером пор 0.2 мкм в течение 1 ч в аппарате для вестерн блоттинга под напряжением 80 вольт. После переноса белковых фракций нитроцеллюлозную мембрану инкубировали в блокирующем буфере при постоянном покачивании на рокере, затем ее инкубировали с поликлональными антителами к БТШ70 в разведении 1:1000 в буфере для антител в течение ночи при 4°С при постоянном покачивании на рокере. Далее мембрану трижды отмывали и инкубировали с козьими противокроличьими иммуноглобулинами, конъюгированными с пероксидазой хрена (вторые антитела) в разведении 1:5000 в буфере для антител при комнатной температуре в течение 1 ч. Мембрану трижды отмывали и подвергали воздействию хемилюминесцентного раствора в течение 1 мин при постоянном покачивании на рокере, встряхивали и промокали салфеткой, оборачивали прозрачной пленкой, накрывали фотографической пленкой для авторадиографии, помещали в кассету для авторадиографии и экспонировали в течение 5 мин, после чего фотопленку проявляли, фиксировали и промывали водой.
В 3-й серии эксперименты были выполнены на сазанах (Cyprinus carpio Linne) массой 16–25 г, выращенных в прудовых хозяйствах г. Нефтечала (Азербайджан). Животных разбили на 2 группы: 1) контрольная группа (n = 17) – животных содержали в контейнере с пресной водой, содержавшей инсектицид актары в концентрации 400 мг/л; 2) опытная группа (n = 15) – животным внутримышечно вводили СМАБ из расчета 1 мг/10 г массы и помещали в контейнер с пресной водой, содержавшей инсектицид актары в концентрации 400 мг/л. По результатам опытов определяли количество выживших рыб (в процентах).
В 4-й серии эксперименты были выполнены на сазанах (Cyprinus carpio Linne) массой 20–34 г. Животных разбили на 3 группы: 1) интактная группа (n = 7) – животных содержали в пресной воде; 2) контрольная группа (n = 6) – кроличьи неиммунные γ-глобулины; животных содержали в контейнере с пресной водой, содержавшей актару в концентрации 420 мг/л; 3) опытная группа (n = 8) – кроличьи поликлональные антитела к СМАБ; животных содержали в контейнере с пресной водой, содержавшей актару в концентрации 420 мг/л. Препараты вводили внутримышечно в количестве 1 мг на 10 г массы тела в забуференном физиологическом растворе (рН 7.3). По результатам опытов определяли количество выживших рыб (в процентах).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
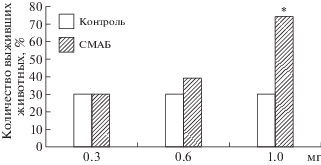
В 1-й серии исследований при создании перитонита мышам контрольной и опытной групп внутрибрюшинно вводили приблизительно 800 000–1 000 000 единиц суспензии кишечной палочки на животное. Применение указанной дозы приводило к гибели 70% животных из контрольной группы на 4-й день после введения суспензии кишечной палочки (рис. 1).
Внутримышечное введение различных количеств СМАБ животным осуществляли дважды в первый день и один раз утром следующего дня сразу после внутрибрюшинного введения суспензии кишечной палочки. Использованные однократные дозы 0.3 и 0.6 мг СМАБ не оказывали влияния на количество выживших животных. Вместе с тем трехкратное введение по 1 мг СМАБ приводило к 75%-ному выживанию животных к 4-му дню после введения суспензии кишечной палочки по сравнению с 30%-ным выживанием в контрольной группе животных (p < 0.05; рис. 1). Описанный положительный эффект инъекций СМАБ на выживание животных был воспроизведен несколько раз.
Во 2-й серии исследования методом вестерн блоттинга с применением поликлональных антител к БТШ70 было выявлено, что внутримышечное введение СМАБ мышам по прошествии 5 ч приводило к резкому увеличению уровня БТШ70 в печени животных опытной группы, тогда как введение инактивированного нагреванием СМАБ не вызывало изменения в уровне БТШ70 в контрольной группе животных (рис. 2). Обработка моноклональными антителами к тубулину нитроцеллюлозной мембраны после переноса на нее водорастворимых белков печени мыши и вымывание с мембраны антител к БТШ70 с помощью стриппингового буфера указывает на равномерное распределение тубулина между различными белковыми полосками, что свидетельствует о равномерной загрузке карманов с белковыми пробами контрольных и опытных животных в полиакриламидном геле во время проведения электрофореза и исключает возможность интерпретации увеличенного количества БТШ70 в связи с неодинаковым количеством нанесенных белковых проб. Таким образом, полученные методом вестерн блоттинга данные указывают на индукцию усиленного синтеза БТШ70 под влиянием введенного извне СМАБ.
Рис. 2.
Влияние в.м. введения СМАБ на уровень БТШ70 в печени мышей. Полосы 1–3 – фракции водорастворимых белков печени мышей, инъецированных инактивированным СМАБ; полосы 4–6 – фракции водорастворимых белков печени мышей, инъецированных нативным СМАБ. Стрелкой указана локализация БТШ70 на фореграмме.

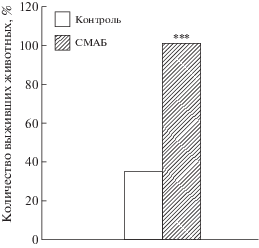
В 3-й серии исследований, выполненной на сазанах массой 16–25 г, было обнаружено, что внутримышечное введение СМАБ животным перед помещением в воду, содержавшую высокую концентрацию инсектицида актары (400 мг/л), приводит к выживанию всех особей из опытной группы в течение 5 сут, тогда как в контрольной группе за этот период выжило лишь 35% (6 из 17) животных (p < < 0.001; рис. 3).
Рис. 3.
Влияние в.м. введения СМАБ на выживаемость сазанов при экспозиции в воде, содержавшей летальную дозу актары, в течение 5 сут. *** – p < 0.001.
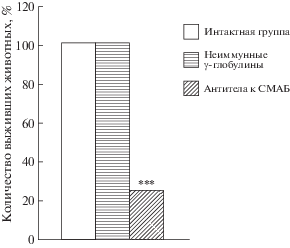
В 4-й серии исследований, выполненной на сазанах массой 20–34 г, было выявлено, что введение животным опытной группы антител к СМАБ в течение 5 сут вызывало гибель у 75% особей, помещенных в воду, содержавшую актару в концентрации 420 мг/л. В то же время в интактной и контрольной группах выжили все животные, помещенные в идентичные условия (p < 0.001; рис. 4).
ОБСУЖДЕНИЕ
Результаты проведенных исследований показали, что искусственное повышение уровня СМАБ в организме животных разных видов способствует их выживанию при воздействии летальных доз токсинов бактериальной и химической природы, вызывающих в этом же эксперименте высокую смертность у животных интактной и контрольной групп. Вместе с тем блокада активности СМАБ антителами в значительной степени повышала чувствительность животных к воздействию токсинов и приводила к их гибели, тогда как в интактной и контрольных группах все особи оставались живыми.
Полученные результаты указывают на то, что активация серотонинергической системы на субклеточном уровне за счет введения СМАБ запускает защитные ресурсы организма. Результаты опытов на мышах показали, что введение им СМАБ вызывает усиленный синтез БТШ70, который, будучи представителем класса белков-шаперонов, обеспечивает защиту тканей организма от гипертермии, аноксии, изменения рН среды в кислую или щелочную стороны, эпилептических судорог и т.д. [1, 7, 8]. Вместе с тем в ранее проведенных нами исследованиях было показано, что СМАБ обладает антимутагенной активностью, поскольку введение его рыбам перед помещением их в загрязненную тяжелыми металлами и полиароматическими углеводородами среду приводит к резкому снижению уровня мутаций в соматических клетках их организма [4]. Эти результаты позволяют предположить существование и другого защитного механизма: возможно, что СМАБ вызывает конформационные перестройки в структуре хроматина, переводя его в конденсированное, таким образом, более защищенное от воздействия неблагоприятных факторов состояние, предотвращая развитие мутагенных изменений в тканях. На возможность существования такого механизма указывают результаты, полученные на модели эмбрионального развития большого прудовика (Lymnaea stagnalis), в которых добавление СМАБ в инкубационную среду эмбрионов на стадии четырех бластомеров приводило к дозо-зависимому торможению развития [3]. Добавление СМАБ в среду инкубации эмбрионов шпорцевых лягушек (Xenopus laevis) на стадии бластулы вызывало их тотальную гибель (Мехтиев и др., неопубликованные данные). Кроме того, заключение о возможности существования такого механизма основывается также на результатах изучения активности СМАБ в поведенческих экспериментах. Как известно, формирование памяти на приобретенные формы поведения невозможно без достаточно высокой активности генетического аппарата, а ее блокада перед сеансами обучения животных приводит к нарушению формирования следов памяти [5]. В ранее проведенных нами исследованиях было выявлено, что при формировании следов памяти в моделях с положительным и отрицательным подкреплением уровень СМАБ в коре головного мозга значительно снижается, тогда как его внутримозговое введение до сеансов обучения препятствует формированию следов памяти [6]. Приведенные выше результаты являются косвенным подтверждением предполагаемого влияния СМАБ собственно на конформацию хроматина, переводящего его в защищенное от пагубного влияния неблагоприятных факторов состояние.
Список литературы
Агаев Ф.А. Индукция белков теплового шока и изменение радиочувствительности при тепловой обработке эмбрионов тутового шелкопряда Bombyx mori L. // Радиобиология. 1993. Т. 33. С. 361–364.
Мехтиев А.А. Обнаружение в головном мозге крыс белка, обладающего антиконсолидационными свойствами// Бюлл. экспер. биол. мед. 2000. Т. 129. № 8. С. 147–150.
Мехтиев А.А., Гайсина А.А., Воронежская Е.Е., Хабарова М.Ю., Гудратов Н.О., Гусейнов Ш.Б. Участие серотонин-модулируемого антиконсолидационного белка в регуляции развития эмбрионов большого прудовика (Lymnaea stagnalis) и саркомы Льюиса у мышей гибридной линии (F1 C57B2/6 x DBA)// Рос. физиол. журн. им. И.М. Сеченова. 2016. Т. 102. № 4. С. 490–499.
Мехтиев А.А., Мовсум-заде С.К. Антимутагенная активность серотонинергической системы и подлежащие механизмы у молоди осетров (Acipenser gueldenstaedti persicus) и серебряных карасей (Carassius auratus)// Ж. эвол. биохим. и физиол. 2008. Т. 44. № 5. С. 476–481.
Gal-Ben-Ari Sh., Kenney J.W., Ounalla-Saad H., Taha E., David O., Levitan D., Gildish I., Panja D., Pai B., Wibrand K., Simpson T.I., Proud Ch.G., Bramham C.R., Armstrong J.D., Rosenblum K. Consolidation and translation regulation // Learning & Memory. Cold Spring Harbor Laboratory Press. 2012. P. 410–422.
Mekhtiev A.A., Panahova E.N., Rashidova A.F., Guseinov Sh.B. Engagement of serotonin-modulating anticonsolidation protein in memory formation and suppression of drug addiction and epileptic seizures. New Developments in Serotonin Research (ed. M.D. Li). Nova Science Publishers, New York. 2015. P. 123–143.
Sharp F.R., Massa S.M., Swanson R.A. Heat shock protein protection// Trends Neurosci. 1999. V. 22. № 3. P. 97–99.
Vijayan M.M., Percia C., Kruzynski G., Iwama G.K. Sub-lethal concentrations of contaminant induce the expression of hepatic heat shock protein 70 in two salmonids. Aqaut. Toxicol// 1998. V. 40. № 2–3. P. 101–108.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии