Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 1, стр. 28-36
ТИЕНОПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ СПЕЦИФИЧНО АКТИВИРУЮТ СТЕРОИДОГЕНЕЗ В СЕМЕННИКАХ, НО НЕ ВЛИЯЮТ НА ФУНКЦИИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
А. А. Бахтюков 1, К. В. Деркач 1, Д. В. Дарьин 2, А. О. Шпаков 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 27.02.2018
После доработки 07.08.2018
Принята к публикации 15.08.2018
Аннотация
Лютеинизирующий гормон (ЛГ) и хорионический гонадотропин человека (ХГЧ), специфически связываясь с внеклеточным доменом рецептора ЛГ/ХГЧ, стимулируют продукцию тестостерона (Т) клетками Лейдига. Рецептор ЛГ/ХГЧ может быть также активирован низкомолекулярными агонистами (НМА), которые связываются с аллостерическим сайтом, расположенным в трансмембранном канале рецептора. Аллостерические сайты в рецепторах ЛГ/ХГЧ и тиреотропного гормона (ТТГ) сходны по структуре, вследствие чего НМА рецептора ЛГ/ХГЧ могут влиять на активность рецептора ТТГ и зависимый от него синтез тиреоидных гормонов. При разработке селективных активаторов стероидогенеза необходимо исключить такую возможность. Цель работы состояла в изучении влияния семи ранее синтезированных тиенопиримидиновых производных (ТП), НМА рецептора ЛГ/ХГЧ, на базальную и стимулированную ХГЧ и ТТГ активность аденилатциклазы (АЦ) в плазматических мембранах, выделенных из семенников и щитовидной железы крыс, а также на базальные и стимулированные люлиберином и тиролиберином уровни Т и тиреоидных гормонов при внутрибрюшинном введении ТП самцам крыс. Все ТП (10–4 М) повышали базальную активность АЦ в тестикулярных мембранах крыс, а при совместном действии ТП и ХГЧ их стимулирующие эффекты были аддитивными. ТП не влияли на базальную и стимулированную ТТГ активность АЦ в тироидальных мембранах. При введении самцам крыс ТП (25 мг/кг, внутрибрюшинно) повышали уровень Т. Эффект TP03, наиболее активного НМА рецептора ЛГ/ХГЧ, сохранялся в условиях активации гонадной оси люлиберином. При этом ТП не влияли на базальные и стимулированные тиролиберином уровни тироксина и трийодтиронина. Исключение составило соединение TP21, которое влияло, хотя и в небольшой степени, на активность рецептора ТТГ и уровни тиреоидных гормонов. В никотинамидной части TP21, в отличие от структурно близкого TP03, имеется дополнительная метоксигруппа, что и меняет его рецепторную специфичность. Таким образом, за исключением TP21, все ТП с активностью агонистов рецептора ЛГ/ХГЧ в условиях in vitro и in vivo не влияют на рецептор ТТГ, что указывает на селективность их действия в отношении гонадной оси.
ВВЕДЕНИЕ
Важнейшими регуляторами функций репродуктивной системы являются лютеинизирующий гормон (ЛГ) и его структурный и функциональный гомолог хорионический гонадотропин человека (ХГЧ), которые специфично связываются с рецепторами ЛГ/ХГЧ. Вызываемая ЛГ и ХГЧ активация этих рецепторов в клетках Лейдига приводит к стимуляции стероидогенеза и продукции тестостерона (Т), что обеспечивает нормальный уровень андрогенов в организме мужчин. У женщин ЛГ и ХГЧ через посредство рецепторов ЛГ/ХГЧ стимулируют стероидогенез в клетках теки и гранулезы яичников, повышая продукцию андростендиона и прогестерона, а также индуцируют овуляцию и формирование желтого тела. ЛГ и ХГЧ применяются у мужчин для нормализации уровня Т при андрогенной недостаточности и у женщин для контролируемой индукции овуляции при ослаблении функций яичников [1, 2]. Однако применение гонадотропинов сопряжено с рядом побочных эффектов, которые обусловлены гиперактивацией рецепторов ЛГ/ХГЧ и нижележащих сигнальных каскадов и быстрым развитием резистентности к ним тканей-мишеней. Необходимо также отметить, что природные формы ЛГ и ХГЧ гетерогенны по составу, а используемые в клинике рекомбинантные формы сильно отличаются от природных гормонов по N-гликозилированию, что приводит к изменению их активности и селективности действия [3, 4]. Вследствие этого ведется поиск новых агонистов рецепторов ЛГ/ХГЧ, среди которых наибольший интерес представляют низкомолекулярные соединения со структурой тиенопиримидиновых производных (ТП). Нами и другими авторами показано, что ТП дозозависимо стимулируют стероидогенез в клетках яичников и семенников, действуя как агонисты рецептора ЛГ/ХГЧ [5–11]. Однако в отличие от гонадотропинов, которые с высоким сродством связываются со значительным по размеру внеклеточным доменом рецептора ЛГ/ХГЧ, ТП проникают внутрь трансмембранного канала, образованного семью трансмембранными участками рецептора, и специфично связываются с расположенным там аллостерическим сайтом. Следует отметить, что при активации рецептора ЛГ/ХГЧ гонадотропином аллостерический сайт остается свободным.
Молекулярное моделирование рецепторов гипофизарных гликопротеиновых гормонов показало, что аллостерический сайт, расположенный в трансмембранном канале рецептора ЛГ/ХГЧ, структурно близок таковому в рецепторе тиреотропного гормона (ТТГ) [12, 13]. Активность рецепторов ТТГ, расположенных в тироцитах щитовидной железы (ЩЖ), стимулируется при их связывании с ТТГ, следствием чего является повышение продукции тиреоидных гормонов – тироксина (Т4) и трийодтиронина (Т3). Поиск регуляторов рецептора ТТГ привел к разработке его низкомолекулярных агонистов и антагонистов, причем, как и в случае рецептора ЛГ/ХГЧ, наибольшую активность продемонстрировали ТП [14–16]. Это, как полагают, обусловлено сходством аллостерических сайтов рецепторов ЛГ/ХГЧ и ТТГ. Но имеется одно существенное различие. Вход в трансмембранный канал рецептора ТТГ обогащен гидрофобными аминокислотными остатками, в то время как вход в трансмембранный канал рецептора ЛГ/ХГЧ более гидрофилен и содержит отрицательно заряженные аминокислотные остатки. Вследствие этого ТП, лиганды рецептора ТТГ характеризуются большей гидрофобностью в сравнении с ТП, лигандами рецептора ЛГ/ХГЧ [13]. Сходство структур аллостерических сайтов рецепторов ЛГ/ХГЧ и ТТГ ставит задачу оценить способность ТП, агонистов рецептора ЛГ/ХГЧ, влиять на тиреоидную ось и на активность рецепторов ТТГ [17].
Нами ранее были синтезированы и изучены семь ТП – TP01, TP02, TP03, TP04, TP21, TP22 и TP23, которые в условиях in vitro в клетках Лейдига стимулировали аденилатциклазу (АЦ), ответственную за активацию стероидогенеза, и при различных способах введения самцам крыс повышали у них продукцию Т [9–11, 18, 19]. Однако влияние ТП на рецептор ТТГ и продукцию тиреоидных гормонов не изучалось. Не были сопоставлены эффекты ТП на активность гонадной и тиреоидной осей, что совершенно необходимо для оценки селективности их действия. Цель работы состояла в изучении влияния ТП на базальную и стимулированную гормонами (ХГЧ, ТТГ) активность АЦ в плазматических мембранах, выделенных из семенников и ЩЖ крыс, а также на базальные и стимулированные рилизинг-факторами (люлиберином и тиролиберином) уровни Т и тиреоидных гормонов при внутрибрюшинном (в/б) введении ТП самцам крыс.
МАТЕРИАЛ И МЕТОДИКА
Синтез ТП – 5-амино-N-(трет-бутил)-4-(3-(изоникотинамидо)фенил)-2-(метилтио)тиено-[2,3-d]пиримидин-6-карбоксамида (TP01), 5-амино-N-(трет-бутил)-2-(метилтио)-4-(3-(тиофен-3-карбоксамидо)фенил)-тиено[2,3-d]пиримидин-6-карбоксамида (TP02), 5-амино-N-трет-бутил-2-(метилсульфанил)-4-(3-(никотинамидо)фенил)тиено[2,3-d]пиримидин-6-карбоксамида (TP03), 5-амино-N-трет-бутил-4-(3-(1-метил-1H-пиразол-4-карбоксамидо)фенил)-2-(метилсульфанил)тиено[2,3-d]пиримидин-6-карбоксамида (TP04), 5-амино-N-(трет-бутил)-4-(3-(2-метоксиникотинамидо)фенил)-2-(метилтио)тиено[2,3-d]пиримидин-6-карбоксамида (TP21), 4-((3-(5-амино-6-(трет-бутилкарбамоил)-2-(метилтио)тиено[2,3-d]пиримидин-4-ил)фенил)карбамоил)пиридин 1-оксида (TP22) и 5-амино-N-(трет-бутил)-4-(3-(2-хлорникотинамидо)фенил)-2-(метилтио)тиено[2,3-d]пиримидин-6-карбоксамида (TP23) проводили, как описано ранее [9–11, 20], осуществляя взаимодействие 5-амино-4-(3-аминофенил)-N-трет-бутил-2-(метилсульфанил)тиено[2,3-d]пиримидин-6-карбоксамида с ацилирующими агентами, несущими целевой заместитель. Реакцию проводили в присутствии 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфата (HATU) и N,N-диизопропилэтиламина в N,N-диметилформамиде. Все реагенты, используемые при синтезе ТП, были получены из фирмы “Sigma” (США). Структуру ТП подтверждали с помощью 1Н-ЯМР-спектроскопии (спектрометр Bruker Avance III 400, “Bruker”, Германия) и масс-спектрометрии высокого разрешения (electrospray ionization – time of flight, ESI-TOF, спектрометр micrOTOF, “Bruker”, Германия). ХГЧ был произведен Московским эндокринологическим заводом (Россия). Люлиберин, тиролиберин, ТТГ из гипофиза быка, креатинфосфат, кретинфосфокиназа из мышц кролика, цАМФ, АТФ были получены из фирмы “Sigma” (США).
Для экспериментов использовали трехмесячных самцов крыс Wistar, которых содержали в стандартных условиях вивария. Все процедуры проводили в соответствии с правилами, разработанными и утвержденными Этическим Комитетом ИЭФБ РАН, и правилами и требованиями, изложенными в документах “European Communities Council Directive 1986” (86/609/EEC) и “Guide for the Care and Use of Laboratory Animals”. ТП растворяли в диметилсульфоксиде (ДМСО) и вводили крысам (в/б, 25 мг/кг). Контрольным животным вводили ДМСО в том же объеме. Уровни Т и тиреоидных гормонов измеряли через 1 и 3 ч после введения препаратов. Кровь для определения гормонов получали из хвостовой вены, используя местный наркоз с помощью анестезии 2%-ным лидокаином (2–4 мг/кг). Уровень Т определяли, используя наборы “Тестостерон-ИФА” (“Алкор-Био”, Россия). Определение концентрации свободного тироксина (fТ4), общего тироксина (tТ4) и общего трийодтиронина (tТ3) проводили с помощью наборов “ИФА-СвТ4-1”, “ИФА-ТТ4-1” и “ИФА-ТТ3-1” (ЗАО “НВО Иммунотех”, Россия), как описано ранее [21]. Все измерения проводили на спектрофотометре Anthos Absorbance Reader 2020 (“Anthos Labtec Instruments”, Австрия).
Люлибериновый и тиролибериновый тесты использовали для оценки влияния TP03, наиболее активного ТП, на продукцию Т и тиреоидных гормонов. Люлибериновый тест проводили путем интраназального (и/н) введения самцам крыс люлиберина в дозе 10 пг/крысу в 20 мкл физиологического раствора. При проведении тиролиберинового теста тиролиберин вводили интраназально в дозе 300 мкг/кг в 20 мкл физиологического раствора, как описано ранее [22]. Соединение TP03 (в ДМСО) вводили (в/б, 25 мг/кг) за 30 мин до тиролиберина. Изучали 4 группы животных (в каждой n = 4): контроль (вводили ДМСО, в/б, и физиологический раствор, и/н), “Тир” (вводили ДМСО, в/б, и тиролиберин, и/н), “TP03” (вводили TP03, в/б, и физиологический раствор, и/н) и “Тир + TP03” (вводили последовательно TP03, в/б, и тиролиберин, и/н). Образцы крови отбирали через определенные промежутки времени после введения TP03 и измеряли в них уровень гормонов.
Выделение фракций тестикулярных и тироидальных мембран из семенников и ЩЖ крыс для определения активности АЦ проводили, как описано ранее [10, 23]. Животных (n = 6) декапитировали в условиях анестезии и удаляли у них семенники и ЩЖ. Ткани промывали охлажденным до 4°C 40 мМ Tris-HCl-буфером (pH 7.4), содержащим 5 мМ MgCl2, 10% (w/v) сахарозу и ингибиторы протеаз – 500 мкМ O-фенантролина, 2 мкМ пепстатина и 1 мМ фенилметилсульфонилфторида (буфер А), затем измельчали и гомогенизировали с помощью Политрона в 10 объемах буфера А. Гомогенат ткани семенников центрифугировали при 1500 × g в течение 10 мин, после чего супернатант центрифугировали при 20 000 × g в течение 30 мин. Гомогенат ткани ЩЖ центрифугировали при 500 g в течение 15 мин, осадок отбрасывали, а полученный супернатант центрифугировали при 10 000 g в течение 30 мин. Активность АЦ определяли, как описано ранее [24]. Инкубацию мембран с реакционной смесью проводили при 37°С в течение 12 мин. Инкубационная смесь содержала 50 мМ Tris-HCl (pH 7.5), 5 мМ MgCl2, 0.1 мМ цАМФ, 1 мМ АТФ, 37 КБк [α-32P]-АТФ, 20 мМ креатинфосфата, 0.2 мг/мл креатинфосфокиназы и 50–100 мкг мембранного белка. Для определения активности АЦ использовали [α-32P]АТФ (150 ГБк/ммоль) (Всерегиональное объединение “Изотоп”, Россия). Активность АЦ оценивали по количеству цАМФ, который получался в ходе ферментативной реакции, и выражали в пмоль цАМФ/мин/мг мембранного белка. Базальная активность фермента измерялась в отсутствие гормонов и ТП.
Для статистического анализа использовали дисперсионный анализ ANOVA, данные обрабатывали с помощью пакета программ IBM SPSS Statistics. Каждый эксперимент выполняли не менее трех раз. Данные представлены в виде средних величин и их среднестатистических ошибок из нескольких независимых экспериментов. Различия оценивали как достоверные при p < 0.05.
РЕЗУЛЬТАТЫ
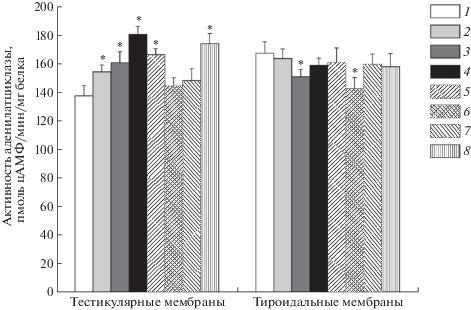
Все изученные ТП в концентрации 10–4 М повышали базальную активность АЦ в тестикулярных мембранах крыс, хотя по эффективности и уступали ХГЧ, демонстрирующего сходный эффект уже в концентрации 10–9 М (табл. 1). Наиболее эффективными были TP03 и TP23. Вызываемые ими приросты активности АЦ над базальной активностью фермента составили 53 и 44 пмоль цАМФ/мин/мг мембранного белка соответственно. В мембранах, выделенных из ЩЖ крыс, где рецепторы ЛГ/ХГЧ отсутствуют, все ТП, за исключением TP21, не влияли на активность АЦ. Следует, однако, отметить, что эффект TP21 был выражен в незначительной степени и составил всего 6% от стимулирующего эффекта ТТГ (10–9 М). На следующем этапе для оценки возможного ингибирующего эффекта ТП на рецепторы ЛГ/ХГЧ и ТТГ изучали влияние ТП на активность АЦ, стимулированную гипофизарными гормонами. В тестикулярных мембранах, преинкубированных в течение 5 мин с ТП, отмечали повышение стимулирующего АЦ эффекта ХГЧ, добавленного в концентрации 10–9 М. Это указывает на аддитивность эффектов ТП и ХГЧ, что обусловлено различиями в сайтах их связывания с рецептором ЛГ/ХГЧ. Во всех случаях, кроме TP21 и TP22, влияние которых на базальную активность АЦ было выражено слабо, различие стимулирующих эффектов ХГЧ и его комбинации с ТП было статистически значимым (рис. 1). В тироидальных мембранах, преинкубированных с ТП, стимулирующий эффект ТТГ (10–9 М) не отличался от такового в контроле, за исключением небольшого его снижения в случае TP02 и TP21 (рис. 1). Таким образом, за исключением TP02 и TP21, все выбранные для исследования ТП в концентрации, в которой достигался их максимальный стимулирующий эффект на активность АЦ в тестикулярных мембранах, практически не влияли на базальную и стимулированную ТТГ активность АЦ в тироидальных мембранах.
Таблица 1.
Влияние тиенопиримидиновых производных и гипофизарных гликопротеиновых гормонов на базальную активность аденилатциклазы в мембранах, выделенных из семенников и щитовидной железы крыс
| Соединение | Тестикулярные мембраны | Тироидальные мембраны |
|---|---|---|
| Активность АЦ, пмоль цАМФ/мин/мг мембранного белка, M ± SD | ||
| Базальная активность | 23 ± 4 | 19 ± 3 |
| TP01, 10–4 М | 48 ± 4* | 22 ± 3 |
| TP02, 10–4 М | 53 ± 6* | 23 ± 3 |
| TP03, 10–4 М | 76 ± 4* | 24 ± 4 |
| TP04, 10–4 М | 54 ± 2* | 23 ± 2 |
| TP21, 10–4 М | 44 ± 3* | 28 ± 3* |
| TP22, 10–4 М | 41 ± 2* | 17 ± 2 |
| TP23, 10–4 М | 67 ± 5* | 23 ± 3 |
| ХГЧ, 10–9 М | 137 ± 7* | 24 ± 4 |
| ТТГ, 10–9 М | 25 ± 3 | 166 ± 8* |
Рис. 1.
Влияние тиенопиримидиновых производных на стимулирующие аденилатциклазу эффекты ХГЧ в тестикулярных мембранах и ТТГ в мембранах, выделенных из щитовидной железы крыс. 1 – ХГЧ или ТТГ (10–9 М), 2 – гормон + TP01, 3 – гормон + TP02, 4 – гормон + TP03, 5 – гормон + TP04, 6 – гормон + TP21, 7 – гормон + TP22, 8 – гормон + TP23. Мембраны преинкубировали с ТП (10–4 М) в течение 5 мин (+4°С) перед добавлением ХГЧ или ТТГ (10–9 М). Данные представлены, как M ± SD, n = 6. * – различия между активностью АЦ, стимулированной гормоном в отсутствие ТП, и активностью АЦ, стимулированной гормоном в мембранах, преинкубированных с ТП, статистически значимы при p < 0.05.
Введение ТП самцам крыс (в/б, 25 мг/кг) уже через 1 ч приводило к достоверному повышению уровня Т, причем в дальнейшем, через 3 ч, этот эффект для TP01, TP03 и TP04 усиливался, подобно тому, как это происходило при введении ХГЧ (табл. 2). Показано, что при введении соединений TP03 и TP04 через 3 ч прирост уровня Т был сопоставим с таковым ХГЧ. В то же время стимулирующий эффект TP23 на уровень Т через 3 ч снижался на 30%, что, как можно полагать, обусловлено его деградацией в кровотоке. Необходимо отметить, что активное в условиях in vitro соединение TP02 не влияло на уровень Т при внутрибрюшинном введении и было исключено из дальнейшего исследования.
Таблица 2.
Влияние тиенопиримидиновых производных и ХГЧ на уровень тестостерона через 1 и 3 ч после их введения крысам
| Соединение | Прирост уровня тестостерона, нмоль/л, M ± SD | |
|---|---|---|
| Через 1 ч | Через 3 ч | |
| TP01, 25 мг/кг | 20.3 ± 6.7 | 33.6 ± 10.2 |
| TP03, 25 мг/кг | 34.5 ± 9.2 | 101.8 ± 22.3 |
| TP04, 25 мг/кг | 36.6 ± 10.5 | 71.9 ± 18.7 |
| TP21, 25 мг/кг | 23.3 ± 7.4 | 19.7 ± 6.6 |
| TP22, 25 мг/кг | 19.2 ± 6.8 | 14.0 ± 8.3 |
| TP23, 25 мг/кг | 38.4 ± 10.3 | 26.7 ± 7.4 |
| ХГЧ, 100 МЕ/крысу | 87.4 ± 12.3 | 143.5 ± 29.2 |
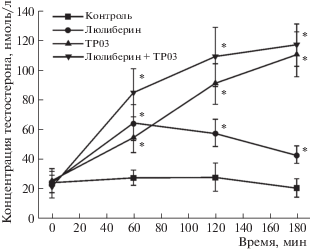
С целью показать аддитивность эффектов ТП и гонадотропинов в условиях in vivo использовали люлибериновый тест, для чего самцам крыс интраназально вводили люлиберин (10 пг/крысу), рилизинг-фактор ЛГ. Через 30 мин после введения люлиберина прирост уровня Т в крови крыс составил 41 нмоль/л, но в дальнейшем снижался и через 150 мин составил 19 нмоль/л (рис. 2). При обработке крыс соединением TP03 (в/б, 25 мг/кг) уровень Т нарастал во времени – через 3 ч прирост концентрации Т составил 85 нмоль/л и был в три раза выше такового через 1 ч после введения TP03. У крыс, которым сначала вводили TP03 и через 30 мин люлиберин, отмечали аддитивность эффектов ТП и эндогенного ЛГ, секретируемого гонадотрофами гипофиза в ответ на введение люлиберина. Аддитивность, которая в интервале от 30 до 150 мин составила 86–89%, рассчитывали как отношение прироста Т при совместном введении TP03 и люлиберина к сумме приростов Т, вызванных TP03 и люлиберином по отдельности (все расчеты проводили относительно концентрации Т в контроле). При этом как стимулирующий продукцию Т эффект люлиберина, так и его эффект на фоне стимуляции TP03 со временем снижались, что, вероятно, связано с десенситизацией части рецепторов ЛГ/ХГЧ при действии на них эндогенного ЛГ.
Рис. 2.
Стимулирующее влияние TP03 и люлиберина на уровень тестостерона при их введении самцам крыс по отдельности и совместно. Соединение TP03 вводили внутрибрюшинно в дозе 25 мг/кг (в ДМСО), люлиберин – интраназально в дозе 10 пг/крысу в физиологическом растворе. Введение люлиберина осуществляли через 30 мин после введения TP03. Время отсчитывали с момента введения TP03. Во всех экспериментах n = 4. Данные представлены, как M ± SD. * – различия между контролем и группами, обработанными люлиберином и ТП, статистически значимы при p < 0.05.
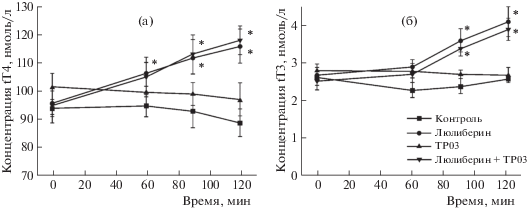
Все изученные ТП, за исключением TP21, не влияли на уровни fT4, tT4 и tT3 как через 1 ч, так и через 3 ч после введения крысам (данные не представлены). Соединение TP21 повышало уровни тиреоидных гормонов в очень небольшой степени (рис. 3). Интраназальное введение крысам тиролиберина (300 мкг/кг), рилизинг-фактора ТТГ, вызывало повышение уровня тиреоидных гормонов. В случае тироксина (fT4 и tT4) достоверное повышение уровней гормона отмечали через 1 ч, в то время как повышение уровня трийодтиронина (tT3) запаздывало, что связано с необходимостью конверсии T4 в T3 (рис. 3). Для оценки способности ТП подавлять стимулирующие эффекты эндогенного ТТГ на продукцию тиреоидных гормонов, было изучено совместное действие TP03 и тиролиберина. Стимулирующий эффект тиролиберина на уровни тиреоидных гормонов у крыс, предварительно обработанных TP03, не менялся (рис. 4). Это исключает возможность ингибирующего влияния TP03 на рецептор ТТГ в ЩЖ, что согласуется с данными экспериментов in vitro. Таким образом, совокупность полученных данных свидетельствует о том, что в условиях in vivo, за исключением TP21, все изученные ТП с активностью агонистов рецептора ЛГ/ХГЧ не влияют на рецептор ТТГ и продукцию тиреоидных гормонов.
Рис. 3.
Влияние тиролиберина и TP21 на уровни свободного (а) и общего тироксина (б) и на уровень общего трийодтиронина (в) через 1 и 3 ч после их введения крысам. 1 – тиролиберин, 2 – TP21. Тиролиберин вводили интраназально в дозе 300 мкг/кг (в физиологическом растворе), TP21 – внутрибрюшинно в дозе 25 мг/кг (в ДМСО). Во всех экспериментах n = 4. Данные представлены, как M ± SD. * – различия между уровнями тиреоидных гормонов до и через 1 и 3 ч после обработки статистически значимы при p < 0.05.
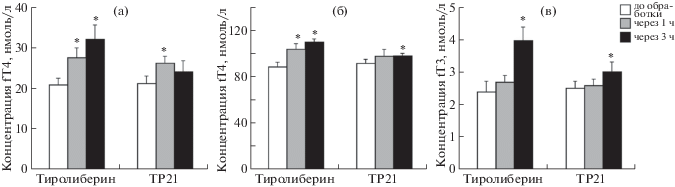
Рис. 4.
Влияние TP03 на стимулированные тиролиберином уровни общего тироксина (а) и общего трийодтиронина (б) у самцов крыс. TP03 вводили внутрибрюшинно (25 мг/кг), тиролиберин – интраназально (300 мкг/кг). Введение тиролиберина осуществляли через 30 мин после введения TP03. Данные представлены, как M ± SD, n = 4. * – различия между контролем и группами, обработанными тиролиберином и ТП, статистически значимы при p < 0.05.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Несмотря на существенные различия внеклеточных доменов рецепторов ЛГ/ХГЧ и ТТГ, их аллостерические сайты, локализованные в трансмембранных каналах, характеризуются значительным сходством структуры. Это обусловливает возможность активации аллостерического сайта рецептора ТТГ низкомолекулярным агонистом рецептора ЛГ/ХГЧ. Доказательства в пользу структурного сходства аллостерических сайтов рецепторов ЛГ/ХГЧ и ТТГ были получены при исследовании соединения Org 41841, агониста рецептора ЛГ/ХГЧ, относящегося к ТП. Было показано, что Org 41841, а также некоторые его аналоги способны активировать, хотя и с очень низкой эффективностью, рецептор ТТГ [6, 14]. В дальнейшем на основе анализа данных по связыванию низкомолекулярных лигандов с аллостерическим сайтом рецепторов ЛГ/ХГЧ и ТТГ и данных по активности химерных рецепторов, трансмембранные каналы которых включали комбинации трансмембранных участков рецепторов ЛГ/ХГЧ и ТТГ, с помощью молекулярного докинга была установлена структура аллостерического сайта рецептора ТТГ [12, 13].
“Капсула” аллостерического сайта рецептора ТТГ сформирована внутренней поверхностью трансмембранных участков III–VII и сверху прикрыта сегментами второй и третьей внеклеточных петель. В отличие от рецептора ЛГ/ХГЧ, внешний вход в аллостерический сайт рецептора ТТГ более узкий и гидрофобный. Это обусловлено тем, что в его формировании принимают участие аминокислотные остатки со значительными по объему гидрофобными радикалами, которые расположены в интерфейсах между внеклеточными петлями и трансмембранными участками IV–VI [12]. После установления структуры аллостерического сайта рецептора ТТГ были разработаны различные по химической природе его агонисты и антагонисты, в том числе на основе гетероциклов тиенопиримидинового ряда [14–16, 25]. В отличие от агонистов рецептора ЛГ/ХГЧ, ТП с активностью агонистов и антагонистов рецептора ТТГ имеют в структуре менее объемные, гидрофобные заместители, что обеспечивает им эффективное проникновение в трансмембранный канал рецептора ТТГ. Так присоединение метоксипропиленовой группы в пара-положение фенильного радикала приводит к более гидрофобному ТП – N-трет-бутил-5-амино-4-(4-(3-метоксипроп-1-енил)фенил)-2-(метилтио)тиено[2,3-d]пиримидин-6-карбоксамида (NIDDK/CEB-52), который является селективным антагонистом рецептора ТТГ и теряет способность связываться с рецептором ЛГ/ХГЧ [14].
Все синтезированные нами ТП имеют значительные по размеру заместители в мета-положении фенильного радикала, которые характеризуются наличием полярных групп, что важно для эффективного взаимодействия с аллостерическим сайтом рецептора ЛГ/ХГЧ и наряду с этим снижает возможность их взаимодействия с рецептором ТТГ. В задачи работы входило провести сравнительное изучение регуляторных эффектов разработанных нами ТП в условиях in vitro и in vivo на рецепторы ЛГ/ХГЧ и систему стероидогенеза, а также исследовать возможное их влияние на рецепторы ТТГ и синтез тиреоидных гормонов. В экспериментах in vitro было показано, что в тех концентрациях, в которых ТП стимулируют базальную активность АЦ в тестикулярных мембранах, действуя на рецепторы ЛГ/ХГЧ, они практически не влияют на активность АЦ в тироидальных мембранах, что указывает на отсутствие их стимулирующего эффекта на рецепторы ТТГ. В условиях in vivo ТП в дозах, в которых они повышали уровень Т при введении самцам крыс, практически не влияли на уровни тиреоидных гормонов, что указывает на отсутствие их стимулирующего влияния на тиреоидную систему. ТП почти не влияли на стимулированную ТТГ активность фермента в мембранах ЩЖ в условиях in vitro, и на уровни тиреоидных гормонов в условиях стимуляции тиролиберином тиреоидной оси у крыс в условиях in vivo, что указывает на отсутствие у ТП антагонистической активности по отношению к рецептору ТТГ. Полученные данные позволяют прийти к выводу, что разработанные нами высокоактивные агонисты рецептора ЛГ/ХГЧ на основе ТП не взаимодействуют с аллостерическим сайтом рецептора ТТГ.
Некоторая активность по отношению к рецептору ТТГ была присуща только соединению TP21, которое в тироидальных мембранах повышало, хотя и в небольшой степени, базальную активность АЦ и снижало ТТГ-стимулированную активность фермента. Мы полагаем, что это связано с присутствием метоксигруппы во втором положении пиридинового кольца никотинамидного остатка, который присоединен к фенильному кольцу TP21 [20]. В молекуле соединения TP03 такая группа отсутствует, и он не влияет на рецептор ТТГ и продукцию тиреоидных гормонов.
При совместном применении ТП и гонадотропинов отмечали аддитивность их стимулирующего эффекта на стероидогенез, что было продемонстрировано как в условиях in vitro, когда стимулирующий эффект ХГЧ на активность АЦ в тестикулярных мембранах повышался в присутствии ТП, так и в условиях in vivo, когда на фоне активации гонадной оси люлиберином, стероидогенный эффект TP03 сохранялся. Полученные данные являются первым доказательством того, что при совместном действии гонадотропинов и низкомолекулярных агонистов рецептора ЛГ/ХГЧ их стероидогенные эффекты не только сохраняются, но и частично суммируются. Причиной такой аддитивности является то, что гонадотропины не конкурируют c ТП за места связывания с рецепторами ЛГ/ХГЧ, расположенными на клетках Лейдига.
Необходимо отметить, что при повышении длительности активации люлиберином гонадной оси как в присутствии, так и в отсутствие TP03 стимулирующий продукцию Т эффект люлиберина снижался, что, как мы полагаем, обусловлено снижением числа функционально активных рецепторов ЛГ/ХГЧ. Действительно, при гиперактивации рецепторов ЛГ/ХГЧ эндогенными гонадотропинами в условиях стимуляции их секреции люлиберином в клетках Лейдига запускаются β-аррестиновые сигнальные пути, что ведет к эндоцитозу и деградации рецепторных молекул и неизбежно снижает чувствительности клеток Лейдига к агонистам рецепторов ЛГ/ХГЧ [26, 27]. В этой связи необходимо отметить, что TP03-индуцируемая стимуляция стероидогенеза, напротив, возрастала, хотя мишенью в этом случае также были рецепторы ЛГ/ХГЧ. Одним из объяснений этого может быть способность ТП проникать через плазматическую мембрану и взаимодействовать с расположенными там молекулами рецепторов, вызывая их внутриклеточную активацию [28]. Однако этот механизм требует дальнейшего изучения.
Список литературы
Cole L.A. hCG, the wonder of today’s science // Reprod. Biol. Endocrinol. 2012. V. 10. P. 24.
La Vignera S., Condorelli R.A., Cimino L., Russo G.I., Morgia G., Calogero A.E. Late-onset hypogonadism: the advantages of treatment with human chorionic gonadotropin rather than testosterone // Aging Male. 2016. V. 19. P. 34–39.
Fournier T. Human chorionic gonadotropin: Different glycoforms and biological activity depending on its source of production // Ann. Endocrinol. (Paris). 2016. V. 77. P. 75–81.
Шпаков А.О. Гликозилирование гонадотропинов, как важнейший механизм регуляции их активности // Рос. физиол. журн. им. И.М. Сеченова. 2017. Т. 103. № 9. С. 1004–1021.
van Straten N.C., Schoonus-Gerritsma G.G., van Some-ren R.G., Draaijer J., Adang A.E., Timmers C.M., Hans-sen R.G., van Boeckel C.A. The first orally active low molecular weight agonists for the LH receptor: Thienopyr(im)idines with therapeutic potential for ovulation induction // ChemBioChem. 2002. V. 3. P. 1023–1026.
Moore S., Jaeschke H., Kleinau G., Neumann S., Costanzi S., Jiang J.K., Childress J., Raaka B.M., Colson A., Paschke R., Krause G., Thomas C.J., Gershengorn M.C. Evaluation of small-molecule modulators of the luteinizing hormone/choriogonadotropin and thyroid stimulating hormone receptors: structure-activity relationships and selective binding patterns // J. Med. Chem. 2006. V. 49. P. 3888–3896.
van de Lagemaat R., Timmers C.M., Kelder J., van Koppen C., Mosselman S., Hanssen R.G. Induction of ovulation by a potent, orally active, low molecular weight agonist (Org 43553) of the luteinizing hormone receptor // Hum. Reprod. 2009. V. 24. P. 640–648.
Gerrits M., Mannaerts B., Kramer H., Addo S., Hanssen R. First evidence of ovulation induced by oral LH agonists in healthy female volunteers of reproductive age // J. Clin. Endocrinol. Metab. 2013. V. 98. P. 1558–1566.
Derkach K.V., Dar’in D.V., Lobanov P.S., Shpakov A.O. Intratesticular, intraperitoneal, and oral administration of thienopyrimidine derivatives increases the testosterone level in male rats // Dokl. Biol. Sci. 2014. V. 459. P. 326–329.
Derkach K.V., Dar’in D.V., Bakhtyukov A.A., Lobanov P.S., Shpakov A.O. In vitro and in vivo studies of functional activity of new low molecular weight agonists of the luteinizing hormone receptor // Biochemistry (Moscow). Suppl. Ser. A: Memb. Cell Biol. 2016. V. 10. P. 294–300.
Derkach K.V., Bakhtyukov A.A., Shpakov A.A., Dar’in D.V., Shpakov A.O. Specificity of heterotrimeric G protein regulation by human chorionic gonadotropin and low-molecular agonist of luteinizing hormone receptor // Cell Tissue Biol. 2017. V. 11. P. 475–482.
Hoyer I., Haas A.K., Kreuchwig A., Schülein R., Krause G. Molecular sampling of the allosteric binding pocket of the TSH receptor provides discriminative pharmacophores for antagonist and agonists // Biochem. Soc. Trans. 2013. V. 41. P. 213–217.
Kleinau G., Worth C.L., Kreuchwig A., Biebermann H., Marcinkowski P., Scheerer P., Krause G. Structural-functional features of the thyrotropin receptor: A class a G-protein-coupled receptor at work // Front. Endocrinol. (Lausanne). 2017. V. 8. P. 86.
Neumann S., Kleinau G., Costanzi S., Moore S., Jiang J.K., Raaka B.M., Thomas C.J., Krause G., Gershengorn M.C. A low-molecular-weight antagonist for the human thyrotropin receptor with therapeutic potential for hyperthyroidism // Endocrinology. 2008. V. 149. P. 5945–5950.
Neumann S., Gershengorn M.C. Small molecule TSHR agonists and antagonists // Ann. Endocrinol. (Paris). 2011. V. 72. P. 74–76.
Neumann S., Padia U., Cullen M.J., Eliseeva E., Nir E.A., Place R.F., Morgan S.J., Gershengorn M.C. An enantiomer of an oral small-molecule TSH receptor agonist exhibits improved pharmacologic properties // Front. Endocrinol. (Lausanne). 2016. V. 7. P. 105.
Шпаков А.О. Новые достижения в разработке и изучении механизмов действия низкомолекулярных агонистов рецепторов тиреотропного и лютеинизирующего гормонов // Цитология. 2015. Т. 57. № 3. С. 167–176.
Shpakov A.O., Dar’in D.V., Derkach K.V., Lobanov P.S. The stimulating influence of thienopyrimidine compounds on the adenylyl cyclase systems in the rat testes // Dokl. Biochem. Biophys. 2014. V. 456. P. 104–107.
Shpakov A.O., Derkach K.V., Dar’in D.V., Lobanov P.S. Activation of adenylyl cyclase by thienopyrimidine derivatives in rat testes and ovaries // Cell Tissue Biol. 2014. V. 8. P. 400–406.
Derkach K.V., Legkodukh A.S., Dar’in D.V., Shpakov A.O. The stimulating effect of thienopyrimidines structurally similar to Org 43553 on adenylate cyclase activity in the testes and on testosterone production in male rats // Cell Tissue Biol. 2017. V. 11. P. 73–80.
Derkach K.V., Bogush I.V., Berstein L.M., Shpakov A.O. The influence of intranasal insulin on hypothalamic-pituitary-thyroid axis in normal and diabetic rats // Horm. Metab. Res. 2015. V. 47. P. 916–924.
Derkach K.V., Shpakova E.A., Titov A.M., Shpakov A.O. Intranasal and intramuscular administration of lysine-palmitoylated peptide 612–627 of thyroid-stimulating hormone receptor increases the level of thyroid hormones in rats // Int. J. Pept. Res. Ther. 2015. V. 21. P. 249–260.
Shpakov A.O., Shpakova E.A., Tarasenko I.I., Derkach K.V. Peptide 612–627 of thyrotropin receptor and its modified analogs as regulators of adenylyl cyclase in rat thyroid gland // Cell Tissue Biol. 2014. V. 8. P. 488–498.
Shpakov A.O., Shpakova E.A., Tarasenko I.I., Derkach K.V., Vlasov G.P. The peptides mimicking the third intracellular loop of 5-hydroxytryptamine receptors of the types 1B and 6 selectively activate G proteins and receptor-specifically inhibit serotonin signaling via the adenylyl cyclase system // Int. J. Pept. Res. Ther. 2010. V. 16. P. 95–105.
Latif R., Realubit R.B., Karan C., Mezei M., Davies T.F. TSH Receptor Signaling Abrogation by a Novel Small Molecule // Front. Endocrinol. (Lausanne). 2016. V. 7. P. 130.
Casarini L., Reiter E., Simoni M. β-Arrestins regulate gonadotropin receptor-mediated cell proliferation and apoptosis by controlling different FSHR or LHCGR intracellular signaling in the hGL5 cell line // Mol. Cell. Endocrinol. 2016. V. 437. P. 11–21.
Riccetti L., Yvinec R., Klett D., Gallay N., Combarnous Y., Reiter E., Simoni M., Casarini L., Ayoub M.A. Human luteinizing hormone and chorionic gonadotropin display biased agonism at the LH and LH/CG receptors // Sci. Rep. 2017. V. 7. P. 940.
Newton C.L., Whay A.M., McArdle C.A., Zhang M., van Koppen C.J., van de Lagemaat R., Segaloff D.L., Millar R.P. Rescue of expression and signaling of human luteinizing hormone G protein-coupled receptor mutants with an allosterically binding small-molecule agonist // Proc. Natl. Acad. Sci. USA. 2011. V. 108. P. 7172–7176.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


