Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 1, стр. 65-72
Отличия эффекта аргинин-вазотоцина и аргинин-вазопрессина на почку крыс в эволюции осморегуляции у позвоночных
Д. В. Голосова 1, Е. И. Шахматова 1, Ю. В. Наточин 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: natochin1@mail.ru
Поступила в редакцию 19.03.2018
После доработки 24.07.2018
Принята к публикации 15.08.2018
Аннотация
Аргинин-вазотоцин (АВТ) является гормоном большинства позвоночных, но у млекопитащих его сменяет вазопрессин. Исследование эффекта обоих нонапептидов семейства вазопрессина [аргинин-вазопрессин, (АВП) и АВТ] показало, что в почке крыс они участвуют в регуляции реабсорбции Na+ и реабсорбции осмотически свободной воды. Эти эффекты обусловлены влиянием на разные подтипы V‑рецепторов, активируемые разными концентрациями гормона в сыворотке крови. Предложен иммуноферментный метод определения концентрации АВТ в условиях полного подавления секреции АВП. Показано, что при инъекции одинаковых доз нонапептидов АВТ медленнее разрушается и дольше действует у крыс, чем АВП. Большая скорость метаболизма нонапептида в крови служит эволюционным преимуществом как способ улучшения качества регуляции водно-солевого обмена. Обсуждается вопрос о значении сопоставления эффекта утраченных в ходе эволюции гормонов позвоночных как метод изучения эволюции функций.
ВВЕДЕНИЕ
Нонапептиды семейства вазопрессина секретируются в кровь у представителей всех классов позвоночных. Среди них аргинин-вазотоцин (АВТ), гидрин 2, окситоцин, ихтиотоцин, аргинин-вазопрессин (АВП) [1]. Эти гормоны участвуют в регуляции водно-солевого обмена [1, 2], репродуктивной функции [1, 2] и поведения [3, 4]. В эволюции позвоночных происходит смена химической структуры нонапептидов и их роли в регуляции функций. Анализ огромной литературы по сравнительной эндокринологии [1, 5, 6] не дает ответа на вопрос о причинах, которые обусловили смену аминокислот в нонапептидах у представителей разных классов, какие функции приобретает новый аналог гормона. Сказанное предопределяет возможность еще одной линии сравнительно-физиологических исследований, имеющих значение для эволюционной физиологии – изучение эффекта физиологически активных веществ низших позвоночных у эволюционно более высоко развитых групп позвоночных, которые утратили этот гормон в ходе эволюции. Это может позволить выяснить, не только как видоизменилась регуляция функции, но и в чем суть несоответствия ранее существовавших гормонов новым условиям, какие последовали изменения молекулярной организации и физиологической реакции, вызванные сменой регуляторного фактора.
У млекопитающих в крупноклеточных нейросекреторных ядрах гипоталамуса образуется АВП или лизин-вазопрессин [7], но не синтезируется АВТ, секретируемый у большинства позвоночных. Задачей настоящей работы послужило изучение трех взаимосвязанных вопросов, которые могут позволить выяснить причину смены нонапептидов в осморегуляции у млекопитающих: 1) сопоставление эффекта АВТ и АВП на почку крыс; 2) изучение соотношения между выведением этих гормонов почкой и реабсорбцией в канальцах воды и ионов; 3) определение длительности эффекта гормонов как проявление скорости смены паттерна регуляторных молекул в крови.
МАТЕРИАЛ И МЕТОДИКА
Эксперименты проведены на крысах линии Вистар. Животные получали стандартный гранулированный корм (рецепт ПК-120, ООО “Аллер Петфуд”, Россия) и находились в условиях свободного доступа к воде. Утром в день эксперимента крыс не кормили, сохраняя возможность пить воду. Крыс использовали в повторных опытах не чаще 1 раза в неделю. Их содержание и проведение экспериментов выполнялось в соответствии с Российскими и международными правилами по работе с лабораторными животными.
АВП и АВТ (“Bachem”, Швейцария) инъецировали в дозах от 0.001 до 0.1 нмоль на 100 г массы тела. Для подавления секреции эндогенного АВП неанестезированным крысам вводили водную нагрузку (ВН) в объеме 5 мл на 100 г массы тела зондом в желудок и на этом фоне инъецировали изучаемый нонапептид. Препараты растворяли в 0.9%-ом растворе NaCl и вводили в объеме 0.1 мл на 100 г массы тела внутримышечно. Контролем служила группа животных с инъекцией растворителя в том же объеме без введения ВН.
Во время опыта крыс помещали в индивидуальные клетки-пеналы с проволочным дном, через отверстия которого моча по воронке стекала в мерную пробирку. Диурез регистрировали при спонтанных мочеиспусканиях в течение 4 ч. После мочеиспускания тотчас измеряли объем пробы и брали аликвоту для иммуноферментного анализа в пробирки типа эппендорф, в которые был добавлен ингибитор протеаз апротинин (500 КИЕ/мл). Аликвоты мочи помещали в холодильную камеру и хранили при температуре –80°С. Концентрацию АВП в пробах мочи измеряли наборами для иммуноферментного анализа (ИФА) – ELISA, Enzo Life Sciences, Inc., США. Для определения концентрации АВТ в пробах мочи использовали наборы EIA, Peninsula Laboratories International, Inc., США. Измерение оптической плотности осуществляли в 96‑луночных планшетах по методике тест-системы на автоматическом ридере ELx808 (Bio-Tek Instruments, США) по методике соответствующих тест-систем. Кровь у животных брали из сонной артерии под золетиловым (“Virbac”, Франция) наркозом (5 мг на 100 г массы тела внутримышечно). После свертывания кровь центрифугировали при 8000 оборотах в минуту на микроцентрифуге Hettich Micro 20 (Andreas Hettich GmbH, Германия) в течение 15 мин, для последующих анализов использовали сыворотку.
Осмоляльность в пробах сыворотки крови и мочи определяли криоскопическим методом на микроосмометре 3320 (Advanced Instruments, Inc., США). Концентрацию Na+ в пробах мочи измеряли на пламенном фотометре Sherwood-420 (Sherwood Scientific, Великобритания), в сыворотке крови – с помощью ионоселективного блока на автоматическом биохимическом анализаторе Erba XL-200 (Erba Lachema, Чехия), концентрацию креатинина в сыворотке и моче – кинетическим методом по реакции Яффе без депротеинизации на том же анализаторе. Показатели функций почек рассчитывали по стандартным формулам [8] и нормализовали на 100 г массы тела. Для оценки динамики параметров функций почек использовали их средние взвешенные значения по 30-минутным интервалам.
Сравнение групп проводили с использованием одно- или двухфакторного дисперсионного анализа с поправкой Бонферрони для множественных сравнений с контрольной группой или c последующим применением теста Холма и Шидака для попарного сравнения средних. Различия считали статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
После введения в желудок ВН в течение часа водный диурез достигает максимума, что обусловлено удалением из мембран клеток собирательных трубок аквапорина 2 и образованием осмотически свободной воды (рис. 1). Инъекция на этом фоне АВП или АВТ уменьшает выведение осмотически свободной воды в результате повышения осмотической проницаемости стенки канальца (рис. 1), но не изменяет выведение Na+ (рис. 2). Скорость гломерулярной фильтрации, измеренная по клиренсу креатинина, остается во всех сериях опытов на одном уровне: после введения ВН СCr = 0.34 ± ± 0.02 мл/мин, после инъекции АВП и АВТ на фоне ВН СCr = 0.40 ± 0.03 и СCr = 0.31 ± 0.04 мл/мин соответственно (p > 0.05 к контролю). Следовательно, влияние нонапептидов на транспорт воды обусловлено участием клеток канальцев, а не изменением скорости гломерулярной фильтрации. Так как при инъекции нонапептидов в дозе 0.001 нмоль на 100 г массы тела выведение Na+ практически не меняется (рис. 2, в верхней части выделен фрагмент, где размерность ординаты увеличена в 10 раз, чтобы были различимы особенности эффекта гормонов при изменении дозы на два порядка). Увеличение дозы нонапептида до 0.1 нмоль на 100 г массы тела сопровождается выраженной способностью гормона влиять на реабсорбцию осмотически свободной воды и на натрийурез (рис. 2). Проведенные опыты показали, что имеется зависимость между выделением нонапептида почкой и натрийуретическим эффектом. Следует обратить внимание, что действие АВП на функцию почки менее длительно, чем эффекты такой же дозы АВТ (рис. 1, 2).
Рис. 1.
Влияние аргинин-вазопрессина (АВП) и аргинин-вазотоцина (АВТ) на очищение осмотически свободной воды почкой на фоне водной нагрузки (ВН). По оси абсцисс – время опыта, мин; по оси ординат – выведение осмотически свободной воды, мл/мин. 1 – ВН; 2 – ВН + АВП; 3 – ВН+АВТ. Стрелка – введение 0.001 нмоль на 100 г массы тела гормонов и 5% ВН, *p < < 0.05 – достоверность отличий эффекта гормонов при сравнении с ВН.
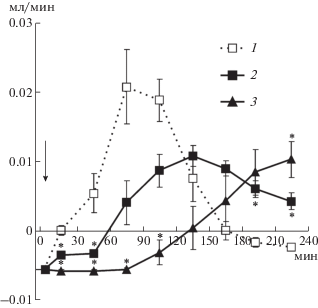
Рис. 2.
Экскреция ионов натрия почкой после инъекции различных доз аргинин-вазопрессина (АВП) и аргинин-вазотоцина (АВТ) на фоне ВН. По оси абсцисс – время опыта, мин; по оси ординат – выведение ионов натрия, мкмоль/мин. 1 – ВН; 2 – ВН + 0.1 нмоль на 100 г массы тела АВТ; 3 – ВН + 0.1 нмоль на 100 г массы тела АВП; 4 – ВН + 0.001 нмоль на 100 г массы тела АВП; 5 – ВН + 0.001 нмоль на 100 г массы тела АВТ. Стрелка – введение гормонов и 5% ВН, * p < 0.05 – достоверность отличий эффекта гормонов при сравнении с ВН.
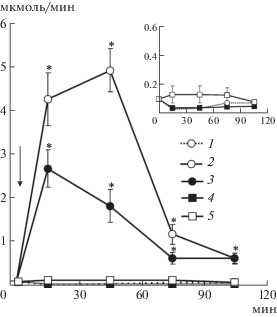
Сопоставление экскреции нонапептидов (рис. 3) и Na+ с мочой позволяет понять, в чем причина отличий реакции почки крыс на эти нонапептиды. У крыс оба гормона в небольших концентрациях влияют на реабсорбцию воды в канальцах почки, т.е. вызывают антидиуретическое действие. Полученные данные свидетельствуют о том, что под влиянием ВН осмоляльность сыворотки снижается с 295 ± 6 в контроле до 281 ± 1 мОсм/кг H2O (p < < 0.05) и тем самым рефлекторно подавляется секреция эндогенного АВП. После ВН концентрация АВП в крови у крыс становится очень мала и его экскреция падает до нулевых значений (рис. 3). После инъекции АВП в этих условиях в течение первых 30 мин растет его выведение почкой, а затем оно быстро снижается (рис. 3). При отсутствии АВП в сыворотке крови в условиях ВН появляется экспериментальная возможность измерить концентрацию АВТ с помощью ИФА после инъекции этого гормона крысам. Причина в том, что из-за высокой кросс-реактивности при использовании метода ИФА нельзя измерить концентрацию АВТ в присутствии АВП в одной и той же пробе. Применение нашего метода с блокадой секреции АВП нейрогипофизом при введении ВН позволило определить выделение АВТ почкой. Показано, что выделение АВТ длится дольше и его экскреция с мочой почти на 2 порядка выше, чем АВП (рис. 3). Следовательно, более выраженное влияние АВТ на реабсорбцию ионов Na+ в почке может определяться более медленным разрушением в крови этого нонапептида и поэтому более длительным эффектом.
Рис. 3.
Экскреция аргинин-вазопрессина (АВП) и аргинин-вазотоцина (АВТ) после их инъекции на фоне ВН. По оси абсцисс – время опыта, мин; по оси орди-нат – выведение нонапептидов, пг/мин. 1 – ВН + + 0.1 нмоль на 100 г массы тела АВТ; 2 – ВН + 0.1 нмоль на 100 г массы тела АВП; 3 – ВН. Стрелка – введение гормонов и 5% ВН, * p < 0.05 достоверность при сравнении к экскреции АВП.
Сопоставление выделения АВТ и Na+ почкой показывает, что имеется прямая корреляция между экскрецией этого гормона и натрийурезом (рис. 4). Представление об особенностях влияния изучаемых нонапептидов (АВП, АВТ) на выделение растворенных в ультрафильтрате веществ может дать сопоставление клиренса осмотически активных веществ и осмотически свободной воды в опытах с инъекцией одинаковых доз нонапептидов у крыс. АВТ и АВП увеличивают осмоляльное очищение (Cosm), что указывает на уменьшение реабсорбции различных ионов. Действие АВТ значительно превышает действие АВП (рис. 5). Оба нонапептида усиливают осмотическое концентрирование мочи, что находит выражение в усилении реабсорбции осмотически свободной воды в почке (рис. 5). Тем самым полученные результаты показали, что АВТ, гормон большинства “домлекопитающих” позвоночных, обладает у крыс более выраженным эффектом, чем АВП, на выделение осмотически активных веществ, в том числе Na+, но также повышает реабсорбцию воды в почке крыс. Естественно, необходим анализ причин бóльшего эффекта той же дозы АВТ у крыс по сравнению с АВП. Структура опытов с инъекцией АВП и АВТ была идентичной, одинаковыми были водный и пищевой режимы у крыс. Оказалось, что скорость деградации инъецированного АВП выше, чем АВТ (рис. 3). Тем самым при инъекции одинаковых доз нонапептидов кумулятивный эффект на транспорт воды и ионов в почке будет тем выше, чем дольше находится в крови гормон при условии, что он влияет на те же подтипы V-рецепторов. Введение одинаковых доз нонапептидов на фоне ВН, когда снижена секреция эндогенного АВП, позволяет рассчитать, какая часть гормона подвергается деградации и выводится с мочой. Расчеты показали, что если принять количество инъецированного гормона за 100%, то за 2 ч эксперимента с мочой выводится 16.48% АВТ и лишь 0.18% АВП. Это свидетельствует о большей устойчивости АВТ к деградации ферментами в организме крыс и соответственно наблюдается более выраженное натрийуретическое действие.
Рис. 4.
Зависимость между экскрецией аргинин-вазотоцина (АВТ) и ионов натрия при его инъекции на фоне ВН. По оси абсцисс – выведение АВТ, пг/мин; по оси ординат – выведение ионов натрия, мкмоль/мин; r – коэффициент корреляции.
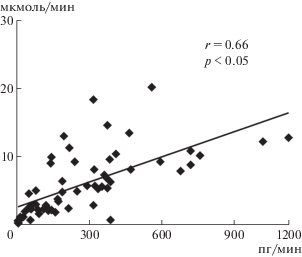
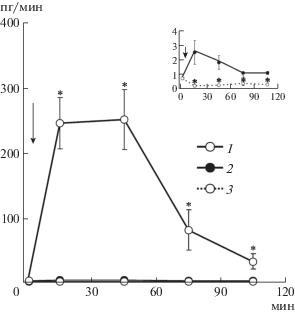
Рис. 5.
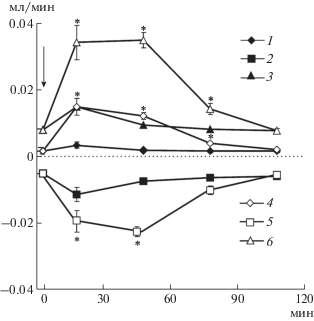
Клиренс осмотически активных веществ, диурез, клиренс осмотически свободной воды при инъекции аргинин-вазопрессина (АВП) и аргинин-вазотоцина (АВТ) без ВН. По оси абсцисс – время опыта, мин; по оси ординат – диурез (V), мл/мин; выведение осмотически активных веществ (COsm), мл/мин; выведение осмотически свободной воды (${{{\text{C}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$), мл/мин. При инъекции АВП: 1 – V; 2 – ${{{\text{C}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$; 3 – COsm. При инъекции АВТ: 4 – V; 5 – ${{{\text{C}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$; 6 – COsm. Стрелка – инъекция 0.1 нмоль на 100 г массы тела АВП и АВТ, * p < 0.05 достоверность при сравнении с эффектом АВП.
Динамическое изучение концентрации нонапептидов нейрогипофиза в крови крыс технически сложно. Если брать несколько проб крови у одного животного для измерения концентрации гормона в течение короткого времени, то это изменит объем циркулирующей в сосудах крови и вызовет стрессорную реакцию. Поэтому был использован новый подход с угнетением секреции АВП с помощью ВН и изучена динамика содержания в жидкостях внутренней среды АВП и АВТ после их инъекции по изменению экскреции почкой. АВП и АВТ полностью свободно фильтруются в клубочках почки, а потому поступают в просвет канальца в той же концентрации, что имеются в крови.
Почка у крыс при стандартном водном режиме функционирует в состоянии антидиуреза благодаря секреции нейрогипофизом антидиуретического гормона, которым у крыс является АВП. Он увеличивает осмоляльность в мозговом веществе почки и повышает осмотическую проницаемость клеток эпителия, что усиливает реабсорбцию осмотически свободной воды. Ранее нами было показано, что инъекция АВТ в дозе 0.05 нмоль на 100 г массы тела приводит не только к увеличению реабсорбции осмотически свободной воды, но и оказывает натрийуретическое действие [9, 10]. Усиление экскреции Na+ при увеличении дозы вводимого АВП коррелирует с экскрецией нонапептида с мочой [11]. У крыс на стандартном водном режиме без введения ВН инъекция 0.1 нмоль на 100 г массы тела АВТ вызывала усиление диуреза, натрийуреза и реабсорбции осмотически свободной воды. Натрийуретический эффект АВТ значительно превышал действие АВП (рис. 5).
Естественно, эффект вещества зависит от длительности его нахождения в крови. Были сопоставлены эффективные дозы АВП и АВТ на выведение ионов почками крыс и была произведена оценка степени их деструкции. На фоне ВН, которая снижала секрецию АВП (рис. 3), инъецировали АВП или АВТ в одинаковых дозах – 0.1 нмоль на 100 г массы тела. Найдена корреляция между экскрецией Na+ и выведением АВТ почкой (рис. 4). Инъекция АВТ уменьшает реабсорбцию клетками канальцев нефрона ионов Na, увеличивает диурез и салурез. Возникает, казалось бы невозможная ситуация: рост мочеотделения, из-за снижения реабсорбции ионов натрия и осмотически связанной с ними воды, одновременно сопровождается повышением реабсорбции осмотически свободной воды (рис. 2). В основе этого явления лежит стимуляция нонапептидом различных подтипов V-рецепторов, что приводит к снижению реабсорбции Na+ при стимуляции V1a-рецепторов, повышению осмоляльности мозгового вещества почки крыс и увеличению проницаемости стенок собирательных трубок для воды в результате стимуляции V2-рецепторов. Инъекция АВТ и АВП в одинаковых дозах в опытах без ВН сопровождается увеличением диуреза, салуреза одновременно с возрастанием реабсорбции осмотически свободной воды (рис. 5). Это обусловлено действием нонапептида на разные подтипы V-рецепторов, стимуляция которых зависит от концентрации гормона в крови [12, 13].
Сиюминутная концентрация нонапептида в крови после инъекции зависит от объема внеклеточной жидкости, в которой он распределяется, и одновременного действия на процесс ряда факторов: 1) скорости расщепления нонапептида, что определяет полупериод его жизни; 2) локуса действия гормона в клетке канальца почки – базолатеральная либо люминальная мембрана, поскольку V-рецепторы выявлены на обеих мембранах; 3) соотношения разных подтипов V-рецепторов в мембранах клеток разных частей канальцев в каждой из популяций нефронов в почках. В конце концов, это находит выражение в виде увеличения реабсорбции осмотически свободной воды, усилении экскреции ионов натрия, осмотически активных веществ, что функционально проявляется в более эффективном восстановлении осморегуляции у животных при действии инъецированного нонапептида.
Нонапептиды нейрогипофиза влияют на транспорт Na+ и воды не только в почке, но и в других осморегулирующих органах позвоночных животных. У амфибий АВТ увеличивает проницаемость для воды и регулирует транспорт Na+ клетками кожи и мочевого пузыря бесхвостых амфибий [14]. В почке млекопитающих АВП усиливает реабсорбцию Na+ при участии V2-рецепторов [15], в то же время АВП и АВТ в более высоких дозах вызывают выраженный натрийурез, действуя на V1а-рецепторы [16, 17].
Смена АВТ на АВП была связана и с появлением высокого уровня осмотического концентрирования мочи у эндотермных позвоночных. Отчасти у птиц, но преимущественно у млекопитающих, нонапептиды нейрогипофиза, сохраняя высокую функциональную активность, действуют на почку в иных условиях, исходя из их предназначения для физико-химической стабильности крови. Появление эндотермных позвоночных (птицы, млекопитающие) сопровождалось формированием системы осмотического концентрирования мочи, которой не было у представителей других классов позвоночных. Работу этой системы регулирует антидиуретический гормон. Так как у всех позвоночных, кроме теплокровных, осмоляльность мочи не превышает осмоляльности сыворотки крови, следовательно, концентрация основного осмотически активного компонента сыворотки крови – Na+ не может быть больше его концентрации в выделяемой моче. Поэтому должны быть синхронизированы объем выделяемой мочи и количество экскретируемого Na+, что очень важно для контроля объема внеклеточной жидкости, общего содержания в ней Na+, и, в конечном счете, гемодинамики. Иное дело у млекопитающих, где осмоляльность мочи может быть значительно выше осмоляльности крови. В этом случае натрийуретический эффект нонапептида мог бы привести к существенным изменениям баланса Na+ и вызвать нарушение объема внеклеточной жидкости, оказать негативное влияние на циркуляцию крови.
Поясним сказанное, так как почка млекопитающих может выделять осмотически концентрированную мочу, то в ней может быть в несколько раз выше концентрация Na+, чем в крови. Становится необходим не только строгий контроль объема внеклеточной жидкости, но и концентрации в ней натрия, и, следовательно, общего количества Na+ в организме. Решить проблему позволило бы, по-видимому, создание системы более динамичной регуляции водно-солевого обмена. При однократном прохождении крови по сосудам почки профильтровавшийся АВП поступает в просвет канальца. Гормон может взаимодействовать с V-рецепторами люминальных мембран клеток нефрона и оказывать эффект. Часть АВП захватывается клетками эпителия проксимального канальца, подвергается гидролизу, все аминокислоты реабсорбируются и вновь используются для построения новых молекул, в том числе и АВП, часть гормона экскретируется с мочой. У млекопитающих возникает потребность в более быстрой регуляции, чем у других позвоночных, поскольку у теплокровных выше скорость биохимических реакций в соответствии с Q10. Появление АВП вместо АВТ дает преимущество при адаптации к разным экологическим условиям: удается без изменения компонентов системы, но обеспечивая высокую скорость подгонки нужной концентрации данного гормона в крови, приспособиться к складывающейся ситуации при адаптации к разным условиям водно-солевого режима. Такой подход позволил сохранить принципиально ту же систему регуляции, но ускорил смену концентрации гормона в крови при более быстром разрушении секретированного гормона и секреции в кровь необходимого, иногда такого же, количества нонапептида, в соответствии с сиюминутными потребностями организма. Все это обеспечила мутация, которая привела к замене изолейцина на фенилаланин в 3-м положении кольцевой части молекулы АВТ и его преобразовании в АВП. В итоге в гипофизе млекопитающих основным гормоном стал вазопрессин, который сменил вазотоцин.
Смена химического строения нонапептида касается одного из элементов этой системы в ходе эволюции. Осуществление разных функций, обеспечиваемых одним нонапептидом, было решено природой, благодаря возникновению разных подтипов V-рецепторов. Их стимуляция зависит от разных концентраций гормона в крови, что решает проблему селективности эффекта. Суть в том, что даже при такой модификации (смена АВТ на АВП) разные подтипы V-рецепторов, локализованные в плазматической мембране одной клетки, будут по-разному включаться в регуляцию функции в зависимости от концентрации гормона в крови. Это касается V1a-, V1в- и V2-рецепторов. Известно, что они имеются в мембранах клеток дистального сегмента нефрона, толстого восходящего отдела петли Генле и собирательных трубок [15, 18], V1a-рецепторы также локализованы в клетках стенок сосудов [13].
В экспериментах с микропункцией нефрона и на изолированных канальцах было показано, что АВП увеличивает реабсорбцию Na+, стимулируя V2-рецепторы [19]. В значительных концентрациях АВП приводит к усилению экскреции Na+ [20–24]. Это обусловлено тем, что АВП в зависимости от дозы вызывает два противоположно направленных эффекта на транспорт Na+: 1) увеличение реабсорбции Na+, при активации V2-рецепторов, и его аккумуляцию в мозговом веществе почки для повышения осмотического концентрирования; 2) увеличение натрийуреза при стимуляции V1a-рецепторов. Ранее нами было показано, что величина экскретируемого почкой Na+ при селективной стимуляции V1a-рецепторов сопоставима с эффектом фуросемида [25]. Такой силы натрийуретический эффект может вызвать блокада функции Na, K, 2Cl-котранспортеров, которые локализованы в толстом восходящем отделе петли Генле. При блокаде V1a-рецепторов натрийуретический эффект нонапептидного регулятора прекращается [10, 23].
Данные настоящей работы дают основание высказать предположение о биохимических механизмах отличий участия АВП и АВТ в регуляции функций и предпочтительности АВП для млекопитающих. В опытах с введением равных количеств этих нонапептидов крысам видно, что выделение АВТ почкой длится дольше, чем АВП. Это означает, что он медленнее расщепляется, дольше сохраняется в крови и дольше оказывает физиологическое действие, в том числе на реабсорбцию воды и экскрецию ионов почкой, регуляция при участии АВТ становится более инертной. В то же время смену концентрации гормона в крови можно рассматривать как важный фактор эффективности обеспечения гомеостаза. Поэтому столь существенный фактор в системе регуляции, как удаление гормона из крови и секреция в нее в данный момент времени нужных его количеств, позволяет строго контролировать гомеостатические параметры организма. Изменение осмоляльности сыворотки крови затрагивает функции всех клеток млекопитающих, поскольку от концентрации АВП зависит осмоляльность внеклеточной жидкости, а оттого объем каждой клетки. Этот фактор влияет на ряд функций различных органов и систем, прежде всего нейронов мозга.
Проведенный анализ показывает, сколь существенное значение в структуре эволюционной физиологии [26] может иметь предлагаемый в данной работе новый метод исследований эволюции функций с изучением эффекта утраченных гормонов для понимания развития и становления систем регуляции. Иными словами, изучение эффекта ранее действовавших физиологически активных веществ у животных для организмов последующих уровней эволюционного развития. Нельзя не обратить внимание на многоплановость решения проблем эволюции функций на примере водно-солевого гомеостаза у млекопитающих. Одна из линий развития касалась смены нонапептида [1], другая линия касается эволюции рецепторов вазопрессина и окситоцина [27]. Данные настоящего исследования позволяют проникнуть в смысл перемен состояния функции, к которым привели отобранные эволюцией варианты развития.
Таким образом, АВТ и АВП в почке крыс вызывают в зависимости от концентрации как снижение, так и увеличение реабсорбции Na+; как возрастание экскреции жидкости, так и усиление реабсорбции осмотически свободной воды. Эти эффекты зависят от влияния на разные подтипы V‑рецепторов, активируемые в зависимости от концентрации гормона в сыворотке крови. Предложенный в настоящем исследовании метод определения концентрации АВТ в условиях практически полного подавления секреции АВП может быть применен и для измерения эффекта других аналогов вазопрессина и вазотоцина, которые имеют сходное строение с АВП. Использованный прием позволяет выявить физиологические эффекты нонапептида, и также может иметь широкое применение, когда физиологическим путем временно удается полностью подавить секрецию гормона и на этом фоне определить эффект иных регуляторных молекул подобного действия.
Список литературы
Bentley P.J. Endocrines and osmoregulation. A comparative account in vertebrates. Berlin, 2002.
Наточин Ю.В. Эволюция осморегуляции у позвоночных // Рос. физиол. журн. им. И.М. Сеченова. 1999. Т. 85. № 4. С. 582–593.
Donaldson Z.R., Young L.J. Oxytocin, vasopressin, and the neurogenetics of sociality // Science. 2008. Vol. 322. №. 5903. P. 900–904.
Caldwell H.K. Oxytocin and vasopressin: powerful regulators of social behavior // Neuroscientist. 2017. doi: 10.1177/1073858417708284
Acher R., Chauvet J., Rouille Y. Dynamic processing of neuropeptides // J. Mol. Neurosci. 2002. Vol. 18. № 3. P. 223–228.
Banerjee P., Joy K.P., Chaube R. Structural and functional diversity of nonapeptide hormones from an evolutionary perspective: A review // Gen. Comp. Endocrinol. 2017. V. 241. P. 4–23. doi: 10.1016/j.ygcen. 2016.04.025.
Wallis M. Molecular evolution of the neurohypophysial hormone precursors in mammals: comparative genomics reveals novel mammalian oxytocin and vasopressin analogues // Gen. Comp. Endocrinol. 2012. V. 179. № 2. P. 313–318.
Наточин Ю.В. Почка: Справочник врача. СПб., 1997.
Гао Цзе, Наточин Ю.В. Эволюционные преимущества участия вазопрессина вместо вазотоцина в регуляции водно-солевого обмена у млекопитающих // Ж. эвол. биохим. и физиол. 2004. Т. 40. № 2. С. 168–172.
Канашкина Т.А, Кузнецова А.А., Шахматова Е.И., Наточин Ю.В. Роль V1a- и V2-рецепторов в механизме физиологического парадокса – увеличение реабсорбции осмотически свободной воды на фоне повышения диуреза // Рос. физиол. журн. им. И.М. Сеченова. 2006. Т. 92. № 10. С. 1228–1238.
Kutina A V., Golosova D.V., Marina A.S., Shakhmato-va E.I., Natochin Y.V. Role of vasopressin in the regulation of renal sodium excretion: interaction with glucagon-like peptide-1 // J. Neuroendocrinol. 2016. V. 28. № 4. doi: .10.1111/jne.12367
Bankir L., Bichet D.G., Bouby N. Vasopressin V2 receptors, ENaC, and sodium reabsorption: a risk factor for hypertension? // Am. J. Physiol. Renal Physiol. 2010. V. 299. № 5. P. F917–F928.
Koshimizu T.A., Nakamura K., Egashira N., Hiroyama M., Nonoguchi H., Tanoue A. Vasopressin V1a and V1b receptors: from molecules to physiological systems // Phys. Rev. 2012. V. 92. № 4. P. 1813–864.
Наточин Ю.В., Чапек К. Методы исследования транспорта ионов и воды. Почечные канальцы, кожа, мочевой пузырь. Л., 1976.
Mutig K., Paliege A., Kahl T., Jöns T., Müller-Esterl W., Bachmann S. Vasopressin V2 receptor expression along rat, mouse, and human renal epithelia with focus on TAL // Am. J. Physiol. Renal Physiol. 2007. V. 293. № 4. P. F1166–F1177.
Наточин Ю.В., Канашкина Т.А., Шахматова Е.И., Беспалова Ж.Д., Мордцинцев Д.Ю., Поляк Я.Л. Влияние аналогов вазотоцина на выведение ионов Na+, K+, Mg2+ почкой крыс // Эксперм. и клин. фармакол. 2008. Т. 71. № 2. С. 32–35.
Bankir L. Antidiuretic action of vasopressin: quantitative aspects and interaction between V1a and V2 receptor-mediated effects // Cardiovasc. Res. 2001. V. 51. P. 372–390.
Ecelbarger C.A., Kim G.H., Wade J.B., Knepper M.A. Regulation of the abundance of renal sodium transporters and channels by vasopressin // Exp. Neurol. 2001. V. 171. № 2. P. 227–234.
Fenton R., Knepper M. Mouse models and the urinary concentrating mechanism in the new millennium // Physiol. Rev. 2007. V. 87. № 70. P. 1083–1112.
Balment R.J., Brimble M.J., Forsling M.L., Musabayane C.T. Natriuretic response of the rat to plasma concentrations of arginine vasopressin within the physiological range // J. Physiol. 1984. V. 352. P. 517–526.
Forsling M.L., Judah J.M., Windle R.J. The effect of vasopressin and oxytocin on glomerular filtration rate in the conscious rat: contribution to the natriuretic response // J. Endocrinol. 1994. V. 141. № 1. P. 59–67.
Kompanowska-Jezierska E., Emmeluth C., Grove L., Christensen P., Sadowski J., Bie P. Mechanism of vasopressin natriuresis in the dog: role of vasopressin receptors and prostaglandins // Am. J. Physiol. 1998. V. 274. V. 6. Pt 2. P. R1619–1625.
Perucca J., Bichet D.G., Bardoux P., Bouby N., Bankir L. Sodium excretion in response to vasopressin and selective vasopressin receptor antagonists // J. Am. Soc. Nephrol. 2008. V. 19. № 9. P. 1721–1731.
Kortenoeven M.L., Pedersen N.B., Rosenbaek L.L., Fenton R.A. Vasopressin regulation of sodium transport in the distal nephron and collecting duct // Am. J. Physiol. Renal Physiol. 2015. V. 309. № 4. P. F280–F299.
Голосова Д.В., Каравашкина Т.А., Кутина А.В., Марина А.С., Наточин Ю.В. Влияние селективных агонистов V1a, V2 и V1b рецепторов на транспорт натрия в почке крыс // Бюл. эксп. биол. и мед. 2015. Т. 160. № 12. С. 712–715.
Наточин Ю.В. Эволюционная физиология // Ж. эвол. биохим. и физиол. 2017. Т. 53. № 2. С. 139–150.
Paré P., Paixão-Côrtes V.R., Tovo-Rodrigues L., Vargas-Pinilla P., Viscardi L.H., Salzano F.M., Henkes L.E., Bortolini M.C. Oxytocin and arginine vasopressin receptor evolution: implications for adaptive novelties in placental mammals // Genet. Mol. Biol. 2016. V. 39. № 4. P. 646–657.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


