Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 1, стр. 43-50
ВЛИЯНИЕ ЭКСТРАКТА EUBOTHRIUM RUGOSUM (CESTODA) НА ПРОТЕОЛИТИЧЕСКУЮ АКТИВНОСТЬ В КИШЕЧНИКЕ РАЗЛИЧНЫХ ВИДОВ РЫБ
Г. И. Извекова 1, *, Т. В. Фролова 1, Е. И. Извеков 1, А. Н. Паршуков 2, М. М. Соловьев 3, 4
1 Институт биологии внутренних вод им. И.Д. Папанина РАН
Ярославская обл., Борок, Россия
2 Институт биологии КарНЦ РАН
Петрозаводск, Россия
3 Институт систематики и экологии животных СО РАН
Новосибирск, Россия
4 Томский государственный университет
Томск, Россия
* E-mail: izvekov@ibiw.yaroslavl.ru
Поступила в редакцию 22.11.2016
После доработки 02.02.2018
Принята к публикации 15.08.2018
Аннотация
Установлено, что экстракт цестоды Eubothrium rugosum ингибирует активность протеиназ кишечника хозяина – налима. Снижение протеолитической активности слизистой оболочки кишечника при использовании в качестве ингибитора экстракта E. rugosum сопоставимо с таковым при применении ингибитора сериновых протеиназ – PMSF, свидетельствуя о том, что выделяемый цестодой ингибитор инактивирует основные сериновые протеиназы кишечника – трипсин и химотрипсин. Показано, что экстракт червя ингибирует протеолитическую активность слизистой оболочки кишечника не только у налима, но и у двух других видов рыб (синца и леща). Применение индекса Джини позволило выявить определенную неравномерность распределения уровней процентного ингибирования для анализируемого набора видов. Согласно результатам этого анализа, экстракт червя оказывает более селективное ингибирующее воздействие на протеиназы различных видов рыб, по сравнению с PMSF. Это свидетельствует о частичной, но достаточно четко выраженной видовой селективности продуцируемого гельминтом ингибитора по отношению к протеиназам хозяина, что может вносить определенный вклад в формирование специфичности взаимоотношений хозяина и паразита.
ВВЕДЕНИЕ
Одна из фундаментальных проблем паразитологии – проблема взаимоотношений паразита и его хозяина. Для установления тесных специфичных взаимоотношений при попадании в организм хозяина паразит всесторонне адаптируется к жизни в этих условиях. Кроме того, гельминты, обитающие в кишечнике позвоночных животных, должны противостоять действию протеолитических ферментов хозяев. Один из главных механизмов защиты от этих ферментов – секреция ингибиторов, способных эффективно инактивировать протеиназы хозяина в среде обитания гельминтов [1]. Достаточно давно считается, что паразиты могут использовать ингибиторы протеиназ для выживания в хозяине. Довольно велико количество выделенных и описанных ингибиторов протеиназ белкового происхождения [2], относящихся к группе ингибиторов сериновых протеиназ [3]. В связи с эпидемиологической значимостью многих видов нематод исследован очень широкий круг этих паразитов, в результате чего у них обнаружены ингибиторы всех классов протеиназ (аспартиловых, сериновых, цистеиновых и металлопротеиназ). В то же время цестоды в этом отношении исследованы в значительно меньшей степени. К настоящему моменту для них установлено существование только ингибиторов сериновых протеиназ – трипсина и химотрипсина [4]. Серия работ посвящена исследованию способности цестоды Hymenolepis diminuta, паразитирующей в кишечнике крыс, ингибировать протеиназы хозяина [1, 5, 6]. Однако далеко не всегда удается обнаружить у цестод ингибирующую способность или выделить ингибиторы протеиназ у этих червей [7, 8].
Цель исследования – определить способность широко распространенной цестоды Eubothrium rugosum, обитающей в кишечнике налима, ингибировать активность щелочных протеиназ в кишечнике хозяина и установить, насколько специфичен выделяемый цестодой ингибитор для протеиназ налима.
МАТЕРИАЛ И МЕТОДИКА
Объект исследований. Объектом исследований служили цестоды E. rugosum из кишечника налима Lota lota. Исследованы черви из 5 налимов, выловленных в зимний период в Рыбинском водохранилище. Число червей в одном налиме колебалось от 1 до 10 экз., масса – от 0.31 до 1.88 г. Вскрытие рыб, их кишечников, извлечение червей и приготовление различных препаратов производили на ледяной бане.
Кишечники рыб вскрывали, извлекали червей и трижды тщательно промывали в 10 мл раствора Рингера (рН 7.5) для холоднокровных животных с целью удаления ферментов хозяина.
Приготовление гомогенатов червей и слизистой оболочки кишечника рыб. Извлеченных из кишечников налимов и отмытых, как описано выше, червей разделили на 5 близких по массе групп, гомогенизировали, и гомогенат разводили раствором Рингера в соотношении масса: объем 1 : 9.
Для определения протеолитической активности кишечника хозяина и исследования ингибирующей способности червей готовили гомогенаты слизистой оболочки кишечника налимов. Для проверки гипотезы о возможной специфичности ингибирующей способности червей по отношению к активности протеиназ хозяев готовили гомогенаты слизистой оболочки кишечника различных видов рыб (см. таблицу 1). Для этого после вскрытия кишечника и удаления химуса скребком снимали слизистую оболочку, гомогенизировали ее и разводили раствором Рингера в соотношении 1:49. Все гомогенаты готовили с помощью стеклянных гомогенизаторов фирмы Sartorius AG (Germany).
Таблица 1.
Исследованные виды рыб
| Вид рыб, n* | Водоем | Время вылова | Размер рыб, см | Тип питания |
|---|---|---|---|---|
| Налим Lota lota, n = 5 | Рыбинское водохранилище | Февраль 2016 | 44–48 | Хищник – факультативный бентофаг |
| Судак Sander lucioperca, n = 4 | “ | Август 2016 | 48–54 | Хищник |
| Синец Ballerus ballerus, n = 4 | “ | Август 2016 | 29.4–30.1 | Планктофаг |
| Лещ Abramis brama, n = 3 | “ | Август 2016 | 35.5–41.6 | Бентофаг |
| Щука Esox lucius, n = 3 | “ | Май 2016 | 48–50 | Хищник |
| Форель Oncorhynchus mykiss, n = 4 | Садки, Ладожское озеро | Сентябрь 2015 | 28.8–30.0 | Хищник |
| Окунь Perca fluviatilis, n = 4 | Ладожское озеро | Сентябрь 2015 | 14.5–14.7 | Хищник |
Гомогенаты червей и слизистой оболочки кишечника центрифугировали при 6500 g в течение 5 мин при 4°C. Для определения протеолитической активности слизистой оболочки кишечника и ингибирующей способности червей использовали полученные супернатанты.
Определение ингибирующей способности. В качестве источника ингибиторов протеиназ у червей использовали супернатант (экстракт) их гомогената. Для определения ингибирующей способности в опытную среду, содержащую 500 мкл гомогената слизистой оболочки кишечника, добавляли 50 мкл экстракта червей и инкубировали в течение 15 мин при температуре 20–22°C. В серии предварительных экспериментов было установлено, что увеличение объема экстракта гельминта не приводит к росту ингибирования, поэтому соотношение 1 : 9, указанное выше, при приготовлении экстракта выбрано как оптимальное. Одновременно в соответствующую контрольную пробу добавляли аналогичный объем буфера. После этой инкубации в пробах определяли протеолитическую активность, как описано ниже.
Для сравнения с уровнями ингибирующей способности экстрактов E. rugosum определяли ингибирующий эффект 50 мкл PMSF (фенил-метил-сульфонил-флуорид) – ингибитора сериновых протеиназ, в концентрации 100 мМ в DMSO (диметилсульфоксид), по отношению к протеолитической активности слизистой оболочки кишечника различных видов рыб.
Определение протеолитической активности. Суммарную активность протеиназ в гомогенате слизистой оболочки кишечника рыб (активность трипсина НФ 3.4.21.4, химотрипсина НФ 3.4.21.1 и дипептидаз НФ 3.4.13.18) определяли с использованием в качестве субстрата 0.3% азо-казеина в трис-буфере, рН 7.5 [9]. Субстрат и ферментативно активный препарат инкубировали 60 мин при 20–22°С. Реакцию останавливали добавлением 1 мл 0.3 N раствора трихлоруксусной кислоты (ТХУ), образовавшийся осадок из негидролизованного белка удаляли центрифугированием при 6500 g в течение 5 мин. Интенсивность развивающегося окрашивания, пропорционального активности ферментов, измеряли в супернатанте при 440 нм на спектрофотометре Lambda 25 (PerkinElmer).
Протеиназную активность (ЕА) выражали как разность (ΔЕ) между показаниями спектрофотометра для пробы с субстратом и холостой пробы (содержащей вместо фермента и ингибитора соответствующий объем буфера) в расчете на единицу массы слизистой оболочки кишечника за 1 минуту (ΔЕ × г–1 × мин–1). Все биохимические определения проводили в трех повторностях.
Количественная оценка видовой селективности ингибиторов. Селективность ингибирующего воздействия экстракта червя и PMSF на протеиназы хозяина и других видов рыб оценивали с помощью индекса Джини [10]. Этот показатель рассчитывается для набора значений процентного ингибирования, полученных при одной и той же концентрации ингибитора. Значения сортировали в порядке усиления ингибирующего эффекта, суммировали и нормализовали. Затем вычисляли индекс Джини, анализируя зависимость кумулятивной доли суммарного ингибирования от кумулятивной доли числа тестируемых видов. Показатель может принимать значения от нуля (отсутствие селективности) до единицы (абсолютная селективность). Расчеты проводили в двух вариантах: 1) для всего набора из семи исследуемых видов и 2) для более узкого круга из пяти хищных видов (т.е. за исключением леща и синца).
Статистическая обработка. Результаты представлены в виде средних и их стандартных ошибок. Обработка результатов выполнена с помощью статистических пакетов “Microsoft Excel 2010” и STATISTICA 8 (StatSoft Inc., Tulsa, OK). Ингибирующий эффект оценивали при помощи однофакторного дисперсионного анализа с использованием критерия Тьюки для множественного сравнения средних значений при p < 0.05. Достоверность различий в эффективности ингибирования между экстрактом гельминта и синтетическим ингибитором PMSF в процентном выражении оценивали с помощью двухстороннего критерия Манна–Уитни для каждого вида рыб в отдельности.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
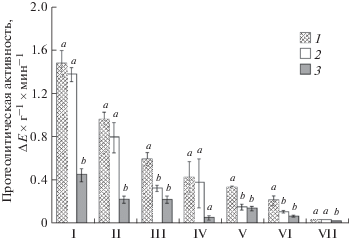
В результате проведенных исследований установлено, что добавление 50 мкл экстракта червя E. rugosum к реакционной смеси при определении протеолитической активности слизистой оболочки кишечника налима снижает эту активность почти в 2 раза с 0.587 ± 0.068 до 0.323 ± 0.023 ΔЕ × г–1 × мин–1. PMSF снижает активность протеиназ слизистой оболочки кишечника налима до 0.214 ± 0.038 ΔЕ × г–1 × × мин–1, что достоверно не отличается от значений, полученных при использовании экстракта червей как источника ингибитора. Однако при вычислении доли ингибирования экстрактом червей и PMSF обнаружены достоверные различия в этих показателях: экстракт червя ингибирует активность протеиназ кишечника на 45.4%, а PMSF – на 64.3% (критерий Манна–Уитни; p < 0.05).
Проверка гипотезы о специфичности ингибирующей способности E. rugosum по отношению к протеиназам хозяина показала, что экстракт червей ингибирует активность протеиназ не у всех исследованных видов рыб (рис. 1). Так, добавление экстракта червей достоверно снижает активность протеиназ слизистой оболочки кишечника у трех из семи исследованных видов рыб: у хозяина – налима, а также у синца и леща (p < 0.05). В то же время PMSF достоверно снижает активность протеиназ слизистой оболочки кишечника у всех исследованных видов рыб, за исключением судака. Следует отметить, что для слизистых оболочек кишечника налима, синца и леща не установлено достоверных различий в снижении протеолитической активности при использовании экстракта червей и PMSF, в то время как для остальных исследованных видов рыб PMSF снижал активность протеиназ в значительно большей степени, чем экстракт цестод (рис. 1).
Рис. 1.
Протеолитическая активность слизистой оболочки кишечника различных видов рыб (1) и влияние на нее экстракта червей E. rugosum (2) и PMSF (3). По оси ординат – протеолитическая активность, ΔЕ × г–1 × мин–1, по оси абсцисс – I – форель, II – окунь, III – налим, IV – судак, V – синец, VI – лещ, VII – щука. Средние значения, обозначенные разными буквенными индексами (a и b), достоверно отличаются друг от друга (p < 0.05) для каждого отдельного вида рыб.
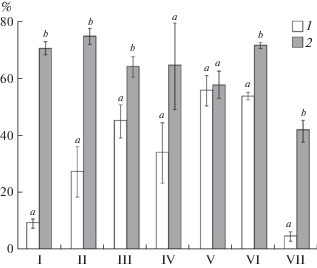
Вычисление доли ингибирования активности протеиназ слизистой оболочки кишечника изученных видов рыб позволило установить, что только у синца и судака эта активность ингибируется экстрактом E. rugosum и PMSF в одинаковой степени. Для всех остальных исследованных рыб PMSF ингибирует протеолитическую активность слизистой оболочки кишечника достоверно сильнее, чем экстракт E. rugosum, p < 0.05 (рис. 2). При этом доля ингибирования активности PMSF для разных видов рыб колеблется от 41.8% (щука) до 75.2% (окунь), в то время как экстракт E. rugosum ингибирует эту активность в пределах от 4.6% (щука) до 56.2% (синец). Самая низкая доля ингиби-рования экстрактом червя отмечена для слизистой оболочки кишечника форели и щуки, а самая высокая – для леща и синца (рис. 2).
Рис. 2.
Доля (%) ингибирования протеолитической активности слизистой оболочки кишечника различных видов рыб экстрактом червей E. rugosum (1) и PMSF (2). По оси ординат – %, остальные обозначения как на рис. 1.
Однофакторный дисперсионный анализ показал, что вид рыбы как фактор оказывал достоверный эффект на величину процентного ингибирования как зависимую переменную и в случае экстракта гельминта (F = 103.90, p 0.0001), и в случае PMSF, но в гораздо меньшей степени (F = 9.55, p < < 0.001). Серия множественных попарных сравнений продемонстрировала, что эффективность действия ингибитора, продуцируемого цестодой, на протеолитические ферменты кишечника хозяина не проявляет достоверных отличий от соответствующих значений для аналогичных ферментов леща, синца и судака (p > 0.05). В то же время протеиназы слизистой оболочки кишечника у налима оказались более чувствительными к воздействию экстракта червя, по сравнению с протеиназами из кишечника других хищников (форели, щуки и окуня) (p < 0.05).
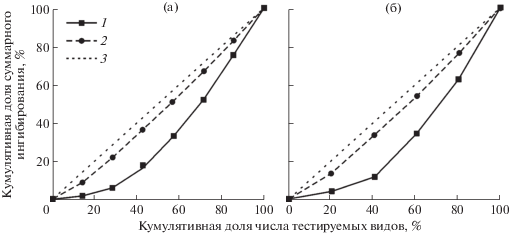
Как показывает индекс Джини, видовая селективность эффекта ингибирования при использовании экстракта червя более выражена, чем при использовании раствора PMSF (рис. 3). Так, при воздействии ингибитора, продуцируемого червем, кумулятивные кривые отстоят значительно дальше от диагональной линии графика, указывая на более неравномерное распределение данных по разным видам рыб, чем при использовании PMSF. Соответственно индекс Джини достигает 32.4% в случае применения экстракта червя и не превышает 8.6% в случае воздействия PMSF (при использовании полного набора данных от семи видов рыб). Сходные результаты были получены и при анализе аналогичных данных отдельно для хищных видов рыб (соответственно 35.2 и 9.3%).
Рис. 3.
Оценка селективности ингибирующего действия экстракта Eubothrium rugosum (1) и PMSF (2) при использовании полного набора данных по семи видам рыб (а) и для подгруппы из пяти хищных видов (б) (3 – отсутствие ингибирования). По оси ординат – кумулятивная доля суммарного ингибирования (%), по оси абсцисс – кумулятивная доля числа тестируемых видов (%).
Следует также отметить, что при воздействии экстракта червей среднее значение процентного ингибирования для вида-хозяина (45.4%) было заметно выше по сравнению со средним уровнем для всех остальных видов рыб (31.0%). При использовании же PMSF, эти уровни были практически одинаковыми (64.3% и 64.4% соответственно). Согласно критерию Манна–Уитни, различия между сравниваемыми выборками были значимыми (p < 0.05) в первом случае (т.е. при воздействии экстракта червей) и недостоверными во втором (т.е. при воздействии PMSF). Эти данные также указывают на определенную степень специфичности ингибитора, продуцируемого червями, по отношению к протеиназам хозяина, а также на его более выраженную селективность по сравнению с эффектом PMSF.
ОБСУЖДЕНИЕ
Использование PMSF – ингибитора сериновых протеиназ – позволило установить преобладание активности этих протеиназ, представленных трипсином, химотрипсином и эластазой [11], у всех изученных видов рыб. По всей вероятности, различия в уровнях активности сериновых протеиназ у исследованных видов рыб связаны с различиями в местах обитания, сроках отлова рыб и их типов питания [12]. Имеющиеся в литературе данные также указывают на большую вариабельность доли сериновых протеиназ в общей протеолитической активности различных видов рыб. Преобладание активности сериновых протеиназ в общей протеолитической активности показано для рыб с различным типом питания – растительноядных, всеядных и хищных [13]. Так, для хищника араваны Scleropages formosus установлено 77.1% ингибирование сериновых протеиназ ингибитором PMSF [11]. В пило-рических придатках некоторых лососевых рыб ингибируется 44.09–70.27% сериновых протеиназ [14]. В кишечнике трех видов карповых Catla catla, Labeo rohita и Hypophthalmichthys molitrix PMSF ингибирует 59.1–79.6% активности [15], в кишечнике обыкновенного робало Centropomus undecimalis активность протеиназ снижается на 60% [16], а толстогубой кефали Chelon labrosus – на 87% [17]. Значительно меньшее ингибирование протеиназ этим ингибитором показано для хищных рыб дорады Sparus aurata, окуня-клювача Sebastes mentella (43.7 и 46.3% соответственно) и совсем незначительное 11.5% – для тюрбо Scophthalmus maximus [18]. Небольшое ингибирование (26%) PMSF установлено в кишечнике всеядной пресноводной рыбы брикон Brycon orbignyanus [19]. Различные уровни ингибирования сериновых протеиназ даже у рыб с одинаковым типом питания могут быть связаны с видовыми и физиологическими особенностями исследованных рыб [12], с возможными видоспецифичными особенностями структуры сериновых протеиназ, а также с различными методами, используемыми разными авторами при определении активности этих ферментов.
Снижение протеолитической активности слизистой оболочки кишечника налима при добавлении экстракта E. rugosum свидетельствует о присутствии в нем ингибитора протеиназ. Известно, что ингибиторы протеиназ секретируются в окружающую среду в незначительных количествах [20]. Поскольку объем реакционной смеси при определении протеолитической активности составляет 1.5 мл, а для определения ингибирования добавляется 50 мкл разведенного в 10 раз гомогената червей, т.е. от начальной массы червя разведение составляет 300 раз, можно предположить, что E. rugosum продуцирует небольшие количества высокоэффективного ингибитора протеиназ. Поскольку снижение протеолитической активности слизистой оболочки кишечника при использовании в качестве ингибитора экстракта E. rugosum сопоставимо с таковым при применении ингибитора сериновых протеиназ – PMSF, можно предположить, что выделяемый цестодой ингибитор инактивирует основные сериновые протеиназы кишечника – трипсин и химотрипсин. Несмотря на то что доля ингибирования протеиназ при использовании экстракта E. rugosum значительно ниже, чем при применении PMSF, в кишечнике цестода устойчива к действию протеолитических ферментов. Очевидно, продуцируемого количества ингибитора достаточно, чтобы обеспечить паразиту эту устойчивость. По мнению некоторых авторов, взаимодействие протеиназ хозяев и ингибиторов, продуцируемых цестодами, происходит непосредственно на адсорбционной поверхности последних, что приводит к необратимой инактивации фермента [5, 6].
Полученные данные об ингибирующем действии экстракта цестод на активность протеиназ хозяев согласуются с имеющимися в литературе сведениями. Так, ранее обнаружено ингибирование протеолитической активности экстрактами плероцеркоидов Ligula intestinalis из полости тела леща и взрослых червей из кишечника утки [21]. Позже было установлено, что экстракты, приготовленные из личинок и взрослых червей Bothriocephalus acheilognathi, угнетали трипсиновую и химотрипсиновую активность кишечника карпа in vitro [22]. При этом известно, что большинство охарактеризованных белковых ингибиторов гельминтов относятся к группе ингибиторов сериновых протеиназ [3].
Согласно первоначальной рабочей гипотезе, предполагалось, что поскольку E. rugosum паразитирует только в кишечнике налима, выделяемый цестодой ингибитор может быть специфичным для протеиназ хозяина. Это предположение также опиралось на мнение некоторых авторов о том, что от ингибиторов протеиназ паразитов зависит специфичность паразита к хозяину [23]. Однако результаты проведенных исследований оказались не столь однозначными. С одной стороны, экстракт червя достоверно понижал активность протеиназ слизистой оболочки кишечника не только налима, но также двух других видов рыб (синца и леща). Это показывает, что специфичность исследуемого ингибитора в отношении протеиназ хозяина и других видов далеко не абсолютна. В то же время имеются определенные свидетельства частичной селективности данного ингибитора. Согласно результатам однофакторного дисперсионного анализа, ингибирующая способность экстракта червей достоверно зависела от вида исследуемых рыб, что также свидетельствует о селективном характере действие данного ингибитора. Статистически, значения процентного ингибирования для протеиназ кишечника налима были не ниже, чем для аналогичных ферментов остальных рыб, и в то же время достоверно выше, чем для большинства таковых у хищных видов. В пользу частичной селективности ингибитора, вырабатываемого E. rugosum, свидетельствует и индекс Джини, значения которого также указывают на неравномерное распределение уровней процентного ингибирования для исследуемого набора видов. Значения индекса Джини были невысокими (32.4–35.2% в зависимости от варианта расчета). В то же время они вполне сопоставимы со значениями, полученными при исследовании некоторых других ингибиторов. Например, коэффициенты Джини, вычисленные для 40 ингибиторов киназ, каждый из которых воздействовал на 85 различных киназ, изменялись в широких пределах от 9.3% для неселективного ингибитора до 90.5% для высокоселективного, составляя 56.8% для ингибитора с умеренной селективностью [10]. Следует отметить, что экстракт гельминта отличался более выраженной селективностью воздействия в сравнении с PMSF. В случае полного набора данных (включавшего семь протестированных видов рыб), индекс Джини, скорее, характеризует общую неравномерность процентного ингибирования (т.е. селективность воздействия), чем специфичность как таковую, поскольку формально видхозяин не находится на вершине кумулятивной кривой. В то же время в выборке хищных видов рыб налим демонстрирует наивысшие показатели ингибирования, и в этой ситуации индекс Джини в равной мере отражает как селективность ингибитора, так и его специфичность к протеиназам конкретного хозяина. Дополнительным аргументом в пользу специфичности действия экстракта червя может служить тот факт, что среднее значение процентного ингибирования для протеиназ слизистой оболочки кишечника налима заметно превышает соответствующий средний уровень, вычисленный для аналогичных ферментов всех остальных видов рыб.
Имеются и другие сведения о специфичности действия ингибиторов цестод по отношению к различным протеиназам. Например, было выдвинуто предположение о специфичности взаимодействия H. diminuta, паразитирующей в кишечнике крыс, с трипсином, поскольку другие протеолитические ферменты (субтилизин, пепсин и папаин) не инактивируются этой цестодой [6]. Избирательная специфичность ингибирования протеиназ показана для половозрелых цестод Taenia pisiformis из кишечника собак [24]. Экстракты этих червей проявляли ингибирующую способность по отношению к трипсину и химотрипсину быка, собаки и кролика, однако этот ингибитор не влиял на гидролитическую активность субтилизина, эластазы, коллагеназы, пепсина, ренина и папаина. Было также показано, что внутриклеточный серпин, вырабатываемый цестодой Echinococcus multilocularis, ингибирует трипсин и трипсиноподобный плазмин, а также панкреатическую эластазу свиньи и эластазу нейтрофилов человека, что, по мнению авторов, может способствовать блокировке протеолитических ферментов в кишечнике хозяина [25].
Таким образом, в результате проведенных исследований установлено, что экстракт цестоды Eubothrium rugosum ингибирует активность протеиназ кишечника хозяина – налима. Снижение протеолитической активности слизистой оболочки кишечника при использовании экстракта E. rugosum в качестве ингибитора сопоставимо с таковым при применении ингибитора сериновых протеиназ – PMSF, хотя доля ингибирования в первом случае несколько меньше, чем во втором. Ингибирование экстрактом червя протеолитической активности слизистой оболочки кишечника у различных видов рыб свидетельствует об умеренной и вместе с тем достаточно отчетливо выраженной специфичности продуцируемого ингибитора по отношению к протеолитической активности хозяина.
Значение такой специфичности для отношений хозяина и паразита предстоит выяснить в дальнейших экспериментах на нескольких видах цестод с использованием выделенных и очищенных ингибиторов, а также с расширенным кругом видов рыб – как служащих хозяевами исследуемых цестод, так и используемых для сравнительного анализа.
Список литературы
Pappas P.W., Uglem G.L. Hymenolepis diminuta (Cesto-da) liberates an inhibitor of proteolytic enzymes during in vitro incubation / Parasitology. 1990. V. 101. P. 455–464.
Rawlings N.D., Tolle D.P., Barrett A.J. Evolutionary families of peptidase inhibitors / Biochem. J. 2004. V. 378. P. 705–716.
Molehin A.J., Gobert G.N., McManus D.P. Serine protease inhibitors of parasitic helminthes / Parasitology. 2012. V. 139. № 6. P. 681–695.
Извекова Г.И., Фролова Т.В. Протеолитические ферменты и их ингибиторы у цестод / Успехи совр. биол. 2016. Т. 136. № 4. С. 404–416.
Pappas P.W., Read C.P. Trypsin inactivation by intact Hymenolepis diminuta / J. of Parasitol. 1972. V. 58. P. 864–871.
Schroeder L.L., Pappas P.W., Means G.E. Trypsin inacti-vation by intact Hymenolepis diminuta (Cestoda) : some characteristics of the inactivated enzyme / J. of Parasitol. 1981. V. 67. № 3. P. 378–385.
Клименко В.В., Кеныня В.А. О влиянии филогении и экологии на некоторые биохимические механизмы адаптации гельминтов / Изв. академии наук Латвийской ССР. 1971. № 11. С. 93–96.
Дубовская А.Я. Исследование протеолитической активности у некоторых видов цестод / Паразитология. 1973. Т. VII. № 2. С. 154–159.
Alarcón F.J., Martinez T.F., Barranco P., Cabello T., Diaz M., Moyano F.J. Digestive proteases during development of larvae of red palm weevil, Rhynchophorus errugineus (Olivier, 1790) (Coleoptera: Curculionidae) / Insect Biochem. Mol. Biol. 2002. V. 32. P. 265–274.
Graczyk P. Gini coefficient: a new way to express kinase selectivity against a family of kinases / J. Med. Chem. 2007. V. 50. P. 5773–5779.
Natalia Y., Hashim R., Ali A., Chong A. Characterization of digestive enzymes in a carnivorous ornamental fish, the Asian bony tongue Scleropages formosus (Osteoglossidae) / Aquaculture 2004. V. 233. P. 305–320.
Уголев A.М., Кузьмина В.В. Пищеварительные процессы и адаптации у рыб. СПб.: Гидрометеоиздат, 1993.
Solovyev M.M., Kashinskaya E.N., Izvekova G.I., Gisbert E., Glupov V.V. Feeding habits and ontogenic changes in digestive enzyme patterns in five freshwater teleosts / J. of Fish Biology. 2014. V. 85. № 5. P. 1395– 1412.
Dimes L.E., Garcia-Carre$\tilde {n}$o F.L., Haard N.F. Estimation of protein digestibility-III. Studies on the digestive enzymes from the pyloric ceca of rainbow trout and salmon / Comp. Biochem. Physiol. 1994. V. 109A. № 2. P. 349–360.
Kumar S., Garcia-Carre$\tilde {n}$o F.L., Chakrabarti R., Toro M.A.N., Cordova-Murueta J.H. Digestive proteases of three carps Catla catla, Labeo rohita and Hypophthalmichthys molitrix: partial characterization and protein hydrolysis efficiency / Aquaculture Nut. 2007. V. 13. P. 381–388.
Concha-Frias B., Alvarez-González C.A., Gaxiola-Cortes M.G., Silva-Arancibia A.E., Toledo-Aguero P.H., Martinez-Garcia R., Camarillo-Coop S., Jimenez-Martinez L.D., Arias-Moscoso J.L. Partial сharacterization of digestive proteases in the common snook Centropomus undecimalis / Int. J. Biology. 2016. V. 8. № 4. P. 1–11.
Pujante I.M., Díaz-López M., Mancera J.M., Moyano F.J. Characterization of digestive enzymes protease and alpha-amylase activities in the thick-lipped grey mullet (Chelon labrosus, Risso 1827) / Aquaculture Res. 2017. V. 48. 367–376.
Munilla-Morán R., Saborido-Rey F. Digestive enzymes in marine species. I. Proteinase activities in gut from redfish (Sebastes mentella), seabream (Sparus aurata) and turbot (Scophthalmus maximus) / Comp. Biochem. Physiol. 1996. V. 113B. № 2. P. 395–402.
Garcґía-Carreño F.L., Albuquerque-Cavalcanti C., Navarrete del Toroa M.A., Zaniboni-Filho E. Digestive proteinases of Brycon orbignyanus (Characidae, Teleostei): characteristics and effects of protein quality / Comp. Biochem. Physiol. 2002. V. 132B. P. 343–352.
Martzen M.R., Geise G.L., Hogan B.J., Peanasky A.J. Ascaris suum: localization by lmmunochemical and fluorescent probes of host proteases and parasite proteinase inhibitors in cross-sections / Exp. Parasitol. 1985. V. 60. P. 139–149.
Matskási I., Juhász S. Ligula intestinalis (L., 1758): Investigation on plerocercoids and adults for protease and protease inhibitor activities / Parasitol. Hung. 1977. V. 10. P. 51–60.
Matskási I. The effect of Bothriocephalus acheilognati Yamaguti, 1934, infection on the protease activity in the gut of carp fry / Parasitol. Hung. 1978. V. 11. P. 51–56.
Hawley J.H., Peanasky A.J. Ascaris suum: Are trypsin inhibitors involved in species specificity of ascarid nematodes? / Exp. Parasitol. 1992. V. 75. P. 112–118.
Németh I., Juhász S., Baintner K. A trypsin and chymot-rypsin inhibitor from Taenia pisiformis / Int. J. Parasitol. 1979. V. 9. P. 515–522.
Merckelbach A., Ruppel A. Biochemical properties of an intracellular serpin from Echinococcus multilocularis / Mol. Biochem. Parasitol. 2007. V. 156. P. 84–88.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


