Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 1, стр. 59-64
НАРУШЕНИЯ ВСЛЕДСТВИЕ ПЕРИНАТАЛЬНОЙ ГИПОКСИИ ПОВЕДЕНЧЕСКОЙ И ГОРМОНАЛЬНОЙ СТРЕСС-РЕАКЦИЙ КРЫС АДОЛЕСЦЕНТНОГО ВОЗРАСТА И ИХ КОРРЕКЦИЯ НОВЫМ ПРОИЗВОДНЫМ ГАМК
Н. Э. Ордян 1, *, В. К. Акулова 1, С. Г. Пивина 1, В. А. Отеллин 1, И. Н. Тюренков 2
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 Волгоградский государственный медицинский университет
Волгоград, Россия
* E-mail: neo@infran.ru
Поступила в редакцию 14.03.2018
После доработки 10.08.2018
Принята к публикации 15.08.2018
Аннотация
Изучены последствия гипоксического воздействия на 2 сут постнатальной жизни (модель недоношенной беременности человека) на поведение в тесте “открытое поле” и активность гипоталамо-гипофизарно-адренокортикальной системы (ГГАС) у крыс адолесцентного возраста, а также возможность коррекции выявленных нарушений введением после гипоксического воздействия производного ГАМК салифена (аддукт γ-амино-β-фенилмаслянной и салициловой кислот). Показано, что после гипоксического воздействия наблюдается нарушение тормозных механизмов в ЦНС, проявляющееся в отсутствие торможения двигательной активности в открытом поле, а также в повышенной и пролонгированной стрессорной реакции ГГАС. Введение салифена в дозе 15 мг/кг в течение 14 дней после гипоксического воздействия эффективно восстанавливало тормозные процессы, за исключением повышенной гормональной стрессорной реактивности. Обсуждаются возможные механизмы терапевтических эффектов салифена.
ВВЕДЕНИЕ
Перинатальная гипоксия у доношенных и особенно у недоношенных детей проявляется в дальнейшей жизни в виде различных неврологических нарушений, ухудшения процессов внимания, обучения и памяти [1]. Подобные нарушения диагностируются как в ювенильном возрасте, так и в адолесцентный период развития [2]. Последний период, сопряженный с половым созреванием, характеризуется интенсивной реорганизацией мозга и поведения, повышенной реактивностью к различным стрессогенным факторам [3, 4]. Показано, что в это время продолжается развитие многих гормональных систем, в том числе гипоталамо-гипофизарно-адренокортикальной системы (ГГАС) [5], гормоны которой являются важнейшей составляющей адаптивных процессов в организме. Повышенная стрессорная реактивность ГГАС, несвоевременное торможение стрессорного ответа и, как следствие, деструктивное действие глюкокортикоидных гормонов на головной мозг и другие органы и системы организма служат причиной возникновения многочисленных болезней адаптации [6].
В связи с тем что последствия перинатальной гипоксии представляют значительную медицинскую и социальную проблему, поиск эффективных методов коррекции таких последствий весьма актуален. Наиболее обоснованным подходом для поиска путей коррекции постгипоксических нарушений является подход, основанный на данных о механизмах и мишенях воздействия гипоксии. В этом отношении наибольшее внимание привлекают препараты, обладающие эндотелиопротекторными свойствами, поскольку от состояния эндотелиоцитов зависит не только проницаемость гематоэнцефалического барьера, но и адекватность кровоснабжения головного мозга в целом [7].
Ранее нами была разработана клинически и физиологически обоснованная модель одного из последствий перинатальной гипоксии – энцефалопатии новорожденных с учетом особенностей недоношенных детей. С использованием этой модели было показано, что после перинатальной гипоксии происходят значительные морфологические изменения элементов стенки сосудов микроциркуляторного русла неокортекса и, в частности, эндотелиоцитов [8]. Выявленные изменения микроциркуляторного русла эффективно корректировались путем введения крысятам после гипоксического воздействия салифена [9], который представляет собой аддукт γ-амино-β-фенилмаслянной и салициловой кислот [10]. Кроме того, эффективность салифена была показана в отношении рефлекторной деятельности и поведения ювенильных крысят в ранние сроки после перенесенной гипоксии [11].
В настоящем исследовании было изучено действие перинатальной гипоксии у крысят на 2-й день жизни (модель недоношенной беременности) на характер гормонального и поведенческого стрессорного ответа в адолесцентном возрасте. О гормональной составляющей стрессорного ответа судили по динамике стрессорной активности ГГАС, позволяющей оценить как процесс активации системы, так и степень торможения после стрессорной активации [12]. Поведенческий стрессорный ответ выявляли с помощью теста “открытое поле” с усиленной стрессогенностью новой остановки.
МАТЕРИАЛ И МЕТОДИКА
Работа выполнена на новорожденных крысах самцах линии Вистар, популяция которых поддерживается в Институте физиологии им. И.П. Павлова РАН. Крысята находились в пометах с матерями в стандартных условиях вивария без ограничения в доступе к воде и пище. При проведении экспериментов соблюдались требования, сформулированные в Директивах Совета Европейского сообщества (86/609/ЕЕС) об использовании лабораторных животных. Протоколы опытов были утверждены Комиссией по гуманному обращению с животными Института физиологии им. И.П. Павлова РАН.
На 2-й день жизни крысята подвергались воздействию нормобарической гипоксии в барокамере при содержании в дыхательной смеси кислорода – 7.6–7.8%, углекислого газа – 0.15–0.21%, азота – 91.8%, при температуре – 21.3–23°С. Длительность воздействия составляла 1 ч. Контрольных крысят также помещали в барокамеру на 1 ч, но без гипоксического воздействия. Далее крысят содержали в пометах с матерями до 30-дневного возраста, а затем по 6–7 особей в клетке.
Крысята, подвергнутые воздействию гипоксии, были разделены на 3 группы. Первая группа через сутки после помещения в барокамеру получала подкожные инъекции салифена в дозе 15 мг/кг в течение 14 дней. Второй группе в эти же сроки вводили физиологический раствор. Третья группа инъекций не получала, что дало возможность разделить эффекты самого гипоксического воздействия и хэндлинга, который сопровождал инъекции. Контрольным животным также вводили физиологический раствор.
В возрасте 45 дней у крысят контрольной и подопытной групп определяли поведенческую реактивность при помещении в новую обстановку с повышенной стрессогенностью ситуации. Для этого животных помещали в центр открытого поля, которое представляло собой четырехугольную камеру размером 90 × 90 × 50 см, пол которой был расчерчен на 30 квадратов размером 15 × 15 см каждый. В центре “поля” на высоте 50 см помещали источник света (100 Вт), создающий дополнительный стрессорный фактор, поскольку крысы как ночные животные избегают пространства с повышенной освещенностью. В этом тесте в течение 5 мин регистрировали следующие параметры: число пересеченных квадратов, число вертикальных стоек, продолжительность груминга и замирания, а также продолжительность пребывания животного в центре камеры как показатель уровня тревожности. Двигательную активность (число пересеченных квадратов) учитывали в каждую минуту теста.
Динамику стрессорного ответа ГГАС на стресс новизны обстановки оценивали после тестирования крыс в открытом поле. С этой целью из хвостовой вены отбирали пробы крови через 30 и 180 мин от начала тестирования. Первый временной интервал позволяет судить о максимальной выраженности стрессорного ответа, второй – о торможении ГГАС после стрессорной активации [12]. Далее пробы крови центрифугировали при 2500 об/мин, а плазму хранили при 20°С до момента определения содержания в ней кортикостерона. Тесты выполняли в одно и то же время суток с 12-00. В каждой группе было 6–7 животных.
Содержание кортикостерона в плазме крови определяли иммуноферментным методом с использованием стандартных наборов (“Хема-Медика”, Россия).
Статистическую обработку результатов проводили с использованием однофакторного дисперсионного анализа (ANOVA, пакета программ “STATISTICA 8.0”) с последующими парными post-hoc сравнениями (Dunnett’s тест) отдельных групп. В качестве критерия достоверности принимали p < 0.05. Результаты представлены в виде среднего арифметического ± стандартная ошибка.
РЕЗУЛЬТАТЫ
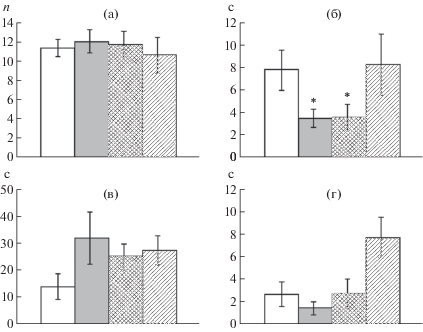
Проведенные исследования показали, что общее число пересеченных квадратов поля не различается у контрольных и подопытных групп животных (рис. 1б). Однако анализ числа пройденных квадратов в каждую минуту теста позволил выявить существенные различия в динамике локомоторной активности исследованных групп животных (рис. 1а). Так, по сравнению с контрольными крысами животные, подвергнутые воздействию перинатальной гипоксии, более длительное время сохраняют высокую двигательную активность. Различия касались 4-й и 5-й мин теста. В то же время крысы, которым после воздействия гипоксии вводили салифен, быстрее тормозят двигательную активность в новой обстановке, что проявлялось уже на 2-й мин тестирования. Стоит отметить, что крысы, которым после гипоксического воздействия вводили физиологический раствор, не отличались по динамике двигательной активности от крыс только с воздействием гипоксии. Число вертикальных стоек и продолжительность груминга не различались у исследованных групп животных (рис. 2а, 2в). Вместе с тем продолжительность пребывания в центре поля крыс, перенесших перинатальную гипоксию, была снижена, что свидетельствует о повышенном уровне тревожности этих животных (рис. 2б). У крыс, которым после гипоксического воздействия вводили салифен, была обнаружена повышенная продолжительность замирания (рис. 2г).
Рис. 1.
Влияние перинатальной гипоксии и введения салифена на двигательную активность крыс в открытом поле. а – число пересеченных квадратов в каждую минуту теста (n). 1 – крысы, подвергнутые перинатальной гипоксии, 2 – крысы, подвергнутые гипоксии и последующему введению физиологического раствора, 3 – крысы, подвергнутые гипоксии и последующему введению салифена; б – суммарное число пересеченных квадратов открытого поля (n). Светлые столбики – контрольные крысы, темные столбики – крысы после гипоксического воздействия, серые столбики – крысы после гипоксического воздействия и введения физиологического раствора, столбики со штриховкой – крысы после гипоксического воздействия и введения салифена. * – достоверные (p < 0.05) отличия от контрольных животных.
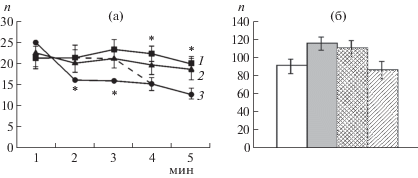
Рис. 2.
Поведение крыс в тесте “открытое поле”. а – число вертикальных стоек (n); б – время пребывания животного в центральных квадратах поля (c); в – продолжительность реакции груминга (c); г – продолжительность замирания (c). Светлые столбики – контрольные крысы, темные столбики – крысы после гипоксического воздействия, серые столбики – крысы после гипоксического воздействия и введения физиологического раствора, столбики со штриховкой – крысы после гипоксического воздействия и введения салифена. * – достоверные (p < 0.05) отличия от контрольных животных.
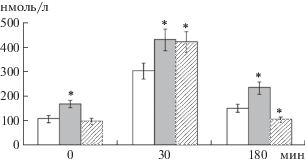
Существенные различия между исследованными группами животных были обнаружены и при изучении динамики стрессорного ответа ГГАС (рис. 3). В связи с тем, что при тестировании животных в открытом поле мы не обнаружили значимых различий между крысами, подвергнутыми перинатальной гипоксии и крысами, которым после гипоксического воздействия вводили физиологический раствор, при исследовании функции ГГАС эти животные были объединены в общую группу. У крыс с воздействием гипоксии выявлены повышение базального уровня кортикостерона и стрессорной реактивности и менее выраженное торможение системы после стрессорной активации. Введение салифена, не влияя на уровень стрессорной реактивности, которая сохранялась повышенной, существенно усиливало торможение ГГАС после стрессорной активации.
Рис. 3.
Динамика стрессорного ответа гипоталамо-гипофизарно-адренокортикальной системы у крыс, подвергнутых перинатальной гипоксии и введению салифена. По оси абсцисс – время от начала тестирования в открытом поле. По оси ординат – содержание кортикостерона в крови (нмоль/л). Светлые столбики – контрольные крысы, темные столбики – крысы после гипоксического воздействия, столбики со штриховкой – крысы после гипоксического воздействия и введения салифена. * – достоверные (p < 0.05) отличия от контрольных животных.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенные исследования показали, что гипоксическое воздействие, перенесенное в перинатальный период развития, проявляется у крыс адолесцентного возраста в существенном изменении поведенческого и гормонального ответа на стрессогенный стимул. Эти изменения в целом можно охарактеризовать как нарушение тормозных процессов в ЦНС. Об этом свидетельствует отставленное торможение двигательной активности в тесте “открытое поле” и замедленное торможение ГГАС после стрессорной активации, выявленное у крыс с воздействием перинатальной гипоксии. Следует отметить, что повышение двигательной активности после перинатальной гипоксии нами было выявлено ранее и у крыс ювенильного возраста [11]. Это свидетельствует о том, что нарушение тормозных процессов вследствие перинатальной гипоксии проявляется уже в достаточно ранние сроки после воздействия. Такое нарушение тормозных процессов может быть обусловлено повреждающим действием перинатальной гипоксии на ГАМК-ергические нейроны. Было установлено, что после воздействия гипоксии в перинатальном периоде развития в ювенильном и адолесцентном возрасте у крыс наблюдается значительное снижение численности ГАМК-ергических интернейронов в сенсомоторной области неокортекса [13]. Эти нейроны контролируют время возбуждения пирамидных нейронов, генерацию кортикальных ритмов, организацию сенсорных полей и кортикальную пластичность [14]. Полагают, что сокращение численности популяций кортикальных тормозных интернейронов и снижение их активности могут служить структурной основой для возникновения различных нейрологических и психических нарушений [15].
Влияние воздействия гипоксии на ранних сроках после рождения на активность ГГАС в отношении стрессорной активности и регуляции системы по механизму отрицательной обратной связи было установлено и в исследованиях других авторов. Так показано, что перинатальная гипоксия на 2-й день жизни приводит к повышению стрессорной реактивности системы у ювенильных крысят после тестирования их в открытом поле [16], а у взрослых животных пролонгирует кортикостероновый ответ на иммобилизационный стресс [17]. Наши исследования показали, что оба эти нарушения активности ГГАС проявляются у крыс адолесцентного возраста после перенесенной перинатальной гипоксии. Нарушения активности ГГАС вследствие гипоксического воздействия также может быть обусловлено нарушением ГАМК-ергической трансмиссии в мозге.
ГАМК-ергическим проекциям в паравентрикулярное ядро (ПВЯ) гипоталамуса принадлежит существенная роль в регуляции активности ГГАС. Об этом свидетельствует тот факт, что около 50% всех синапсов в ПВЯ являются ГАМК-ергическими [18]. ГАМК-ергические проекции поступают в ПВЯ не только от различных областей самого гипоталамуса, но и от других мозговых структур и, прежде всего, от ядра ложа конечной полоски (bed nucleus stria terminalis, BNST) – структуры, осуществляющей связь ПВЯ гипоталамуса с лимбическими отделами мозга [19]. Было установлено, что задняя часть BNST, содержащая популяцию ГАМК-ергических нейронов, оказывает тормозное влияние на стрессорную активность ГГАС, поскольку его разрушение приводило к существенному росту в пределах ПВЯ мРНК кортиколиберина и вазопрессина и, как следствие, к увеличению содержания в крови кортикостерона в ответ на стрессорное воздействие [20]. Учитывая повреждающее действие перинатальной гипоксии на ГАМК-ергические нейроны неокортекса, можно полагать, что страдают ГАМК-ергические нейроны и других образований мозга и, в частности, BNST. Этим можно объяснить значительное повышение стрессорной реактивности ГГАС, которое мы наблюдали у крыс с воздействием перинатальной гипоксии. Следует отметить, что разрушение задней части BNST не влияло на торможение ГГАС после стрессорной активации. Последнее, в большей мере, зависит от функций гиппокампа, который через глюкокортикоидные рецепторы принимает участие в регуляции ГГАС по механизму отрицательной обратной связи [21]. Ранее было установлено, что перинатальная гипоксия приводит к значительным нарушениям, выраженным в уменьшении числа нейронов и сокращении их рядов, в повреждении значительной части клеток в зубчатой извилине и поле СА1 гиппокампа у крыс адолесцентного возраста [22]. По всей видимости, уменьшение числа нейронов в гиппокампе, главным образом, в зубчатой извилине, снижает ингибиторную функцию гиппокампа в отношении торможения ГГАС после стрессорной активации.
Факт вовлеченности ГАМК-ергической трансмиссии в повреждающее действие перинатальной гипоксии на поведенческую и гормональную стресс реактивность подтверждается корректирующими эффектами салифена, вводимого непосредственно после гипоксического воздействия. Салифен оказывает протективное действие не только в отношении структур гемато-энцефалического барьера и состояния микроциркуляторного русла неокортекса, но и способствует выживаемости ГАМК-ергических нейронов в этой области мозга [23]. Следует отметить, что эффективность салифена нами установлена преимущественно для нормализации тормозных процессов, о чем свидетельствует снижение двигательной активности в тесте “открытое поле” и усиление торможения ГГАС после стрессорной активации. Однако салифен оказался неэффективным для коррекции повышенной стрессорной реактивности ГГАС, поскольку максимальный выброс кортикостерона в кровь в ответ на стрессорное воздействие у животных, получавших салифен, был столь же высок, как и у животных с воздействием перинатальной гипоксии. Вероятно, имеется определенная региональная специфичность в нейропротективном действии салифена, что нуждается в дальнейшей проверке.
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют о том, что после гипоксического воздействия в перинатальный период развития наблюдается нарушение тормозных механизмов в ЦНС, проявляющееся в отсутствие торможения двигательной активности в открытом поле, а также в повышенной и пролонгированной стрессорной реакции ГГАС у крыс адолесцентного возраста. Выявленные нарушения могут быть обусловлены повреждающим действием гипоксии на ГАМК-ергические нейроны неокортекса и других образований мозга. Введение после гипоксического воздействия производного ГАМК салифена, обладающего нейропротективными свойствами, эффективно восстанавливало тормозные процессы, за исключением повышенной гормональной стресс-реактивности ГГАС.
Список литературы
van Handel M., Swaab Y., de Vties L.S., Jongman M.J. Behavioral outcome in children with a history of neonatal encephalopathy following perinatal asphyxia // J. Pediatr. Psychol. 2010 V. 35. № 3. P. 289–295.
Allin M., Rooney M., Cuddy M., Wyatt J., Walshe M., Rifkin L., Murray R. Personality in young adults who are born preterm // Pediatrics. 2006. V. 117. № 2. P. 309–316.
Andersen S.L. Trajectories of brain development: point of vulnerability or window of opportunity? // Neurosci Behav. Rev. 2003. V. 27. Iss. 1–2. P. 3–18.
Dudley K.J., Li X., Kobor M.S., Kippin T.E., Bredy T.W. Epigenetic mechanisms mediating vulnerability and resilience to psychiatric disorders // Neurosci. Biobehav. Rev. 2011. V. 35. P. 1544–1551.
McCormick C.M., Mathews I.Z. HPA function in adolescence: role of sex hormones in its regulation and the enduring consequences of exposure to stressors // Pharmacology Biochem. Behav. 2007. V. 86. № 2. P. 220–233.
McEwen B.S. The neurobiology of stress: from serendipity to clinical relevance // Brain Res. 2000. V. 886. Iss. 1–2. P. 172–189.
Моргун А.В., Кувачева Н.В., Таранушенко Т.Е., Хилажева Е.Д., Малиновская Н.А., Горина Я.В., Пожиленкова Е.А., Фролова О.В., Салмина А.Б. Современные представления о патогенезе перинатального ишемического повреждения клеток нейроваскулярной единицы головного мозга: молекулы-мишени для нейропротекции // Вестник РАМН. 2013. № 12. С. 26–35.
Отеллин В.А., Хожай Л.И., Шишко Т.Т. Реакция структурных элементов гемато-энцефалического барьера новорожденных крысят на нормобарическую гипоксию // Ж. эвол. биохим. и физиол. 2015. Т. 51. С. 377–382.
Отеллин В.А., Хожай Л.И., Тюренков И.Н. Воздействие перинатальной гипоксии на структуры гематоэнцефалического барьера у крыс при введении салифена // Морфология. 2015. Т. 148. № 6. С. 78–82.
Тюренков И.Н., Воронков А.В., Слиецанс А.А., Волотова Е.В. Эндотелиопротекторы – новый класс фармакологических препаратов // Вестник РАМН. 2012. № 7. С. 50–57.
Ордян Н.Э., Акулова В.К., Миронова В.И., Отеллин В.А. Вызванные перинатальной гипоксией поведенческие нарушения у ювенильных крыс и их коррекция производным ГАМК // Бюлл. эксперим. биол. мед. 2017. Т. 164. № 8. С. 140–144.
Шаляпина В.Г., Бедров Я.А., Ордян Н.Э., Венцов А.В., Пивина С.Г. Характеристика основных параметров гормональной функции коры надпочечников и ее модификация в онтогенез крыс // Ж. эвол. биохим. и физиол. 2001. Т. 37. №. 2. С. 131–135.
Хожай Л.И., Отеллин В.А. Архитектоника GABAергической тормозной сети в сенсомоторной области неокортекса крыс в ранний постнатальный период в норме и после острой перинатальной гипоксии // Ж. эвол. биохим. и физиол. 2017. Т. 53. № 3. С. 208–214.
Markram H., Toledo-Rodriguez M., Wang Y., Gupta A., Silberberg G., and Wu C. Interneurons of the neocortical inhibitory system // Nat. Rev. Neurosci. 2004. V. 5. P. 793–807.
Benarroch E.E. Neocortical interneurons: functional diversity and clinical correlations // Neurology. 2013. V. 81. № 3. P. 273–280.
Rogalska J., Caputa M. Neonatal asphyxia under hyperthermic conditions alters HPA axis function in juvenile rats // Neurosci Lett. 2010. V. 472. P. 68–72.
Chintamaneni K., Bruder E.D., Raff H. Programming of the hypothalamic-pituitary-adrenal axis by neonatal intermittent hypoxia: effects on adult male ACTH and corticosterone responses are stress specific // Endocrinology. 2014. V. 155. № 5. P. 1763–1770.
Herman J.P., Mueller N.K., Figueiredo H. Role of GABA and glutamate circuitry in hypothalamo-pituitary-adrenocortical stress integration // Ann. N. Y. Acad. Sci. 2004 V. 1018 P. 35–45.
Dong H.W., Swanson L.W. Projection from bed nucleus of the stria terminalis, dorsomedial nucleus: implications for cerebral hemisphere integration of neuroedocrine, autonomic, and drinking responses // J. Comp. Neurol. 2006. V. 494. P. 75–107.
Choi D.C., Furay A.R., Evanson N.K., Ostrander M.M., Ulrich-Lai Y.M., Herman J.P. Bed nucleus of the stria terminalis subregions differentially regulated hypothalamic-pituitary-adrenal axis activity: implications for the integration of limbic inputs // J. Neurosci. 2007. V. 27. № 8. P. 2025–2034.
De Klot E.R. From receptor balance to rational glucocorticoid therapy // Endocrinology. 2014. V. 155. P. 2754–2769.
Хожай Л.И., Отеллин В.А. Распределение GAD-67-экспрессирующих нейронов и морфологические изменения в структурах гиппокампа в пубертатный период после острой перинатальной гипоксии у крыс // Ж. эвол. биохим. и физиол. 2017. Т. 53. № 6. С. 462–464.
Otellin V.A., Khozhai L.I., Shishko T.T., Tyurenkov I.N. Long-term consequences of perinatal hypoxia and their possible pharmacological correction: responses of neocortical nerve cells and synapses // Neurosci. Behav. Physiol. 2017. V. 47. P. 999–1003.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


