Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 2, стр. 90-96
АКТИВАЦИЯ Fas РЕЦЕПТОРОВ, КАСПАЗЫ-8 И КАСПАЗЫ-3 ИОНАМИ ФТОРА В ЭРИТРОЦИТАХ КРЫСЫ IN VITRO
Н. И. Агалакова 1, *, Т. И. Петрова 1, Г. П. Гусев 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: nagalak@mail.ru
Поступила в редакцию 21.05.2018
После доработки 20.07.2018
Принята к публикации 13.08.2018
Аннотация
Целью исследования было показать способность ионов фтора (F-) активировать ключевые компоненты рецептор-зависимого пути апоптоза – мембранные рецепторы Fas, каспазы-8 и каспазы-3 – в эритроцитах крысы in vitro. Клетки инкубировали в присутствии увеличивающихся концентраций NaF (0.1–10 мМ) в течение 1, 5 и 24 ч. Активность каспазы-8 и каспазы-3 оценивали с помощью проточной цитометрии, экспрессию Fas рецепторов – методом иммуноблоттинга. Результаты работы показали, что кинетика стимуляции Fas рецепторов, каспаз-8 и каспаз-3 в эритроцитах крысы ионами фтора различается и зависит как от его дозы, так и от времени экспозиции. Так, активация каспаз наблюдалась уже после 1 ч инкубации клеток с фтором, а обработка эритроцитов 5 мМ NaF в течение суток увеличивала популяцию эритроцитов с активными каспазами-8 и каспазами-3 до ~15–16%. Однако экспрессия Fas рецепторов дозо-зависимо увеличивалась только после 24-ч инкубации с NaF. Таким образом, одним из механизмов, лежащих в основе преждевременной гибели эритроцитов крысы под действием фтора in vitro, является его способность стимулировать посредники рецептор-зависимого пути апоптоза, но возможно, что активация каспазы-8 и каспазы-3 происходит, по крайней мере частично, независимо от мембранного механизма активации Fas рецепторов.
ВВЕДЕНИЕ
В течение долгого времени фтор считался одним из микроэлементов, необходимых для нормального развития человека. Соединения фтора используются для профилактики заболеваний зубов и для лечения остеопороза благодаря его способности ингибировать потребление глюкозы микрофлорой полости рта и стимулировать рекальцификацию костной ткани. Во многих странах соединения фтора добавляются в питьевую воду, молоко, соль, пищевые добавки [1]. Однако в последнее время широкое применение фтора, особенно фторирование питьевой воды, вызывает бурные научные дебаты и массовые протесты населения [2, 3]. Никаких заболеваний при дефиците фтора не описано, а достоверных доказательств о его биохимической роли в организме нет. Наоборот, негативные эффекты фтора на здоровье человека известны с первой половины XX века, когда клинические обследования населения в регионах с его высоким содержанием в окружающей среде выявили трудно поддающееся лечению заболевание – эндемический флюороз, характеризующийся патологическими изменениями костной и зубной тканей, а также увеличением риска развития диабета, неврологических и эндокринных расстройств [3–7]. Кроме того, в последнее время из-за неконтролируемого потребления фторированной воды и фтор-содержащих продуктов, часто превышающего терапевтический эффект, все больше случаев флюороза регистрируется в странах, где содержание фтора в окружающей среде низко.
Молекулярные механизмы, лежащие в основе фтор-индуцированных токсических эффектов, разнообразны по природе и включают снижение внутриклеточной концентрации АТФ, окислительный стресс, изменение экспрессии генов и ингибирование синтеза белка, нарушение клеточного цикла, роста и дифференциации клеток, повреждение ДНК [8, 9]. Накапливающиеся повреждения приводят к гибели клеток, в том числе к апоптозу – регулируемому процессу программируемой клеточной гибели [10].
Апоптотические процессы реализуются через два основных пути передачи сигнала – рецептор-зависимый сигнальный (внешний) путь с участием рецепторов гибели клетки и митохондриальный (собственный) путь. В зрелых эритроцитах млекопитающих, лишенных ядер и митохондрий, может быть активирован только рецептор-зависимый путь апоптоза. В ответ на апоптотические стимулы трансмембранные рецепторы клеточной гибели взаимодействуют с их специфическими внеклеточными лигандами, что приводит к формированию сигнального комплекса DISC (Death Inducing Signalling Complex), включающего адаптерный белок FADD и инициаторную каспазу-8. Активация каспазы-8 из этого комплекса инициирует каскад каспаз, приводящий к стимуляции эффекторной каспазы-3 и последующему протеолизу клеточных белков. В эритроцитах человека были идентифицированы рецепторы гибели Fas и неактивные зимогены каспаз-8 и каспаз-3 [11–15], а активные каспазы-8 и каспазы-3 были выявлены в старых эритроцитах человека, имеющих фосфатидилсерин на мембране и представляющих собой смесь дискоцитов и сжатых клеток [16]. Таким образом, стимуляция рецепторного пути апоптоза может иметь важное физиологическое значение для процессов гибели эритроцитов (эриптоза), по крайней мере в некоторых условиях.
Ранее мы показали, что ионный фтор (из NaF) индуцирует преждевременную апоптоз-подобную гибель эритроцитов крысы как в условиях in vitro [17], так и после длительного потребления крысами избыточных доз фторида in vivo [18]. Целью представленной работы было выяснить, способны ли ионы фтора активировать каспазы и мембранные рецепторы клеточной гибели Fas в эритроцитах крысы.
МАТЕРИАЛ И МЕТОДИКА
Экспериментальные животные. Эксперименты проводили на эритроцитах, выделенных из крови аутбредных крыс линии Wistar возрастом 8–12 нед и весом 150–200 г. Животные содержались в условиях вивария при температуре 20–23°C и освещении 12 ч свет/12 ч темнота, имели свободный доступ к стандартной диете и воде с низким содержанием фтора (0.4 ppm). Все экспериментальные процедуры соответствовали международным нормам по содержанию и использованию животных в научных целях (Guide for the Care and Use of Laboratory Animals 2011).
Приготовление суспензии эритроцитов. Крыс анестезировали диэтиловым эфиром, после чего рассекали брюшную аорту и собирали кровь в пробирки с гепарином. Кровь немедленно центрифугировали в течение 5 мин при 3000 g и 4°C, плазму и верхний слой белых клеток удаляли, а эритроциты отмывали три раза холодным стандартным раствором (137 мМ NaCl, 4 мМ KCl, 1 мМ MgSO4, 1 мМ CaCl2, 5 мМ NaHCO3, 0.3 мМ Na2HPO4, 0.4 мМ KH2PO4, pH 7.4 при 4°C). Отмытые клетки ресуспендировали в этом же растворе до гематокрита 10%. Для экспериментов аликвоты суспензии эритроцитов добавляли в 500 мкл инкубационной среды, содержащей 137 мМ NaCl, 4 мМ KCl, 1 мМ MgSO4, 1 мМ CaCl2, 5 мМ NaHCO3, 0.3 мМ Na2HPO4, 0.4 мМ KH2PO4, 5 мМ глюкозы и 1% (w/v) пенициллина-стрептомицина (pH 7.4 при 37°C), до гематокрита 1%. Клетки инкубировали в присутствии увеличивающихся концентраций NaF (0.1–10 мМ) в течение 1, 5 и 24 ч при 37°С в атмосфере 5% CO2/95% O2.
Изучение активности каспаз 8 и 3. Активности каспазы-8 и каспазы-3 оценивали с помощью соответствующих наборов CaspGLOWTM, в которых используются ингибиторы каспазы-8 и каспазы-3 IETD-FMK и DEVD-FMK, соответственно, конъюгированные с флуоресцентной меткой FITC. Эти соединения нетоксичны и хорошо проникают в клетки, где необратимо связываются с каспазами после их стимуляции. Флуоресцентная метка FITC позволяет напрямую регистрировать активные каспазы в апоптотических клетках. Процедура мечения проводилась в соответствии с рекомендациями производителя. После 1, 5- и 24-ч обработки NaF из каждой пробы брали аликвоты (100 мкл), к которым добавляли флуорогенные субстраты FITC-IETD-FMK и FITC-DEVD-FMK, и клетки инкубировали в течение 1 ч при тех же условиях. Затем эритроциты осаждали центрифугированием при 3000 g в течение 3 мин, отмывали еще 2 раза холодным стандартным раствором, ресуспендировали в этом же растворе до гематокрита 0.1% и помещали на лед. Флуоресценцию клеток анализировали методом проточной цитометрии в канале FL-1 цитометра EPICS XL (Beckman Coulter Inc., Brea, CA, USA), используя программу SYSTEM II (Version 3.0).
Экспрессия рецептора Fas. Возможные изменения экспрессии Fas оценивали методом иммуноблоттинга. Для этих экспериментов эритроциты инкубировали в течение 1, 5 и 24 ч с 0.1, 1 и 10 мМ NaF. После окончания обработки клетки лизировали холодным гипотоническим раствором, содержащим 10 мM Tris-HCl, 1% Triton X-100, 1 мМ ЭДТА и ингибиторы клеточных протеаз (pH 7.4 при 4°C). Общее содержание белка в лизатах определяли методом Лоури. Клеточные белки (100 мкг из каждой пробы) разделяли по молекулярной массе методом электрофореза в 10% полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) и переносили на нитроцеллюлозную мембрану. Неспецифическое связывание мембран блокировали 5% раствором обезжиренного сухого молока в буфере TBS (150 мM NaCl, 20 мМ Tris-HCl, pH 7.4 при 20°С). Мембраны последовательно инкубировали с первичными антителами, специфичными для Fas (разведение 1:200), и с вторичными антителами, конъюгированными с пероксидазой хрена. Белки, связавшиеся с антителами, проявляли с помощью хемилюминесцентного раствора. Для контроля количества белка в пробах мембраны отмывали от Fas-специфичных антител и инкубировали с антителами к ферменту GAPDH (разведение 1 : 1000). Экспрессию белков оценивали с помощью денситометрического анализа проявленных полос, используя программу Quantity One (BioRad, USA). Показатели денситометрии полос Fas нормализовали по отношению к показателям GAPDH.
Реактивы. Все реактивы для растворов и NaF были куплены у компании Sigma Aldrich (USA), смесь пенициллина-стрептомицина – у компании “Росмедбио” (Россия). Наборы CaspGLOWTM и мышиные Fas-специфичные антитела были приобретены у фирмы BioVision Research products (USA), кроличьи антитела к GAPDH – у Santa Cruz Biotechnology (USA), вторичные анти-мышиные и анти-кроличьи антитела, конъюгированные с пероксидазой хрена – у GE Healthcare (USA).
Статистическая обработка данных. Результаты экспериментов анализировали в программе SigmaPlot ver. 11.0 (Jandel Scientific). Статистическая достоверность различий между разными группами данных рассчитывалась с помощью дисперсионного анализа ANOVA в комбинации с тестом Тьюки. Данные представлены как средние ± стандартные ошибки средних. Величина р меньше 0.05 считалась статистически достоверной.
РЕЗУЛЬТАТЫ
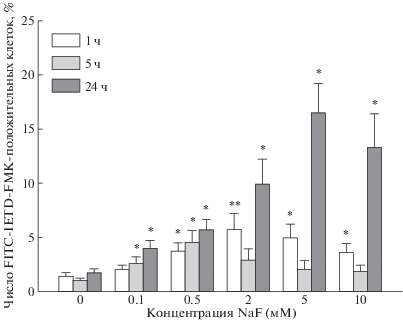
Активность каспазы-8. Результаты, представленные на рис. 1, показали, что способность NaF стимулировать инициаторную каспазу-8 в изолированных эритроцитах крысы зависит как от его дозы, так и от времени инкубации. После 1-ч инкубации достоверное увеличение числа клеток с активными каспазами-8 наблюдалось для 0.5 мМ NaF, а после 5-ч обработки – уже для 0.1 мМ NaF. Наиболее значительная стимуляция каспазы-8 отмечалась после 24-ч инкубации с 2–10 мМ NaF. Например, обработка эритроцитов 5 мМ NaF в течение суток увеличивала популяцию эритроцитов с активными каспазами-8 до ~16%. Интересно, что после 5-ч экспозиции уровень стимуляции каспазы-8 немного возрастал по сравнению с 1-ч инкубацией под влиянием низких концентраций NaF (0.1–0.5 мм), но снижался примерно в 2 раза в тех же самых пробах в присутствии относительно высоких доз фторида (2–10 мМ), хотя этот эффект не достиг статистической значимости. В контрольных условиях число клеток с активными каспазами-8 было относительно стабильным и не превышало 1.38 ± 0.35%, 1.02 ± 0.19% и 1.69 ± 0.38% после 1-ч, 5-ч и 24-ч инкубации, соответственно (различия статистически недостоверны).
Рис. 1.
Зависимость стимуляции каспазы-8 в эритроцитах крысы от концентрации NaF и времени инкубации с ним. Эритроциты инкубировали с 0.1–10 мМ NaF в течение 1, 5 и 24 ч, затем нагружали флуоресцентной меткой FITC-IETD-FMK в течение 1 ч и измеряли активность каспазы-8 методом проточной цитометрии. * p < 0.01, ** p < 0.001 по сравнению с соответствующим контролем.
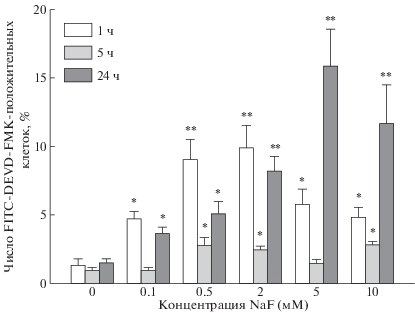
Активность каспазы-3. Характер стимуляции эффекторной каспазы-3 (рис. 2) в целом повторял таковой для каспазы-8. Наибольшее число эритроцитов с активными каспазами-3 (~15%) также наблюдалось после 24-ч обработки с 5 мМ NaF. Число клеток с активной каспазой-3 после 5-ч обработки NaF было статистически достоверно ниже, чем таковое из тех же самых проб после 1-ч инкубации. Следует отметить и другой факт. Так, после 1-ч экспозиции низкие концентрации NaF (0.1–2 мМ) продуцировали примерно в 2 раза больше клеток с активной каспазой-3, чем с каспазой-8. В контрольных пробах степень стимуляции каспазы-3 также оставалась постоянной в течение всего периода инкубации и составляла 1.2 ± 0.4%, 0.9 ± 0.2% и 1.5 ± 0.3% после 1, 5 и 24 ч соответственно.
Рис. 2.
Влияние различных доз NaF и времени инкубации с ним на активность каспазы-3 в эритроцитах крысы. Клетки обрабатывали 0.1–10 мМ NaF в течение 1, 5 и 24 ч, затем нагружали флуоресцентной меткой FITC-DEVD-FMK в течение 1 ч и измеряли активность каспазы-3 методом проточной цитометрии. * p < 0.01, ** p < 0.001 по сравнению с соответствующим контролем.
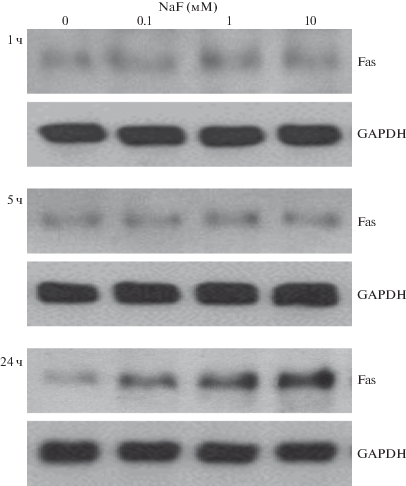
Экспрессия Fas. После 1-ч и 5-ч инкубации эритроцитов крысы с 0.1–10 мМ NaF достоверной стимуляции Fas не наблюдалось (рис. 3). Экспрессия Fas дозо-зависимо увеличивалась только после 24-ч обработки. В контрольных пробах активность Fas не изменялась на протяжении всего периода инкубации.
Рис. 3.
Изменение экспрессии рецепторов Fas в изолированных эритроцитах крысы под влиянием фтора. Эритроциты инкубировали с 0.1–10 мМ NaF в течение 1, 5 и 24 ч, затем в лизатах клеток методом иммуноблоттинга оценивали экспрессию Fas. Оптическую плотность полос Fas нормализовали по оптической плотности GADPH.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты работы показали, что ионы фтора способны инициировать рецептор-зависимый путь гибели эритроцитов крысы in vitro. Однако кинетика стимуляции компонентов этого пути – рецепторов Fas, каспаз-8 и каспаз-3 – сильно различается. Так, активация каспаз происходит уже после 1-ч инкубации клеток с NaF (рис. 1 и 2), а заметные изменения экспрессии Fas наблюдаются только после 24-ч обработки (рис. 3). Возможно, стимуляция каспазы-8 и каспазы-3 происходит, по крайней мере частично, независимо от мембранного механизма активации Fas.
Другой интересный феномен, выявленный в нашей работе – сложная зависимость стимуляции каспаз от времени инкубации и применяемых доз NaF. Например, число клеток с активными каспазами после 5-ч обработки NaF было ниже, чем таковое из тех же самых проб после 1-ч инкубации. Особенно наглядно эта зависимость проявилась для каспазы-3. Это может означать, что стимуляция каспаз является кратковременной. Скорее всего, этот феномен отражает различное физиологическое состояние клеток. Общая популяция эритроцитов состоит из клеток разного возраста. Возможно, что в течение первого часа инкубации каспазы стимулируются только в старых клетках. К пятому часу обработки эти эритроциты заканчивают процесс апоптоза, поэтому число клеток с активными каспазами уменьшается. После 24 ч инкубации каспазы стимулируются уже в тех зрелых клетках, которые вначале были нормальными и запустили процесс преждевременной гибели, индуцированной только NaF. Подтверждением этому может служить и увеличение экспрессии Fas, наблюдаемое только после суточной обработки клеток NaF.
Внутриклеточные механизмы, лежащие в основе активации рецепторов гибели и каспаз под влиянием фторида, в настоящее время не ясны. Анализ литературных данных показывает, что стимуляция каспаз в эритроцитах зависит от природы стимула. Так, зимогены каспазы-3 не активировались в процессе преждевременной гибели эритроцитов человека, индуцированной накоплением Ca2+ и обработкой Ca2+ ионофором A23187, хотя экстернализация фосфатидилсерина на мембранах предотвращалась ингибитором каспаз Ac-DEVD-CHO [11]. Несколько других широко применяемых индукторов клеточной гибели, в том числе стауроспорин и иономицин, также не были способны стимулировать прокаспазы-8 и ‑3 [12]. Наоборот, каспазы-8 и -3 активировались в эритроцитах человека в ответ на обработку про-оксидантом терт-бутил-гидропероксидом (tBHP), что сопровождалось ингибированием активности фермента флиппазы (аминофосфолипид-транслоказы), перемещением фосфатидилсерина на внешний слой мембраны, протеолизом белка полосы 3 и активацией эритрофагоцитоза [13–15]. Эти же авторы продемонстрировали связывание Fas рецепторов с его лигандами [15]. Кроме того, стимуляция каспаз 8 и 3 была описана в эритроцитах человека, в которых апоптоз был индуцирован пероксинитритом [19], 9-О-ацетилированным ганглиозидом GD3 [20], в физиологически старых эритроцитах, имеющих фосфатидилсерин на мембранах [16] и после длительного хранения в условиях банка крови [20].
Исходя из этого, мы полагаем, что в зрелых эритроцитах каспазы могут быть стимулированы как старением клеток, так и окислительным стрессом, т.е. нарушением баланса между возрастающей продукцией активных форм кислорода (ROS) и активностью антиокислительных ферментов. Ранее мы показали, что обработка эритроцитов крысы NaF приводила к накоплению супероксида и перекиси водорода в условиях in vitro [22] и перекисей в условиях in vivo [18]. Хотя ионы фтора не являются ни донорами, ни акцепторами электронов из-за полностью заполненной электронной оболочки, благодаря высокой электроотрицательности они способны формировать сильные водородные связи, особенно с –OH и –NH группами в молекулах, а также формировать комплексы с поливалентными металлами типа Al3+, Fe3+, и Mg2+. Таким образом, ионы фтора способны оказывать мощное влияние на ферменты, контролирующие состояние антиокислительных систем в клетках различных типов [7, 8, 23]. В условиях кровеносного русла, в котором эритроциты подвергаются многочисленным повреждающим воздействиям (осмотическому шоку в почках, окислительному стрессу в легких, механической деформации в процессе прохождения через узкие капилляры), активация каспаз может быть необходима как один из механизмов для запуска механизма элиминации старых и дефектных клеток и эритрофагоцитоза.
Список литературы
Fluoride in drinking water // WHO (World Health Organization). K. Bailey, J. Chilton, E., Dahi, M. Lennon, P. Jackson, J. Fawell Eds., WHO Press, Switzerland, 2006.
Pizzo G., Piscopo M.R., Pizzo I., Guiliana G. Community water fluoridation and caries prevention: a critical review // Clin. Oral Investig. 2007. V. 11. P. 189–193.
Peckham S. Water fluoridation: a critical review of the physiological effects of ingested fluoride as a public health intervention // ScientificWorld Journal. 2014. 293019. http://dx.doi.org/https://doi.org/10.1155/2014/293019
Krishnamachari K.A. Skeletal fluorosis in humans: a review of recent progress in the understanding of the disease // Prog. Food Nutr. Sci. 1986. V. 10. P. 279–314.
Bronckers A.L., Lyaruu D.M., DenBesten P.K. The impact of fluoride on ameloblasts and the mechanisms of enamel fluorosis // J. Dent. Res. 2009. V. 88. P. 877–893.
Reddy D.R. Neurology of endemic skeletal fluorosis // Neurol. India. 2009. V. 57. P. 7–12.
Dec K., Lukomska A., Maciejewska D., Jakubczyk K., Baranowska-Bosiacka I., Chlubek D., Wasik A., Gutowska I. The influence of fluorine on the disturbances of homeostasis in the central nervous system // Biol. Trace Elem. Res. 2017. V. 177. P. 224–234.
Barbier O., Arreola-Mendoza L., Del Razo L. M. Molecular mechanisms of fluoride toxicity // Chem.-Biol. Interact. 2010. V. 188. P. 319–333.
Agalakova N.I., Gusev G.P. Molecular mechanisms of cytotoxicity and apoptosis induced by inorganic fluoride // ISRN Cell Biol. 2012. ID 403835. http://dx.doi.org/ https://doi.org/10.5402/2012/403835
Ribeiro D.A., Cardoso C.M., Yujra V.Q., De Barros Viana M., Aguiar O.Jr, Pisani L.P., Oshima C.T.F. https://www.ncbi.nlm.nih.gov/pubmed/28870895 Fluoride Induces Apoptosis in Mammalian Cells: In Vitro and In Vivo Studies // Anticancer Res. 2017. V. 37. P. 4767–4777.
Bratosin D., Estaquier J., Petit F., Arnoult D., Quantannens B., Tissier J.P., Slomianny C., Sartiaux C., Alonso C., Huart J.J., Montreuil J., Ameisen J.C. Programmed cell death in mature erythrocytes: a model for investigating death effector pathways operating in the absence of mitochondria // Cell Death. Differ. 2001. V. 8. P. 1143–1156.
Berg C.P., Engels I.H., Rothbart A., Lauber K., Renz A., Schlosser S.F., Schulze-Osthoff K., Wesselborg S. Human mature red blood cells express caspase-3 and caspase-8, but are devoit of mitochondrial regulators of apoptosis // Cell Death Differ. 2001. V. 8. P. 1197–1206.
Mandal D., Moira P.K., Basu J. Caspase 3 regulates phosphatidylserine externalization and phagocytosis of oxidatively stressed erythrocytes // FEBS Lett. 2002. V. 513. P. 184–188.
Mandal D., Baudin-Creuza V., Bhattacharyya A., Pathak S., Delaunay J., Kundu M., Basu J. Caspase 3-mediated proteolysis of the N-terminal cytoplasmic domain of the human erythroid anion exchanger 1 (band 3) // J. Biol. Chem. 2003. V. 278. P. 52551–52558.
Mandal D., Mazumder A., Das P., Kundu M., Basu J. Fas, caspase 8-, and caspase- 3-dependent signaling regulates the activity of the aminophospholipid translocase and phosphatidylserine externalization in human erythrocytes // J. Biol. Chem. 2005. V. 280. P. 39460–39467.
Bratosin D., Tcacenco L., Sidoroff M., Cotoraci C., Slomianny C., Estaquier J., Montreuil J. Active caspases-8 and -3 in circulating human erythrocytes purified on immobilized annexin-V: a cytometric demonstration // Cytometry. 2009. V. 75A. P. 236–244.
Agalakova N.I., Gusev G.P. Fluoride-induced death of rat erythrocytes in vitro // Toxicol. In Vitro. 2011. V. 25. P. 1609–1618.
Agalakova N.I., Gusev G.P. Excessive fluoride consumption leads to accelerated death of erythrocytes and anemia in rats // Biol. Trace Elem. Res. 2013. V. 153. P. 340–349.
Pietraforte D., Matarrese P., Straface E., Gambardella L., Metere A., Scorza G., Leto T.L., Malorni W., Minetti M. Two different pathways are involved in peroxynitrite-induced senescence and apoptosis of human erythrocytes // Free Radic. Biol. Med. 2007. V. 42. P. 202–214.
Mukherjee K., Chowdhury S., Mondal S., Mandal C., Chandra S., Bhadra R.K., Mandal C. 9-O-Acetylated GD3 triggers programmed cell death in mature erythrocytes. Biochem. Biophys. Res. Commun. 2007. V. 362. P. 651–657.
Kriebardis A.G., Antonelou M.H., Stamoulis K.E., Economou-Petersen E., Margaritis L.H., Papassideri I.S. Storage-dependent remodeling of the red blood cell membrane is associated with increased immunoglobulin G binding, lipid raft rearrangement, and caspase activation // Transfusion. 2007. V. 47. P. 1212–1220.
Agalakova N.I., Gusev G.P. Fluoride induces oxidative stress and ATP depletion in the rat erythrocytes in vitro // Environ. Toxicol. Pharmacol. 2012. V. 34. P. 334–337.
Burgstahler A.W. Recent research on fluoride and oxidative stress // Fluoride. 2009. V. 42. P. 73–74.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


