Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 2, стр. 121-129
УЧАСТИЕ МЕТАБОТРОПНЫХ ГЛУТАМАТНЫХ РЕЦЕПТОРОВ II ГРУППЫ В МОДУЛЯЦИИ ВЫЗВАННОЙ АКТИВНОСТИ СПИНАЛЬНЫХ МОТОНЕЙРОНОВ ЛЯГУШКИ
Н. М. Чмыхова 1, *, С. О. Гапанович 1, Е. Н. Парийская 2, Н. П. Веселкин 1, 2
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: nchmykhova@gmail.com
Поступила в редакцию 29.06.2018
После доработки 02.10.2018
Принята к публикации 04.02.2019
Аннотация
В электрофизиологических экспериментах на срезах изолированного спинного мозга лягушки исследовано действие агониста мГлуР II группы, включающей подтипы мГлуР 2 и мГлуР 3 (мГлуР2\3), на вызванную активность и электрические свойства мембраны поясничных мотонейронов. При экстра-клеточном отведении наблюдалось уменьшение амплитуды коротколатентных компонентов спинальных рефлексов и суммарной площади ответа при действии DCG-IV (2S,2'R,3'R)-2-(2',3'-Dicarboxycyclopropyl)glycine), агониста мГлуР 2/3 в интервале концентраций 0.05–5 мкМ. ЕС50 подавления коротколатентных компонентов ответа при аппликации DCG-IV составляет около 0.5 мкМ. Внутриклеточные отведения постсинаптических потенциалов мотонейронов при аппликации DCG-IV показали уменьшение числа спайков в постсинаптическом ответе мотонейронов и суммарной площади ответа на раздражение дорсальных корешков. В большинстве исследуемых мотонейронов зарегистрированы гиперполяризация, увеличение амплитуды антидромного потенциала действия, изменение амплитуды его следовых потенциалов, увеличение возбудимости мотонейронов, что может являться свидетельством действия агониста на постсинаптические мГлуР II группы поясничных мотонейронов.
ВВЕДЕНИЕ
Регуляция синаптической передачи между нейронами возможна на пре- и постсинаптическом уровне. Механизм и уровень, на котором происходит эта регуляция, в значительной мере определяется типом рецепторов, активируемых соответствующим передатчиком и их распределением. В нашей предыдущей работе обсуждалось участие пресинаптических мГлуР III группы в регуляция глицинергической синаптической передачи [1]. Участие мГлуР II группы в модуляции синаптической передачи обычно рассматривают тоже как пресинаптический механизм [2–5]. В спинном мозгу млекопитающих агонисты мГлуР 2/3 в большинстве случаев также оказывают тормозящее влияние на синаптическую передачу, действуя на пресинаптическом уровне [6–8].
Однако в ряде исследований получены данные не только о пре-, но и о постсинаптической локализации мГлуР II [9, 10], а также об их влиянии на синаптическую передачу [11–16]. Большая часть этих данных получена в исследованиях, выполненных на ядрах ствола мозга и коре млекопитающих. Данные о постсинаптическом действии агонистов мГлуР 2/3, вызывающих фасилитацию ответов спинальных нейронов, представлены Бонжиани и соавт. и у низших позвоночных [17]. Ранее, при регистрации миниатюрной активности поясничных мотонейронов в опытах на суперфузируемом препарате изолированного спинного мозга лягушки, нами было показано, что селективный антагонист мГлуII рецепторов – EGLU ((2S)-α-ethylglutamic acid) оказывает пресинаптическое облегчающее действие (увеличение частоты миниатюрных событий без увеличения их амплитуды) и этот эффект наблюдался только в части регистрируемых клеток [18].
В настоящем исследовании, используя вне- и внутриклеточную регистрацию активности мотонейронов поясничного утолщения спинного мозга лягушки и применяя DCG-IV, селективный агонист метаботропных глутаматных рецепторов II группы, мы попытались уточнить участие глутаматных рецепторов II группы как в пре-, так и в постсинаптической модуляции вызванной активности спинальных мотонейронов.
МАТЕРИАЛ И МЕТОДИКА
Работa выполнена на 25 озерных лягушках Rana ridibunda обоего пола весом 70–120 г. Опыты были проведены в соответствии с положениями Российского национального комитета по биоэтике. Под эфирным наркозом после дорсальной ламинэктомии у лягушки вырезали костную пластинку, включающую в себя спинной мозг, помещали ее в ванночку с охлажденным раствором Рингера, аэрируемого карбогеном (98% О2 и 2% СО2). Нормальный суперфузирующий раствор имел следующий состав в мM: NaCl – 98, KCl – 2, NaHCO3 – 9.3, MgCl2 – 0.5, глюкоза – 5, CaCl2 – 1.1, Трис (рН 7.4–7.6). Мозг извлекали вместе с корешками, проводили гемисекцию или рассекали на сегменты, используемые в опытах поочередно. Подготовленные препараты укладывали в экспериментальную камеру с постоянным протоком физиологического раствора при температуре 18°С, где вентральные и дорсальные корешки (ВК и ДК соответственно) 8–10-го (поясничных) сегментов помещали в стеклянные пипетки (всасывающие электроды) для антидромной стимуляции мотонейронов и суммарного отведения потенциалов от ВК и для ортодромной стимуляции мотонейронов раздражением ДК. Для ортодромной стимуляции мотонейронов ДК раздражали прямоугольными импульсами тока длительностью 0.3 мс с частотой 0.025 с–1. Сила тока при стимуляции ДК составляла от 1 до 3 пороговых значений для возникновения потенциалов действия и разрядов мотонейронов (30–300 мкА) и не изменялась в течение эксперимента. Действие вещества (2S,1 R,2 R,3 R)-(2,3-dicarboxycyclopropyl)glycine (DCG-IV), агониста мГлуР2/3 (Tocris, Англия), на активность поясничных мотонейронов регистрировали более 2.5 ч. Показания для построения кривых “доза–эффект” снимали, в основном, через 20–30 мин от начала аппликаций. Отмывание агониста до полного восстановления контрольных значений ответов занимало десятки минут в случае аппликации невысоких концентраций агониста (1 мкМ и менее) и около суток – после перфузии 5 мкм DCG-IV. Более высокие концентрации агониста в экспериментах не применяли.
Внутриклеточные отведения от мотонейронов производили с помощью заполненных 3 М раствором KCl стеклянных микроэлектродов с диаметром кончика около 1 мкм, и сопротивлением 10–20 МОм. Мотонейроны идентифицировали по антидромным потенциалам действия (АПД), вызываемым раздражением ВК одиночными стимулами (0.3 мс, 10–15 мкА). Уровень мембранного потенциала мотонейронов (МП) измеряли цифровым вольтметром. Для усиления экстраклеточных вентральнокорешковых потенциалов (ДК-ВКП) использовали дифференциальный усилитель постоянного тока.
Для внутриклеточной регистрации от мотонейронов использовали разработанный и изготовленный в лаборатории оригинальный усилитель с автоматической стабилизацией нулевой линии, сигналы подавали через аналого-цифровой преобразователь на персональный компьютер. При регистрации постсинаптических потенциалов мотонейронов, вызванных раздражением ДК (ДК-ПСП), как и ответов вентрального корешка (ДК-ВКП) записывали 5–10 пробегов с частотой 0.025 с–1, а с частотой 0.5 с–1 при стимуляции ВК записывали АПД. Анализ параметров ДК-ВКП, ДК-ПСП, амплитуды АПД и его послепотенциалов проводили с помощью компьютерной программы Сlampfit 8.2 пакета Pclamp 8.2 Axon instruments. Статистический анализ и графические построения выполняли с помощью пакета программ SigmaPlot 2.0, 11.0 и Мicrosoft Exсel. Результаты представлены как m ± SEM. Для оценки значимости различий распределений экспериментальных значений использовали t-критерий Стьюдента.
РЕЗУЛЬТАТЫ
Влияние DCG-IV, агониста мГлуР2/3 на ДК-ВКП и ДК-ПСП
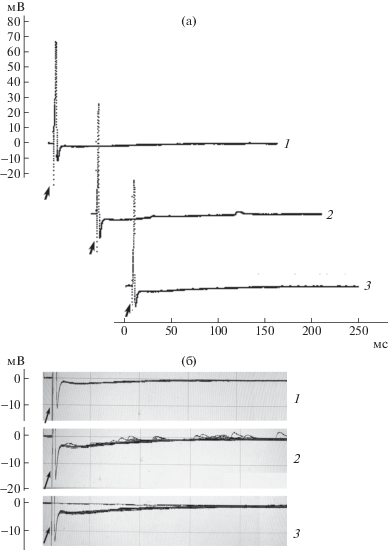
Экстраклеточная регистрация потенциалов от вентральных корешков при раздражении ипсилатеральных дорсальных корешков того же сегмента (ДК-ВКП) выполнена в 23 отведениях (23 пары ДК-ВК) на фрагментах спинного мозга, полученных от 6 животных. Типичный ответ на раздражение ДК одиночным импульсом, зарегистрированный монополярно от поверхности ВК, представляет собой коротколатентную (7–8 мсек), позитивную волну длительностью около 10 мсек, достигающую амплитуды 1–3 мВ, за которой следует серия более поздних колебаний, не превышающих нескольких сотен микровольт. Общая длительность ответа достигает 250–1000 мсек. Аппликация DCG-IV в концентрации от 0.05 до 5 мкМ вызывала дозозависимое уменьшение амплитуды коротколатентных компонентов и суммарной площади ответов, включающей длиннолатентные (полисинаптические) компоненты (рис. 1). Скорость восстановления первоначальных параметров ответа после начала отмыва нормальным раствором существенно варьировала – от 30 мин (в случае действия малых концентраций агониста) и до 12 ч после действия 5 мкМ DCG-IV. По мере увеличения концентрации агониста DCG-IV (0.05, 0.25, 0.5, 1 и 5 мкМ) амплитуда коротколатентного компонента ответа уменьшалась по сравнению с зарегистрированной исходно в нормальном растворе для данной пары ДК-ВК (контроль). В среднем это уменьшение было на 19.1 ± 3.2% (n = 19); 27.1 ± 5.3% (n = 14); 31.9 ± 4.9% (n = 10); 49.9 ± 5.4% (n = 17) и 62.9 ± 5.6: (n = 18)% соответственно. Кривая “доза–эффект” изменения амплитуды коротколатентного компонента ДК-ВКП того же сегмента при увеличении концентрации DCG-IV от 0.05 до 5 мкМ представлена на рис. 2а.
Рис. 1.
Действие возрастающей концентрации DCG-IV на сегментарные ДК-ВКП в поясничном утолщении спинного мозга лягушки. Момент нанесения раздражения показан стрелкой. Каждая кривая – наложение 5 ответов при частоте стимуляции 0.025 с–1.
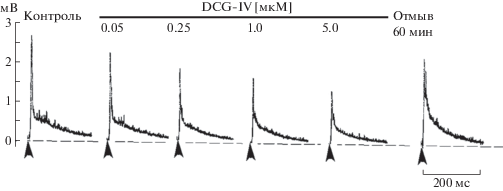
Рис. 2.
Дозозависимые изменения амплитуды коротколатентного компонента и суммарной площади ДК-ВКП при аппликации DCG-IV в возрастающей концентрации. (а) Кривая “Доза–эффект” подавления коротколатентных компонентов сегментарных ДК-ВКП при аппликации 50 (n = 19), 250 (n = 14), 500 (n = 10) нМ, 1 (n = 17) и 5 (n = 18) мкM DCG-IV; ось абсцисс – концентрация агониста DCG-IV в нМ, ось ординат – подавление коротколатентного компонента ДК-ВКП в % от значений параметра в нормальном растворе. (б) площади суммарных ДК-ВКП в нормальном (столбики без штриховки – 1, 7) перфузирующем растворе до и после аппликации DCG-IV, при аппликации 50, 250, 500 нМ, 1 и 5 мкM DCG-IV (заштрихованные столбики – 2–6). Число регистраций указано в основаниях столбиков, по вертикали – нормированная площадь ДК-ВКП (%). 1 – значение в нормальном растворе, 2 –6 – нарастающая концентрация DCG-IV, 7 – отмыв агониста.
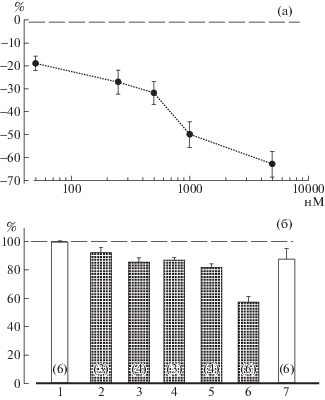
При увеличении концентрации агониста в том же диапазоне, но при регистрации от более каудальных вентральных корешков, амплитуда коротколатентных компонентов ДК-ВКП соответственно уменьшалась на 16 ± 6.7 (n = 5); 31.0 ± 11.1 (n = 4); 43.8 ± 8.1 (n = 5); 54 ± 5.9 (n = 4); 81.7 ± 9.4 (n = 3)%. При этом ЕС50 действия агониста составляет около 0.5 мкМ.
Уменьшение суммарной площади коротколатентного и длиннолатентных компонентов ипсилатеральных ДК-ВКП при действии возрастающих концентраций агониста было более умеренным, и при аппликации 5 мкМ DCG-IV достигало 56 ± ± 5.1% от контрольного значения (рис. 2б).
При внутриклеточной регистрации ДК-ПСП добавление в перфузионный раствор DCG-IV вызывает уменьшение числа спайков и площади ДК-ПСП мотонейронов. Смена на нормальный раствор постепенно возвращает спайковую активность мотонейрона (рис. 3а). В случае регистрации ДК-ПСП мотонейрона Х сегмента на раздражение корешка стимулами средней величины (1.5–2 пороговых значения вызова спайковой активности) через 10 минут после начала аппликации агониста в меньшей концентрации (250 нМ) количество спайков ДК-ПСП и площадь ответа уменьшались на 25% и 10%, при продолжении действия 250 мкМ агониста наблюдается тенденция восстановления спайковой активности. Следующая аппликация 1 мкМ DCG-IV вновь приводит к дальнейшему подавлению обоих показателей и через 30 мин спайковая активность сокращается на 70.0 ± 2.1%, площадь ответа – на 30.0 ± 4.8% (рис. 3б). Отмыв агониста после смены раствора на раствор нормального состава обычно занимал длительное время (см. в разделе Методика). Большая сила стимуляции ДК (2,5 порога для вызова спайковой активности мотонейрона) при аппликации 1 мкМ DCG-IV приводила к более значительному сокращению числа спайков ДК-ПСП другого мотонейрона (более чем на 80% от активности в нормальном растворе), а 30 мин отмыва приводило к медленному началу восстановления ДК-ПСП (рис. 3в). В экспериментах на срезах амигдалы крыс подавляющее действие 1 мкМ DCG-IV длилось 20 мин, что привело к уменьшению амплитуды полевого ответа на 70%, через час после прекращения его аппликации составляло около 50%, а полной реверсии ответа в экспериментах без антагониста мГлуР2/3 не возникало [19].
Рис. 3.
Действие DCG-IV на ДК-ПСП мотонейронов при раздражении дорсального корешка. (а) подавление спайкового ответа мотонейрона (момент раздражения показан стрелкой) при аппликации 1 мкМ DCG-IV. 1 – регистрация ДК-ПСП в нормальном растворе (9–7 спайков) – контроль, 2 – действие агониста в течение 30 мин (1 спайк), 3 – начало восстановления ответа через 30 минут после начала отмыва (2–3 спайка). (б) изменение параметров ДК-ПСП мотонейрона Х сегмента: сокращение числа спайков (кружки) и площади (квадраты) ДК-ПСП при последовательной аппликации 250 нМ и 1 мкМ DCG-IV. Ось ординат – уменьшение числа спайков в ответе и площади ДК-ПСП в % от значений этих параметров в нормальном растворе – контроль ( пунктирная линия), ось абсцисс – время эксперимента в минутах. Каждая точка рассчитана по 10 регистрациям. (в) изменения числа спайков (кружки) и площади (квадраты) ДК-ПСП в ответах другого мотонейрона на стимуляцию ДК большей интенсивности ( 2.5 порога вызова спайковой активности в мотонейроне), при аппликации 1 мкМ DCG-IV и после смены перфузирующего раствора на нормальный состав. Количество регистраций в каждом случае – 5; (г) сравнение нормированных значений изменения числа спайков в ДК-ПСП (столбцы без штриховки) и площади ДК-ПСП (заштрихованные столбцы), регистрируемых в 9 мотонейронах при аппликации 250, 500 нМ и 1 мкМ DCG-IV.
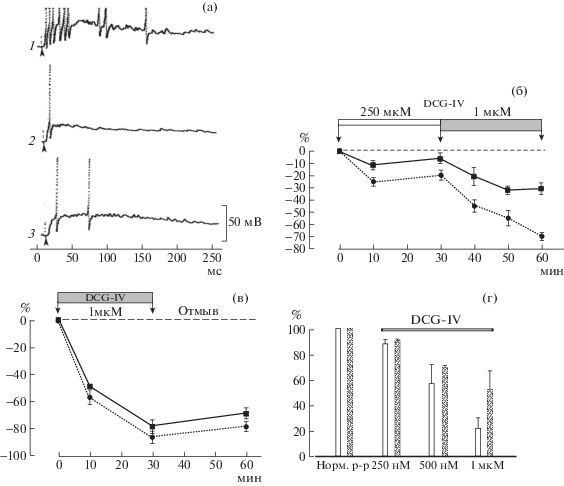
При увеличении концентрации агониста его влияние на ответ мотонейрона увеличивается. Сравнение нормированных значений изменения числа спайков ДК-ПСП и площади ДК-ПСП, регистрируемых во всех 9 мотонейронах при аппликации 250, 500 нМ и 1 мкМ DCG-IV, представлено на рис. 3г. Таким образом, полученные данные указывают на участие мГлуР 2/3 в модуляции передачи сенсорных сигналов к спинальным мотонейронам лягушки.
Влияние агониста DCG-IV на мембранный потенциал покоя поясничных мотонейронов, антидромный потенциал и его следовые потенциалы
Аппликация DCG-IV вызывала гиперполяризацию потенциала покоя мотонейронов (МП) от контрольного –63.0 ± 1.5 мВ (n = 23) до –77.5 ± 2.1 мВ (n = 6) (p < 0.0001, t-критерий Стьюдента для независимых выборок) и увеличение амплитуды антидромного потенциала действия мотонейронов (АПД): от 75.4 ± 3.0 мВ (n = 23) до 100.8 ± 6.3 мВ (n = 6), (p < 0.001, t – критерий Стьюдента для независимых выборок), (рис. 4а). Изменялась не только амплитуда АПД, но и амплитуда следовых потенциалов (рис 4б, в; рис. 5). Исходно в контроле в 22% регистрируемых мотонейронов (в 5 из 23) присутствовала следовая деполяризация, а большинство АПД мотонейронов имели следовую гиперполяризацию с быстрой (fast after-hyperpolarization – fAHP) и, после небольшого деполяризационного перегиба, медленной (slow after-hyperpolarization- sAHP) фазами. В контроле амплитуда fAHP и sAHP составляла соответственно –11.5 ± 2.2 мВ и ‒3.4 ± 0.4 мВ в 6 клетках. В растворе с агонистом в 4 из 6 мотонейронов со следовой гиперполяризацией амплитуда fAHP уменьшалась на 2.1 мВ (p < < 0.05, paired t-test), sAHP на 1.0 мВ (p < 0.05, парный критерий Стьюдента) и появлялась ADP (рис. 4б, в). В двух мотонейронах изменения следовых потенциалов имели другой характер: амплитуды fAHP и sAHP увеличивались, ADP не возникала. Так в одном мотонейроне при действии 0.5 мкМ DCG-IV изменения fAHP составляли от –11.2 до ‒15.7 мВ и sAHP от –2.0 до –3.9 мВ (рис. 5), в другом при действии 250 нМ DCG-IV – fAHP от –15.9 до 20.0, sAHP – от – 1.8 до –2.3 мВ. Кроме того, при отведении АПД мотонейронов в растворе с агонистом наблюдали увеличение спонтанной синаптической активности (рис. 5а – 2, 5б – 2).
Рис. 4.
Влияние DCG-IV на МП, АПД и следовые потенциалы АПД поясничных мотонейронов: (а) изменение МП мотонейронов и амплитуды АПД, регистрируемых в нормальном растворе (столбцы без штриховки) при действии DCG-IV (1 мкМ) (заштрихованные столбцы); (б) записи АПД поясничного мотонейрона без ADP в нормальном растворе, при аппликации DCG-IV (1 мкМ) и длительном отмыве в нормальном растворе. Калибровка – 50 мВ, 5 мс. (в) изменение следовых потенциалов АПД мотонейрона (ADP, sAHP, fAHP) при последовательной аппликации возрастающих концентраций (250 нМ и 1 мкМ) DCG-IV. Каждое значение – среднее по пяти регистрациям. Стандартные ошибки среднего, составляющие десятую или сотые доли мВ, не показаны.
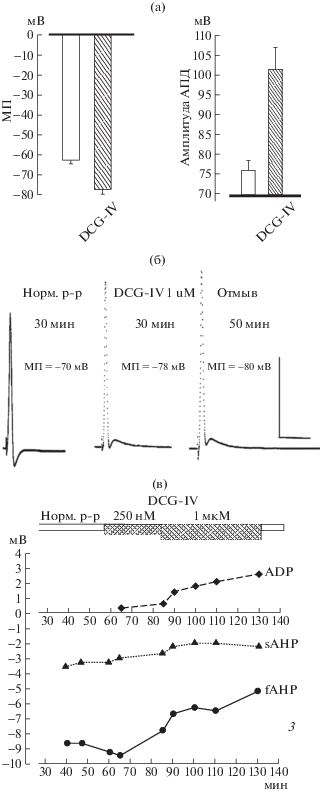
Рис. 5.
Влияние DCG-IV (0.5 мкМ) на следовые потенциалы АПД мотонейрона без ADP в нормальном растворе. Момент раздражения ВК показан стрелкой. По вертикали – амплитуда ответов в мВ, по горизонтали – временная шкала в мс. (а): 1 – регистрации АПД мотонейрона в нормальном растворе, 2 – через 30 мин аппликации DCG-IV, 3 – через 30 минут смены раствора на нормальный состав. (б) на фрагментах записей: 1 – регистрация в нормальном растворе, 2 – увеличение амплитуд fAHP и sAHP при действии DCG-IV, 3 – тенденция к их уменьшению после отмыва. На записи 2 заметно усиление миниатюрной спонтанной активности регистрируемого мотонейрона.
ОБСУЖДЕНИЕ
Мы не нашли в литературе сведений об эффективной концентрации DCG-IV при действии препарата на синаптическую передачу в нервной системе низших позвоночных. В работе Ишида и соавт. [6], исследовавших влияние DCG-IV на моносинаптическое возбуждение мотонейронов в изолированном спинном мозгу новорожденных крысят, использованная концентрация агониста варьировала в широком диапазоне – от 30 нМ до 1 мкМ. Концентрации DCG-IV 0.1 и 1 мкМ применялись в исследованиях роли метаботропных глутаматных рецепторов в синаптической пластичности, выполненных на срезах мозга крысенка [19, 20]. Таким образом, используемые нами концентрации агониста близки к используемым при работе на срезах мозга млекопитающих. Однако Жу и соавт. [8], исследуя участие мГлуР II группы в модуляции возбуждающих и тормозных синаптических входов нейронов заднего рога спинного мозга крысы, использовали тот же агонист в значительно большей, 10-микромолярной концентрации. В их работе были получены данные, подтверждавшие, что торможение этим агонистом глутаматергических и глицинергических входов исследуемых нейронов осуществляется на пресинаптическом уровне, но несмотря на использование DCG-IV в достаточно высокой концентрации Жу и соавт. не обнаружили его влияния на НМДА рецепторы и, вопреки указаниям других авторов [2, 6], не получили потенциации синаптических ответов, хотя Тышкевич и соавт. наблюдали на диссоциированных пирамидных нейронах префронтальной коры потенциацию тока через НМДА каналы в результате активации мГлуР II группы [21]. Позже Трепанье и соавт. выявили при активации мГлуР 2/3 усиление постсинаптической роли НМДА рецепторов при уменьшении АМПА/НМДА соотношения возбуждающих постсинаптических токов в синапсах коллатералей Шафера – СА 1 [22].
Влияние DCG-IV на собственные электрические свойства нейронов дорсального рога Жу и соавт. отрицают [8]. Такой же вывод сделан в отношении поясничных мотонейронов новорожденного крысенка [7]. Показано, что агонист мГлуР II группы не подавляет AHP пирамидальных клеток гиппокампа [23]. Однако в более ранних работах было обнаружено, что активация мГлуР II группы гиперполяризует нейроны амигдалы [24, 25], а в последующих исследованиях было показано, что мГлуР II группы гиперполяризует нейроны и других отделов ЦНС [16, 26–29], что подтверждено и нами в настоящем исследовании. Таким образом, полученные нами данные с высокой степенью вероятности указывают на то, что в использованных нами условиях аппликации агониста мГлуР II группы (DCG-IV), его эффекты могут быть связаны в том числе с его прямым действием на постсинаптическую мембрану нейрона. Известно, что гиперполяризация мембраны может вызываться активацией выходящего калиевого тока или блокадой тонически активного входящего тока. В разных нейронах ЦНС могут отличаться субъединичный состав, плотность и распределение потенциалзависимых натриевых и калиевых каналов начального сегмента аксона [30]. Показано, что К+‑каналы, а их множество, являются важной мишенью мГлуР [31]. Различие влияния агониста на собственные свойства разных регистрируемых мотонейронов, наблюдавшееся в наших экспериментах можно объяснить различиями их характеристик в зависимости от возможной принадлежности их к разным функциональным группам, иннервирующим экстензорные или флексорные, быстрые или медленные мышцы, к фазным или тоническим моторным единицам [32–34]. Соответственно мотонейроны могут обладать разным набором рецепторов и различными внутриклеточными сигнальными путями.
Список литературы
Карамян О.А., Чмыхова Н.М., Веселкин Н.П. Вторичные посредники пресинаптической регуляции глицинергического синапса мотонейрона лягушки // Российский физиологический журнал им. И.М. Сеченова. 2016. Т. 102. № 9. С. 1099–1110.
Conn P.J., Pin J.P., Pharmacology and functions of metabotropic glutamate receptors // Annu. Rev. Pharmacol. Toxicol. 1997. V. 37. P. 205–237.
Marti M., Paganini F., Stocchi S., Bianchi C., Beani L., Morari M. Presynaptic group I and II metabotropic glutamate receptors oppositely modulate striatal acetylcholine release // Eur. J. Neurosci. 2001. V. 14. P. 1181–1184.
Chen C.Y., Ling E., Horowitz J.M., Bonham A.C. Synaptic transmission in nucleus tractus solitarius is depressed by Group II and III but not Group I presynaptic metabotropic glutamate receptors in rats // J. Physiol. 2002. V. 538. P. 773–786.
Farazifard R., Wu S.H. Metabotropic glutamate receptors modulate glutamatergic and GABAergic synaptic transmission in the central nucleus of the inferior colliculus // Brain Res. 2010. V. 1325. P. 28–40.
Ishida M., Saitoh T., Shimamoto K., Ohfune Y., Shinozaki H. A novel metabotropic glutamate receptor agonist: marked depression of monosynaptic excitation in the newborn rat isolated spinal cord // Br. J. Pharmacol. 1993. V. 109. P. 1169–1177.
Taccola G., Marchetti C., Nistry A. Role of group II and III metabotropic glutamate receptors in rhythmic patterns of the neonatal rat spinal cord in vitro // Exp. Brain Res. 2004. V . 156. P. 495–504.
Zhou H.Y., Chen S.R., Chen H., Pan H.L. Functional plasticity of group II metabotropic glutamate receptors in regulating spinal excitatory and inhibitory synaptic input in neuropathic pain // J. Pharmacol. Exp. Ther. 2010 doi:https://doi.org/10.1124/jpet.110.173112
Petralia R.S., Wang Y.-X., Niedzielski A.S., Wenthold R.J., The metabotropic glutamate receptors, mGluR2 and mGluR3, show unique postsynaptic, presynaptic and glial localizations // Neuroscience. 1996 V. 71. № 1. P. 949–976.
Tang F.R., Sim M.K. Pre- and/or post-synaptic localisation of metabotropic glutamate receptor 1α (mGluR1α) and 2/3 (mGluR2/3) in the rat spinal cord // Neurosci. Res. 1999. V. 34. Issue 2. P. 73–78.
Cox C.L., Sherman S.M. Glutamate inhibits thalamic reticular neurons // J Neurosci. 1999. V. 19. P. 6694–6699. PubMed: .https://doi.org/10414998
Donato R, Lape R, Nistry A. Pre- and postsynaptic effects of metabotropic glutamate receptor activation on neonatal rat hypoglossal motoneurons // Neurosci. Lett. 2003. V. 338. P. 9–12.
Muly E.C., Mania I., Guo Ji-Dong, Rainnie D.J. Group II metabotropic glutamate receptors in anxiety circuitry: correspondence of physiological response and subcellular distribution // J. Comp. Neurol. 2007. doi https://doi.org/10.1002/cne.21525. V. 505. P. 682–700.
Lee C.C., Sherman S.M. Glutamatergic inhibition in sensory neocortex // Cereb. Cortex. 2009. V. 19. P. 2281–2289.
Lee C.C., Sherman S.M. Intrinsic modulators of auditory thalamocortical transmission // Hear. Res. 2012. V. 287. P. 43–50.
Lee C.C. Inhibition of mamillary body neurons by direct activation of Group II metabotropic glutamate receptors // Neurotransmitter. 2016. V. 3. P. 1–10. : e1357.doi: https://doi.org/10.14800/nt1357
Bongianni F., Mutolo D., Carfi M., Pantaleo T. Group I and II metabotropic glutamate receptors modulate respiratory activity in the lamprey // Eur. J. Neurosci. V. 16. P. 454–460. 2002.
Карамян О.А., Кожанов В.М., Масалов И.С., Чмыхова Н.М., Веселкин Н.П. Роль метаботропных глутаматных рецепторов II и III групп в модуляции миниатюрной синаптической активности мотонейронов спинного мозга лягушки // Цитология. 2008. Т. 50. № 9. С. 747–755.
Lodge D., Tidball P., Mercier M.S., Lucas S., Hanna L., Ceolin L., Kriticos M., Fitzjohn S.M., Sherwood J.l., Bannister N., Volianskis A., Jane D.E., Bortolotto Z.A., Collingridge G.L. Antagonists reversibly reverse chemical LTD induced by group I, group II and group III metabotropic glutamate receptors // Neuropharmacology. 2013. V. 74. P. 135–146.
Lucas S.J., Bortolotto Z.A., Collingridge G.L., Lodge D. Selective activation of either mGluR2 or mGluR3 receptors can induce LTD in the amygdale // Neuropharmacology. 2013. V. 66. P. 196 – 201.
Tyszkiewicz J.P., Gu Z., Wang X., Cai X., Yan Z. Group II metabotropic glutamate receptors enhance NMDA receptor currents via a protein kinase C-dependent mechanism in pyramidal neurones of rat prefrontal cortex // J. Physiol. 2003. V. 554. 3. P. 765–777.
Trepanier C., Lei G., Xie Y-F., MacDonald J. Group II metabotropic glutamate receptors modify N-metyl-D-aspartate receptors via Src kinase // Sci. Rep 2013. V. 3. P. 926–934.
Gereau R.W., Conn P.J. Roles of specific metabotropic glutamate receptor subtypes in regulation of hippocampal CA1 pyramidal cell excitability // J. Neurophysiol. 1995. V. 74. P. 122–129.
Rainnie D.G., Holmes K.H., Shinnock-Gallagher P. Activation of metabotropic glutamate receptors by trans-ACPD hyperpolarizes neurons of the basolateral amygdale // J. Neurosci. 1994. V. 14. P. 7208–7220.
Holmes K.H., Keele N.B., Shinnick-Gallagher P. Loss of mGluR- mediated hyperpolarizations and increase in mGluR depolarizations in basolateral amygdala neurons in kindling-induced epilepsy // J. Neurophysiol. 1996. V. 76. P. 2808–2812.
Dutar P., Petrozzino J.J., Vu H.M., Schmidt M.F., Perkel D.J. Slow synaptic inhibition mediated by metabotropic glutamate receptor activation of GIRK channels // J. Neurophysiol. 2000. V. 84. P. 2284–2290.
Watanabe D., Nakanishi S. mGluR2 postsynaptically senses granule cell inputs at Golgi cell synapses // Neuron. 2003. V. 39. P. 821–829.
Sekizawa S., Bechtold A.G., Tham R.C., Bonham A.C. A novel postsynaptic group II metabotropic glutamate receptor role in modulating baroreceptor signal transmission // J. Neurosci. 2009. V. 29. P. 11807–11816.
Zhang H., Cilz N.I., Yang C, Hu B., Dong H., Lei S. Depression of neuronal excitability and epileptic activities by group II metabotropic glutamate receptors in the medial entorhinal cortex // Hippocampus 2015. V. 25. P. 1299–1313.
Lorinz A., Nusser Z. Cell-type-dependent molecular composition of the axon initial segment. // J. Neurosci. 2008. V. 28 (53). P. 14329–14340.
Anwyl R., Metabotropic glutamate receptors: electrophysiological properties and role in plasticity // Brain. Res. Rev. 1999. V. 29. P. 83–120.
Stuart D. The segmental motor system – advances, issues and possibilities // In: Progress in Brain Research. ed. by M.Binder. Elsevier Science B. V. 1999. V. 123. P. 3–28.
Cotel F., Antri M., Barthe J-Y., Orsal D. Identified ankle extensor and flexor motoneurons display different firing profiles in the neonatal rat // J. Neurosci. 2009. V. 29. P. 2748–2753.
Krutki P., Hałuszka A., Mrówczynski W., Gardiner P.F., Celichowski J. Adaptations of motoneuron properties to chronic compensatory muscle overload // J Neurophysiol. 2015. V. 113. P. 2769–2777.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


