Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 2, стр. 104-114
КРЫСА (Rattus norvegicus) КАК ОБЪЕКТ ИССЛЕДОВАНИЯ В МОДЕЛИ ОСТРОГО ОТРАВЛЕНИЯ ФОСФОРОРГАНИЧЕСКИМИ СОЕДИНЕНИЯМИ. 1. БИОХИМИЧЕСКИЕ АСПЕКТЫ
Н. В. Гончаров 1, 2, *, М. А. Терпиловский 2, В. И. Шмурак 1, Д. А. Белинская 2, П. В. Авдонин 3
1 ФГУП “НИИ гигиены, профпатологии и экологии человека” ФМБА России
Ленинградская обл., г.п. Кузьмоловский, Россия
2 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
3 Институт биологии развития им. Н.К. Кольцова РАН
Москва, Россия
* E-mail: ngoncharov@gmail.com
Поступила в редакцию 18.04.2018
После доработки 18.10.2018
Принята к публикации 04.02.2019
Аннотация
Отставленные последствия острых отравлений фосфорорганическими соединениями (ФОС) остаются недостаточно изученными, а в экспериментальных моделях часто не учитываются видовые особенности грызунов. В настоящей работе представлены две токсикологические модели и проведен сравнительный анализ широкого ряда биохимических показателей крови в динамике на сроках до 3 мес после острого отравления крыс параоксоном. Наиболее чувствительным биохимическим показателем в ранние часы и дни после отравления ФОС ожидаемо является активность ацетилхолинэстеразы (АХЭ) цельной крови, которая снижается почти на порядок во всех опытных группах через 3 ч после отравления. Установлены изменения в показателях углеводного и жирового обмена (уровень триглицеридов, свободных жирных кислот, D-3-гидроксибутирата, холестерола и глицерола) в экспериментальных группах на разных сроках после отравления. Обнаружены статистически значимые изменения ряда биохимических маркеров у крыс положительного контроля относительно интактных животных.
ВВЕДЕНИЕ
С середины XIX века крыса Rattus norvegicus является одним из наиболее популярных объектов в лабораторных исследованиях [1, 2]. Заболевания ЦНС, почек и кишечника, спортивная физиология, протеомика и метаболомика, токсикология, действие фармпрепаратов и нутрицевтиков – вот неполный перечень научных направлений, где без использования крыс невозможно обойтись [2–8]. В свете задач трансляционной медицины необходимо как можно полнее учитывать генетические и физиолого-биохимические особенности крыс, чтобы адекватно интерпретировать полученные данные применительно к человеку. В токсикологии, особенно при изучении механизмов действия фосфорорганических соединений (ФОС) и разработке средств терапии отравлений, главной биохимической особенностью крыс, которую необходимо принимать во внимание, является наличие в плазме крови карбоксилэстеразной активности. Карбоксилэстеразы (КЭ, КФ 3.1.1.1) млекопитающих принадлежат к мультигенному суперсемейству с широкой субстратной специфичностью, катализируя гидролиз эфиров, тиоэфиров, амид-содержащих ксенобиотиков и эндогенных соединений, в т.ч. эфиров жирных кислот [9, 10]. В отличие от грызунов и зайцеобразных, в плазме крови человека, обезьян и полорогих парнокопытных нет КЭ [11]. Однако эстеразной активностью обладает сывороточный альбумин, каталитические характеристики которого близки у альбуминов крысы и человека, но существенно отличаются от характеристик бычьего альбумина [12–14]. Подавление активности КЭ плазмы крови грызунов может в значительной степени повысить адекватность экспериментальных моделей при изучении механизма действия и разработки новых антидотов против таких высокотоксичных ФОС, как зоман, зарин, табун, параоксон [15–17]. Для этого иногда используют нокаутных (ES1-/-) мышей [18]. Нокаутные крысы, однако, не выведены вследствие технической сложности и дороговизны технологии. Применение специфических ингибиторов КЭ является гораздо более простым и доступным методом, который, однако, применялся в очень ограниченных масштабах: динамика возникновения оставленных последствий острого отравления ФОС на фоне подавления активности КЭ плазмы крови крыс практически не изучена. Более того, даже без предварительного подавления активности КЭ последствия острого отравления ФОС изучали в ограниченных временных интервалах и, как правило, с использованием небольшого перечня показателей [19]. Ранее мы исследовали динамику активности холинэстераз и ряда других биохимических и гематологических показателей крови на разных сроках от 3 ч до 6 недель после острого отравления зоманом и веществом типа VX [20, 21]. Особенностью той серии экспериментов было введение ФОС дважды с интервалом 1 час по 0.4ЛД50. Первое введение было направлено на частичное подавление КЭ плазмы крови крыс, чтобы второе введение преимущественно воздействовало на холинэстеразы крови и синапсов. Недостаток такой модели – невысокая селективность высокотоксичных ФОС по отношению к КЭ, притом что VX вовсе не взаимодействует с КЭ [16]. Кроме того, количество биохимических и гематологических показателей в наших ранних экспериментах было довольно ограниченным.
Цель настоящей серии исследований – сравнительный физиолого-биохимический анализ экспериментальных моделей исследования отставленных последствий острого отравления ФОС на примере параоксона с применением 2-(о-крезил)-4Н-1,3,2-бензодиоксафосфорин-2-оксида (CBDP), одного из селективных ингибиторов КЭ [22]. В данной работе представлены две токсикологические модели и проведен сравнительный анализ ряда биохимических показателей крови в динамике на сроках до 3 месяцев после острого отравления параоксоном.
МАТЕРИАЛ И МЕТОДИКА
В работе применяли следующие реактивы: параоксон (O,O-диэтил-O-(п-нитрофенил)фосфат, POX, Sigma); 2-(о-крезил)-4Н-1,3,2-бензодиоксафосфорин-2-оксид (2-(O-cresyl)-4H-1,3,2-benzodioxaphosphorin-2-oxide, CBDP, синтезирован в НИИ гигиены, профпатологии и экологии человека ФМБА России); наборы для биохимического анализатора (Randox, UK); диметилсульфоксид (ДМСО) и пропиленгликоль фирмы Вектон (Россия).
Токсикологические и биохимические исследования проводили на крысах-самцах Rattus norvegicus аутбредной линии Вистар массой 200–240 г в соответствии с правилами, рекомендованными Физиологической секцией Российского национального комитета по биологической этике, положениями “Руководства по экспериментальному (доклиническому) изучению новых фармакологических веществ” [23], положениями “Руководства по лабораторным животным и альтернативным моделям в биомедицинских исследованиях” [24], “Правилами доклинической оценки безопасности фармакологических средств (GLP)” (РД 64-126-91) и требованиями Приказа Минздравсоцразвития РФ №708н от 23.08.2010. Животных содержали в виварии при температуре воздуха +20–22°С, влажности – не более 50%, объеме воздухообмена (вытяжка: приток) – 8:10, в световом режиме день/ночь = 12/12 ч, в стандартных пластиковых клетках с подстилом обеспыленным “Рехофикс” (PFLANZENFASER REHOFIX MK. 3500) и получали воду и стандартный рацион (гранулированный корм ПК120-3) ad libitum. Интактным животным (отрицательный контроль, или (–)контроль) не вводили ничего и содержали в отдельных клетках по 4 крысы в клетке. Животным положительного контроля ((+)контроль) вводили подкожно (п.к.) физиологический раствор вместо параоксона и содержали в одной клетке с отравленными животными, по одной контрольной крысе с тремя экспериментальными в клетке. Параоксон вводили п.к. в область холки в объеме из расчета 100 мкл на 100 г веса крысы, двукратно с интервалом 1 ч (РОХ2х, дозы 0.45 + 0.6ЛД50) и через 1 ч после CBDP в дозе 0.6ЛД50 (группа CBPOX). CBDP вводили внутрибрюшинно (в.б.) в количестве 3.3 мг/кг. Измерение показателей проводили через 3 и 24 ч, 1, 2, 4, 6 и 12 нед после воздействия. На каждую временную точку было взято не менее 6 животных.
Гепаринизированную (50 ед/мл) кровь получали после декапитации и центрифугировали 4 мин при 3000 об/мин (1500 g). Полученную плазму хранили при –70°С до проведения измерений. Экспериментальным путем был установлен перечень из 27 биохимических маркеров, спектрофотометрическое определение количества или активности которых в плазме крови оправдано с точки зрения стоящих перед нами задач и имеющихся технических возможностей: ацетилхолинэстераза (АХЭ) цельной крови, холинэстеразы (ХЭ) плазмы крови, бутирилхолинэстераза (БХЭ), карбоксилэстераза (КЭ) плазмы крови, параоксоназа 1 (PON1), аланинаминотрансфераза (АЛТ), альбумин, общий белок, глюкоза, D-3-гидроксибутират (3ГБ, бета-оксимасляная кислота), триглицериды (ТГ), свободные жирные кислоты (СЖК), глицерол, холестерол, желчные кислоты, липопротеиды высокой плотности (ЛВП), липопротеиды низкой плотности (ЛНП), липаза, железо, неорганический фосфат, щелочная фосфатаза (ЩФ), мочевина, креатинин, кальций (Са), мочевая кислота (МК), амилаза, орозомукоид (альфа-1-кислый гликопротеин, АКГ).
Активность АХЭ цельной крови и ХЭ плазмы крови определяли по методу Эллмана в планшетной модификации [25, 26]. Измеряли абсорбцию на длине волны 412 нм на планшетном спектрофотометре ThermoMultiskan FC (США). Биохимические анализы плазмы крови выполняли после разморозки на автоматическом биохимическом анализаторе Sapphire 400 с использованием коммерческих наборов в соответствии с рекомендациями фирмы-производителя. Активность КЭ и PON1 определяли по образованию нитрофенола при гидролизе параоксона по методу Phuntwate [27] с модификациями.
Статистическую и математическую обработку данных проводили с помощью языка программирования Python (https://www.python.org). Использовали научные пакеты SciPy, NumPy, Pandas [28–30], Matplotlib, Seaborn и Scikit-Posthocs [31]. Применяли непараметрический дисперсионный анализ Краскела–Уоллиса с последующим апостериорным анализом по методу Коновера с поправками p-величин по Бенджамини и Хохбергу [32]. Статистически обработанные данные представлены как среднее арифметическое ± стандартная ошибка.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
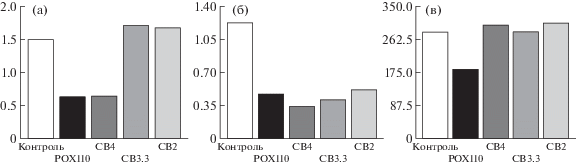
Установлены основные токсикометрические показатели параоксона для крыс-самцов: при однократном п.к. введении параоксона ЛД16 = = 241 мкг/кг, ЛД50 = 250 мкг/кг и ЛД84 = 259 мкг/кг. В серии отдельных экспериментов были подобраны эквитоксические дозы параоксона и CBDP – 110 мкг/кг и 3.3 мг/кг соответственно. При этом главная задача состояла в том, чтобы применяемая доза CBDP не ингибировала АХЭ цельной крови. Установлено, что активность АХЭ цельной крови через 1 ч после введения параоксона в дозе 110 мкг/кг и CBDP в дозе 4 мг/кг была снижена более чем в два раза, тогда как CBDP в дозе 3.3 мг/кг и ниже не ингибирует активность АХЭ и БХЭ (рис. 1). При двукратном введении с интервалом 1 ч параоксона (110 мкг/кг + Х) или CBDP с параоксоном вторая доза параоксона для достижения ЛД50 составляет 165 мкг/кг, т.е. введение CBDP примерно на треть повышает чувствительность крыс к параоксону. Это отличается от данных [16], согласно которым предварительное введение крысам CBDP в дозе 2 мг/кг повышает их чувствительность к параоксону в 2 раза. Очевидно, различия в дозах и степени повышения чувствительности обусловлены способом введения параоксона – подкожно в экспериментах [16] и внутрибрюшинно в наших экспериментах. Двукратное отравление параоксоном крыс в дозах 110 и 150 мкг/кг (0.45 и 0.6ЛД50, группа РОХ2х), а также введение параоксона в дозе 150 мкг/кг через 1 ч после введения CBDP в дозе 3.3 мг/кг (группа CВPOX) не приводит к гибели животных, но обусловливает клинические проявления холинергического криза, характерного для действия нервнопаралитических ядов, с последующим развитием отставленной патологии. Последнее представляет наибольший теоретический и практический интерес, т.к. механизмы развития последствий острого отравления далеки от понимания, а эффективные средства предупреждения (профилактики) или терапии этих последствий не разработаны.
Рис. 1.
Влияние различных доз CBDP (2–4 мг/кг) и параоксона (110 мкг/кг) на активность ферментов эстеразного профиля крови: (а) ацетилхолинэстеразы (АХЭ), (б) карбоксилэстеразы (КЭ) и (в) бутирилхолинэстеразы (БХЭ). По оси абсцисс: группа, по оси ординат: (а) активность АХЭ цельной крови (мкмоль/мин/г Hb), (б) активность КЭ плазмы крови (мкмоль НФА/мин/мл), (в) активность БХЭ плазмы крови (Ед/л).
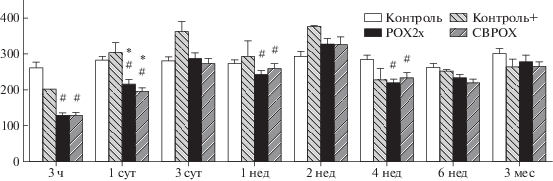
Из биохимических показателей для целей диагностики в ранние часы и дни после отравления ФОС наиболее чувствительным параметром является активность АХЭ цельной крови, которая снижается почти на порядок в обеих экспериментальных группах (p < 0.001) через 3 ч после отравления (рис. 2). Через сутки она ниже контроля в 2–2.5 раза, через 3 сут – в 1.5–2 раза, через неделю восстанавливается почти до уровня (–)контроля, однако остается на 20–30% ниже (+)контроля за счет некоторого повышения активности в этой группе относительно (–)контроля. Полученные данные свидетельствуют о влиянии психического стресса животных (+)контроля на уровень АХЭ цельной крови, основной вклад в который вносит, по-видимому, АХЭ плазмы крови, хотя вопрос о вкладе холинэстераз плазмы крови и системных корреляциях биохимических и (пато)физиологических показателей заслуживает специальных исследований. В связи с этим следует отметить описанную в литературе положительную корреляцию между активностью холинэстераз плазмы крови людей и их возрастом, индексом массы тела, уровнем стресса, воспалительными процессами и нейродегенеративными заболеваниями [33–38]. Полное восстановление активности АХЭ до исходного уровня отмечено через 2 недели после отравления, хотя на этом сроке в группе положительного контроля все еще наблюдается повышенная активность АХЭ. Такая динамика восстановления АХЭ у отравленных животных в большей степени соответствует изменениям, выявленным нами после отравления крыс зоманом (через неделю – восстановление до 60%), по сравнению с веществом типа VX, когда через неделю наблюдалось полное восстановление АХЭ [21]. Количество и активность БХЭ плазмы или сыворотки крови крыс примерно в 20 раз меньше, чем у человека, и не столь значительно снижается при отравлении ФОС: в норме она составляет 250–300 Ед/л, через 3 ч после отравления активность БХЭ снижена в 2 раза (p < 0.01), через сутки – на треть, а через 3 суток наблюдается полное восстановление активности БХЭ (рис. 3). Суммарная активность холинэстераз плазмы крови крыс также снижена в 2 раза через 3 ч после отравления, но полное восстановление происходит позже, через неделю, что объясняется более значительным количеством АХЭ по сравнению с БХЭ в плазме крови крыс [15, 39].
Рис. 2.
Динамика изменения активности ацетилхолинэстеразы цельной крови в контрольных и опытных группах. По оси абсцисс: срок отравления, по оси ординат: активность АХЭ цельной крови (мкмоль/мин/г Hb). Примечание к рис. 2–11 : * – достоверные отличия между экспериментальной группой и (+)контролем; # – достоверные отличия между экспериментальной группой и (–)контролем; $ – достоверные отличия между экспериментальными группами; & – достоверные отличия между (+) и (–)контролем.
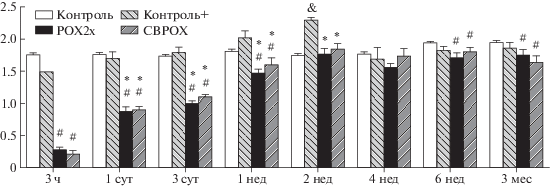
Рис. 3.
Динамика изменения активности бутирилхолинэстеразы плазмы крови в контрольных и опытных группах. По оси абсцисс: срок отравления, по оси ординат: активность БХЭ (Ед/л).
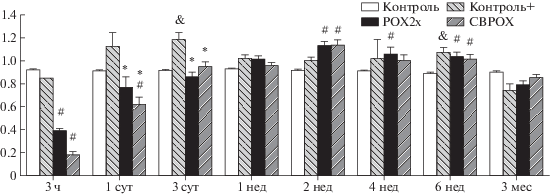
Активность КЭ плазмы крови снижена в 3 и 4 раза в группах РОХ2х и СВРОХ соответственно (рис. 4). Восстановление активности по отношению к (–)контролю происходит через 3 сут, но через 1 и 3 сут активность КЭ в группе (+)контроля повышена на 15–20% (через 3 сут – статистически значимо). В дальнейшем наблюдается устойчивая тенденция к повышению уровня активности КЭ в группах (+)контроля, РОХ2х и СВРОХ, особенно через 2, 4 и 6 нед, возвращаясь к норме через 3 мес после начала эксперимента. Через 2 нед отличия статистически значимы в обеих экспериментальных группах относительно (–)контроля, через 4 нед достоверность изменений выявлена лишь в группе РОХ2х, тогда как через 6 нед установлены статистически значимые отклонения от (–)контроля не только в экспериментальных группах, но и в группе (+)контроля (рис. 4). Можно предположить, что КЭ является одним из положительных острофазных белков, хотя для подтверждения этого необходимо исследование экспрессии соответствующего гена ES1. Другим возможным объяснением может служить поражение эндотелия сосудов и/или печени, в которых, наряду с известными тканеспецифическими маркерами, имеется в значительном количестве КЭ, кодируемая геном CES1 [40]. Параоксоназа PON1, сопряженная по методу измерения с КЭ, демонстрирует повышенную активность у отравленных животных через 3 сут, 2 и 4 недели, и пониженную – через 6 недель, но только относительно (–)контроля, т.к. в группе (+)контроля отмечен значительный разброс показаний на фоне однонаправленных с показателями экспериментальных групп колебаний активности. PON1 является компонентом ЛВП, уровень которых повышен у отравленных животных через 3 ч и сутки (p < 0.05) по отношению к (–)контролю, снижаясь через 3 сут и 3 мес после отравления по отношению к обеим контрольным группам. В то же время через 3 мес отмечен повышенный уровень ЛНП в обеих экспериментальных группах (p < 0.01).
Рис. 4.
Динамика изменения активности карбоксилэстеразы плазмы крови в контрольных и опытных группах. По оси абсцисс: срок отравления, по оси ординат: активность КЭ (мкмоль НФА/мин/мл).
Показатели углеводного и жирового обмена изменены на разных сроках после отравления не только в экспериментальных группах, но и в группе (+)контроля, причем изменения некоторых показателей имеют фазовый характер. Так, через 3 ч и сутки почти в 2 раза снижен уровень ТГ в трех группах относительно интактных животных (p < 0.01), через 3 сут наблюдается восстановление у отравленных животных и превышение исходного уровня в 1.5–2 раза в группе (+)контроля (p < 0.01), затем наблюдается некоторое снижение через 1 нед, повышение через 2 нед и почти полное восстановление через 4 нед после отравления (рис. 5). Уровень СЖК также претерпевает фазовые изменения, более выраженные в группе СВРОХ: повышение через 3 ч, снижение через 1 и 3 сут, восстановление через 1 нед, повторное снижение через 2 нед и окончательное восстановление через 4 нед после отравления. Фазовые изменения уровня глицерина более выражены в группе СВРОХ и, как ни странно, в группе положительного контроля, что дополнительно свидетельствует о высоком уровне стресса контрольных крыс, находящихся в одной клетке с отравленными: повышение через 3 ч, снижение через сутки (p < 0.05), повторное повышение через 3 сут, опять снижение через неделю (p < 0.05) и восстановление через 2 нед. Однако динамику 3ГБ демонстрируют лишь группы отравленных животных: повышение в 3–4 раза через 3 ч (p < 0.05), снижение до уровня контроля через сутки, повторное повышение в 2–3 раза через 3 сут (p < 0.05), почти полное восстановление через неделю и еще один подъем уровня 3ГБ через 6 нед, но только в группе СВРОХ. Поскольку 3ГБ является наиболее специфическим показателем кетоза, по сравнению с ацетоном и ацетоацетатом, можно предположить, что у животных группы СВРОХ в большей степени по сравнению с группой РОХ2х нарушена утилизация глюкозы, повышен глюконеогенез из белков и жирных кислот, снижается мышечная масса и повышен риск развития метаболического синдрома. В пользу такого предположения свидетельствует не только более резкое повышение через 3 ч уровня глюкозы в группе СВРОХ (в 3 раза) по сравнению с группой РОХ2х (в 2 раза) (р < 0.01), но и тенденция к уменьшению уровня глюкозы в группе СВРОХ через 3 мес (р < 0.1). Повышение α-амилазы в группах РОХ2х и СВРОХ через 3 ч после отравления примерно одинаково, на 20–30% (р < 0.05), но опять же отметим тенденцию к более выраженному повышению в группе СВРОХ, что свидетельствует о более значительном поражении поджелудочной железы в токсикогенной фазе отравления.
Рис. 5.
Динамика изменения уровня триглицеридов (ТГ) в плазме крови в контрольных и опытных группах. По оси абсцисс: срок отравления, по оси ординат: концентрация ТГ (ммоль/л).
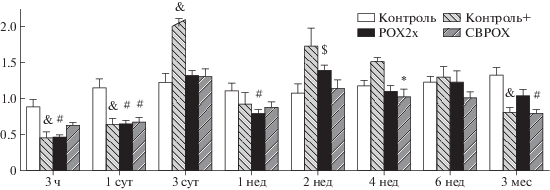
Фазовые изменения уровня холестерола в группе (+)контроля почти соответствуют таковым в группе РОХ2х, с той разницей, что максимум в (+)контроле приходится на 1-е сутки, а в группе РОХ2х – на 3-и, а также то, что амплитуда колебаний в группе РОХ2х сильнее выражена с минимумом через 1 нед после отравления (р < 0.05). Выравнивание показаний холестерола в этих группах с группой отрицательного контроля отмечено лишь через 4 нед. Динамика фазовых изменения холестерола в группе СВРОХ не столь ярко выражена, однако примечательно то, что максимум приходится на 3 ч, а минимум – на 6 нед после отравления (р < 0.05). Пониженный уровень холестерола, как известно, не менее опасен для организма, чем его повышенный уровень, будучи фактором риска геморрагического инсульта и неблагоприятного исхода после инфаркта и ишемического инсульта [41–46]; кроме того, пониженный уровень холестерола может способствовать развитию нейродегенеративных заболеваний [47, 48]. Выявленные нарушения метаболизма не исключают возможное развитие в отдаленные сроки после острого отравления ФОС гипометаболического состояния, проявлением которого могут стать нейродегенеративные заболевания, в частности болезнь Альцгеймера [49].
Признаки поражения печени наиболее отчетливо проявляются в группе СВРОХ: повышение АЛТ в 2 раза через 3 ч и сутки после отравления (рис. 6). В группе РОХ2х изменения менее выражены: повышение АЛТ на 20–30% через 3 ч и в 2 раза через сутки. Полное восстановление уровня АЛТ в группах РОХ2х и СВРОХ наблюдается лишь через неделю, но через 4 нед отмечено повышение АЛТ у отравленных животных на 10–20% (рис. 6). Альбумин и общий белок незначительно снижены (на 5–10%) у отравленных животных через 3 ч, но положительный острофазный белок АКГ (орозомукоид) повышен почти в 3 раза через сутки после отравления (рис. 7), что является реакцией на развитие воспалительных процессов и нарушение кровообращения. Следует отметить, что в дальнейшем уровень АКГ имеет тенденцию к повышению относительно (–)контроля не только у отравленных животных, но и в группе (+)контроля, причем на некоторых сроках (1 и 2 нед) даже в большей степени, чем у отравленных, возвращаясь к норме лишь через 3 мес.
Рис. 6.
Динамика изменения активности аланинаминотрансферазы (АЛТ) в плазме крови в контрольных и опытных группах. По оси абсцисс: срок отравления, по оси ординат: активность АЛТ (Ед/л).
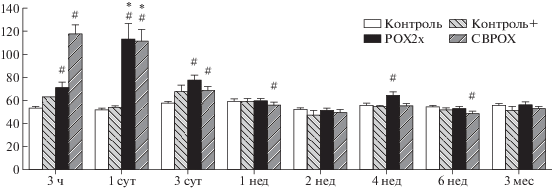
Рис. 7.
Динамика изменения уровня альфа-1-кислого гликопротеина (орозомукоида) в плазме крови в контрольных и опытных группах. По оси абсцисс: срок отравления, по оси ординат: содержание орозомукоида (г/л).
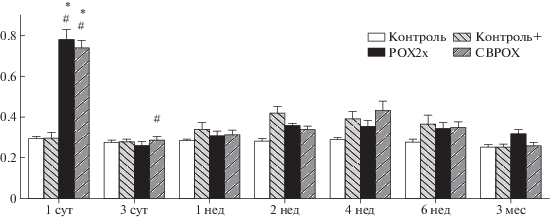
О поражении почек свидетельствуют биохимические данные по уровню креатинина, мочевины, а также мочевой кислоты. Уровень креатинина повышен на 35–40% через 3 ч в группе СВРОХ (р < < 0.05), тогда как уровень мочевины повышен на 20–30% через 1 и 2 нед у отравленных животных лишь относительно (–)контроля (р < 0.05). Ранее мы выявили близкие по величине статистически значимые повышения уровня креатинина через 4 и 6 нед после отравления зоманом и уровня мочевины через 4 и 6 нед после отравления веществом типа VX и зоманом соответственно [21]. Мочевая кислота (МК) – один из немногих показателей, значение которого в наших экспериментах изменялось исключительно в группе РОХ2х: отмечено повышение на 20–40% через сутки и 1 нед, хотя следует отметить равное, но недостоверное повышение уровня МК у животных обеих групп через 3 ч после отравления. Поскольку до 80% МК выделяется почками, этот показатель дополнительно свидетельствует о поражении почек при остром отравлении ФОС. Кроме того, выявлено почти синхронное повышение уровня ионов кальция и неорганического фосфата, а также активности ЩФ в группе СВРОХ через 3 ч после отравления (рис. 8, 9). Одновременное повышение уровня кальция и фосфата свидетельствует об усилении катаболических процессов в тканях, в том числе при кетоацидозе, а также о нарушении функции почек [50]. С учетом повышения креатинина, мочевины и МК в плазме крови и гликозаминогликанов в моче [6] можно считать поражение почек неотъемлемой составляющей последствий холинергического криза. Заслуживает внимания снижение активности ЩФ через 3 мес после отравления в трех группах относительно (–)контроля, наряду с повышением уровня кальция в этих же группах (рис. 10). Сочетание этих признаков может свидетельствовать о гипоминерализации скелетных костей и даже о развитии эпилептического статуса [51], что подтверждается данными нейрофизиологических и токсикологических исследований [52, 53]. Кроме того, снижение гидролитической активности ЩФ по отношению к АТФ, физиологическому агонисту P2X7-рецепторов, обусловливает повышенную их активацию и, как следствие, снижение скорости аксонального роста [54].
Рис. 8.
Динамика изменения концентрации ионов кальция в плазме крови в контрольных и опытных группах. По оси абсцисс: срок отравления, по оси ординат: концентрация Ca2+ (ммоль/л).
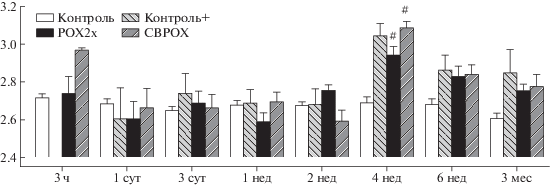
Рис. 9.
Динамика изменения концентрации фосфора в плазме крови в контрольных и опытных группах. По оси абсцисс: срок отравления, по оси ординат: концентрация фосфора (ммоль/л).
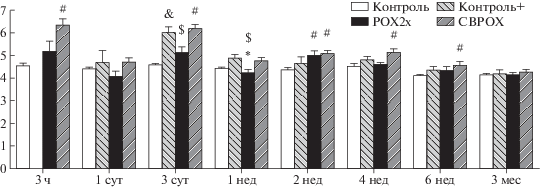
Рис. 10.
Динамика изменения активности щелочной фосфатазы (ALP) в плазме крови в контрольных и опытных группах. По оси абсцисс: срок отравления, по оси ординат: активность ALP (Ед/л).
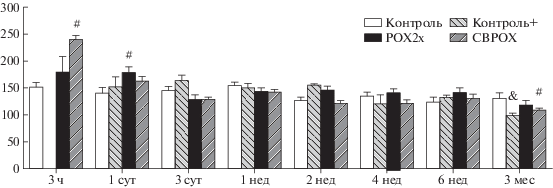
Одно из наиболее важных результатов исследования – выявленные нами статистически значимые изменения целого ряда биохимических маркеров у крыс (+)контроля, которые постоянно находились в одной клетке с отравленными животными, относительно крыс (–)контроля, находящихся в отдельных клетках. Наибольшие отличия установлены в динамике жирового обмена: так, уровень ТГ снижен в 2 раза через 3 и 24 ч, но повышен в 1.5–2 раза через 3 сут и 2 нед после отравления (рис. 5). Повышение холестерола на 20% отмечено через сутки, а восстановление до уровня (–)контроля происходит через 4 нед. Однако уровень СЖК, будучи сниженным у крыс группы (+)контроля через сутки после отравления в среднем на 20%, в дальнейшем не претерпевает существенных изменений относительно группы (–)контроля.
Следует отметить реципрокное повышение уровня АКГ и снижение уровня альбумина у животных (+)контроля через 2 нед после отравления. Интересно, что максимально повышенный уровень БХЭ и АХЭ цельной крови у этих крыс приходится также на 2-недельный срок (рис. 2, 3). Плазма крови, а значит и цельная кровь крыс и мышей, в отличие от крови человека, содержит довольно значительное количество АХЭ, порядка 200 мкг/л [11], при этом у крыс количество БХЭ в плазме крови меньше, чем АХЭ. Выше мы отмечали целый ряд публикаций, свидетельствующих о том, что БХЭ и АХЭ плазмы крови являются маркерами низкоуровневых воспалительных процессов [34], также следует отметить корреляцию между повышенной активностью БХЭ, уровнем ТГ и пониженной чувствительностью к инсулину у больных диабетом 2 типа [55]. Полученные нами данные позволяют предположить существенное нарушение метаболизма у крыс (+)контроля через 2 нед после отравления как результат перенесенного стресса. В связи с этим следует упомянуть работу Flannery et al. [19], в которой был выявлен аналогичный феномен – развитие нейровоспалительных процессов в ЦНС и ослабление когнитивных функций у крыс после острого отравления ФОС, причем примерно в одинаковой степени у животных как с максимальными, так и с минимальными проявлениями интоксикации. Масштабные изменения у животных (+)контроля по отношению к (‒)контролю представлены нами впервые. По-видимому, состояние тревожности и стресса является у крыс самостоятельным и достаточно мощным фактором, позволяющим получить аддитивный или даже синергичный эффект по целому ряду физиолого-биохимических показателей. Этот феномен заслуживает в дальнейшем отдельного изучения.
Список литературы
Shimoyama M., Laulederkind S.J., De Pons J., Nigam R., Smith J.R., Tutaj M., Petri V., Hayman G.T., Wang S.J., Ghiasvand O., Thota J., Dwinell M.R. Exploring human disease using the rat genome database // Dis. Model. Mech. 2016. V. 9. № 10. P. 1089–1095.
Ellenbroek B., Youn J. Rodent models in neuroscience research: is it a rat race? // Dis. Model. Mech. 2016. V. 9. № 10. P. 1079–1087.
Уколов А.И., Кессених Е.Д., Радилов А.С., Гончаров Н.В. Токсикометаболомика: поиск маркеров хронического воздействия низких концентраций алифатических углеводородов // ЖЭБФ. 2017. Т. 53. № 1. С. 23–32.
Корф Е.А., Кубасов И.В., Вонский М.С., Новожилов А.В., Рунов А.Л., Курчакова Е.В., Матросова Е.В., Тавровская Т.В., Гончаров Н.В. Экстракт зеленого чая повышает экспрессию генов, ответственных за регуляцию баланса кальция в медленных мышцах крысы, при изнуряющей физической нагрузке // Бюлл. эксп. биол. и мед. 2017. Т. 164. № 7. C 10–14.
Миндукшев И.В., Скверчинская Е.А., Хмелевской Д.А., Добрылко И.А., Гончаров Н.В. Ингибитор ацетилхолинэстеразы параоксон усиливает индуцированный in vitro оксидативный стресс в эритроцитах крыс // Биол. мембраны. 2017. Т. 34. № 6. С. 147–154.
Sobolev V.E., Jenkins R.O., Goncharov N.V. Sulfated glycosaminoglycans in bladder tissue and urine of rats after acute exposure to paraoxon and cyclophosphamide // Exp. Toxicol. Pathol. 2017. V. 69. № 6. P. 339–347.
Singh D.P., Borse S.P., Rana R., Nivsarkar M. Curcumin, a component of turmeric, efficiently prevents diclofenac sodium-induced gastroenteropathic damage in rats: A step towards translational medicine // Food Chem. Toxicol. 2017. V. 108. P. 43–52.
Barker-Haliski M.L., Löscher W., White H.S., Galanopoulou A.S. Neuroinflammation in epileptogenesis: Insights and translational perspectives from new models of epilepsy // Epilepsia. 2017. V. 58. S. 3. P. 39–47.
Hatfield M.J., Umans R.A., Hyatt J.L., Edwards C.C., Wierdl M., Tsurkan L., Taylor M.R., Potter P.M. Carboxylesterases: general detoxifying enzymes // Chem. Biol. Interact. 2016. V. 259. P. 327–331.
Lian J., Nelson R., Lehner R. Carboxylesterases in lipid metabolism: from mouse to human // Protein Cell. 2018. V. 9. № 2. P. 178–195.
Li B., Sedlacek M., Manoharan I., Boopathy R., Duysen E.G., Masson P., Lockridge O. Butyrylcholinesterase, paraoxonase, and albumin esterase, but not carboxylesterase, are present in human plasma // Biochem. Pharmacol. 2005. V. 70. P. 1673–1684.
Гончаров Н.В., Белинская Д.А., Разыграев А.В., Уколов А.И. О ферментативной активности альбумина // Биоорг. химия. 2015. Т. 41. № 2. С. 131–144.
Гончаров Н.В., Терпиловский М.А., Шмурак В.И., Белинская Д.А., Авдонин П.В. Сравнительный анализ эстеразной и параоксоназной активности различных видов альбумина // ЖЭБФ. 2017. Т. 53. № 4. С. 241–250.
Goncharov N.V., Belinskaia D.A., Shmurak V.I., Terpilowski M.A., Jenkins R.O., Avdonin P.V. Serum Albumin binding and esterase activity: mechanistic interactions with organophosphates // Molecules. 2017. V. 22. № 7. Pii. E1201.
Maxwell D.M., Brecht K.M., O’Neill B.L. The effect of carboxylesterase inhibition on interspecies differences in soman toxicity // Toxicol. Lett. 1987. V. 39. № 1. P. 35–42.
Maxwell D.M. The specificity of carboxylesterase protection against the toxicity of organophosphorus compounds // Toxicol. Appl. Pharmacol. 1992. V. 114. № 2. P. 306–312.
Duysen E.G., Cashman J.R., Schopfer L.M., Nachon F., Masson P., Lockridge O. Differential sensitivity of plasma carboxylesterase-null mice to parathion, chlorpyrifos and chlorpyrifos oxon, but not to diazinon, dichlorvos, diisopropylfluorophosphate, cresylsaligenin phosphate, cyclosarin thiocholine, tabun thiocholine, and carbofuran // Chem. Biol. Interact. 2012. V. 195. № 3. P. 189–198.
Duysen E.G., Koentgen F., Williams G.R., Timperley C.M., Schopfer L.M., Cerasoli D.M., Lockridge O. Production of ES1 plasma carboxylesterase knockout mice for toxicity studies // Chem. Res. Toxicol. 2011. V. 24. P. 1891–1898.
Flannery B.M., Bruun D.A., Rowland D.J., Banks C.N., Austin A.T., Kukis D.L., Li Y., Ford B.D., Tancredi D.J., Silverman J.L., Cherry S.R., Lein P.J. Persistent neuroinflammation and cognitive impairment in a rat model of acute diisopropylfluorophosphate intoxication // J. Neuroinflammation. 2016. V. 13. № 1. P. 267.
Гарнюк В.В., Войтенко Н.Г., Волкова М.О., Максакова А.М., Гончаров Н.В. Гемопоэз у лабораторных животных при остром отравлении фосфорорганическими отравляющими веществами // Токсикол. Вестн. 2012. № 4. С. 35–40.
Шмурак В.И., Курдюков И.Д., Надеев А.Д., Войтенко Н.Г., Глашкина Л.М., Гончаров Н.В. Биохимические маркеры интоксикации фосфорорганическими отравляющими веществами // Токсикол. Вестн. 2012. № 4. С. 30–34.
Chambers J.P., Hartgraves S.L., Murphy M.R., Wayner M.J., Kumar N., Valdes J.J. Effects of three reputed carboxylesterase inhibitors upon rat serum esterase activity // Neurosci. Biobehav. Rev. 1991. V. 15. № 1. P. 85–88.
Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Под ред. Р.У. Хабриева. М., 2005.
Руководство по лабораторным животным и альтернативным моделям в биомедицинских исследованиях / Под ред. Н.Н. Каркищенко и С.В. Грачева. М., 2010.
Prokofieva D.S., Voitenko N.G., Gustyleva L.K., Babakov V.N., Savelieva E.I., Jenkins R.O., Goncharov N.V. Microplate spectroscopic methods for determination of the organophosphate soman // J. Environ. Monit. 2010. V. 12. № 6. P. 1349–1354.
Prokofieva D.S., Jenkins R.O., Goncharov N.V. Microplate biochemical determination of Russian VX: Influence of admixtures and avoidance of false negative results // Anal. Biochem. 2012. V. 424. № 2. P. 108–113.
Phuntuwate W., Suthisisang C., Koanantakul B., Mackness M.I., Mackness B. Paraoxonase 1 status in the Thai population // J. Hum. Genet. 2005. V. 50. № 6. P. 293–300.
Pérez F., Granger B. E. IPython: a system for interactive scientific computing // Comput. Sci. Eng. 2007. V. 9. № 3. P. 21–29.
McKinney W. Data structures for statistical computing in python // Proceedings of the 9th Python in Science Conference. 2010. V. 445. P. 51–56.
Van Der Walt S., Colbert S. C., Varoquaux G. The NumPy array: a structure for efficient numerical computation // Comput. Sci. Eng. 2011. V. 13. № 2. P. 22–30.
Hunter J. D. Matplotlib: A 2D graphics environment // Comput. Sci. Eng. 2007. V. 9. № 3. P. 90–95.
Benjamini Y., Hochberg Y. Controlling the false discovery rate: a practical and powerful approach to multiple testing // J. R. Stat. Soc. Ser. B Methodol. 1995. V. 57. P. 289–300.
Sklan E.H., Lowenthal A., Korner M., Ritov Y., Landers D.M., Rankinen T., Bouchard C., Leon A.S., Rice T., Rao D.C., Wilmore J.H., Skinner J.S., Soreq H. Acetylcholinesterase/paraoxonase genotype and expression predict anxiety scores in Health, Risk Factors, Exercise Training, and Genetics study // Proc. Natl. Acad. Sci. U. S. A. 2004. V. 101. № 15. P. 5512–5517.
Das U.N. Acetylcholinesterase and butyrylcholinesterase as possible markers of low-grade systemic inflammation // Med. Sci. Monit. 2007. V. 13. № 12. RA. 214–221.
Thayer J.F., Sternberg E.M. Neural aspects of immunomodulation: focus on the vagus nerve // Brain Behav. Immun. 2010. V. 24. № 8. P. 1223–1228.
Dong M.X., Xu X.M., Hu L., Liu Y., Huang Y.J., Wei Y.D. Serum butyrylcholinesterase activity: a biomarker for parkinson’s disease and related dementia // Biomed. Res. Int. 2017. V. 2017. P. 1524107.
Shields G.S., Moons W.G., Slavich G.M. Inflammation, self-regulation, and health: an immunologic model of self-regulatory failure // Perspect. Psychol. Sci. 2017. V. 12. № 4. P. 588–612.
Reale M., Costantini E., Di Nicola M., D’Angelo C., Franchi S., D’Aurora M., Di Bari M., Orlando V., Galizia S., Ruggieri S., Stuppia L., Gasperini C., Tata A.M., Gatta V. Butyrylcholinesterase and Acetylcholinesterase polymorphisms in Multiple Sclerosis patients: implication in peripheral inflammation // Sci. Rep. 2018. V. 8. № 1. P. 1319.
Курдюков И.Д., Шмурак В.И., Надеев А.Д., Войтенко Н.Г., Прокофьева Д.С., Гончаров Н.В. “Эстеразный статус” организма при воздействии токсических веществ и фармпрепаратов // Токсикол. Вестн. 2012. № 6. С. 6–13.
Orcholski M.E., Khurshudyan A., Shamskhou E.A., Yuan K., ChenI Y., Kodani S.D., Morisseau C., Hammock B.D., Hong E.M., Alexandrova L., Alastalo T.P., Berry G., Zamanian R.T., de Jesus Perez V.A. Reduced carboxylesterase 1 is associated with endothelial injury in methamphetamine-induced pulmonary arterial hypertension // Am. J. Physiol. Lung Cell. Mol. Physiol. 2017. V. 313. № 2. L252–L266.
Iso H., Jacobs D.R. Jr., Wentworth D., Neaton J.D., Cohen J.D. Serum cholesterol levels and six-year mortality from stroke in 350.977 men screened for the multiple risk factor intervention trial // N. Engl. J. Med. 1989. V. 320. № 14. P. 904–910.
Vauthey C., de Freitas G.R., van Melle G., Devuyst G., Bogousslavsky J. Better outcome after stroke with higher serum cholesterol levels // Neurology. 2000. V. 54. № 10. P. 1944–1949.
Suzuki K., Izumi M., Sakamoto T., Hayashi M. Blood pressure and total cholesterol level are critical risks especially for hemorrhagic stroke in Akita, Japan // Cerebrovasc. Dis. 2011. V. 31. № 1. P. 100–106.
Markaki I., Nilsson U., Kostulas K., Sjöstrand C. High cholesterol levels are associated with improved long-term survival after acute ischemic stroke // J. Stroke Cerebrovasc. Dis. 2014. V. 23. № 1. e47–53.
Zhao W., An Z., Hong Y., Zhou G., Guo J., Zhang Y., Yang Y., Ning X., Wang J. Low total cholesterol level is the independent predictor of poor outcomes in patients with acute ischemic stroke: a hospital-based prospective study // BMC Neurol. 2016. V. 16. e36.
Zhou G., An Z., Zhao W., Hong Y., Xin H., Ning X., Wang J. Sex differences in outcomes after stroke among patients with low total cholesterol levels: a large hospital-based prospective study // Biol. Sex Differ. 2016. V. 7. e62.
Fukui K., Ferris H.A., Kahn C.R. Effect of cholesterol reduction on receptor signaling in neurons // J. Biol. Chem. 2015. V. 290. № 44. P. 26383–26392.
Ferris H.A., Perry R.J., Moreira G.V., Shulman G.I., Horton J.D., Kahn C.R. Loss of astrocyte cholesterol synthesis disrupts neuronal function and alters whole-body metabolism // Proc. Natl. Acad. Sci. U. S. A. 2017. V. 114. № 5. P. 1189–1194.
Landin K., Blennow K., Wallin A., Gottfries C.G. Low blood pressure and blood glucose levels in Alzheimer’s disease. Evidence for a hypometabolic disorder? // J. Intern. Med. 1993. V. 233. № 4. P. 357–363.
Marshall W., Lapsley M., Day A. Clinical Chemistry. Edinb., 2016.
Buchet R., Millán J.L., Magne D. Multisystemic functions of alkaline phosphatases // Methods Mol. Biol. 2013. V. 1053. P. 27–51.
Deshpande L.S., Blair R.E., Huang B.A., Phillips K.F., DeLorenzo R.J. Pharmacological blockade of the calcium plateau provides neuroprotection following organophosphate paraoxon induced status epilepticus in rats // Neurotoxicol. Teratol. 2016. V. 56. P. 81–86.
Deshpande L.S., Blair R.E., Phillips K.F., DeLorenzo R.J. Role of the calcium plateau in neuronal injury and behavioral morbidities following organophosphate intoxication // Ann. NY Acad. Sci. 2016. V. 1374. № 1. P. 176–183.
Sebastián-Serrano Á., de Diego-García L., Martínez-Frailes C., Ávila J., Zimmermann H., Millán J.L., Miras-Portugal M.T., Díaz-Hernández M. Tissue-nonspecific alkaline phosphatase regulates purinergic transmission in the central nervous system during development and disease // Comput. Struct. Biotechnol. J. 2014. V. 13. P. 95–100.
Abbott C.A., Mackness M.I., Kumar S., Olukoga A.O., Gordon C., Arrol S., Bhatnagar D., Boulton A.J., Durrington P.N. Relationship between serum butyrylcholinesterase activity, hypertriglyceridaemia and insulin sensitivity in diabetes mellitus // Clin. Sci. (Lond). 1993. V. 85. № 1. P. 77–81.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


