Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 2, стр. 148-152
ИЗМЕНЕНИЯ ВЕЗИКУЛЯРНОГО ТРАНСПОРТА МОДЕЛЬНОГО ФЛУОРЕСЦЕНТНОГО БЕЛКА В ЭПИТЕЛИИ ПРОКСИМАЛЬНЫХ КАНАЛЬЦЕВ ПОЧКИ ЛЯГУШКИ RANA TEMPORARIA ПОСЛЕ НАГРУЗКИ ЛИЗОЦИМОМ
Н. П. Пруцкова 1, *, Е. В. Селивёрстова 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова
Российской академии наук
Санкт-Петербург, Россия
* E-mail: natprut@yandex.ru
Поступила в редакцию 14.06.2018
После доработки 26.09.2018
Принята к публикации 02.10.2018
Современные представления о реабсорбции различных белков и механизмах эндоцитоза в проксимальных канальцах (ПК) почки сформированы на основе значительного числа клинических и молекулярно-генетических исследований, экспериментов на лабораторных животных и различных клеточных линиях почки млекопитающих [3]. В то же время недостает сведений о реабсорбции белка и молекулярных механизмах эндоцитоза в почке представителей других классов позвоночных, получение которых могло бы способствовать пониманию как фундаментальных закономерностей, так и особенностей изучаемых процессов в восходящем ряду позвоночных.
Среди низших позвоночных удобными объектами для подобных исследований могут служить амфибии, в почке которых установлено действие основных молекулярных механизмов эндоцитоза, сходных с таковыми у млекопитающих [1, 2] и соответствующих известным модельным схемам [3, 4]. Согласно этим схемам, эндоцитоз белка инициируется связыванием молекул белка со специальными рецепторами, перемещением лиганд-рецепторных комплексов в окаймленные (клатриновые) ямки апикальной мембраны и образованием клатриновых везикул. После потери клатринового покрытия мелкие гомотипичные везикулы сливаются и формируют ранние эндосомы с последующим высвобождением рецепторов и дальнейшим внутриклеточным трафиком интернализованного белка в более глубокие области цитоплазмы в составе образующихся поздних эндосом, после чего белок поступает в лизосомы, в которых происходит его деградация. Опыты in vivo на лягушках, являющихся удобной экспериментальной моделью, дают представление о динамике эндоцитоза белка и его внутриклеточного транспорта в эпителии ПК в реальных условиях клубочковой фильтрации и канальцевой реабсорбции различных веществ [5]. Инъекции устойчивых к гидролизу зеленого и желтого флуоресцентных белков (GFP и YFP) позволили проследить перемещение эндоцитозных везикул с белком от апикальной мембраны эпителиоцитов в надъядерную область и другие отделы цитоплазмы [1]. При этом показано снижение эффективности рецептор-опосредованного эндоцитоза при повторных инъекциях этих белков. После введения лягушкам лизоцима обнаружены появление этого белка в эндосомах эпителиоцитов и замедление его поступления в лизосомы [2]. В недавних экспериментах было исследовано влияние предварительной белковой нагрузки на реабсорбцию YFP [6]. Установлены снижение всасывания YFP в ПК после инъекций лизоцима в течение 2‒4-х дней и усиление эффекта с повышением величины нагрузки и ее продолжительности при отсутствии структурных повреждений в нефронах. В продолжение этих исследований представляло интерес проанализировать распределение внутриклеточных везикул с абсорбированным белком и выявить наиболее ранние и последующие изменения везикулярного транспорта в результате нагрузки. Цель работы состояла в детализации паттерна реабсорбции YFP и особенностей динамики внутриклеточного везикулярного транспорта этого белка у зимующих лягушек при различной продолжительности инъекций лизоцима в нагрузочной дозе и последующего перерыва в нагрузке.
Материал для морфологических исследований получен в опытах на самцах травяной лягушки, Rana temporaria L. (n = 21). Условия содержания амфибий и методы работы соответствовали требованиям регламента использования лабораторных животных в ИЭФБ РАН, принятого и утвержденного Ученым советом Института 28.01.2016 г. и комиссией по биоэтике от 05.02.2016 г. (протокол № 11 от 25.02.2016 г.). Белки растворяли в изоосмотическом фосфатно-солевом буфере (PBS), используя препараты лизоцима белка куриного яйца (Sigma Aldrich, Inc., США) и YFP (Институт белка РАН, Пущино-на-Оке, Россия). Применяли подкожные инъекции (в спинной лимфатический мешок) по следующей схеме: лизоцим (15 мг/0.5 мл на лягушку, однократно, в течение 2-х или 4-х дней) и YFP (17 мкг/100 мкл/30 г массы тела, через 1 день после последней инъекции лизоцима, а также через 5 дней после 4-дневной нагрузки).
Контролем к эффекту нагрузки (YFP-контроль) служили инъекции PBS. Образцы ткани почки фиксировали в растворе параформальдегида с последующим отмыванием, криопротекцией, заключением в криогель и замораживанием в жидком азоте, согласно описанному ранее протоколу [1]. В криостате CM 1510 (Leica, Германия) готовили срезы (толщиной 5–7 мкм, через каждые 100–150 мкм) и заключали их в мовиол при монтировании на предметные стекла (Mowiol 4-88, Applichem, Германия). Регистрацию свечения YFP в срезах почки (в зеленой области спектра) и получение изображений осуществляли с помощью флуоресцентного микроскопа “Biozero” (серия BZ-8100E, Keyence Corporation, Япония), используя фильтр OP-66835 BZ FILTER GFP, объектив 40× и электронное масштабирование.
Для статистики в профилях ПК определяли число флуоресцентных везикул (в расчете на 5 соседних клеток) в надъядерной области эпителиоцитов (включая апикальную зону) и в базолатеральной области. Условной линией разграничения служила линия, параллельная люминальной мембране, проведенная на уровне верней границы ядер эпителиоцитов. Учитывали также число профилей ПК с абсорбированным YFP (в процентах к общему числу профилей ПК на полученных изображениях). Рассчитывали средние значения показателей со стандартной ошибкой для разных позиций опыта, в каждой из которых использовали 3 лягушки и анализировали 15–20 изображений, полученных из разных частей почки. Применяли однофакторный дисперсионный анализ с последующим тестом Ньюмана-Кейлса, различия считали достоверными при p < 0.05.
Согласно результатам применения однократных внутривенных и внутрибрюшинных инъекций флуоресцентных белков их специфическое свечение в эпителиоцитах ПК визуализируется через 10–15 мин, имеет преимущественно диффузный характер, а в последующие периоды выявляются светящиеся эндоцитозные везикулы (диаметром до 1 мкм) с интернализованным белком [1]. Через 30 мин флуоресцентные везикулы локализуются в надъядерной области (преимущественно в апикальной цитоплазме), а через 1–1.5 ч могут располагаться перинуклеарно, а также в базолатеральной области. Исходя из сказанного, для тестирования реабсорбции YFP после подкожных инъекций и оценки эндоцитозного транспорта этого белка в эпителиоцитах был выбран интервал 60 мин после инъекции. За этот период количество профилей ПК со свечением YFP составило 69.1% ± 2.9%, а флуоресцентных везикул – 15.3 ± 0.4. Предварительное 4-дневное введение PBS не повлияло на аналогичные показатели всасывания YFP. Так, после инъекций PBS (YFP-контроль к эффекту нагрузки) значения этих показателей были сходными – 64.7% ± 2.2% и 14.9 ± 0.3 соответственно (p > 0.05). При этом относительное количество содержащих YFP везикул в надъядерной области клеток ПК составило 53.5 ± 1.7%, остальные везикулы распределялись в базолатеральной области при отсутствии достоверных различий в их количестве между анализируемыми областями (p > 0.05). Пример распределения флуоресцентных везикул в различных областях цитоплазмы эпителиоцитов в отсутствие нагрузки лизоцимом можно видеть на рис. 1 (А, а). Количественная оценка морфологических показателей реабсорбции YFP в используемой модели показала, что существенное снижение всасывания тестируемого белка происходит после введения лизоцима в течение 3-х и 4-х дней [6]. При этом среднее число флуоресцентных везикул в последнем случае снизилось приблизительно в 7 раз (до 1–3 везикул на 5 клеток). Поэтому внутриклеточное распределение эндоцитозных везикул анализировали после 2-х дней нагрузки лизоцимом, когда снижение захвата YFP было незначительным по сравнению с 4-мя днями (см. рис. 1, А, б в сравнении с в). Установлено, что через 2 дня нагрузки распределение в различных областях цитоплазмы везикул со свечением YFP кардинально изменилось по сравнению с контролем – почти в 8 раз уменьшилось число везикул, переместившихся в базолатеральную область (см. рис. 1, Б, 1, 2), и подавляющее большинство везикул локализовалось в апикальной зоне (А, б). Следует отметить, что в этом варианте опытов число профилей ПК со свечением YFP не отличалось от контроля, свидетельствуя об отсутствии изменений в фильтрации белка в почечных клубочках и его продвижении по ходу канальцев. Поэтому можно полагать, что замедление скорости везикулярного эндоцитозного транспорта в почке лягушки является одним из наиболее ранних признаков снижения способности клеток к реабсорбции белка. В качестве возможных причин подобных изменений можно отметить образующийся дефицит эндоцитозных рецепторов [6], а также задержку поступления белка в лизосомы. Так, перегрузка канальцев альбумином у мышей снижала реабсорбцию фильтрующихся низкомолекулярных белков вследствие недостаточного протеолиза в лизосомах, обусловленного нарушением процесса слияния эндосом с лизосомами [7].
Рис. 1.
Распределение эндоцитозных везикул со свечением YFP в эпителии проксимальных канальцев почки лягушки. На А: изображения профилей ПК, а – YFP-контроль (60 мин после инъекции); б, в – через 2 и 4 дня после нагрузки лизоцимом; г, д – через 2 и 4 дня после прекращения 4-дневной нагрузки соответственно. На Б: распределение флуоресцентных везикул в различных областях цитоплазмы эпителиоцитов (%), 1 – YFP-контроль; 2 – через 2 дня после нагрузки лизоцимом; 3, 4 – через 2 и 4 дня после прекращения 4-дневной нагрузки соответственно. Темные столбцы – надъядерная область, светлые – базолатеральная область. Достоверность различий: * – p < 0.001 по сравнению с 1 и 4; # – p < 0.05 по сравнению с 2; NS – p > 0.05 по сравнению с 1. На В: а – YFP-контроль (30 мин после инъекции); б – эффект 4-дневной нагрузки лизоцимом; в – через 4 дня после 4-дневной нагрузки. Масштаб на А и В: 25 мкм.
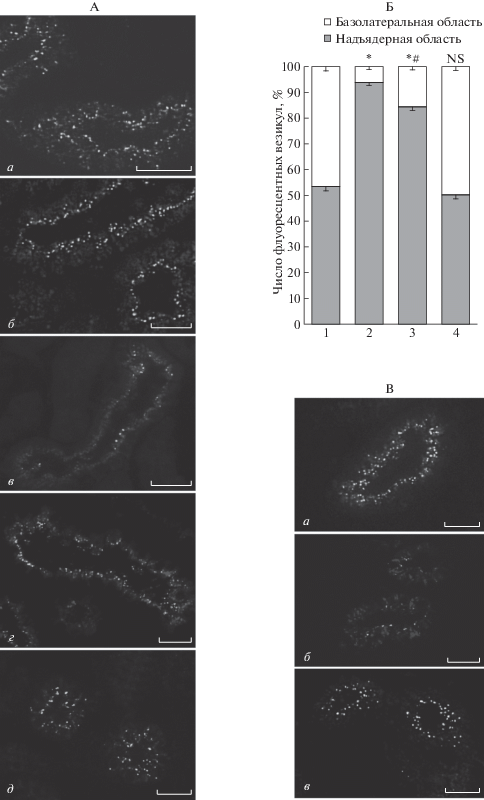
Поскольку прекращение 4-дневной нагрузки лизоцимом приводило к постепенному увеличению числа светящихся профилей ПК и общего количества флуоресцентных везикул в эпителиоцитах [6], следовало выяснить, сопровождается ли восстановление реабсорбции YFP изменением его внутриклеточного транспорта. Оказалось, что через 2 дня после прекращения 4-дневной нагрузки число везикул, локализованных в надъядерной области клеток, по-прежнему значительно преобладало по сравнению с базолатеральной областью (см. рис. 1, А, г). В то же время оно достоверно снизилось по сравнению с 2-мя днями после нагрузки за счет увеличения более чем вдвое количества везикул переместившихся в базолатеральную область (см. рис. 1, Б, 3). На рисунке видно, что через 4 дня перерыва в нагрузке распределение флуоресцентных везикул в анализируемых областях цитоплазмы уже не отличалось от контроля (А, д, Б, 4). При таком перерыве в нагрузке ранее было отмечено восстановление среднего числа флуоресцентных профилей ПК до контрольных значений и увеличение числа везикул, иммунопозитивных к рецепторам эндоцитоза (мегалину и кубилину) по сравнению с перерывом в 2 дня [5, 6]. Чтобы удостовериться в стабильности и обратимости эффекта нагрузки при повышении скорости реабсорбции тестируемого белка, мы увеличили дозу YFP в 1.5 раза и уменьшили вдвое интервал времени, после которого анализировали реабсорбцию. Результаты подтвердили ингибирующее влияние канальцевой нагрузки лизоцимом (см. рис. 1, С, а в сравнении с б) и восстановление паттерна реабсорбции YFP с распределением эндоцитозных везикул в различных частях цитоплазмы, аналогичным YFP-контролю (в).
В целом можно полагать, что в почке лягушки замедление скорости эндоцитозного транспорта белка является одним из наиболее ранних признаков снижения абсорбционной емкости проксимальных канальцев, а увеличение числа образующихся в процессе захвата белка эндоцитозных везикул, обусловленное повышением экспрессии и/или активности эндоцитозных рецепторов, сопряжено с увеличением скорости везикулярного транспорта.
Список литературы
Prutskova N.P., Seliverstova E.V. Absorption capacity of renal proximal tubular cells studied by combined injections of YFP and GFP in Rana temporaria L. // Comp. Biochem. Physiol. A. Mol. Integr. Physiol. 2013. V. 166. P. 138–146.
Seliverstova E.V., Prutskova N.P. Receptor-mediated endocytosis of lysozyme in renal proximal tubules of the frog Rana temporaria // Eur. J. Histochem. 2015. V. 59. P. 79–86.
Christensen E.I., Birn H., Storm T., Weyer K., Nielsen R. Endocytic receptors in the renal proximal tubule // Physiology (Bethesda). 2012. V. 27. P. 223–236.
De S., Kuwahara S., Saito A. The endocytic receptor megalin and its associated proteins in proximal tubule epithelial cells // Membranes (Basel). 2014. V. 4. P. 333–355.
Seliverstova E.V., Prutskova N.P. Protein reabsorption in the amphibian kidney: comparative and evolutionary aspects // In: Evolutionary physiology and biochemistry – advances and perspectives. Chapter 11 / Ed. I. Simcic. Rijeka, Croatia: INTECH, 2018. P. 137–151. DOI: https://doi.org/10.5772/intechopen.73659.10.5772/intechopen.73659
Селивёрстова Е.В., Пруцкова Н.П. Паттерн канальцевой реабсорбции белка в модельном организме лягушки (Rana temporaria): эффект предварительной белковой нагрузки // Ж. эвол. биохим. и физиол. 2017. Т. 53. № 3. С. 192–200.
Lee D., Gleich K., Fraser S.A., Katerelos M., Mount P.F., Power D.A. // Limited capacity of proximal tubular proteolysis in mice with proteinuria. Am. J. Physiol. Renal Physiol. 2013. V. 304. P. F1009–F1019.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


