Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 3, стр. 226-228
НИЗКИЕ КОНЦЕНТРАЦИИ УАБАИНА СТИМУЛИРУЮТ ФОРМИРОВАНИЕ ЭПИТЕЛИАЛЬНОГО БАРЬЕРА В ЛИНИИ КЛЕТОК IPEC-J2
А. А. Федорова 1, V. Cornelius 2, S. Amasheh 2, И. И. Кривой 1, А. Г. Марков 1, *
1 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
2 Institute of Veterinary Physiology, Department of Veterinary Medicine, Freie Universität
Berlin, Germany
* E-mail: markov_51@mail.ru
Поступила в редакцию 14.09.2018
После доработки 04.10.2018
Принята к публикации 04.02.2019
Na,K-АТФаза – интегральный белок, поддерживающий трансмембранные градиенты Na+ и K+ за счет активного транспорта этих ионов, что обеспечивает мембранный потенциал и возбудимость, а также ряд других транспортных механизмов клетки. Кроме того, благодаря ряду структурных доменов Na,K-АТФаза способна образовывать мультимолекуляpные комплексы и участвовать в качестве cкаффолда в формировании функциональных микpодоменов клетки, межклеточных взаимодействиях, а также выполнять регуляторную и сигнальную функции [1]. В эпителиальных клетках Na,K-АТФаза не только участвует в осуществлении транспортных свойств этих клеток, но является также важным регулятором фенотипа эпителия. Эта способность обеспечивается тем, что Na,K-АТФаза участвует в формировании плотных контактов, в регуляции их молекулярной организации и проницаемости [2, 3]. В качестве основного инструмента в таких исследованиях применяют ингибитор Na,K-АТФазы уабаин, специфическим рецептором для которого является α-субъединица Na,K-АТФазы. В настоящее время доказано существование эндогенного аналога уабаина, который синтезируется в коре надпочечников и в гипоталамусе, циркулирует в наномолярном диапазоне концентраций и рассматривается в качестве важного физиологического регулятора [1].
Уабаин в микромолярных концентрациях, блокируя активность Na,K-АТФазы, нарушает молекулярную организацию плотных контактов в эпителиальных клетках и вызывает снижение трансэпителиального сопротивления (ТЭС) [2]. Напротив, уабаин в наномолярных концентрациях, сопоставимых с уровнем эндогенного уабаина, оказывает противоположное действие, сопровождающееся увеличением ТЭС. Такие эффекты уабаина показаны в клеточной линии почки собаки (MDCK II) [2] и клетках Сертоли [3], что подтверждает возможность участия эндогенного уабаина в регуляции фенотипа эпителия. В настоящей работе мы впервые исследовали влияние уабаина в наномолярных концентрациях на ТЭС с использованием линии клеток тощей кишки свиньи (IPEC-J2), которые рассматривают как перспективную модель для изучения процессов в желудочно-кишечном тракте человека [4].
Клетки IPEC-J2 были культивированы в среде DMEM/F12 (1:1), содержащей стабильный глутамин (Biochrom, Germany), а также дополненный 1% раствором антибиотиков пенициллина и стрептомицина и 10%-ой сывороткой крови свиньи (Biochrom). Культура клеток была выращена при температуре 37°C в атмосфере 5% СО2. Клетки (3 × 106 клеток/посев) были высеяны на специализированные мембранные фильтры диаметром 12 мм, размером пор 0.4 мкм (Merck Millipore Ltd., Darmstadt, Germany). Клетки культивировали в среде без уабаина (контроль), а также в средах, содержащих уабаин (1, 10 и 100 нМ). Замена среды проводилась каждые два-три дня. ТЭС измеряли при помощи усилителя EVOM (World Precision Instruments, USA). Все приемы работы соответствовали нормам международного и российского законодательства. Статистический анализ проводился с использованием множественного t-теста в программном обеспечении GraphPad Prism версия 6.01 (Graphpad Software Inc., SanDiego, CA, USA). Для обработки данных все значения ТЭС были нормализованы по площади фильтра; величины сопротивлений раствора и фильтра вычитались из зарегистрированных значений. В тексте и на рисунках приведены средние значения величин с их ошибками (m ± SEM). Уровень значимости p < 0.05 принимался как статистически значимый. Уабаин и все прочие применяемые вещества были производства Sigma-Aldrich.
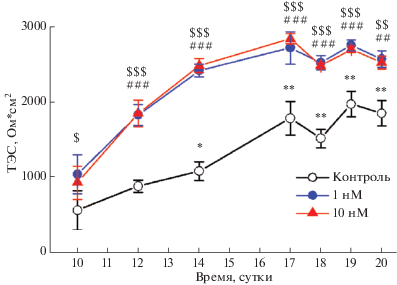
В контроле наблюдалось постепенное увеличение значений ТЭС от 570 ± 260 до 1790 ± 220 Ом · см2 (n = 5), зарегистрированных соответственно на 10‑й и 17-й день культивирования; в дальнейшем изменений не происходило (рис. 1). В присутствии уабаина в концентрации 1 нМ такая динамика сохранялась, однако наблюдалось существенное и достоверное увеличение ТЭС по сравнению с контролем (рис. 1). Величины ТЭС составили 1050 ± 260 Ом см2 и 2720 ± 210 Ом · см2 (n = 6) на 10-й и 17-й дни культивирования соответственно. Уабаин в концентрации 10 нМ вызывал аналогичный эффект (рис. 1). В присутствии 100 нМ уабаина ТЭС не было зарегистрировано. Это может отражать токсическое (обусловленное ингибированием активности Na,K-АТФазы) действие уабаина, препятствующее образованию конфлюэнтного монослоя клеток. Аналогичное снижение ТЭС до нуля наблюдалось также в клетках линии MDCK II при действии 1 мкМ уабаина и сопровождалось дезорганизацией плотных контактов [2]. Увеличение ТЭС при действии 10 нМ уабаина также наблюдали в экспериментах с уже сформировавшимся монослоем клеток линии MDCK II [2] и клеток Сертоли [3]. Наши данные впервые показывают, что уабаин в наномолярных концентрациях способен эффективно влиять на процесс формирования барьерных свойств эпителия.
Рис. 1.
Стимуляция формирования эпителиального барьера уабаином. Изменение трансэпителиального сопротивления (ТЭС) клеток IPEC-J2 в ходе их инкубации в контрольной среде (светлые кружки), в присутствии уабаина в концентрациях 1 нМ (темные кружки) и 10 нМ (треугольники). По оси абсцисс – время инкубации, сутки; по оси ординат – величина ТЭС, Ом · см2. Достоверность различий: * р < 0.05 и ** р < 0.01 – по сравнению с 10-м днем культивирования в контрольной среде; § р < 0.05, §§ р < 0.01, §§§ р < 0.001 и ## р < 0.01, ### р < 0.001 для ТЭС в среде с уабаином (1 и 10 нМ соответственно) – по сравнению с аналогичным периодом в контроле.
Обсуждается возможность реализации эффектов наномолярных концентраций уабаина через активацию Na,K-АТФазы и изменение ионного баланса [5]. Однако имеющиеся данные подтверждают скорее Src-зависимый сигнальный механизм регуляции фенотипа эпителия уабаином [2, 3]. По современным представлениям Na,K-АТФаза функционирует не только как ионный насос, но и участвует также в мембранной и внутриклеточной сигнальной трансдукции. Наиболее изученным белком в реализации сигнальной функции Na,K-АТФазы является Src-киназа [1]. Оба эти белка имеют специализированные структурные домены, обеспечивающие их прямое взаимодействие друг с другом, и являются компонентами мультимолекулярного сигнального комплекса. Предполагается, что функциональный комплекс Na,K-АТФаза/Src-киназа исходно находится в неактивном состоянии. Связывание молекулы уабаина с α-субъединицей Na,K-АТФазы вызывает такое изменение конформации фермента, которое через комплекс с Src-киназой передается белкам окружения и запускает ряд сигнальных внутриклеточных каскадов.
Важно отметить, что снижение проницаемости эпителия при действии уабаина в низких концентрациях реализуется, прежде всего, за счет усиления экспрессии клаудинов [2, 3] – основных белков, определяющих парацеллюлярную проницаемость и барьерные свойства эпителия [6]. Так, уабаин в наномолярных концентрациях вызывал усиление экспрессии клаудина-1, -2 и -4 в клетках линии MDCK II [2] и клаудина-1 и -11 в клетках Сертоли [3]. Поскольку α-субъединица Na,K-АТФазы является единственным известным рецептором для уабаина [1], имеющиеся данные подтверждают существование функциональной связи между Na,K-АТФазой и клаудинами и ее возможную роль в физиологическом механизме регуляции фенотипа эпителия эндогенным уабаином. В клетках линии IPEC-J2 экспрессируются клаудин-1, -3, -4, -5, -7 и -8 [4]. Выяснение индивидуального участия этих клаудинов, а также возможной роли натриевого баланса и эпителиальных натриевых каналов (ENaC) [7], в наблюдаемых нами эффектах уабаина требует специального анализа.
Список литературы
Matchkov V.V., Krivoi I.I. Specialized Functional Diversity and Interactions of the Na,K-ATPase // Front. Physiol. 7: 179. 2016. https://doi.org/10.3389/fphys.2016.00179
Larre I., Lazaro A., Contreras R.G., Balda M.S., Matter K., Flores-Maldonado C., Ponce A., Flores-Benitez D., Rincon-Heredia R., Padilla-Benavides T., Castilloa A., Shoshania L., Cereijido M. Ouabain modulates epithelial cell tight junction // Proc. Natl. Acad. Sci. USA. 107: 11387–11392. 2010. https://doi.org/10.1073/pnas.1000500107
Dietze R., Shihan M., Stammler A., Konrad L., Scheiner-Bobis G. Cardiotonic steroid ouabain stimulates expression of blood–testis barrier proteins claudin-1 and -11 and formation of tight junctions in Sertoli cells // Mol. Cell. Endocrinol. 405: 1–13. 2015. https://doi.org/10.1016/j.mce.2015.02.004
Zakrzewski S.S., Richter J.F., Krug S.M., Jebautzke B., Lee I.-F.M., Rieger J., Sachtleben M., Bondzio A., Schulzke J.D., Fromm M., Günzel D. Improved Cell Line IPEC-J2, Characterized as a Model for Porcine Jejunal Epithelium // PLoS ONE. 8 (11): e79643. 2013. https://doi.org/10.1371/journal.pone.0079643
Orlov S.N., Klimanova E.A., Tverskoi A.M., Vladychenskaya E.A., Smolyaninova L.V., Lopina O.D. ${\text{Na}}_{i}^{ + },{\text{K}}_{i}^{ + }$-Dependent and Independent Signaling Triggered by Cardiotonic Steroids: Facts and Artifacts // Molecules. 22 (4): 635. 2017. https://doi.org/10.3390/molecules22040635
Markov A.G., Aschenbach J.R., Amasheh S. Claudin clusters as determinants of epithelial barrier function // IUBMB Life. 67: 29–35. 2015. https://doi.org/10.1002/iub.1347
Amasheh S., Milatz S., Krug S.M., Bergs M., Amasheh M., Schulzke J.D., Fromm M. Na+ absorption defends from paracellular back-leakage by claudin-8 upregulation // Biochem. Biophys. Res. Commun. 378 (1), 45–50. 2009. https://doi.org/10.1016/j.bbrc.2008.10.164
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


