Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 3, стр. 188-198
КРЫСА (Rattus norvegicus) КАК ОБЪЕКТ ИССЛЕДОВАНИЯ В МОДЕЛИ ОСТРОГО ОТРАВЛЕНИЯ ФОСФОРОРГАНИЧЕСКИМИ СОЕДИНЕНИЯМИ. 2. СИСТЕМНЫЙ АНАЛИЗ ЭФФЕКТИВНОСТИ ЭКСТРАКТА ЗЕЛЕНОГО ЧАЯ В КАЧЕСТВЕ СРЕДСТВА ПРЕДУПРЕЖДЕНИЯ ОТСТАВЛЕННЫХ ПОСЛЕДСТВИЙ ОТРАВЛЕНИЯ
Н. В. Гончаров 1, 2, *, М. А. Терпиловский 2, И. В. Кудрявцев 3, 4, М. К. Серебрякова 3, Д. А. Белинская 2, В. Е. Соболев 1, 2, В. И. Шмурак 1, Е. А. Корф 2, П. В. Авдонин 5
1 НИИ гигиены, профпатологии и экологии человека Федерального медико-биологического агентства
188663 Ленинградская обл., г.п. Кузьмоловский, ст. Капитолово, Россия
2 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
3 Институт экспериментальной медицины
Санкт-Петербург, Россия
4 Дальневосточный федеральный университет
Приморский край, Владивосток, Россия
5 Институт биологии развития им. Н.К. Кольцова РАН
Москва, Россия
* E-mail: ngoncharov@gmail.com
Поступила в редакцию 07.11.2018
После доработки 30.01.2019
Принята к публикации 20.02.2019
Аннотация
Изучение препаратов природного происхождения, способствующих восстановлению организма при острых отравлениях бытовыми и промышленными токсикантами, является задачей не только токсикологии, но также информатики как важнейшего инструмента развития методологии системного анализа. В настоящей работе представлены данные о влиянии декофеинизированного экстракта зеленого чая (ЭЗЧ) в составе гранулированного корма на динамику восстановления крыс в течение 12 нед после острого отравления параоксоном (РОХ) в моделях с предварительным специфическим и неспецифическим ингибированием карбоксилэстеразы плазмы крови крыс. ЭЗЧ обусловливает снижение индексов атерогенности, а также позитивную динамику новых комбинаторных индексов за счет изменения уровней альбумина, триглицеридов, орозомукоида, мочевой кислоты, баланса клеток иммунной системы, способствуя регенерации организма после острого отравления РОХ. Оптимизирован предложенный нами ранее алгоритм поиска комбинаторных биомаркеров по методу ветвей и границ, что позволило повысить статистическую значимость межгрупповых и/или временны́х отличий, сформировать синдромальные комплексы за счет кластеризации физиолого-биохимических показателей. Последнее может послужить существенным дополнением к экспериментальным исследованиям, проводимым на разных видах животных, с последующей более адекватной интерпретацией полученных данных применительно к человеку.
ВВЕДЕНИЕ
При изучении механизмов и эффектов воздействия фосфорорганических соединений (ФОС) на организм человека и животных приходится иметь дело с совокупностью проблем, одни из которых давно являются, а другие могут стать самостоятельными научными дисциплинами на ближайшие годы и даже десятилетия. В первую очередь, это сугубо токсикологические проблемы антидотной терапии острых отравлений, диагностики и предупреждения оставленных последствий, аналитического поиска химических и биологических маркеров острого или хронического отравления. Кроме того, это проблемы из области “гражданской” медицины, такие как нарушения холинергической регуляции при аутоиммунных и нейродегенеративных заболеваниях, а также при некоторых пищевых отравлениях. Особое положение по отношению к первым двум категориям занимают проблемы экспериментальной биологии и трансляционной медицины, суть которых состоит в разработке новых и адекватном использовании имеющихся экспериментальных моделей in silico, in vitro, in vivo, с тем чтобы минимизировать использование животных и более эффективно “транслировать” полученные данные в область практической медицины. И здесь не обойтись без методологических наработок эволюционной или сравнительной биохимии и физиологии. Лейтмотивом работ в этой области может послужить фрагмент названия одной из недавних публикаций: “человек не есть большая крыса” [1].
Одна из наиболее сложных и в наименьшей степени решенных проблем – предупреждение отставленной патологии. Продолжительные судороги, развивающиеся при остром отравлении, обусловливают поражение миндалины, пириформной коры, гиппокампа, коры, таламуса и хвостатого ядра [2]. Эффективность применения противосудорожных препаратов зависит от многих факторов, а в случае даже небольшой передозировки наиболее популярных и в целом достаточно эффективных бензодиазепинов они могут усилить токсический эффект в токсикогенную фазу или привести к возобновлению судорог (эпилептический статус) в соматогенную фазу отравления. Чуть менее популярный вальпроат может стать причиной идиосинкратического и/или токсического гепатита [3]. Вариантов, предлагаемых в качестве альтернативы бензодиазепинам и вальпроату, немного, порой они бывают довольно экзотичными, как, например, уретан в экспериментальной модели отравления ФОС на крысах [4], так что перспектива их использования для человека вызывает большие сомнения. Дело в том, что с точки зрения токсикологии органофосфатов главной биохимической особенностью грызунов, которую необходимо принимать во внимание при изучении механизмов действия не только ФОС, но и карбаматов, к коим относится уретан, является наличие в плазме крови карбоксилэстеразной активности. В плазме крови человека, обезьян и полорогих парнокопытных (к коим относятся важнейшие сельскохозяйственные животные – коровы, овцы, козы) нет карбоксилэстераз (CE) [5]. Подавление активности CE плазмы крови грызунов может в значительной степени повысить адекватность экспериментальных моделей. Для этого иногда используют нокаутных (ES1–/–) мышей [6]. Нокаутные крысы, однако, не выведены вследствие технической сложности и дороговизны технологии. Применение специфических ингибиторов CE является гораздо более простым и доступным методом, который, однако, применялся в очень ограниченных масштабах: динамика возникновения оставленных последствий острого отравления ФОС на фоне подавления активности CE плазмы крови крыс практически не изучена. Более того, даже без предварительного подавления активности CE последствия острого отравления ФОС изучали в ограниченных временных интервалах и, как правило, с использованием небольшого перечня показателей [7]. Мы разработали две токсикологические модели острого отравления крыс ФОС на примере параоксона (РОХ) с предварительным ингибированием СЕ эквитоксическими дозами самого РОХ (группа РОХ2х) и более специфического ингибитора карбоксилэстераз – CBDP (группа СВРОХ) [8].
В поисках средств предупреждения отставленной патологии в последнее время стали уделять внимание нутрицевтикам, биологически активным веществам природного происхождения, как правило, компонентам продуктов питания, действие которых проявляется не сразу, но при продолжительном приеме, иногда в составе т.н. функционального питания [9]. В экспериментах с ФОС установлены превентивные эффекты омега-3-полиненасыщенных жирных кислот [10], экстракта корня имбиря Zīngiber officināle [11] и полифенолов Parquetina nigrescens, представителя семейства Кутровых [12]. Представляет интерес действие полифенолов декофеинизированного зеленого чая Camellia sinensis (ЭЗЧ) в силу его плейотропных эффектов посредством активации сигнального хаба PGC-1α (коактиватор 1-альфа гамма-рецептора, активированного пероксисомным пролифератором) и различных изоформ PPAR (рецепторы, активированные пероксисомным пролифератором), что позволяет использовать этот нутрицевтик в целях профилактики заболеваний, ускорения регенеративных процессов в спортивной медицине [13, 14], однако перспективы применения ЭЗЧ в токсикологии изучены очень слабо, а в токсикологии ФОС не изучены вообще. Трудности изучения эффектов нутрицевтиков частично обусловлены тем, что вещества фосфорорганической природы обладают различными токсикокинетическими характеристиками, а потому имеют различный спектр молекулярных и клеточных мишеней. Другая, более весомая причина состоит в отсутствии критериев диагностики на дальних сроках после отравления, когда уровень или активность холинэстераз не отличается от нормы, а дорогими химико-аналитическими методами, даже если они доступны, невозможно определить аддукты ФОС с белками крови. Развитие метаболомики дало некоторую надежду на решение проблемы диагностики на поздних стадиях интоксикации, однако сложность методологии и малодоступность инструментальной базы, наряду с неоднозначными и порой малопонятными для практического врача выводами существенно снижает уровень оптимизма [15]. Можно отметить общие тенденции изменения комплекса биохимических показателей: помимо холинэстераз крови, активность аминотрансфераз и гамма-глутамилтрансферазы являются биохимическими маркерами интоксикации в течение первой недели после острого отравления высокотоксичными ФОС, тогда как уровень креатинина и мочевины можно рассматривать как неспецифические маркеры отравления на более поздних сроках [16]. Установлены изменения в показателях углеводного и жирового обмена крыс на разных сроках после отравления параоксоном [8]. Комбинация отдельных показателей (биомаркеров) составляет комбинаторный биомаркер, который по сути является формализованным представлением некоего синдрома, для идентификации которого обычно применяют многопараметрический анализ [17]. Для определения паттерна показателей, составляющих комбинаторный биомаркер, требуется применение методов биоинформатики, которые еще нужно должным образом адаптировать для работы с многомерным пространством данных.
Цель данного исследования – разработать алгоритм поиска новых комбинаторных биомаркеров, с помощью которых определить эффективность ЭЗЧ в качестве профилактического средства, ускоряющего регенерацию организма аутбредных крыс Rattus norvegicus в экспериментальных моделях острого отравления РОХ с применением 2-(о-крезил)-4Н‑1,3,2-бензодиоксафосфорин-2-оксида (CBDP) в качестве специфического ингибитора карбоксил-эстераз. В данной работе оптимизирован предложенный нами ранее алгоритм поиска комбинаторных биомаркеров по методу ветвей и границ [18], что позволило не только повысить статистическую значимость межгрупповых и/или временных отличий, но и сформировать синдромальные комплексы за счет кластеризации физиолого-биохимических показателей. Последнее может послужить существенным дополнением методического или даже методологического характера к экспериментальным исследованиям, проводимым на разных видах животных, с последующей более адекватной интерпретацией полученных данных применительно к человеку (трансляционная медицина).
МАТЕРИАЛЫ И МЕТОДЫ
В работе применяли следующие реактивы: параоксон (O,O-диэтил-O-(п-нитрофенил)фосфат, POX, Sigma); 2-(о-крезил)-4Н- 1,3,2-бензодиоксафосфорин-2-оксид (2-(O-cresyl)-4H-1,3,2-benzodioxaphosphorin-2-oxide, CBDP, синтезирован в “НИИ ГПЭЧ” ФМБА России); декофеинизированный экстракт зеленого чая (Sunphenon 90D, Taiyo International Inc., USA ); наборы для биохимического анализатора (Randox, Великобритания).
Токсикологическая модель подробно описана в первой публикации по результатам серии исследований [8]. Здесь отметим особенности эксперимента с применением корма, содержащего ЭЗЧ. Комплекс нутрицевтиков (ЭЗЧ) вводили в гранулированный корм крыс-самцов после его механического дробления с последующим тщательным перемешиванием и регранулированием. Концентрация ЭЗЧ в таком корме составляла 1 г в 1 кг, так что 1 животное ежесуточно потребляло примерно 80 мг ЭЗЧ, т.е. около 70 мг полифенолов, 45% которых составляет эпигаллокатехин-3-галлат (ЭГКГ). Корм с ЭЗЧ (спецкорм) начинали давать крысятам через 4 нед после рождения, сразу после того как их забирали от самки. Контрольные животные того же возраста получали обычный корм. Острое отравление проводили еще примерно через месяц, когда крысы набирали вес 200 г, далее за животными наблюдали на протяжении 12 нед. В каждой группе крыс (на обычном корме и на корме с ЭЗЧ) была подгруппа внутреннего контроля – крысы, которые не были подвержены отравлению: отрицательный контроль – на обычном корме, положительный контроль – на корме с ЭЗЧ. Для получения представленных данных из каждой подгруппы на каждой временной точке использовали не менее 6 животных.
Гепаринизированную (50 ед/мл) кровь получали после декапитации и це нтрифугировали 4 мин при 3000 об/мин (1500 g). Полученную плазму хранили при –70°С до проведения измерений. Экспериментальным путем был установлен перечень из 27 биохимических маркеров, спектрофотометрическое определение количества или активности которых в плазме крови оправдано с точки зрения стоящих перед нами задач и имеющихся технических возможностей: аланинаминотрансфераза (ALT), альбумин (Alb), амилаза (Amls), ацетилхолинэстераза (ACE) цельной крови, бутирилхолинэстераза (BCE), D-3-гидроксибутират (3HB), глицерол (Glyc), глюкоза (Gluc), железо (Fe), желчные кислоты (BA), кальций (Са), карбоксилэстераза (CE), креатинин (Crea), липаза (Lps), липопротеиды высокой плотности (HDL), липопротеиды низкой плотности (LDL), мочевая кислота (UA), мочевина (Urea), неорганический фосфат (Phos), общий белок (TP), орозомукоид (альфа-1-кислый гликопротеин, AGP), параоксоназа 1 (PON1), свободные жирные кислоты (NEFA), триглицериды (TAG), холестерол (Chol), щелочная фосфатаза (ALP). Активность АСЕ и ВСЕ определяли по методу Эллмана в планшетной модификации [19]. Измеряли абсорбцию на длине волны 412 нм на планшетном спектрофотометре Thermo Multiskan FC (США). Биохимические анализы плазмы крови выполняли сразу после разморозки на автоматическом биохимическом анализаторе Sapphire 400 с использованием наборов Randox. Активность PON1 определяли по образованию нитрофенола при гидролизе параоксона по методу Phuntwate [20] с модификациями.
Методом мультиплексного анализа определяли следующие показатели: растворенная молекула межклеточной адгезии-1 (sICAM-1), фактор фон Виллебранда (vWF), эотаксин, интерлейкины IL-1β, IL-6, IL-10, цитокин TNFα, Е-селектин (sE-Selectin), адипонектин. Для этого использовали коммерческие тест-системы “Milliplex MAP” (Millipore, США), основанные на технологии Luminex xMAP (Luminex, США) с применением магнитных микросфер Milliplex Mag. Регистрацию и анализ данных проводили на приборе Luminex MAGРIX (Luminex, США). Использовали программное обеспечение xPONENT 4.2 для построения калибровочных кривых и определения концентраций каждого аналита.
На гематологическом анализаторе Medonic (Boule Diagnostics, Швеция) определяли 20 базовых параметров и 3 гистограммы распределения эритроцитов, лейкоцитов и тромбоцитов по объему. Кроме того, на цитофлуориметре Navios™ (Beckman Coulter, США) определяли процент ретикулоцитов (окраска тиазоловым оранжевым).
Для выявления основных субпопуляций лимфоцитов периферической крови в пробирки 10 × 75 мм (Beckman Coulter, США) вносили по 50 мкл цельной крови, после чего образцы окрашивали препаратом антител, конъюгированных с различными флуорохромами (все антитела производства Biolegend, США). Для выявления основных субпопуляций лимфоцитов периферической крови использовали следующий набор антител – CD45-APC/Cy7 (клон OX-1), CD3-APC (клон 1F4), CD4-PE/Cy7 (клон W3/25), CD8a-PerCP (клон OX-8), CD161a-PE (клон 3.2.3) и CD45RA-FITC (клон OX-33). Данная комбинация антител применялась для выделения общей популяции Т-лимфоцитов – клеток, экспрессирующих CD3 на своей поверхности, а также популяций Т-хелперов (Th) и цитотоксических Т-клеток (Tcyt), несущих на своей поверхности, помимо CD3, еще и CD4 или CD8a соответственно. В-клетки периферической крови определялись как CD3–CD45RA+, тогда как естественные киллеры (NК cells) обладали фенотипом CD3–CD161a+. Также определяли относительное содержание Т-лимфоцитов, ко-экспрессировавших CD161a на своей поверхности (NКТ cells, фенотип CD3+CD161a+). Кроме того, с использованием антител против CD44H, конъюгированных с FITC (клон OX-49), и против CD62L, конъюгированных РЕ (клон OX-85), Tcyt и Тh были разделены на следующие субпопуляции: наивные клетки с фенотипом CD44dimCD62L+, клетки центральной памяти (CD44brightCD62L+), клетки эффекторной памяти (CD44brightCD62L–) и зрелые эффекторные клетки (CD44dimCD62L–). Анализ образцов проводили на проточном цитофлуориметре Navios™, оснащенном двумя диодными лазерами 488 и 638 нм. Для каждого из образцов анализировали не менее 20 000 лимфоцитов, отвечающих указанным выше условиям. Математическую обработку цитофлуориметрических данных проводили при помощи программ Navios Software v.1.2 и Kaluza™ v.1.3 (Beckman Coulter, США).
Регистрация поведенческой активности животного. Для выявления различий в поведенческой активности крыс после отравления использовали автоматическую систему “Laboras” (B.V. Metris, Hoofddorp, Нидерланды). При использовании данной установки измеряли продолжительность следующих поведенческих показателей: локомоция (горизонтальная активность), стойки с опорой и без опоры (вертикальная, исследовательская и ориентировочная активность), неподвижность (сон и неподвижность бодрствующих животных), груминг, потребление пищи и воды. Измерения проводились в специальных одноместных клетках в автоматическом режиме на протяжении 18 ч (с 17 ч одного дня до 11 ч следующего). Взвешивание лабораторных животных производили ежедневно в течение первой недели и еженедельно в последующий период эксперимента.
Статистическую и математическую обработку данных проводили в среде разработки Jupyter с помощью научных пакетов SciPy, NumPy, Pandas, Matplotlib, Seaborn и scikit-posthocs [21, 22], написанных на языке программирования Python. Применяли непараметрический дисперсионный анализ Краскела–Уоллиса с последующим апостериорным анализом по методу Коновера с поправками p-величин по Бенджамини и Хохбергу [23]. Статистически обработанные данные представлены как среднее арифметическое ± стандартная ошибка.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ЭЗЧ в составе корма вызвал у крыс, не подвергавшихся отравлению, изменения следующих показателей (сравнение подгрупп положительного и отрицательного контроля): Alb, BCE, 3HB, Gluc, Fe, Crea, UA, Urea, TP, PON1, NEFA, ALP, sЕ-Selectin, sICAM-1. Отметим показатели, которые статистически значимо отличались (как правило, в сторону нормализации) у крыс, получавших “спецкорм”, на разных сроках после отравления: Alb, Amls, ACE, BCE, 3HB, AGP, Glyc, Gluc, Ca, Crea, Lps, HDL, LDL, UA, Urea, TP, PON1, NEFA, TAG, Phos, Chol, ALP. На следующем этапе необходимо было определить производные биомаркеры, представляющие собой многопараметрические индексы. Это сложная вычислительная задача, требующая алгоритмических оптимизаций. Например, число индексов, включающих 5 маркеров (комбинации из 69 по 5 с учетом положения знака деления), составляет 44 954 052. Мы доработали и оптимизировали предложенный нами ранее алгоритм поиска индексов по методу ветвей и границ [18]. Суть оптимизации заключалась в следующем: из всех показателей были составлены двухпараметрические индексы (например, Alb/Gluc), упорядочены по присвоенным оценкам и выбраны только непересекающиеся индексы, содержащие уникальный набор показателей. Выбранные индексы служили началами отдельных ветвей. По количеству показателей в индексе мы условно присваивали ему соответствующее значение “сложности”. Алгоритм следовал по каждой ветви и, перебирая все не включенные в индекс показатели, итеративно добавлял к нему те, которые максимально увеличивали оценки индекса (полученную с помощью оценочной функции), учитывая также и положение знака деления. Так, к двухпараметрическому индексу добавлялся 3-й показатель (из оставшихся 67 показателей), который увеличивал его оценки лучше других, проверялись соответствующие варианты a/(b × c) и a × b/c, и автоматически этому индексу присваивался уровень сложности 3. Затем процесс итеративно повторялся. Т.о., по каждой ветви было получено 17 многопараметрических индексов, которые содержали от 2 (начало ветви) до 19 показателей (конец ветви). Чувствительность, специфичность индекса и коэффициент корреляции Мэтьюса оценивали после обучения классификатора на основе градиентного бустинга (использовали параметры по умолчанию) с помощью пакета scikit-learn.
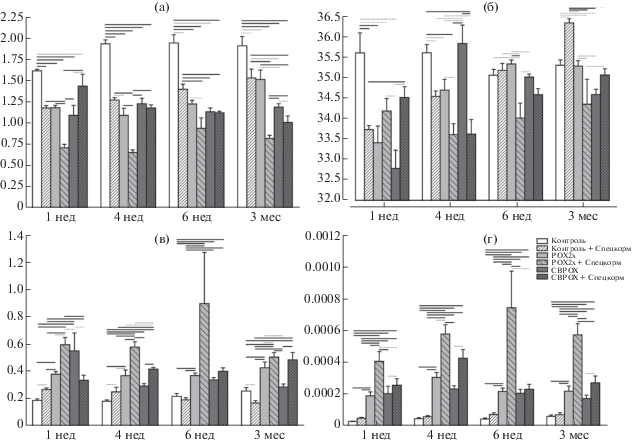
Показатели, которым были присвоены максимальные оценки, приведены в табл. 1. Среди них биохимические, гематологические и поведенческие показатели. Все показатели объединяли в индексы 2-й сложности (двухпараметрические индексы) и итеративно оценивали. Далее их ранжировали по оценке, из них выбрали 37 непересекающихся индексов, которые служили началами “ветвей”. Среди двухпараметрических индексов высокие оценки получили следующие: MID%/TAG, Tcyt/Th, HCT/MCHC, NEFA/PLT, GRN%/tCE (табл. 2). Из всех ветвей одной из самых эффективных на низких степенях сложности является 1-я ветвь, началом которой служил индекс MID%/TAG. Добавление к этому индексу третьего показателя (уровень альбумина в плазме крови, Alb) приводит к повышению его чувствительности и специфичности на 8 и 16% соответственно (табл. 3). Включение в этот индекс еще одного показателя (содержание гемоглобина в крови, HGB) вызвало повышение чувствительности на 7%, но снижение специфичности на 35%. Все ветви комбинаторно дополнялись показателями до 19-й степени сложности. Максимальные оценки были присвоены лишь 6 ветвям, началами которых служили индексы MID%/TAG, Tcyt/Th, HCT/MCHC, PDW/Th44(–)62(+), UA/tCD62(+)Th, (CD4/CD8)/RBC. Некоторые оценки продолжали увеличиваться до последней степени сложности, достигнув 0.91 (чувствительность) и 0.95 (специфичность). Среди простых или одиночных индексов, демонстрировавших довольно высокие чувствительность и специфичность, можно выделить несколько показателей: гематокрит (HCT), содержание мочевой кислоты (UA), численность Т-хелперов центральной памяти (Th44+62+), процент (в меньшей степени численность) моноцитов, базофилов и эозинофилов (MID%) и продолжительность потребления корма (Feed). Коэффициенты атерогенности KA1 ((Chol-HDL)/HDL) и KA2 ((LDL+TAG/2.2)/HDL) показали чувствительность и специфичность, равные 0.72 и 0.30, 0.75 и 0.38 соответственно. В упорядоченном ряду простых индексов они оказались на 54-м и 30-м месте, показав удовлетворительный уровень специфичности и чувствительности. Коэффициент атерогенности КА1 демонстрирует статистически значимое уменьшение через 6 нед в группе РОХ2х+ЭЗЧ относительно контроля и группы РОХ2х, а также через 12 нед в группах контроль+ЭЗЧ и РОХ2х+ЭЗЧ относительно интактного контроля и группы РОХ2х соответственно (рис. 1а). Коэффициент КА2 более отчетливо демонстрирует отличия в действии ЭЗЧ на всех сроках после отравления: снижение на 25–35% в группе контроль+ЭЗЧ по сравнению с контролем через 1, 4, 6 и 12 нед, тогда как в группе РОХ2х+ЭЗЧ снижение относительно контроля составляет 50–65%, а относительно группы РОХ2х – на 15–60% на всех исследуемых сроках, причем максимально выражено отличие через 12 недель после отравления (рис. 1б).
Таблица 1.
Высокоранговые одиночные индексы
| Индекс | Чувствительность | Специфичность | Коэффициент корреляции Мэтьюса (ККМ) |
|
|---|---|---|---|---|
| 1 | HCT | 0.75 | 0.63 | 0.36 |
| 2 | UA | 0.91 | 0.38 | 0.34 |
| 3 | Th44(+)62(+) | 0.77 | 0.58 | 0.34 |
| 4 | MID% | 0.79 | 0.53 | 0.32 |
| 5 | Feed | 0.87 | 0.35 | 0.26 |
| 6 | ALP | 0.80 | 0.43 | 0.24 |
| 7 | MID | 0.80 | 0.43 | 0.24 |
| 8 | MPV | 0.80 | 0.43 | 0.24 |
| 9 | TP | 0.91 | 0.28 | 0.24 |
| 10 | CE | 0.82 | 0.40 | 0.23 |
| 11 | HB | 0.83 | 0.38 | 0.22 |
| 12 | RET% | 0.83 | 0.38 | 0.22 |
| 13 | Th44(–)62(–) | 0.83 | 0.38 | 0.22 |
| 14 | GRN% | 0.80 | 0.40 | 0.22 |
| 15 | TAG | 0.71 | 0.50 | 0.21 |
| 16 | WBC | 0.80 | 0.38 | 0.19 |
| 17 | RDWa | 0.82 | 0.35 | 0.18 |
| 18 | AGP | 0.79 | 0.38 | 0.18 |
| 19 | LYM | 0.79 | 0.38 | 0.18 |
| 20 | Akns | 0.85 | 0.30 | 0.18 |
Таблица 2.
Полный перечень непересекающихся двухпараметрических индексов, служивших началами ветвей при дальнейшем комбинаторном поиске
| № | Индекс | Чувствительность | Специфичность | Коэффициент корреляции Мэтьюса (ККМ) |
|---|---|---|---|---|
| 1 | MID%/TAG | 0.80 | 0.75 | 0.53 |
| 2 | Tcyt/Th | 0.84 | 0.63 | 0.47 |
| 3 | HCT/MCHC | 0.82 | 0.65 | 0.46 |
| 4 | NEFA/PLT | 0.89 | 0.53 | 0.44 |
| 5 | GRN%/tCE | 0.83 | 0.60 | 0.43 |
| 6 | Th44(–)62(–)/tCD62(–)Tcyt | 0.80 | 0.58 | 0.38 |
| 7 | ACEb/CE | 0.84 | 0.53 | 0.38 |
| 8 | Phos/Th 44(+)62(+) | 0.82 | 0.55 | 0.37 |
| 9 | PDW/Th44(–)62(+) | 0.79 | 0.58 | 0.37 |
| 10 | Ca/WBC | 0.86 | 0.48 | 0.36 |
| 11 | GRAN/Akns | 0.83 | 0.53 | 0.36 |
| 12 | UA/tCD62(+)Th | 0.82 | 0.50 | 0.33 |
| 13 | AGP/Alb | 0.85 | 0.45 | 0.33 |
| 14 | HB/Tcyt44(–)62(–) | 0.85 | 0.45 | 0.33 |
| 15 | LPCR/MCV | 0.77 | 0.55 | 0.32 |
| 16 | HDL/Wtr | 0.89 | 0.38 | 0.30 |
| 17 | LYM/PCT | 0.80 | 0.48 | 0.29 |
| 18 | CD3+CD8+/RETabs | 0.80 | 0.48 | 0.29 |
| 19 | Crea/LDL | 0.80 | 0.48 | 0.29 |
| 20 | Fe/Tcyt44(–)62(+) | 0.82 | 0.45 | 0.28 |
| 21 | DNTcells/NKcells | 0.79 | 0.45 | 0.25 |
| 22 | ALP/Gluc | 0.83 | 0.40 | 0.25 |
| 23 | LYM%/tCD62(+)Tcyt | 0.83 | 0.40 | 0.25 |
| 24 | ALT/TP | 0.80 | 0.43 | 0.24 |
| 25 | Bcells/RET% | 0.80 | 0.43 | 0.24 |
| 26 | MID/MPV | 0.91 | 0.28 | 0.24 |
| 27 | (CD4/CD8)/RBC | 0.87 | 0.33 | 0.24 |
| 28 | CD3(+)CD4(+)/DPTcells | 0.87 | 0.33 | 0.24 |
| 29 | PON/RDW% | 0.82 | 0.40 | 0.23 |
| 30 | Tcells/Urea | 0.90 | 0.28 | 0.22 |
| 31 | MCH/Grm | 0.78 | 0.40 | 0.19 |
| 32 | NKTcells/tCD62(–)Th | 0.82 | 0.33 | 0.16 |
| 33 | BCE/Tcyt44(+)62(+) | 0.75 | 0.40 | 0.15 |
| 34 | Th44(+)62(–)/Act | 0.79 | 0.33 | 0.13 |
| 35 | Chol/Stnd | 0.78 | 0.30 | 0.09 |
| 36 | Glyc/Feed | 0.74 | 0.28 | 0.01 |
Таблица 3.
Сложные индексы, состоящие из нескольких показателей (биомаркеров) и имеющие высокие оценки в рамках разных степеней сложности
| № | Индексы | Чувстви-тельность | Специ-фичность | ККМ | Слож-ность | Ветвь |
|---|---|---|---|---|---|---|
| CI1 | MID%/TAG | 0.80 | 0.75 | 0.53 | 2 | 1 |
| CI2 | MID%/(TAG×Alb) | 0.87 | 0.88 | 0.72 | 3 | 1 |
| CI3 | MID%/(TAG×Alb×HGB) | 0.93 | 0.65 | 0.62 | 4 | 1 |
| CI4 | UA/(tCD62(+)Th×MID%×(tCD62(+)Th/tCD62(–)Th)×Tcyt) | 0.92 | 0.75 | 0.68 | 5 | 12 |
| CI5 | MID%/(TAG×Alb×HGB×tCD62(+)Tcyt×Th44(–)62(–)) | 0.91 | 0.80 | 0.71 | 6 | 1 |
| CI6 | MID%/(TAG×Alb×HGB×tCD62(+)Tcyt×Th44(–)62(–)×KA2) | 0.92 | 0.88 | 0.78 | 7 | 1 |
| CI7 | (CD4/CD8)×RBC×MID%/(KA2×HDL×Tcyt44(+)62(+)×TAG× ×Th44(–)62(–)) | 0.92 | 0.83 | 0.74 | 8 | 27 |
| CI8 | MID%/(TAG×Alb×HGB×tCD62(+)Tcyt×Th44(–)62(–)×KA2× ×Chol×HDL) | 0.93 | 0.80 | 0.74 | 9 | 1 |
| CI9 | Tcyt/(Th×UA×Th44(–)62(–)×TAG×LPCR×Alb×tCE×PON×Phos) | 0.91 | 0.85 | 0.75 | 10 | 2 |
| CI10 | MID%/(TAG×Alb×HGB×tCD62(+)Tcyt×Th44(–)62(–)×KA2× ×Chol×HDL×PON×CD4/CD8) | 0.93 | 0.80 | 0.74 | 11 | 1 |
| CI11 | MID%/(TAG×Alb×HGB×tCD62(+)Tcyt×Th44(–)62(–)×KA2× ×Chol×HDL×PON×CD4/CD8×tCE) | 0.94 | 0.80 | 0.76 | 12 | 1 |
| CI12 | PDW×Th44(–)62(+)×Gluc×CE×MID%/ (RDW%×HGB×TAG×AGP×LYM%×Fe×HCT×RDWa) | 0.90 | 0.88 | 0.75 | 13 | 9 |
| CI13 | UA×tCD62(+)Th×MID%×(tCD62(+)Th/tCD62(–)Th)×Tcyt/ (RDW%×Crea×MCHC×TAG×HDL×Th44(–)62(–)×tCE× ×CD3+CD4+×Th44(+)62(+)) | 0.91 | 0.90 | 0.79 | 14 | 12 |
| CI14 | PDW×Th44(–)62(+)×Gluc×CE×MID%×RDW%/ (HGB×TAG×AGP×LYM%×Fe×HCT×RDWa×tCD62(–)Th×Th) | 0.95 | 0.83 | 0.80 | 15 | 9 |
| CI15 | PDW×Th44(–)62(+)×Gluc×CE×MID%×RDW%/ (HGB×TAG×AGP×LYM%×Fe×HCT×RDWa×tCD62(–)Th×Th×tCE) | 0.95 | 0.85 | 0.82 | 16 | 9 |
| CI16 | PDW×Th44(–)62(+)×Gluc×CE×MID%×RDW%/ (HGB×TAG×AGP×LYM%×Fe×HCT×RDWa×tCD62(–)Th×Th× ×tCE×HDL) | 0.98 | 0.78 | 0.80 | 17 | 9 |
| CI17 | HCT×MCHC×ALT×Th44(–)62(+)×MID%/ (RBC×ACEb×Th44(+)62(+)×MCH×RDW%×RDWa×TP× ×PDW×AGP×Th×Th44(–)62(–)×tCE×TAG) | 0.94 | 0.90 | 0.84 | 18 | 3 |
| CI18 | HCT×MCHC×ALT×Th44(–)62(+)×MID%/ (RBC×ACEb×Th44(+)62(+)×MCH×RDW%×RDWa×TP× ×PDW×AGP×Th×Th44(–)62(–)×tCE×TAG×Alb) | 0.91 | 0.95 | 0.83 | 19 | 3 |
Рис. 1.
Коэффициенты атерогенности KA1 (а) и KA2 (б). Обозначения достоверности различий: пунктирная линия – p < 0.05, линия серого цвета – p <0.01, линия черного цвета – p < 0.001.
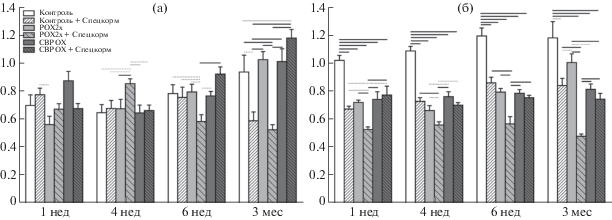
Рассмотрим первую ветвь из выявленных нами индексов, которой были присвоены высокие оценки. Ветвь начинается с соотношения двух показателей, имеющих высокие оценки среди одиночных индексов – MID%/TAG (CI1). Алгоритм добавляет к этому индексу еще один показатель – уровень альбумина в плазме крови. Полученный индекс из трех показателей (CI2) имеет чувствительность и специфичность, равные 0.87 и 0.88 соответственно. На рисунке 2 показано, что индекс CI2 обладает не только большей чувствительностью по сравнению с простыми показателями TAG (рис. 2а) и Alb (рис. 2б) за счет большего количества достоверных отличий между всеми группами, но и большей специфичностью, что связано с достоверными отличиями или, наоборот, их отсутствием в целевых парах (т.е. в парах сравнения) как внутри метагрупп, так и между ними: контроль – опыт (POX и CBPOX, обычный корм), опыт – опыт (POX и CBPOX, спецкорм – обычный корм), а также контроль (обычный корм) – опыт (спецкорм). В группе (+)контроля (спецкорм, неотравленные крысы) индекс CI2 повышен относительно (–)контроля через 1 и 4 нед, затем происходит выравнивание (6 нед) и снижение через 12 нед (рис. 2в). Для сравнения, показатель TAG стабильно понижен в группе (+)контроля относительно (–)контроля на всем протяжении эксперимента (рис. 2а), что позволяет судить лишь о некоем изменении жирового обмена, возможно позитивного характера, но в целом малоинформативного. Несмотря на то что уровень альбумина не входит не только в перечень непересекающихся двухпараметрических индексов, но даже в перечень высокоранговых одиночных индексов, его динамика представляется более интересной, чем динамика триглицеридов, и заслуживает более подробного анализа. Через 1 нед после отравления уровень альбумина снижен во всех группах относительно (–)контроля на 1–3 г/л (рис. 2б). В максимальной степени снижение отмечено в группах отравленных животных, принимавших обычный корм, а в этой паре относительное и абсолютное среди всех групп “лидерство” принадлежит группе СВРОХ, где выявлено максимальное снижение уровня альбумина – почти в 5 раз по отношению к (–)контролю. В минимальной степени снижение выражено в группах отравленных животных, поедавших спецкорм, причем в этой паре относительное и абсолютное среди всех групп “лидерство” принадлежит группе СВРОХ+ЭЗЧ, так что между группами СВРОХ и СВРОХ+ЭЗЧ средняя разница составляет почти 2 г/л (р < 0.01). Следует отметить, что уровень альбумина весьма важен как интегративный показатель, позволяющий оценить не только белок-синтезирующую функцию печени или уровень воспалительных процессов, но в совокупности с тремя другими биохимическими маркерами прогнозировать вероятность летального исхода у людей независимо от их пола, возраста, расовой принадлежности, особенностей генетического полиморфизма, истории прошлых и характера имеющихся заболеваний [24]. Через 4 нед отличия по уровню альбумина не столь выражены в экспериментальных группах по отношению к (‒)контролю, но зато в целевых парах “обычный корм – спецкорм” они однонаправленны и статистически значимы, причем наиболее существенное отличие выявлено в паре СВРОХ – (СВРОХ+ЭЗЧ) (рис. 2б). В дальнейшем, через 6 и 12 недель после отравления, наблюдается восстановление уровня альбумина и даже достоверное повышение его в группе (+)контроля относительно группы (–)контроля и всех экспериментальных групп.
Рис. 2.
Динамика простых показателей TAG (а), Alb (б) и сложных индексов CI2 = MID% / (TAG×Alb) (в), CI18 = = HCT×MCHC×ALT×Th44(–)62(+)×MID%/(RBC×ACEb×Th44(+)62(+)×MCH×RDW%×RDWa×TP×PDW×AGP×Th× ×Th44(–)62(–)×tCE×TAG×Alb) (г).
Достоверность различий обозначена как на рис. 1.
Между тем индекс CI2 связывает, во-первых, жировой обмен с белковым, что позволяет судить о функциональном состоянии печени, а во-вторых, с относительным изменением моноцитов, эозинофилов и базофилов. Наблюдаемая динамика CI2 свидетельствует о мобилизации в течение 4 нед клеточного и гуморального звеньев иммунитета за счет повышенного гемопоэза и незначительного снижения синтеза альбумина печенью, в том числе за счет повышения синтеза печеночной и постгепариновой липопротеинлипаз (что обусловливает повышенный гидролиз триглицеридов), после чего происходит восстановление баланса активности костного мозга и альбумин-синтезирующей функции печени в группе (+)контроля. Динамика повышения индекса CI2 у отравленных крыс на обычном корме по отношению к (–)контролю более выражена лишь в сторону повышения, особенно в группе СВРОХ через 1 нед, что свидетельствует о более высокой мобилизации костного мозга и клеточного звена иммунитета, с одной стороны, и снижении синтеза альбумина в пользу липопротеинлипаз, с другой стороны. Можно было бы говорить о повышенном уровне синтеза положительных острофазных белков за счет снижения синтеза альбумина, но динамика орозомукоида (AGP) это не подтверждает (данные не представлены). Восстановление до уровня (–)контроля происходит лишь через 3 мес и только в группе СВРОХ. Динамика индекса CI2 у отравленных крыс на спецкорме относительно (–) и даже (+)контроля еще более выражена в сторону повышения, особенно в группе РОХ2х+ЭЗЧ, но не за счет подавления синтеза альбумина, а главным образом за счет повышения синтеза липопротеинлипаз и повышенного потребления TAG, в том числе (или даже в первую очередь) на нужды гемопоэза. Таким образом, индекс CI2 определяет баланс активностей костного мозга и печени, жирового и белкового обмена, в меньшей степени – специфического и неспецифического иммунитета.
Началом самой эффективной 3-й ветви индексов является двойной индекс HCT/MCHC, состоящий из двух гематологических показателей – гематокрита и средней концентрации гемоглобина в эритроцитах. Оценки этой ветви достигают абсолютного максимума только к 17-й и 18-й степеням сложности. На рис. 2г видно, что индекс CI18 (HCT×MCHC×ALT×Th44(–)62(+)×MID%/(RBC× ×ACEb×Th44(+)62(+)×MCH×RDW%×RDWa×TP× ×PDW×AGP×Th×Th44(–)62(–)×tCE×TAG×Alb)) имеет очень высокую чувствительность и специфичность (0.91 и 0.95), причем главным образом между целевыми группами контроль – опыт (POX2x и CBPOX) и опыт – опыт (CBPOX – (CBPOX+ЭЗЧ) и POX2x – (POX2x+ЭЗЧ)). По индексу CI18 группы (–) и (+)контроля не имеют статистически значимых отличий ни на одном сроке проведения измерений. Вместе с тем на всех сроках у всех групп отравленных животных индекс CI18 в разы превышает уровень обоих контролей, также почти на всех сроках имеет место достоверность отличий между метагруппами РОХ2х и РОХ2х+ЭЗЧ, СВРОХ и СВРОХ+ЭЗЧ (за исключением 6-недельного срока), РОХ2х+ЭЗЧ и СВРОХ+ЭЗЧ (за исключением 4-недельного срока). Группы отравленных животных на обычном корме между собой не отличаются по индексу CI18 ни на одном сроке проведения измерений. Физиологический смысл повышения значений индекса CI18, особенно в группах на спецкорме, можно понять, если вникнуть в структуру его числителя и знаменателя. Повышение значений гематокрита, среднеклеточной концентрации гемоглобина, количества наивных Тh, суммарного процента базо-, эозинофилов, моноцитов (отвечают за фагоцитоз отмерших клеток) и клеток-предшественников в незрелом состоянии (в том числе эндотелиальных прогениторов) свидетельствует о мобилизации гемопоэза в самом широком диапазоне, включающего в себя эритропоэз, иммуногенез и эндотелиогенез [25]. Участие в составе числителя показателя ALT свидетельствует о возможном повышении нагрузки на печень, не связанном с дисфункцией этого органа. Умеренное снижение в составе знаменателя таких показателей, как количество зрелых эритроцитов, гемоглобина в эритроците и распределение эритроцитов по величине свидетельствует об обновлении пула эритроцитов; снижение величины распределения тромбоцитов по объему – о стабильности системы гемостаза и отсутствии сосудистых осложнений; умеренное снижение активности холинэстераз и орозомукоида, особенно на дальних сроках после отравления, – признак снижения воспалительных реакций; снижение уровня хелперов центральной памяти наряду со зрелыми эффекторными клетками означает отсутствие перегрузки или перенапряжения иммунной системы; снижение общего белка и альбумина, с одной стороны, свидетельствует о снижении белок-синтезирующей функции печени, но в совокупности со снижением триглицеридов это означает, что анаболическая функция печени вряд ли нарушена, скорее это транзиторное изменение баланса в пользу активизации гемопоэза, мобилизации специфического клеточного иммунитета, повышения экспрессии и активности печеночной и особенно постгепариновой липопротеинлипаз. Таким образом, индекс CI18 определяет не только баланс активностей костного мозга и печени, но также указывает на состояние иммунной системы и даже системы гемостаза, причем делает это с хорошей детализацией картины изменений, что количественно выражается в более высокой его чувствительности и особенно специфичности – важнейших характеристиках, необходимых для диагностики состояния организма и мониторинга эффективности терапии.
ЗАКЛЮЧЕНИЕ
Для решения задач поиска новых биомаркеров в качестве основной эвристики мы применили принципы аналитической комбинаторики и разработали алгоритм, который включает в себя четыре основных этапа и реализован на языке Python. Получено 18 новых индексов с высоким уровнем чувствительности и специфичности, из которых проанализированы два – CI2 и CI18. Индекс CI18 имеет очень высокую чувствительность и максимальную специфичность (0.91 и 0.95 соответственно), его динамика позволяет более уверенно говорить о мобилизации в группах отравленных животных гемопоэза и эритропоэза, иммуно- и эндотелиогенеза (хотя о последнем можно пока судить по косвенным признакам), смещении баланса белок-синтезирующей функции печени в пользу липопротеинлипаз, баланса клеточного и гуморального, специфического и неспецифического звеньев иммунитета. У крыс, принимавших ЭЗЧ в составе спецкорма, изменения индекса CI18 более выражены по сравнению с крысами, принимавшими обычный корм, а в группе РОХ2х+ЭЗЧ отличия от группы СВРОХ+ЭЗЧ имеют статистическую значимость на всех временных интервалах проведения исследований, что можно объяснить гепатотоксическим действием CBDP, специфического ингибитора КЭ, несколько снизившим регенеративный потенциал ЭЗЧ.
Выбранная нами мультимаркерная стратегия поиска комбинаторных индексов с переводом их в цифровой формат повышает ценность экспериментов с крысами и другими видами лабораторных животных, т.к. по своей сути является интегративной, отражая как специфические, так и неспецифические для разных видов животных адаптационные или дезадаптационные изменения. Результаты данной работы могут внести существенный вклад в дальнейшее развитие трансляционной медицины, а также выявить особенности функциональных взаимосвязей в экстремальных условиях у разных видов животных.
Список литературы
Habert R., Livera G., Rouiller-Fabre V. Man is not a big rat: concerns with traditional human risk assessment of phthalates based on their anti-androgenic effects observed in the rat foetus. Basic Clin Androl. 24 (14). 2014. doi:https://doi.org/10.1186/2051-4190-24-14
Figueiredo T.H., Apland J.P., Braga M.F.M., Marini A.M. Acute and long-term consequences of exposure to organophosphate nerve agents in humans. Epilepsia. 2: 92–99. 2018.
Stewart J.D., Horvath R., Baruffini E., Ferrero I., Bulst S., Watkins P.B., Fontana R.J., Day C.P., Chinnery P.F. Polymerase γ Gene POLG determines the risk of sodium valproate-induced liver toxicity. Hepatology. 52: 1791–1796. 2010.
Rojas A., Wang W., Glover A., Manji Z., Fu Y., Dingledine R. Beneficial Outcome of Urethane Treatment Following Status Epilepticus in a Rat Organophosphorus Toxicity Model. eNeuro. 5 (2). 2018. doi:https://doi.org/10.1523/ENEURO.0070-18.2018
Li B., Sedlacek M., Manoharan I., Boopathy R., Duysen E.G., Masson P., Lockridge O. Butyrylcholinesterase, paraoxonase, and albumin esterase, but not carboxylesterase, are present in human plasma. Biochem. Pharmacol. 70: 1673–1684. 2005.
Duysen E.G., Cashman J.R., Schopfer L.M., Nachon F., Masson P., Lockridge O. Differential sensitivity of plasma carboxylesterase-null mice to parathion, chlorpyrifos and chlorpyrifos oxon, but not to diazinon, dichlorvos, diisopropylfluorophosphate, cresylsaligenin phosphate, cyclosarin thiocholine, tabun thiocholine, and carbofuran. Chem. Biol. Interact. 195 (3): 189–198. 2012.
Flannery B.M., Bruun D.A., Rowland D.J., Banks C.N., Austin A.T., Kukis D.L., Li Y., Ford B.D., Tancredi D.J., Silverman J.L., Cherry S.R., Lein P.J. Persistent neuroinflammation and cognitive impairment in a rat model of acute diisopropylfluorophosphate intoxication. J. Neuroinflammation. 13 (1): 267. 2016.
Гончаров Н.В., Терпиловский М.А., Шмурак В.И., Белинская Д.А., Авдонин П.В. Крыса (Rattus norvegicus) как объект исследования в модели острого отравления фосфорорганическими соединениями. 1. Биохимические аспекты. ЖЭБФ. 2. 2019 In print. [Goncharov N.V., Terpilovskii M.A., Shmurak V.I., Belinskaya D.A., Avdonin P.V. The Rat (Rattus norvegicus) as a Model Object for Acute Organophospate Poisoning. 1. Biochemical aspects. J. Evol. Biochem. & Physiol. 55 (2): 28–38, 2019. (In Russ).].
Chauhan B., Kumar G., Kalam N., Ansari S.H. Current concepts and prospects of herbal nutraceutical: A review. J Adv Pharm Technol Res. 4 (1): 4–8. 2013.
Avci B., Bilge S.S., Arslan G., Alici O., Darakci O., Baratzada T., Ciftcioglu E., Yardan T., Bozkurt A. Protective effects of dietary omega-3 fatty acid supplementation on organophosphate poisoning. Toxicol Ind Health. 34 (2): 69–82. 2018.
Mukherjee S., Mukherjee N., Saini P., Roy P., Babu S.P. Ginger extract ameliorates phosphamidon induced hepatotoxicity. Indian J Exp Biol. 9: 574–584. 2015.
Oyagbemi A.A., Omobowale T.O., Ochigbo G.O., Asenuga E.R., Ola-Davies O.E., Ajibade T.O., Saba A.B., Adedapo A.A. Polyphenol-Rich Fraction of Parquetina nigrescens Mitigates Dichlorvos-Induced Cardiorenal Dysfunction Through Reduction in Cardiac Nitrotyrosine and Renal p38 Expressions in Wistar Rats. J Diet Suppl. 15 (3): 269–284. 2018.
Sinha S., Du Z., Maiti P., Klärner F.G., Schrader T., Wang C., Bitan G. Comparison of three amyloid assembly inhibitors: the sugar scyllo-inositol, the polyphenol epigallocatechin gallate, and the molecular tweezer CLR01. ACS Chem Neurosci. 3 (6): 451–458. 2012.
Goncharov N., Maevsky E., Voitenko N., Novozhilov A., Kubasov I., Jenkins R., Avdonin P. Nutraceuticals in sports activities and fatigue. Nutraceuticals: Efficacy, Safety and Toxicity. Ed.: Gupta, R.C. Amsterdam, 2016: 177–188.
Гончаров Н.В., Уколов А.И., Орлова Т.И., Мигаловская Е.Д., Войтенко Н.Г. Метаболомика: на пути интеграции биохимии, аналитической химии, информатики. Успехи современной биологии. 135 (1): 3–17. 2015. [Goncharov N.V., Ukolov A.I., Orlova T.I., Migalovskaia E.D., Voitenko N.G. Metabolomics: on the Way to Integration of Biochemistry, Analytical Chemistry, and Informatics. Achievements of modern biology. 135 (1): 3–17. 2015. (In Russ).].
Шмурак В.И., Курдюков И.Д., Надеев А.Д., Войтен-ко Н.Г., Глашкина Л.М., Гончаров Н.В. Биохимические маркеры интоксикации фосфорорганическими отравляющими веществами. Токсикологический Вестник. 4: 30–34. 2012. [Shmurak V.I., Kurdyukov I.D., Nadeyev A.D., Voitenko N.G., Glashkina L.M., Goncharov N.V. Biomarkers of intoxication by organophosphorous toxic agents. Toksikologicheskiy Vestnik. 4: 30–34. 2012. (In Russ).].
Черепахина Н.Е., Табаксоева Д.А., Marshall T., Агиров М.М., Abe H., Rose N., Шогенов З.С., Martin F.L., Cotter P., Ehrlich G.D., Покровский В.И., Hutfless S., Маев И.В., Yamada Y., Сучков С.В. Постинфекционный аутоиммунный синдром как комбинаторный биомаркер хронических заболеваний инфекционной этиологии и аутоиммунной природы. Аллергология и иммунология. (2): 206–209. 2015. [Cherepakhina N.E., Tabaksoeva D.A., Marshall T., Agirov M.M., Abe H., Rose N., Shogenov Z.S., Martin F.L., Cotter P., Ehrlich G.D., Pokrovskiy V.I., Hutfless S., Mayev I.V., Yamada Y., Suchkov S.V. Post-infectious autoimmune syndrome as a combinatorial biomarker of chronic diseases of infectious etiology. Allergologiya i immunologiya. (2): 206–209. 2015. (In Russ).].
Terpilowski M.A., Korf E.A., Jenkins R.O., Goncharov N.V. An algorithm for deriving combinatorial biomarkers based on ridge regression. Journal of Bioinformatics and Genomics. 2018: 1–6. https://doi.org/10.18454/jbg.2018.1.6.2
Prokofieva D.S., Jenkins R.O., Goncharov N.V. Microplate biochemical determination of Russian VX: Influence of admixtures and avoidance of false negative results. Anal. Biochem. 424 (2): 108–113. 2012.
Phuntuwate W., Suthisisang C., Koanantakul B., Mackness M.I., Mackness B. Paraoxonase 1 status in the Thai population. J. Hum. Genet. 50 (6): 293–300. 2005.
Van Der Walt S., Colbert S.C., Varoquaux G. The NumPy array: a structure for efficient numerical computation. Comput. Sci. Eng. 13 (2): 22–30. 2011.
Hunter J.D. Matplotlib: A 2D graphics environment. Comput. Sci. Eng. 9 (3): 90–95. 2007.
Benjamini Y., Hochberg Y. Controlling the false discovery rate: a practical and powerful approach to multiple testing. J. R. Stat. Soc. Ser. B Methodol. 57: 289–300. 1995.
Fischer K., Kettunen J., Würtz P., Haller T., Havulinna A.S., Kangas A.J., Soininen P., Esko T., Tammesoo M.L., Mägi R., Smit S., Palotie A., Ripatti S., Salomaa V., Ala-Korpela M., Perola M., Metspalu A. Biomarker profiling by nuclear magnetic resonance spectroscopy for the prediction of all-cause mortality: an observational study of 17.345 persons. PLoS Med. 11 (2):e1001606. 2014.
Kideryová L., Pytlík R., Benešová K., Veselá R., Karban J., Rychtrmocová H., Goettsch W., Morawietz H., Trněný M. Endothelial cells (EC) and endothelial precursor cells (EPC) kinetics in hematological patients undergoing chemotherapy or autologous stem cell transplantation (ASCT). Hematol Oncol. 28 (4): 192–201. 2010.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


