Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 3, стр. 179-187
ВЛИЯНИЕ БЛОКАДЫ М-ХОЛИНОРЕЦЕПТОРОВ НА ФУНКЦИОНАЛЬНУЮ АКТИВНОСТЬ МОТОРНОЙ, СЕРДЕЧНОЙ И ДЫХАТЕЛЬНОЙ СИСТЕМ НОВОРОЖДЕННЫХ КРЫСЯТ ПРИ АКТИВАЦИИ ХОЛИНОРЕАКТИВНЫХ СТРУКТУР
В. А. Сизонов 1, Л. Е. Дмитриева 1, С. В. Кузнецов 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: ksv@iephb.ru
Поступила в редакцию 26.03.2018
После доработки 30.10.2018
Принята к публикации 20.02.2019
Аннотация
На 1- и 16-дневных крысятах изучали активность сердечно-сосудистой, дыхательной и соматомоторной систем в условиях нарушения холинергической регуляции.
Ингибирование ацетилхолинэстеразы эзерином, ведущее к последующей активации холинореактивных структур, сопровождается однонаправленными нарушениями синусового ритма сердца у новорожденных и, в меньшей степени, у 16-дневных животных. Активация холинореактивных структур вызывает снижение частоты и регулярности дыхания, а также изменения паттерна и параметров моторной активности. Инъекция эзерина потенцирует моторную активность у однодневных и угнетает у 16‑дневных крысят. Блокада мускариновых холинорецепторов у крысят обоих возрастов в большей степени оказывает влияние на функциональную активность сердечно-сосудистой системы, предотвращая возникновение выраженных нарушений сердечного ритма, вызванных введением ингибитора холинэстеразы.
Показано, что в ранний период постнатального онтогенеза крыс завершается становление дефинитивного уровня холинергической регуляции, включая созревание механизмов реципрокных взаимодействий внутри самой холинергическом системы. С этими процессами связаны имеющиеся возрастные различия в реакциях сердечно-сосудистой, дыхательной и соматомоторной систем на изменение уровня активации холинореактивных структур.
ВВЕДЕНИЕ
Работа посвящена одной из проблем физиологии – изучению механизмов регуляции ритмической организации физиологических функций. В настоящее время существует большое количество информации по различным аспектам развития холинергической системы [1–4]. Известно, что характер межсистемной интеграции неразрывно связан с развитием регуляторных систем организма.
Ранее было установлено, что у крысят в первые часы после рождения усиливается взаимосвязь между активностью соматомоторной и сердечнососудистой систем. С этого момента происходит кардинальное изменение функционирования и дыхательной системы, соответственно, меняется характер ее взаимодействия с другими возбудимыми системами организма [5]. Известно, что в раннем постнатальном онтогенезе млекопитающих спонтанная периодическая моторная активность, являющаяся отражением процессов возбуждения в соматической нервной системе, оказывает значительное влияние на работу сердечно-сосудистой и дыхательной систем. Координация деятельности этих систем является необходимым условием обеспечения гомеостаза организма и важнейшим элементом механизма адаптивных перестроек при изменениях факторов внутренней и внешней среды. Важность холинергической системы для развивающегося организма не вызывает сомнения.
Целью данной работы является получение более полного представления об онтогенетических особенностях холинергических регуляторных влияний на деятельность соматомоторной, дыхательной и сердечно-сосудистой систем в условиях активации холинореактивных структур, а также на фоне блокады мускариновых холинорецепторов (М-ХР).
МАТЕРИАЛ И МЕТОДИКА
Опыты проводили на лабораторных крысах линии Вистар. На новорожденных 1-дневных (Р1) и 16-дневных (Р16) крысятах исследовали функциональную активность сердечной, дыхательной и соматомоторной систем в норме и в условиях активации холинореактивных структур после применения ингибитора ацетилхолинэстеразы (АХЭ) эзерина. Для выявления роли периферических M-ХР в развитии патологических реакций осуществляли премедикацию животных метацином с последующим введением эзерина. Опыты выполняли в соответствии с правилами, рекомендованными Физиологической секцией Российского национального комитета по биологической этике.
Были выбраны два возрастных срока, Р1 и Р16 (период прозревания), в которые кардинально меняется функциональная активность исследуемых систем. Каждая возрастная группа состояла из 30‑ти животных без разделения по половому признаку. Регистрацию проводили на ненаркотизированных крысятах в условиях мягкой фиксации животных, которая позволяла осуществлять альтернирующие движения лап. Во время эксперимента крысят помещали в термостатированную камеру, температуру в которой стабильно поддерживали на уровне 28 ± 0.5°С (температура в гнезде). Контроль температуры осуществляли с помощью цифрового термометра RST-02100 (RST, Швеция).
Исследовали ЭКГ, показатели внешнего дыхания, ЭМГ мышц задней лапы (икроножная мышца). Регистрацию начинали после адаптации животного к условиям эксперимента. В целях снижения уровня шумов при регистрации ЭКГ применяли нестандартное отведение от теменной части головы и крестцовой области. Для анализа частоты дыхания осуществляли регистрацию перкуссии грудной клетки с использованием пьезоэлектрического датчика VP-102 (RFT, Германия).
В экспериментах использовали усилители биопотенциалов ИУ-40 (производство ЭПМ НИИЭМ РАМН). ЧДД регистрировали при полосе пропускания усилителя от 0.15 до 30 гц, ЭКГ – от 5 до 50 Гц, ЭМГ – от 5 до 150 Гц. Для ввода аналоговых сигналов в компьютер использовали АЦП E14-440 (L-card, Россия) с периодом дискретизации 0.5 мс. Общее время исследования каждого животного составляло от 90 до 120 мин. Анализ регистрируемых сигналов проводили в программе “PowerGraph 3.3.9”.
У интактных крысят перед введением препаратов в течение 30 мин определяли показатели моторной активности (МА), сердечного и дыхательного ритмов. Вычисляли коэффициент регулярности дыхания [6] только для интактных животных, так как эзерин вызывает значительную дестабилизацию дыхательного ритма. В программе “Origin 7.5” проводили спектральный анализ прореженной периодограммы ритма сердца по алгоритму быстрого преобразования Фурье (БПФ) с применением окна Ханна. При наличии высокоамплитудных брадикардических комплексов сердечных сокращений использовали 32768 точечное БПФ (33 с) с последующим усреднением спектров. В остальных случаях применяли 131072 точечное БПФ (2.2 мин). Анализ вариабельности сердечного ритма (ВСР) выполняли по трем частотным диапазонам: HF 0.8–2.5 Гц, LF 0.3–0.8 Гц, VLF 0.03–03 Гц. Данные частотные диапазоны были выбраны нами на основании литературных и собственных экспериментальных данных [5, 7]. Рассчитывали мощности спектров в диапазонах HF, LF, VLF в процентах к общей мощности спектра (To), а также показатели LF/HF, HF/To. Для анализа ВСР 16-дневных крысят подбирали животных, у которых в фоне ЧДД не превышала верхнюю границу диапазона HF.
В ходе исследования было проведено две серии экспериментов. В первой серии после 30-минутной регистрации показателей у интактных животных крысятам вводили антихолинэстеразное вещество обратимого действия эзерин. Для 1-дневных крысят опытным путем нами была определена LD50 эзерина (1.75 мг/кг внутрибрюшинно (в/бр)), и на ее основе была установлена рабочая доза 1.3 мг/кг в/бр (¾ LD50), которая позволяла получить четкую реакцию исследуемых систем на действие эзерина при минимальном уровне смертности животных (менее 20%). Доза 1.3 мг/кг оказалась летальной для крысят старшего возраста, гибель которых наступала из-за остановки дыхания. Поэтому для 16-дневных животных нами была индивидуально определена LD50 эзерина, равная 0.95 мг/кг, рабочая доза составила 0.7 мг/кг в/бр (¾ LD50).
Регистрацию физиологических показателей начинали сразу после инъекции, анализу подвергались фрагменты записей с 10-й по 30-ю мин (период максимального эффекта эзерина) и два последующих 30-минутных фрагмента – период последействия. Такой подход к рассмотрению данных связан с высокой вариативностью исследуемых ритмов после активации холинореактивных структур.
Во второй серии экспериментов осуществляли премедикацию животных М-холинолитиком метацином (1 мг/кг, в/бр) с последующей (через 10 мин) инъекцией эзерина. Анализ данных после инъекции эзерина проводили по описанной выше схеме (20+30+30 мин). Известно, что метацин, являясь четвертичным производным бензацина, обладает, помимо выраженного периферического М-холинолитического действия, слабым ганглиоблокирующим эффектом, который проявляется при увеличении дозы препарата. В предварительных исследованиях, выполненных на новорожденных крысятах, нами установлено, что инъекция метацина в дозе 1 мг/кг в/бр не вызывает значимых изменений ЧСС и ЧДД, увеличение дозы препарата до 2 мг/кг в/бр приводит к реакциям, сходным с последствиями блокады никотиновых холинорецепторов [8].
Моторную активность животных оценивали по интегральным показателям ЭМГ. Для анализа индивидуальных изменений интенсивности ЭМГ использовали показатели: (Time_act) – суммарная длительность потенциалов действия в процентах к общему времени регистрации; (Power_EMG) – суммарная величина амплитуд потенциалов действия мышцы, зарегистрированных в период активности “Time_act” и нормированных к одной минуте. Для оценки изменений сердечного ритма ЭКГ преобразовывали в периодограмму, а дыхательный ритм оценивали по спектрам дыхательных движений. Рассчитывали частоту сердечных сокращений (ЧСС) и дыхательных движений (ЧДД).
Статистическую обработку данных осуществляли в программе “Origin 2015”. Использовали парный тест Стьюдента с поправками Холма. Статистически обработанные данные представлены как среднее ± стандартная ошибка. Все изменения рассматривали по отношению к фоновым показателям до введения препаратов. Различия считали статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сердечная деятельность и дыхание. У большинства интактных крысят регистрируется правильный синусовый ритм с амплитудно-частотными модуляциями. Cреднее значение ЧСС у крысят на Р1 практически в два раза ниже, чем на Р16 (табл. 1). У 25% интактных крысят обоих возрастов наблюдаются нерегулярные брадикардические колебания сердечного ритма с длительностью в несколько секунд. Подобные результаты были получены и у крысят в первые часы после рождения (Р0) [9].
Таблица 1.
Изменение физиологических показателей 1- и 16-дневных крысят после введения эзерина
| Показатель | Фон | Р1 | Р16 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Эзерин, 1.3 мг/кг | Фон | Эзерин, 0.7 мг/кг | ||||||||||||
| ПМЭ | Последействие | ПМЭ | Последействие | |||||||||||
| первые 30 мин | вторые 30 мин | первые 30 мин | вторые 30 мин | |||||||||||
| опыт | % к фону | опыт | % к фону | опыт | % к фону | опыт | % к фону | опыт | % к фону | опыт | % к фону | |||
| ЧСС, в мин | 217.7 ± 6.4 | 77.1 ± 8.3* | 35.4 | 111.5 ± 12.2* | 51.2 | 154.5 ± 13.8* | 71.0 | 473.7 ± 18.6 | 336.6 ± 27.4* | 71.1 | 305.3 ± 47.9* | 64.5 | 406.5 ± 18.4* | 85.8 |
| ЧДД, в мин | 76.2 ± 2.7 | 41.6 ± 1.3* | 54.6 | 38.6 ± 0.7* | 50.7 | 41.2 ± 2.1* | 54.1 | 148.3 ± 16.4 | 95.5 ± 7.3* | 64.4 | 99.0 ± 9.6* | 66.8 | 118.5 ± 9.6 | 79.9 |
| Power_EMG, (mV*s)/min | 1.0 ± 0.4 | 1.0 ± 0.3 | 100.0 | – | – | – | – | 2.6 ± 0.7 | 0.4 ± 0.1* | 15.4 | – | – | – | – |
| Time_act, % | 27.9 ± 7.5 | 41.4 ± 6.9 | 148.4 | – | – | – | – | 47.2 ± 12.8 | 11.9 ± 5.1* | 25.2 | – | – | – | – |
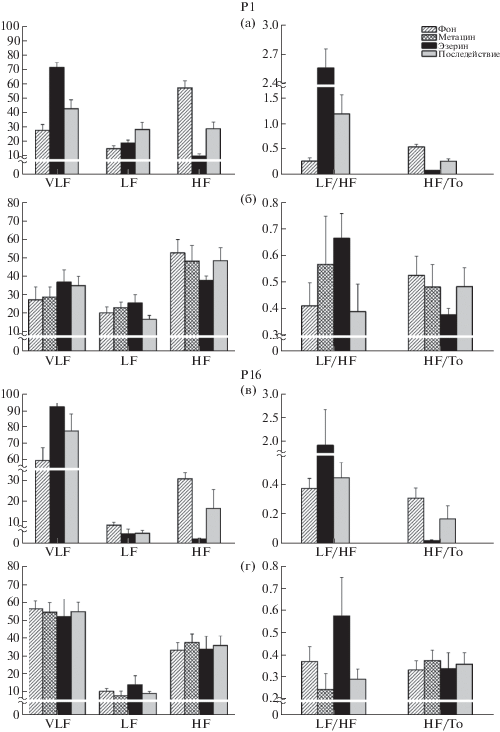
Анализ ВСР показал, что у 1-дневных интактных крысят вагосимпатический баланс смещен в сторону преобладания парасимпатических влияний, в то время как на 16 сут в регуляции сердечного ритма доминируют гуморально-метаболические и симпатоадреналовые влияния (рис. 1).
Рис. 1.
Изменения показателей ВСР у 1-дневных и 16-дневных крысят после инъекции эзерина в дозе ¾ LD50 (а, в) (в норме, в ПМЭ и в последействии) и после инъекции эзерина на фоне премедикации метацином (б, г) (в норме, после инъекции метацина, эзерина и в последействии).
По оси абсцисс – показатели ВСР, по оси ординат – значения сдвигов для показателей VLF, LF, HF даны в % по отношению к значению To данного периода обследования; значения LF/HF, HF/To (у.е.).
У интактных крысят дыхание нестабильно, с выраженными колебаниями как частоты, так и глубины дыхательных движений. Ритм дыхания связан с характером двигательной активности, он дестабилизируется не только комплексами и вспышками МА, но и отдельными вздрагиваниями (джерками). У 1-дневных крысят присутствуют множественные апноэ. В разных возрастных группах колебания частоты дыхания, связанные с характером МА, имеют разную направленность [5]. Средняя ЧДД и регулярность дыхания 16-дневных крысят значительно выше, чем у 1-дневных (коэффициент регулярности на Р16 составляет 0.51 ± 0.04, коэффициент регулярности на Р1 – 0.34 ± 0.01).
Ингибирование ацетилхолинэстеразы (АХЭ) эзерином и последующая активация холинореактивных структур провоцирует развитие нарушений сердечного ритма, которые у 1-дневных крысят становятся выраженными примерно через 10 мин после инъекции. Длительность периода максимального эффекта эзерина (ПМЭ) составляет около 20 мин, и в это время наблюдается феномен, который можно обозначить как “стадия брадикардической аритмии”. У животных происходит значительное урежение сердечного ритма, на фоне которого возникают комплексы еще более выраженной брадикардии, следующие в декасекундном и околоминутном ритме (рис. 2д, 4). Характерной особенностью брадикардических комплексов (БК) в этот период является то, что при максимально низкой частоте сердцебиений их амплитуда может достигать размера более 1 с (~600–700% по сравнению с фоновым уровнем), так называемые высокоамплитудные комплексы. Периодограмма ритма сердца 1-дневного крысенка на стадии брадикардической аритмии представлена на рис. 2б, 2. По окончании ПМЭ у животных наблюдается стадия постаритмии (последействия), во время которой размах БК уменьшается, а период их возникновения составляет несколько минут [10].
Рис. 2.
Спонтанная моторная активность (1), периодограмма сердечного ритма (2) у интактного 1-дневного животного (а), после инъекции эзерина в дозе 1.3 мг/кг (б) и после инъекции эзерина на фоне премедикации метацином (в).
На г, д, е: фрагменты одновременной регистрации моторной активности (1), дыхания (3), ЭКГ (4).
По оси абсцисс – время наблюдения (мин), по оси ординат 1, 3, 4 – нормированная амплитуда, (у.е.); 2 – амплитуда периодограммы сердечного ритма, (с).
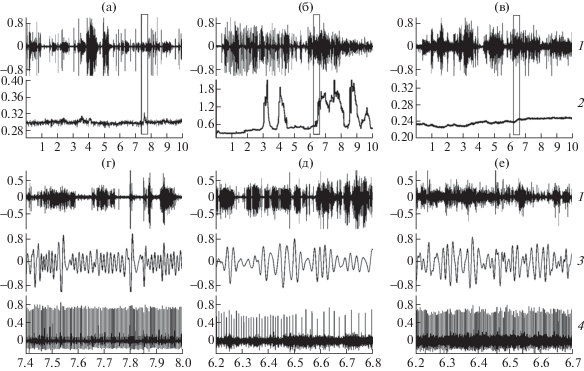
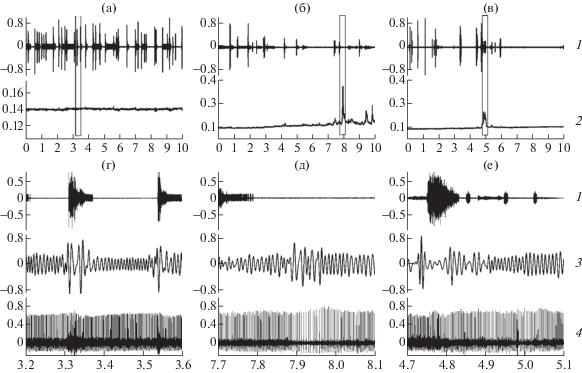
Эзерин, введенный 16-дневным крысятам, начинает действовать позже, через 12–13 мин. Стадия брадикардической аритмии на Р16 в 67% случаев полностью отсутствует, а в остальных – укорачивается. Амплитуда БК в среднем на 150–200% больше, чем до введения препарата. Урежение сердечного ритма на этой стадии на 35.7% меньше, чем у 1-дневных крысят. Периодограмма ритма сердца 16-дневного крысенка в ПМЭ представлена на рис. 3б, 2. Стадия постаритмии представлена низкоамплитудными, уменьшенными по размаху комплексами. Восстановление правильного синусового ритма происходит быстрее, чем у 1-дневных животных. Показатели ЧСС и ЧДД у крысят на разных стадиях действия эзерина представлены в табл. 1.
Рис. 3.
Спонтанная моторная активность (1), периодограмма сердечного ритма (2) у интактного 16-дневного животного (а), после инъекции эзерина в дозе 0.7 мг/кг (б) и после инъекции эзерина на фоне премедикации метацином (в).
На г, д, е: фрагменты одновременной регистрации моторной активности (1), дыхания (3), ЭКГ (4).
По оси абсцисс – время наблюдения (мин), по оси ординат 1, 3, 4 – нормированная амплитуда (у.е.); 2 – амплитуда периодограммы сердечного ритма (с).
Анализ ВСР показал (рис. 1а, 1в), что инъекция эзерина крысятам обеих возрастных групп приводит к перераспределению регуляторных влияний и их усилению со стороны центральных и гуморально-метаболических факторов. Вместе с тем имеются определенные возрастные различия, заключающиеся в том, что в ПМЭ на Р1 вклад парасимпатических влияний снижается на 46.9%, а гуморально-метаболических увеличивается на 43.2%. На Р16 это соотношение составляет 20.7% и 22.9% соответственно. Доля симпатических влияний со стороны симпатической нервной системы после введения эзерина увеличивается на 3.7% на Р1 и снижается на 2.2% на Р16. Сдвиг вагосимпатического баланса сопровождается нарушениями синусового ритма сердца, особенно выраженными у крысят младшего возраста.
У животных обеих возрастных групп дыхательная система реагирует на введение эзерина на несколько минут раньше, чем сердечнососудистая система. Происходит снижение ЧДД и дестабилизация ритма дыхания (табл. 1; рис. 2б, 3; рис. 3б, 3). На Р16 прослеживается тенденция к восстановлению ритма дыхания, в то время как на Р1 снижение ЧДД в ПМЭ более глубокое и восстановления не происходит даже к концу наблюдения (90 мин после инъекции).
Блокада М-ХР метацином не приводит к значимым изменениям ЧСС и ЧДД у крысят обоих возрастов, хотя и есть качественные различия в направленности сдвига ЧДД на Р1 и Р16 (табл. 2, 3). Введение животным эзерина на фоне блокады М-ХР вызывает замедление ЧСС у крысят обоих возрастов без нарушений самого ритма. Наиболее эффективно отрицательное хронотропное действие эзерина купируется блокадой М-ХР у 1-дневных крысят. В ПМЭ на Р1 стадия выраженной брадикардической аритмии полностью отсутствует, наблюдаются незначительные, близкие к фоновым, около- и многоминутные модуляции сердечного ритма (рис. 2г, 2). У 16-дневных крысят в 67% случаев сохраняются низкоамплитудные БК (рис. 3г, 2), а в остальных случаях регистрируются околоминутные модуляции сердечного ритма.
Таблица 2.
Изменение физиологических показателей 1-дневных крысят после введения эзерина на фоне премедикации метацином
| Показатель | Фон | Р1 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Метацин | Эзерин, 1.3 мг/кг | ||||||||
| ПМЭ | Последействие | ||||||||
| первые 30 мин | вторые 30 мин | ||||||||
| опыт | % к фону | опыт | % к фону | опыт | % к фону | опыт | % к фону | ||
| ЧСС, в мин | 241.8 ± 11.2 | 242.6 ± 11.9 | 100.3 | 211.4 ± 12.7 | 87.4 | 210.6 ± 13.2 | 87.1 | 220.6 ± 15.9 | 91.2 |
| ЧДД, в мин | 84.1 ± 4.3 | 80.0 ± 5.8 | 95.1 | 62.2 ± 2.2* | 74.0 | 60.8 ± 2.3* | 72.3 | 59.3 ± 3.4* | 70.5 |
| Power_EMG, (mV*s)/min | 0.4 ± 0.1 | 0.8 ± 0.2 | 200.0 | 0.6 ± 0.1 | 150.0 | – | – | – | – |
| Time_act, % | 20.4 ± 2.2 | 35.7 ± 6.7 | 175.0 | 34.8 ± 5.4 | 170.6 | – | – | – | – |
Таблица 3.
Изменение физиологических показателей 16-дневных крысят после введения эзерина на фоне премедикации метацином
| Р16 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Показатель | Фон | Метацин | Эзерин, 0.7 мг/кг | ||||||
| ПМЭ | Последействие | ||||||||
| первые 30 мин | вторые 30 мин | ||||||||
| опыт | % к фону | опыт | % к фону | опыт | % к фону | опыт | % к фону | ||
| ЧСС, в мин | 472.2 ± 12.9 | 475.5 ± 11.3 | 100.7 | 421.7 ± 13.8* | 89.3 | 415.7 ± 14.3* | 88.0 | 460.8 ± 14.5 | 97.6 |
| ЧДД, в мин | 158.2 ± 19.2 | 168.5 ± 20.1 | 106.5 | 91.6 ± 9.9* | 57.9 | 114.2 ± 8.9 | 72.2 | 156.5 ± 10.1 | 98.9 |
| Power_EMG, (mV*s)/min | 1.7 ± 0.2 | 0.8 ± 0.1* | 47.1 | 0.4 ± 0.1* | 23.5 | – | – | – | – |
| Time_act, % | 22.6 ± 6.3 | 12.6 ± 4.9 | 55.8 | 6.0 ± 1.2* | 26.5 | – | – | – | – |
Показатели ВСР после инъекции метацина незначительно изменяются по отношению к фоновым значениям (рис. 1б, 1г). Однако имеются возрастные различия, заключающиеся в тенденции к снижению доли парасимпатических влияний на Р1 и в их усилении на Р16. Несмотря на то что у 16‑дневных крысят наблюдается некоторое усиление парасимпатических влияний, преимущественно за счет снижения вклада гуморально-метаболических факторов, последние все равно остаются доминирующими.
После инъекции эзерина у крысят на Р1 продолжает развиваться тенденция, ведущая к усилению роли центральных и гуморально-метаболических влияний за счет уменьшения парасимпатических. На Р16 наблюдается дальнейшее снижение низкочастотных (VLF) составляющих модулирующих ритмов при незначительном росте симпатических и парасимпатических влияний.
Наблюдаемые нами возрастные различия в направленности сдвигов вагосимпатического баланса могут быть связаны с гетерохронией развития различных подтипов холинорецепторов. Известно, что между М- и Н-холинорецепторами (Н-ХР) существуют реципрокные отношения [11]. Блокада М-ХР вызывает активацию структур, имеющих в своем составе Н-ХР. Учитывая широкую представленность последних в различных структурах, включая кору надпочечников, нельзя исключить участие Н-ХР в механизмах регуляции сердечного ритма посредством изменения вклада гуморально-метаболических влияний.
Инъекция метацина приводит к снижению ЧДД, более выраженному у 16-дневных крысят. Ингибирование АХЭ, осуществленное на фоне блокады М-ХР, практически не изменяет пониженную ЧДД у крысят на Р1 (табл. 2) и вызывает восстановление частоты дыхания у животных на Р16 (табл. 3). Дизритмия дыхания отсутствует после введения животным метацина и возникает у 1‑дневных после инъекции эзерина. На Р16 мы не обнаружили у крысят значимых нарушений ритма дыхания.
Двигательная активность. У новорожденных интактных крысят спонтанная моторная активность представлена совокупностью длительных моторных комплексов, моторных вспышек и джерков (вздрагиваний) в различных сочетаниях и разделена периодами покоя (а, 1 на рис. 2, 3). Чередование циклов “активность-покой” создает декасекундные, околоминутные и многоминутные колебания этой активности [5]. У большинства животных старшей возрастной группы за короткими высокоамплитудными моторными вспышками наблюдается длительная низкоамплитудная активность (рис. 3а, 1).
После инъекции эзерина у 1-дневных крысят длительность периодов моторного возбуждения увеличивается на 48% без увеличения мощности ЭМГ (табл. 1). У отдельных животных она становится практически непрерывной с минимальными периодами покоя (рис. 2б, 1, 2д, 1). В период последействия вновь увеличивается длительность периодов покоя и паттерн МА приобретает характер периодической активности, при этом у нескольких крысят отмечалось снижение амплитуды ЭМГ. Инъекция эзерина 16-дневным животным сопровождается депрессией МА с существенным падением амплитуды ЭМГ (табл. 1, рис. 3б, 1, 3д, 1).
Блокада М-ХР метацином у 1-дневных животных провоцирует усиление, а у 16-дневных – угнетение МА. Ингибирование АХЭ не вызывает значимых изменений паттерна МА, но несколько снижает амплитуду ЭМГ. У 16-дневных животных продолжается депрессия МА (рис. 2в, 1, 2е, 1; рис. 3в, 1, 3е, 1). Как в случае применения одного эзерина, так и в условиях премедикации метацином паттерн и интегральные показатели МА не возвращаются к исходному уровню. Показатели МА представлены в табл. 2, 3.
Сравнительный анализ полученных нами данных показал, что ингибирование АХЭ эзерином и последующая активация холинореактивных структур сопровождаются сходными нарушениями синусового ритма сердца, как у 1-дневных, так и у 16‑дневных животных. Подобные нарушения сердечного ритма были описаны нами ранее у 4-дневных крысят после воздействия малых доз ингибитора холинэстераз фосфакола [12]. Блокада М-ХР у крысят обоих возрастов предотвращает возникновение выраженных нарушений сердечного ритма, вызванных введением ингибитора АХЭ.
Отравление эзерином вызывает патологические реакции со стороны дыхательной системы и определенные изменения в работе соматомоторной системы. Следует отметить, что несмотря на то, что величина LD50 эзерина для 16-дневных крысят существенно меньше, чем для однодневных, развивающаяся на Р1 дисфункция носит более глубокий и длительный характер, чем на Р16. Исключением является соматомоторная система, в которой угнетение двигательной активности сильнее у животных старшего возраста.
Наблюдаемые нами возрастные различия могут быть связаны с целым рядом факторов, обусловленных как морфологическими, так и функциональными особенностями холинергической регуляции возбудимых структур на разных этапах развития крыс. Парасимпатическая иннервация в сердце крыс выявляется еще в эмбриональный период и полностью формируется ко второму месяцу постнатального онтогенеза [13, 14]. Известно, что в сердце крыс концентрация М-ХР резко увеличивается между 15-м и 19-м днями пренатального развития, а с момента рождения и в течение послеродовой жизни плотность М-ХР в сердце уменьшается [15]. Кроме того, в ходе онтогенеза в миокарде изменяется качественный состав М-ХР. В опытах in vitro показано, что степень воздействия стимуляции М3-рецепторов на электрическую активность желудочкового миокарда максимальна у однодневных крысят и в 3 раза превышает реакцию миокарда взрослых животных. Авторы исследования пришли к выводу, что вклад М3-рецепторов в реализацию холинергических воздействий на миокард снижается в постнатальном онтогенезе и связывают это с уменьшением экспрессии гена М3-рецепторов по сравнению с геном М2-рецепторов [16].
Проведенное нами ранее исследование показателей гемодинамики у 3-30–дневных крыс в условиях блокады М- или Н-холинорецепторов с последующим введением животным эзерина показало, что на ранних стадиях постнатального онтогенеза блокада М-ХР вызывает отрицательный, а Н-ХР, наоборот, положительный инотропный эффект. Наиболее значимые перестройки холинергических влияний на сократительную способность миокарда происходят в период между 10‑ми и 16-ми сут. Начиная с 30-х сут введение холинолитиков не вызывает значимых изменений величины сердечного выброса. Полученные результаты свидетельствуют о том, что у крыс существует гетерохрония вовлеченности различных холинореактивных структур, участвующих в регуляции сократительной способности миокарда. Часть сдвигов показателей гемодинамики, наблюдаемых в ответ на изменение уровня холинергической активации, обусловлена гетерохронией становления реципрокных взаимодействий между М- и Н‑холинорецепторами [8].
Таким образом, показано, что у крысят в первые 16 сут постнатального онтогенеза изменение уровня активации холинореактивных структур, связанное с блокадой М-ХР и накоплением ацетилхолина вследствие ингибирования АХЭ, приводит к нарушениям функциональной активности сердечно-сосудистой, дыхательной и соматомоторной систем. Имеющиеся возрастные различия связаны со становлением дефинитивного уровня холинергической регуляции. Блокада М-ХР оказывает преимущественное влияние на функциональную активность сердечно-сосудистой системы, предотвращая возникновение выраженных нарушений сердечного ритма, вызванных введением ингибитора холинэстеразы. Премедикация холинолитиком не влияет на параметры МА, разнонаправлен-но изменяющейся у 1- и 16-дневных крысят после введения им эзерина.
Список литературы
Berger-Sweeney J., Hohmann C. F. Behavioral consequences of abnormal cortical development: Insights into developmental disabilities. Behav. Brain Res. 86: 121–142. 1997.
Rüdiger T., Bolz J. Acetylcholine influences growth cone motility and morphology of developing thalamic axons. Cell Adhes. Migr. 2 (1): 30–37. 2008.
Coyle J.T., Vamamura H.I. Neurochemical aspects of the ontogenesis of cholinergic neurons in the rat brain. Brain Res. (118): 429–440. 1976.
Holler T., Berse B., Cermak J.M., Diebler M.F., Blusztajn J.K. Differences in the developmental expression of the vesicular acetylcholine transporter and choline acetyltrasferase in the rat brain. Neurosci. Lett. 212: 107–110. 1996.
Кузнецов С.В., Дмитриева Л.Е., Сизонов В.А. Сердечная, дыхательная и моторная деятельность в норме и после активации катехоламинергических систем у новорожденных крысят. Ж. эвол. биохим. и физиол. 48 (4): 367–379. 2012. [Kuznetsov S.V., Dmitrieva L.E., Sizonov V.A. Cardiac, respiratory, and motor activity in norm and after activation of catecholaminergic systems in newborn rat pups. J. Evol. Biochem. Physiol. 48 (4): 367–379. 2012. (In Russ).].
Кузнецов С.В., Сизонов В.А., Дмитриева Л.Е. Изменение характера межсистемных взаимодействий у новорожденных крысят в условиях снижения центральных влияний (уретановый наркоз). Ж. эвол. биохим. и физиол. 50 (4): 207–218. 2014. [Kuznetsov S.V., Sizonov V.A., Dmitrieva L.E. Change of character of intersystemic interactions in newborn rat pups under conditions of a decrease of central influences (urethane anesthesia). J. Evol. Biochem. Physiol. 50 (4): 207–218. 2014. (in Russ).].
Бурсиан А.В., Дмитриева Л.Е., Кулаев Б.С., Полякова Л.А., Семенова Ю.О., Сизонов В.А., Тимофеева О.П. Вторичные ритмы сердечной деятельности в онтогенезе крыс. Ж. эвол. биохим. и физиол. 39 (2): 160–165. 2003. [Bursian A.V., Dmitrieva L.E., Kulaev B.S., Polyakova L.A., Semenov Yu.O., Sizonov V.A., Timofeeva O.P. Secondary rhythms of cardiac activity in rat ontogeny. J. Evol. Biochem. Physiol. 39 (2): 160–165. 2003. (in Russ).].
Кузнецов С.В., Кузнецова Н.Н. Изменение показателей гемодинамики в раннем постнатальном онтогенезе крыс после инъекции ингибитора холинэстеразы эзерина и при премедикации М- и Н-холинолитиками. Рос. физиол. журн. 104 (9): 1075–1085. 2018. [Kuznetsov S.V., Kuznetsova N.N. The change of hemodynamic indexes in early postnatal ontogenesis of rats after injection of the inhibitor of Ezerin cholinesterase and in premedication of m- and n-cholinolithics. Rus. J. Physiol. 104 (9): 1075–1085. 2018. (in Russ).].
Тимофеева О.П., Вдовиченко Н.Д., Кузнецов С.В. Динамика становления ритмической активности сердца у плодов и новорожденных крыс. Бюл. экспер. биол. и мед. 152 (10): 373–378. 2011. [Timofeeva O.P., Vdovichenko N.D., Kuznetsov S. Dynamics heart rhythmic activity formation at unborn and newborn rats. Bull. Experimental. Biol. i Med. 152 (10): 373–378. 2011 (in Russ).].
Дмитриева Л.Е., Сизонов В.А. Нарушения ритма сердца, вызванные инъекцией ингибитора холинэстеразы эзерина в раннем онтогенезе крыс. Бюл. экспер. биол. и мед. 165 (1): 52–56. 2018. [Dmitrieva L.E., Sizonov V.A. The violations of heart rhythms caused by an injection of inhibitor of cholinesterase of an ezerin in early ontogenesis of rats. Experimental. Biol. i Med. 165 (1): 52–56. 2018 (In Russ).].
Лосев Н.А., Сапронов Н.С., Хныченко Л.К., Шабанов П.Д. Фармакология новых холинергических средств (фармакология – клинике). СПб. 2015. [Lo-sev N.A., Sapronov N.S., Hnychenko L.K., Shabanov P.D. Farmakologiya novyh holinergicheskih sredstv (farmakologiya – klinike). Pharmacology of new cholinergic means (pharmacology – clinic)]. St. Petersburg. 2015.]
Кузнецов С.В., Гончаров Н.В., Глашкина Л.М. Изменение параметров функционирования сердечно-сосудистой и дыхательной систем у крыс разного возраста под воздействием малых доз ингибитора холиностераз фосфакола. Ж. эвол. биохим. и физиол. 41 (2): 160–167. 2005. [Kuznetsov S.V., Goncharov N.V., Glashkina L.M. Change of parameters of functioning of the cardiovascular and respiratory systems in rats of different ages under effects of low doses of the cholinesterase inhibitor phosphacol. J. Evol. Biochem. Physiol. 41 (2): 160–167. 2005. (in Russ.)].
Швалев В.Н., Сосунов А.А., Гуски Г. Морфологические основы иннервации сердца. М. 1992. [Shvalev V.N., Sosunov A.A., Guski G. Morphological bases of heart innervation [Morfologicheskie osnovy innervacii serdca]. М. 1992.].
Marvin W.J. Jr, Hermsmeyer K., McDonald R.I., Roskoski L.M., Roskoski R. Jr. Ontogenesis of cholinergic innervation in the rat heart.Circ. Res. 1980. 46: 690–695.
Nedoma J., Slavíková J., Tucek S. Muscarinic acetylcholine receptors in the heart of rats before and after birth.Pflugers Arch. 406 (1): 45–50. 1986.
Тапилина С.В., Абрамочкин Д.В. Снижение чувствительности миокарда к стимуляции мускариновых рецепторов третьего типа в постнатальном онтогенезе. ACTA NATURAE. 8 (2). 29: 141–146. 2016. [Tapilina S.V., Abramochkin D.V. Snizhenie chuvstvitel’nosti miokarda k stimulyacii muskarinovyh receptorov tret’ego tipa v postnatal’nom ontogeneze. ACTA NATURAE. 8 (2). 29: 141–146. 2016. (in Russ).].
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


