Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 4, стр. 282-294
РАСПРЕДЕЛЕНИЕ КАЛЬЦИЙ-СВЯЗЫВАЮЩИХ ПРОТЕИНОВ И АКТИВНОСТИ ЦИТОХРОМОКСИДАЗЫ В ПРОЕКЦИОННОЙ ЗОНЕ (WULST) ТАЛАМОФУГАЛЬНОГО ЗРИТЕЛЬНОГО ПУТИ ГОЛУБЯ. ОБСУЖДЕНИЕ В СВЯЗИ С СОВРЕМЕННЫМ ПРЕДСТАВЛЕНИЕМ О ГОМОЛОГИИ WULST СО СТРИАРНОЙ ЗРИТЕЛЬНОЙ КОРОЙ МЛЕКОПИТАЮЩИХ
М. Г. Белехова 1, *, Н. Б. Кенигфест 1, Д. С. Васильев 1, Т. В. Чудинова 2
1 Федеральное бюджетное государственное учреждение науки Институт эволюционной физиологии и биохимии
им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: belekhova@yahoo.com
Поступила в редакцию 26.06.2018
После доработки 15.11.2018
Принята к публикации 22.02.2019
Аннотация
В настоящей статье дано современное представление об организации гиперпаллиального проекционного поля таламофугального пути птиц (Wulst) о распределении кальций-связывающих протеинов парвальбумина (PV), калбиндина (CB) и активности цитохромоксидазы (CO), включая наши данные, полученные на голубе. Исследование проводилось с помощью иммуногистохимического и гистохимического методов. В главном таламореципиентном отделе Wulst – n. interstitialis hyperpallium apicale/hyperpallium intercalatum (IHA/HI) обнаружены 3 дискретные зоны: две, содержащие точечный PV-ir нейропиль и плотную популяцию преимущественно мелких PV-ir клеток звездчатого и гранулярного типов, одна – точечный CB-ir нейропиль и в основном CB-ir клетки. Область IHA/HI выделялась высокой активностью СО. В hyperpallium apicale (НА) и hyperpallium densocellulare (НD) диффузно рассеяны PV- и CB-ir клетки разных морфотипов в нейропиле, умеренно иммунореактивном к обоим протеинам. Для этих отделов характерно содержание крупных пирамидоподобных и мультиполярных PV- и CB-ir нейронов с длинными дендритными отростками, формирующими в поверхностном отделе НА клеточно-фиброзный слой. Сделан вывод о наличии в таламофугальном зрительном пути голубя параллельных PV- и CB-специфичных каналов. Дан сравнительный анализ вариабельности этих каналов у разных видов птиц, которая обусловлена эколого-адаптивными факторами. В рамках современного представления об организации и эволюционном происхождении Wulst птиц и стриарной зрительной коры млекопитающих обсуждается гомология этих структур.
ВВЕДЕНИЕ
Зрительная система птиц, так же как других амниот (рептилии, млекопитающие), включает два параллельных пути: таламофугальный с переключением в дорсальном ядре наружного коленчатого тела (GLd) и его проекцией в зрительный гиперпаллиум (Wulst), и тектофугальный, берущий начало в тектуме, с переключением в круглом ядре таламуса (Rot) на пути в его проекционное телэнцефальное поле энтопаллиум [1–5]. До настоящего времени сохраняется интерес к проблеме эволюции этих систем, их предшественникам у низших позвоночных, гомологии с таламо-телэнцефальными зрительными системами млекопитающих и к факторам, определяющим их преобразования в филогенезе. В многочисленных работах изучались их различные характеристики (морфологические, ходологические, эмбриогенетические, нейрохимические, генетические, функциональные, поведенческие), используемые для оценки консервативных черт и пластических преобразований текто- и таламофугальных путей среди широкого круга представителей позвоночных. Исследования на птицах привели к ревизии прежнего представления о гомологии значительной части их конечного мозга, рассматриваемого долгое время как гомолог стриатума, к новой интерпретации, согласно которой дорзальная часть стриатума, дорзовентральный гребень (DVR) является паллиальным образованием. В соответствии с этим была изменена номенклатура названий структур конечного мозга птиц [6, 7]. Собственно стриатум, базальные ганглии конечного мозга, занимают по новой номенклатуре сходное положение, имеют такие же связи, относительный объем и молекулярные свойства с таковыми млекопитающих [7].
В сравнительных исследованиях зрительных центров амниот широко используется исследование распределения кальций-связывающих протеинов (СаВРr) и активности окислительного метаболического фермента цитохромоксидазы (СО), отражающих свойства и уровень их функциональной активности. У птиц были обнаружены различия этих характеристик в центрах таламо- и тектофугального путей [8–12]. Наличие экспрессии PV исключительно или преимущественно в центрах тектофугальной системы, а СВ в центрах таламофугальной системы у вьюрка привело к заключению, что тектофугальная система у этого вида птиц PV‑специфичная, а таламофугальная СВ-специфичная. Однако у другого вида птиц, голубей, в тектофугальной системе были обнаружены и PV- и СВ-специфичные каналы, предположительно связанные с их функциональными особенностями, обусловленными обработкой разномодальных зрительных сигналов [12–14]. В таламическом релейном центре таламофугальной зрительной системы GLd также обнаружена вариабельность содержания PV- и СВ-ir клеток у разных видов птиц [9, 12, 14–16]. В нашей предыдущей работе [12] было показано, что GLd голубя не является СаВРr моноспецифичным образованием: в его различных подъядрах, проецирующихся в Wulst, содержатся и PV- и, СВ-ir нейроны. Продолжая изучение таламофугальной системы, в настоящей работе мы исследовали распределение PV, СВ иммунореактивности и активности СО в зрительном Wulst голубя. Распределение в нем этих протеинов у голубя ранее не изучалось. Проведен сравнительный анализ межвидовой вариабельности этих характеристик у разных видов птиц. Обсуждается гомология Wulst птиц и стриарной зрительной коры млекопитающих в свете современного представления об их организации и эволюционном происхождении.
МАТЕРИАЛ И МЕТОДИКА
Материал получен на 11 голубях, которые были использованы для иммуногистохимического и флуоресцентноиммуногистохимического изучения распределения СаВРr, и гистохимического определения активности СО в энтопаллиуме [13]. Эксперименты проводились в соответствии с биоэтическими правилами, утвержденными комитетом по охране животных ИЭФБ РАН. Под глубоким нембуталовым наркозом производили интракардиально перфузию мозга 4%-ным раствором параформальдегида и затем в течение 24 ч изолированный мозг инкубировали в 20%-ном растворе сахарозы на 0.1 М фосфатном буфере, рН 7.4. Из каждого мозга готовили замороженные срезы толщиной 40–50 мкм. Свободно плавающие срезы мозга 4 голубей обрабатывали параллельно с помощью стандартной авидин-биотин-пероксидазной иммуногистохимической техники в одной серии для выявления PV, в другой для выявления СВ. Использовали моноклональные антитела против PV (mouse anti-PV, Sigma, США) в разведении 1:5000–7000 и поликлональные антитела против CB и CR (rabbit anti- CB/CR, Swant, Швейцария) в разведении 1:3500–5000 (детали методики см. [13]. Cрезы конечного мозга одного голубя окрашивали по Нисслю (тионин). При двойной флуоресцентной иммуногистохимии (два голубя) PV выявляли с помощью иммуноглобулинов, конъюгированных с тетраметилродамин изотиоционатом (Sigma, США), дающего зеленое свечение, а CB – с помощью флюоросцеин изотиоционата (Vector, США), дающего красное свечение метки (детали методики см [13]). Выявление активности СО (4 голубя) с использованием цитохрома c из бычьего сердца (Sigma, США) проводили также на свободно плавающих замороженных срезах толщиной 40–50 мкм с помощью стандартной гистохимической методики [17], применявшейся нами ранее [11]. Просмотр материала и фотосъемка производились на микроскопе Zeiss AxioImager A1 (Германия). Колокализация двойного флюоресцентного мечения анализировалась на конфокальном микроскопе Leica SP5 MF. (Leica microsystems, Германия). Обозначения структур конечного мозга голубя даны в соответствии с новой номенклатурой [6], таламических ядер – по [18].
РЕЗУЛЬТАТЫ
Распределение СаВРr и активности СО изучали в слоях зрительного гиперпаллиума, именуемых как HA, IHA, HI, HD согласно новой номенклатуре [6, 7]. Слои IHA и HI трудно разделимы у голубей. Поэтому в нашей работе мы рассматриваем IHA/HI как единую зону, соответствующую Нyperstriatum intercalatum superior (HIS) в старой терминологии [19].
Активность цитохромоксидазы
На срезах мозга, окрашенных по Нисслю, в Wulst нечетко выделяется дорсо-вентрально ориентированный слой плотно упакованных, преимущественно мелких, округлых клеток, топографически совпадающий с IHA/HI. В пограничных с ним медиально НА и латерально НD содержится смешанная популяция диффузно распределенных мелких и более многочисленных, среднего размера и крупных клеток (рис. 1а). Лентовидный слой IHA/HI отчетливо выделялся благодаря высокой активности СО. Она резко уменьшалась в НА и HD (рис 1б; рис. 2а). Нейропиль в IHA/HI состоял из плотного скопления точечных (терминальных) и претерминальных структур, среди которых рассеяны СО-активные клетки, не всегда различимые из-за высокой плотности нейропиля (рис. 1в).
Рис. 1.
Распределение в Wulst активности СО.
На поперечных срезах конечного мозга: а – окраска по Нисслю, нечетко очерченный слой мелких округлых клеток в области, соответствующей IHA/HI (очерчен); в НА и НD преобладают более крупные и интенсивнее окрашенные клетки. б – высокая активность СО ограничена областью IHA/HI. в – при бóльшем увеличении в плотном точечном нейропиле видны отдельные СО-активные клетки. На этом и остальных рисунках: M – медиальная, D – дорсальная стороны. Обозначения структур см. в списке принятых сокращений. Масштаб в мкм: 100 (а, в), 500 (б).

Рис. 2.
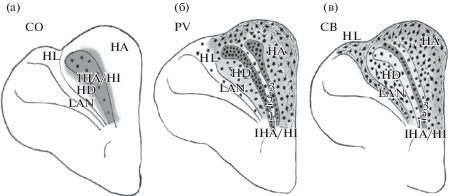
Схематическое изображение распределения активности CO (а), иммунореактивности к PV (б) и CB (в) в нейропиле и нейронах Wulst.
Поперечные срезы полушария конечного мозга на уровне, где представлены все его отделы: НА, IHA/HI и НD, а также пограничные с НD незрительные паллиальные структуры HL и LAN. Окраска фона отражает уровень иммунореактивности к PV, CB и активности СО в нейропиле: темносерая – высокая, светлосерая – умеренная, белый фон –слабая/отсутствие. Точки и символы нейронов – PV-ir, CB-ir и СО-активные клетки. Линии – фрагменты меченых волокон. Видно ограничение максимальной активности СО и PV-иммунореактивности областью IHA/HI. 1 – латеральная парвальбумин-позитивная, 2 – калбиндин-позитивная, 3 – медиальная парвальбумин-позитивная зоны.
Кальций-связывающие протеины
Схематически представленное на рис. 2б, в распределение PV и СВ иммунореактивности основано на объединенных данных, полученных с помощью обычной и флуоресцентной иммуногистохимии.
PV иммунореактивность. В области между НА и HD, занимаемой IHA/HI, выявлены параллельные, дорсовентрально ориентированные латеральная и медиальная лентовидные зоны, содержащие PV-ir нейропиль и клетки (в дальнейшем соответственно парвальбумин-позитивные зоны в тексте, 1 и 3 на рисунках), разделенные более узкой зоной, лишенной PV-ir нейропиля (2 на рисунках). Латеральная парвальбумин-позитивная зона, граничащая с подлежащим HD, отчетливо выражена на всем дорсовентральном протяжении. Ее более массивный дорсальный отдел поворачивает латерально, распространяясь параллельно поверхности полушария до углубления (vallecula, Vа). Менее значительная медиальная парвальбумин-позитивная зона, расположенная по границе с НА, не всегда прослеживалась на всем дорсовентральном протяжении, и более постоянно выявлялась в ее дорсальном отделе (рис. 2б; рис. 3а). По форме и расположению парвальбумин-позитивные зоны совпадают с областью высокой активности СО (см. рис. 1б; рис. 2а). Латеральная зона (1) содержала точечный нейропиль и многочисленные PV-ir клетки, имевшие бóльшую плотность в ее дорсальном отделе. Среди них преобладали в основном умеренно и интенсивно окрашенные мелкие, звездчато-подобные клетки с плохо выявлявшимися проксимальными отделами дендритов, и очень мелкие, круглые (гранулярного типа) клетки без отростков. Реже встречались более крупные и более интенсивно окрашенные клетки с прокрашенными проксимальными дендритами (рис. 3б, в; рис. 5a, б). В медиальной зоне (3) плотность иммунореактивного нейропиля и клеток меньше, чем в латеральной зоне. В ней содержались те же типы PV-ir клеток, но количество мелких клеток было значительно меньше, чем в латеральной зоне. Мелкие клетки были слабее окрашены, чем более крупные клетки с прокрашенными дендритными отростками (рис. 3г; рис. 5б). В полоске, лишенной PV-ir нейропиля (2), разделяющей латеральную и медиальную парвальбумин-позитивные зоны, наблюдались единичные PV-ir клетки (рис. 2б; рис. 3а, б). При иммунофлуоресцентной обработке срезов можно видеть более высокую плотность нейропиля и мелких PV-ir клеток в латеральной зоне IHA/HI, чем в медиальной, а также редкие PV-ir клетки в разделяющей их зоне 2 (рис. 2б; рис. 3а, б; рис. 5a, б, г). В НА, в области, пограничной с IHA/HI, уменьшалась плотность нейропиля, возраставшая в направлении его периферических отделов в значительной степени благодаря отросткам иммунореактивных клеток (рис. 2б; рис. 3а, д, е). В НА диффузно распределены клетки разных морфотипов. Характерной чертой этого отдела Wulst являются ярко окрашенные крупные и среднего размера пирамидоподобные и мультиполярные нейроны с длинными, ветвящимися дендритами. В самом поверхностном отделе НА они формировали плотный клеточно-фиброзный слой. Мелкие, округлые клетки с разной степенью окрашивания и с непостоянно прокрашивавшимися проксимальными отделами дендритных отростков также диффузно рассеяны в НА (рис. 2б; рис. 3а, д, е; рис. 5б). В HD на фоне слабо иммунореактивного нейропиля диффузно рассеяны PV-ir клетки разных морфотипов, сходные с клетками в НА: крупные и среднего размера, интенсивно окрашенные пирамидоподобные и мультиполярные с длинными дендритными отростками, а также мелкие, округлые, слабее окрашенные клетки (рис. 2б; рис. 3а, ж, з).
Рис. 3.
Распределение PV-иммунореактивности в нейропиле и нейронах Wulst, демонстрируемое на микрофотографиях поперечных срезов конечного мозга.
а – общая картина распределения PV-иммунореактивности в Wulst; в дорсальном отделе IHA/HI видны две параллельные парвальбумин-позитивные зоны: латеральная (1) и медиальная (3), выделяющиеся содержанием многочисленных PV-ir клеток и нейропиля, разделенные светлой полоской (обозначена стрелками), содержащей редкие PV-ir клетки. б, в – большая плотность мелких иммунореактивных клеток в латеральной зоне 1 (в – при бóльшем увеличении). г – плотность клеток меньше в медиальной зоне 3. д, е –в HA умеренно окрашенный нейропиль, преобладание крупных PV-ir нейронов с длинными дендритными отростками и более редкие мелкие клетки с разной интенсивностью окрашивания тел и отростков (е – при бóльшем увеличении). ж, з – в НD слабо окрашенный нейропиль, гетерогенный состав PV-ir клеток, сходный с таковым в НА (з – при бóльшем увеличении). На д–з крупные клетки показаны двойными стрелками, мелкие – одинарными. Масштаб в мкм: а (250), б, г, д, ж (50), в, е, з (25).

Рис. 4.
Распределение СВ-иммунореактивности в нейропиле и нейронах Wulst, демонстрируемое на микрофотографиях поперечных срезов конечного мозга.
а – общая картина распределения СВ-иммунореактивности в Wulst; в IHA/HI узкая полоска (калбиндин-позитивная зона 2), содержащая СВ-ir нейропиль и клетки, ограничена парвальбумин-позитивными зонами 1 и 3 с немногочисленными СВ-ir клетками. б– гетерогенный состав СВ-ir клеток в зоне 2; в – при бóльшем увеличении. г, д, е – в HA умеренно окрашенный нейропиль, преобладание крупных СВ-ir нейронов с длинными дендритными отростками и более редкие мелкие клетки с разной интенсивностью окрашивания тел и отростков. При бóльшем увеличении в поверхностном (д) и глубоком (е) отделах НА. ж, з–в НD в слабо окрашенном нейропиле диффузно рассеяны те же типы крупных и мелких СВ-ir клеток, что и в НА; при бóльшем увеличении (з). На в–з крупные клетки показаны двойными стрелками, мелкие – одинарными. Масштаб в мкм: а (250), б, г, ж (50), в, д, е, з (25).

Рис. 5.
Распределение PV- и CB-иммунореактивности в Wulst, выявленное с помощью двойной иммунофлуоресценции.
а – два параллельных слоя в вентральном отделе IHA/HI: латеральный (1), содержащий преимущественно PV-ir нейропиль и клетки, и медиальный (2), содержащий в основном СВ-ir нейропиль и клетки. б, в, г – три зоны в дорсальном отделе IHA/HI: парвальбумин-позитивные латеральная (1) и медиальная (3), калбиндин-позитивная (2) между ними. В НА диффузно распределены PV- и СВ-ir клетки разных размеров. На а, г стрелками отмечены клетки с колокализацией PV и CB. Зеленое окрашивание – PV, красное окрашивание – СВ, желтое окрашивание – колокализация СВ и PV. Масштаб в мкм: 100 (а), 500 (б–г).
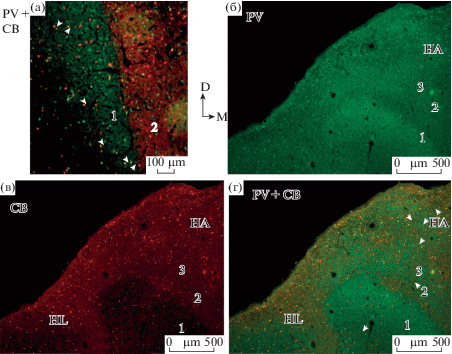
СВ иммунореактивность. Распределение CB-ir нейропиля в IHA/HI было в основном альтернативным по отношению к PV-ir нейропилю. Узкая дорсовентрально ориентированная лентовидная зона точечного, умеренно окрашенного CB-ir нейропиля (калбиндин-позитивная зона, 2 на рисунках) совпадает с лишенной PV-ir нейропиля полоской между латеральной и медиальной парвальбумин-позитивными зонами. Она четко отграничена от подлежащей латеральной парвальбумин-позитивной зоны 1 и менее четко от медиальной парвальбумин-позитивной зоны 3 из-за наличия в последней слабо окрашенного CB-ir нейропиля. Дорсально СВ-ir нейропиль калбиндин-позитивной зоны непрерывно переходит в поверхностный отдел НА (рис. 2в; рис. 4а, б; рис. 5в, г). Калбиндин-позитивная зона содержит не плотно расположенные среднего размера звездчато-подобные клетки с дендритными отростками разной степени окрашивания, и более мелкие, круглые (гранулярного типа), чаще слабо окрашенные клетки без отростков (рис. 2в; рис. 4б, в; рис. 5а, в). Немногочисленные по сравнениию с PV-ir клетками, CB-ir клетки рассеяны и в парвальбумин-позитивных зонах: в латеральной, лишенной CB-ir нейропиля, и в медиальной, содержащей слабо окрашенный СВ-ir нейропиль (рис. 2в; рис. 4а, б; рис. 5а, в, г). В НА в умеренно окрашенном точечном CB-ir нейропиле выявлены множественные иммунореактивные волоконные структуры. Плотность и интенсивность окрашивания нейропиля возрастала в направлении к поверхности полушария, достигая значительной степени в его поверхностном отделе (рис. 2в; рис. 4г, д, е; рис. 5в). Многочисленные ярко окрашенные крупные и среднего размера пирамидоподобные и мультиполярные CB-ir клетки с длинными, ветвящимися дендритными отростками, такого же типа как локализованные в НА PV-ir нейроны, диффузно рассеяны в НА. В поверхностном отделе НА они формировали плотный клеточно-фиброзный слой. В НА содержались также мелкие, круглые клетки с разной степенью окрашивания тел клеток и проксимальных отделов дендритов (рис. 4г, д, е; рис. 5в). HD характеризовался слабо окрашенным точечным CB-ir нейропилем и гетерогенным составом иммунореактивных клеток, сходным с таковым в центральном отделе НА. Он содержал ярко окрашенные, диффузно рассеянные крупные и среднего размера пирамидоподобные и мультиполярные CB-ir клетки с длинными, ветвящимися дендритными отростками, а также мелкие, округлые клетки с варьирующей интенсивностью окрашивания (рис. 2в; рис. 4а, ж, з). Латеральная граница HD с LAN и его дорсальным продолжением НL четко очерчена, благодаря содержанию в последних интенсивно окрашенного CB-ir нейропиля и многочисленных среднего размера и крупных мультиполярных CB-ir клеток. PV-ir нейроны в этих отделах были менее многочисленны, а нейропиль PV-иммунонегативен (рис 2б, в; рис. 5б, в). В опытах с двойным иммунофлуоресцентным маркированием наблюдалась колокализация PV и CB в части клеток: преимущественно крупных, в бóльшем количестве в поверхностном отделе НА, реже в мелких клетках IHA/HI (рис. 5а–г).
Полученные данные показали, что зрительная проекционная область Wulst голубя IHA/HI получает и PV- и СВ-специфичную таламическую иннервацию, распределенную альтернативно соответственно в парвальбумин-позитивных и калбиндин-позитивной зонах, хотя не исключены и другие (тектальные, претектальные) источники этой иннервации. PV- и CB-ir клетки в этих зонах распределены с перекрытием, но в парвальбумин-позитивных зонах преобладает плотная популяция PV-ir мелких клеток звездчато-гранулярного типа, а в калбиндин-позитивной – более крупные и мелкие CB-ir клетки разных типов. В НА и HD также перекрываются диффузно распределенные CB- и PV-ir клетки сходных морфотипов. Для этих отделов характерно наличие крупных и среднего размера пирамидоподобных и мультиполярных клеток, иммунореактивных к CB или PV, и с колокализацией в некоторых из них обоих протеинов.
ОБСУЖДЕНИЕ
Структурная организация Wulst птиц
Телэнцефальная проекционная область (задний отдел Wulst) таламического оптического центра (GLd) таламофугального пути состоит из нескольких радиальных, медио-латерально расположенных слоев, организованных по ядерному типу (псевдоламинарная организация): НА, IHA, HI, HD [6, 7]. Разные виды птиц отличаются разным уровнем развития Wulst и степенью дискретности его слоев. У птиц с боковым, преимущественно монокулярным зрением – (голуби, куры) нечетко разделены IHA и HI, хотя они могут быть выделены по распределению различных биологически активных веществ. У видов с фронтальным расположением глаз и бинокулярным зрением Wulst имеет не только бóльшие размеры, но и более высокую степень ламинарности [3, 4, 19–25]. В IHA у этих видов хорошо выражены наружный и внутренний подслои, имеющие большую плотность клеток, чем в IHA птиц с боковым зрением [24]. В последнее время на основе новых молекулярногенетических данных в зрительном Wulst вьюрка выделяют два отдела: Hyperpallium (Н), соответствующий НА, и Hyperpallium intercalatus (IH), соответствующий IHA и НI, а HD относят к дорсальному отделу мезопаллиума [26, 27]. В связи с необходимостью сравнения наших данных с результатами исследований, использующих номенклатуру, предложенную в ревизии паллиума птиц 2004 г. [6], мы придерживаемся этой номенклатуры.
Геникуло-гиперпаллиальные проекци
Wulst получает топографически организованные проекции из ретинореципиентных подъядер GLd. Они проецируются ипси- и контралатерально в разные отделы Wulst, связанные с представительствами разных полей сетчатки. Наибольшие размеры и количество проецирующихся в Wulst нейронов имеют подъядра переднего дорсолатерального ядра (DLL, DLAmc, DLAlr). Bентральный и дорсальный отделы DLL сравнивают с А и А1 слоями GLd млекопитающих. Основной проекционной зоной GLd является IHA/HI. Менее значительны проекции GLd в НА и HD [3, 4, 18, 28–39]. Локализация и характер проекций в Wulst других подъядер GLd (LA, LdOPT, SpRt, SPC) не до конца выяснены; предполагается, а для некоторых из них (LdOPT, SpRot) доказано, что они также имеют дискретные проекции в Wulst и связаны с обработкой зрительной и магнитной информации [29, 32, 34, 40–42].
Кальций-связывающие протеины в центрах таламофугальной системы птиц. Межвидовая вариабельность
Естественно рассматривать СаВРr специфичность иннервации зрительного Wulst в связи с содержанием проецирующихся в него PV- и CB-ir нейронов в GLd. Поскольку ранее у вьюрков и голубей в GLd были обнаружены CB-ir, но не PV-ir клетки [9, 10, 14], таламофугальная система птиц рассматривалась как СВ-специфичная [9, 10]. В нашей предыдущей работе [12] мы обнаружили в подъядрах GLd голубя клетки, иммунореактивные к обоим протеинам: в DLL и DLAmc наряду с преобладанием CB-ir клеток менее значительное количество PV-ir клеток, в LA их смешанную популяцию и исключительно PV-ir клетки в LdOPT. Так как все эти подъядра проецирутся в Wulst, можно признать существование по крайней мере двух, PV и СВ, компонентов геникуло-гиперпаллиальной системы голубя. Возможно, причина расхождения наших и приведенных выше данных об отсутствии PV-специфичного компонента таламофугального пути у вьюрка и голубя состоит в том, что изучалась иммунореактивность не всех подъядер GLd, а слабо окрашенные PV-ir клетки в GLd не были идентифицированы как экспрессирующие PV. Иначе как объяснить, что у вьюрка, в GLd которого не были найдены PV-ir клетки, главное таламореципиентное поле Wulst IHA, содержит терминальный PV-ir нейропиль [8, 10]. У птиц с высоко развитой таламофугальной системой, таких как совы, GLd содержит PV-ir нейроны [15], в незначительном количестве они найдены в GLd кур [9, 16], что свидетельствует о существовании в таламофугальной системе у этих видов PV-специфичного компонента.
Межвидовая вариабельность содержания в GLd PV- и CB-ir нейронов позволяет предполагать, что GLd анцестральных птиц содержалo оба типа этих нейронов, а также клетки, экспрессирующие другие СаВРr, например, CR, найденные в GLd птиц [9, 10, 16]. В ходе эволюции птиц в дивергентных линиях под давлением различных требований к обработке специфических сигналов окружающего зрительного мира в различных экологических нишах в GLd возникало преобладание или подавление вплоть до исчезновения того или иного типа СаВРr-экспрессирующих нейронов, что объясняет межвидовую вариабельность их содержания. Эта идея была высказана в отношении PV- и CB-ir нейронов в GLd млекопитающих на основании значительной вариабельности их распределения у разных видов [43] и может быть справедлива в отношении GLd птиц.
В зрительном Wulst птиц до настоящего времени нет детального изучения в одной работе иммунореактивности к разным типам CaBPr. У вьюрка PV-ir мелкие клетки, волокна и точечные структуры описаны в hyperstriatum accessorium (“area a” по [44], совпадающей с IHA [8]; СВ- и PV-ir клетки найдены у вьюрков и кур в областях, соответствующих IHA, HA и HD [9]. Эти данные приведены только в тексте и таблице. В более поздней работе [10] у вьюрка PV-ir нейропиль был выявлен во всех трех отделах (HA, IHA, HD), хотя PV-ir клетки в GLd не были обнаружены. CB-ir нейропиль сходной плотности содержится в HA и IHA. PV-ir клетки найдены только в IHA, тогда как СВ-ir клетки – во всех отделах (см. табл. 1 [10]). Однако на приводимых микрофотографиях с малым увеличением трудно различить иммунореактивность нейропиля и клеток к этим протеинам в разных отделах Wulst. CB иммунореактивность в Wulst детально изучалась у кур по мере созревания его отделов в процессе индивидуального развития. У взрослых особей наибольшая плотность CB-ir нейропиля и CB-ir клеток наблюдалась в IHA, появляющемся на более поздней стадии эмбриогенеза, по сравнению с НА, HI и HD [22]. Наличие калбиндин-позитивной иннервации IHA кур согласуется с содержанием CB-ir клеток в его проекционном ядре GLd [9, 16, 22]. PV иммунореактивность в этой работе не изучалась.
Наши данные на голубе частично совпадают с результатами, полученными на вьюрках и курах. Принципиальное сходство состоит в том, что Wulst у этих видов птиц, так же как у голубя, получает и СВ, и PV иннервацию, содержит и СВ-, и PV-ir клетки, хотя распределение и характер СВ и PV иммунореактивности в слоях Wulst голубя не полностью совпадают с описанными у вьюрка и кур. Обнаруженное нами наличие в IHA/HI голубя дискретных зон PV- и CB-ir точечного (терминального) нейропиля позволяет считать этот отдел зоной проекций нейронов GLd соответствующей специфичности, хотя нельзя исключить и другие источники (претектальный и тектальный) этой иннервации. Важно отметить, что PV- и CB-ir нейроны содержатся в проекционной сенсомоторной области Wulst голубя, причем наибольшую плотность в таламореципиентном слое HI имеют PV-ir клетки [45], так же как в IHA/HI зрительной области Wulst в наших опытах.
Описанные цитоархитектонические (Ниссль, Гольджи) морфотипы нейронов в зрительном Wulst птиц на нормальном материале позволяют сопоставить их с морфотипами PV- и СВ-ir клеток. PV- и СВ-ir клетки малого размера в IHA/HI голубя соответствуют короткоаксонным звездчатоподобным нейронам, очень мелкие иммунореактивные клетки – сферическим гранулярным нейронам; на клетках обоих типов оканчиваются терминали аксонов проекционных нейронов GLd (DLL) [3, 20, 30, 46–48]. PV- и CB-ir клетки этих морфотипов в IHA/HI относятся к геникулореципиентным нейронам, сопоставимым с таламореципиентными клетками слоя IV первичной зрительной коры млекопитающих [48]. Вместе с тем клетки этих типов с меньшей плотностью, чем в IHA, содержатся также в НА и HD [30, 47]. Крупные и среднего размера клетки НА голубя с длинными, ветвящимися отростками, содержащие PV или CB, или оба протеина, соответствуют мультиполярным и пирамидоподобным нейронам с длинными дендритами, описанными в НА птиц [30, 47]. По локализации, размерам и форме они могут быть отнесены к эфферентным нейронам с нисходящими проекциями в тектум и таламус и сопоставимы с клетками инфрагранулярных слоев (V и VI) зрительной коры млекопитающих [48, 49]. PV- и CB-ir клетки сходных типов в HD сопоставимы с мультиполярными и пирамидными нейронами слоев II и III зрительной коры [48].
Приведенные данные позволяют утверждать, что Wulst голубя получает из GLd и PV и CB иннервацию, а также содержит PV- и CB-ir геникулореципиентные и эфферентные нейроны. Для выяснения вопроса, какие подъядра GLd с разным содержанием PV- и CB-ir клеток проецируются в соответствующие зоны Wulst, необходимо исследование с использованием комбинации трейсерной техники и PV/CB иммуногистохимии.
Гомология Wulst птиц со стриарной зрительной корой млекопитающих
Уже в старых, а затем и в последующих работах отмечалось большое, хотя и не абсолютное, сходство функциональной организации Wulst у разных видов птиц и первичной зрительной коры млекопитающих, касающееся ретинотопической организации, свойств рецептивных полей, типа нейрональных реакций на различные зрительные сигналы [23, 39, 50–54].
К настоящему времени выявлена роль таламофугальной системы птиц в решении сложных дискриминационных зрительных задач, а также зрительных функций, связанных с различными видами ассоциативного, экстраполяционного, социально-коммуникативного, миграционного поведения, тогда как на протяжении долгого времени доминировало представление о приоритетной роли тектофугального пути в организации зрительного поведения птиц [4, 5, 39, 55–60]. Однако при наличии функционального сходства Wulst и зрительного неокортекса млекопитающих открытым оставался вопрос – является ли это сходство результатом гомологии или конвергентной эволюции.
Ревизия классического представления о гомологии большей части конечного мозга птиц со стриатумом (Wulst с гиперстриатумом) была предложена Г. Картеном [1, 61]. Согласно его революционной концепции “гомологии клеточных популяций” слой гранулярных клеток в HIS (IНА/HI по новой терминологии), получающий наиболее плотные проекции из GLd, сопоставим с таламореципиентным слоем IV первичной зрительной коры млекопитающих. Из IНА/HI зрительная информация переключается в НА, который является основным источником эфферентных интра- и экстрателэнцефальных проекций, и сопоставим с инфрагранулярными (V и VI) слоями зрительной коры млекопитающих. Нейроны HD, обеспечивающие связи между слоями Wulst и с другими паллиальными зонами, соответствуют клеткам супрагранулярных слоев (II, III). Это представление получило подтверждение во многих морфологических, ходологических, нейрохимических исследованиях, а также на основе эмбриогенетических данных о миграции клеток в Wulst из герминального поля [1, 2, 4, 7, 62–64]. Оно окончательно утвердилось на основании сходства генных характеристик основных типов клеток в Wulst и зрительной коре млекопитающих [23, 27, 63–68].
Таким образом, несмотря на различия структурной организации Wulst и зрительной коры млекопитающих, они обладают принципиальным сходством. Оно состоит в содержании в них трех основных типов нейронов – входных (геникулореципиентных), выходных (интрапаллиально-проецирующихся) и выходных (экстрапаллиально- и экстрателэнцефало-проецирующихся), что определяет сходные механизмы обработки поступающей зрительной информации.
Наши данные о распределении PV и CB иммунореактивности в слоях Wulst выявили определенное сходство с их распределением в слоях зрительной коры многих, так называемых “лабораторных” млекопитающих (крысы, кошки, мыши, кролики, обезьяны). Оно касается парвальбумин-позитивной иннервации и наличия мелких PV-ir нейронов звездчатого и гранулярного типов в главном геникулореципиентном слое IHA/HI голубя (настоящие данные), вьюрка [8, 10], характерных для слоя IV первичной зрительной коры млекопитающих [69–78]. Эти отделы у птиц [11] и млекопитающих [69, 71, 73, 75, 76] характеризуются высокой активностью СО.
Сходство распространяется на существование в IHA/HI птиц (настоящие данные; [10, 22]) зоны, содержащей СВ-ir нейропиль и клетки, так же как в слое IV зрительной коры млекопитающих. Последний состоит из нескольких подслоев (А, В, С), лучше дифференцированных у приматов. Они получают проекции из слоев GLd, содержащих разные морфо-функциональные типы клеток, и, в свою очередь, сами имеют индивидуальные морфологические, нейрохимические и функциональные характеристики [77, 79]. Наряду с подслоями, содержащими PV-ir нейропиль и мелкие PV-ir звездчатые и гранулярные клетки, в слое IV выделены подслои с СВ-ir клетками и фиброзным нейропилем [70, 72, 77, 80]. Часть клеток с колокализацией СВ и GABA являются тормозными интернейронами, но другие, преимущественно слабо иммунореактивные, СВ-ir клетки, вероятно, имеют сходную функцию с PV-ir клетками, переключающими сигнализацию в супрагранулярные слои коры [80]. Таким образом, геникуло-телэнцефальный путь и у птиц, и у млекопитающих содержит параллельные, функционально различные, каналы, контролируемые разными СаВРr.
При проведении сравнительного анализа нельзя не учитывать вариабельности распределения PV- и CB-ir таламических проекций и клеток в сенсорных корковых зонах среди представителей дивергентных, особенно отдаленных, таксонов млекопитающих, коррелирует со столь же значительными различиями ламинарной организации неокортекса (размеры и степень дифференциации слоев, плотность клеток в них, колонковая организация) между представителями так называемых “низших” (архетипы) наземных млекопитающих (однопроходные, сумчатые, насекомоядные), водных китовых видов, обладающих 5-слойной агранулярной корой, и большинством видов “высших” плацентарных млекопитающих (грызуны, хищные, приматы, человек), которые обладают принципиально сходной гранулярной 6-слойной сенсорной корой. У “низших” млекопитающих (ехидна, утконос, сумчатый опоссум) и дельфинов в зрительной и других сенсорных зонах коры отсутствует или слабо развит гранулярный слой IV, но бóльшую толщину имеют супрагранулярные слои II, III, в которые у них проецируются в основном нейроны соответствующих релейных таламических ядер. В GLd у этих видов преобладают CB-ir нейроны, проецирующиеся в слои III/II зрительной коры, где их аксоны оканчиваются на апикальных дендритах пирамидных нейронов [71, 81–89]. Характерно, что у этих видов высокой активностью СО обладают супрагранулярные слои [83, 90], а не слой IV, как у других млекопитающих с 6-слойной корой I [73, 76]. Распределение CB- и PV-ir нейронов в НА и HD, где они перекрываются, трудно сопоставимо с их распределением в супра- и инфрагранулярных слоях зрительной коры у млекопитающих, у которых оно, так же как в слое IV, обнаруживает значительную межвидовую вариабельность [71, 73, 75, 76, 83, 84]. Вместе с тем среди них найдены нейроны, которые по морфо-ходологическим, нейрохимическим, включая экспрессию СаВРr, генным характеристикам сопоставимы с нейронами супра- и инфрагранулярных слоев зрительной коры млекопитающих.
Эволюционный консерватизм зрительной коры и ее дивергентная специализация среди амниот
Приведенные литературные данные о сходстве структурно-функциональной организации Wulst птиц и первичной зрительной коры млекопитающих свидетельствуют в пользу их гомологии. Это находит подтверждение в преобразованиях в филогенезе прекурсора зрительной коры у общего предка амниот. Птицы и млекопитающие произошли от предков двух кладов – зауропсид и синапсид соответственно, на которые разделились анцестральные рептилии. В линии зауропсид при переходе от предковых рептилий к птицам в паллиуме (Wulst) последних, не имеющем типичной для млекопитающих строгой ламинарной организации, уже сформирован слой (IHA), сопоставимый с гранулярным слоем IV коры млекопитающих. Другие отделы Wulst имеют скорее ядерно-ламинарную структуру; они содержат смешанную популяцию клеток, сопоставимых с нейронами других слоев коры млекопитающих. Многочисленные литературные данные о нейрональной организации Wulst и наши данные о распределении в нем PV- и CB-ir проекций и клеток различных типов подтверждают это представление.
Решающий аргумент в пользу гомологии паллиального Wulst птиц и зрительной коры млекопитающих получен в эмбриогенетических исследованиях. Была обнаружена общая нейрогенетическая программа развития ламинарной коры млекопитающих (мыши) и ядерно-ламинарного паллиума птиц (куры). Они обладают принципиально сходным набором основных типов корковых нейронов, очевидно унаследованным от общего предка птиц и млекопитающих. Таким образом, ламинарно-специфичные нейроны коры эволюционно предшествуют развитию их ламинарной организации. Появление ее у млекопитающих вызвано серией изменений процессов нейрогенеза и миграции в ходе индивидуального развития под влиянием внешних факторов. Благодаря этим изменениям произошло распределение по слоям прежде преимущественно гомогенно рассеянных множественных типов нейронов в этих неокортикальных зонах [88, 91, 92].
В синапсидной линии у рептилий в паллиуме сформирована 3-слойная дорсальная кора (прекурсор неокортекса), в которой таламические афференты оканчиваются в поверхностном слое (1) на апикальных дендритах нейронов глубокого клеточного слоя (2), сопоставимых соответственно со слоями I и V/VI в коре млекопитающих [87, 88, 93–95]. До недавнего времени считалось, что преобразование дорсальной коры предковых рептилий при переходе к млекопитающим состояло в появлении отсутствующего у рептилий гранулярного слоя IV, который становится у млекопитающих главным таламореципиентным слоем, и в добавлении слоев II и III [87, 88, 94–96]. Новые молекулярно-генетические данные, полученные в исследовании конечного мозга аллигатора, близкородственного птицам вида (архозавры), не подтвердило это представление [27]. В дорсальной коре аллигатора найдены нейроны, имеющие общие гены со всеми типами неокортикальных нейронов млекопитающих. В медиальном отделе клеточного слоя описаны две дискретные зоны: одна, содержащая входные клетки, генетически сходные с таламореципиентными клетками IHA, и слоя IV зрительной коры млекопитающих, другая, содержащая клетки, сходные с выходными нейронами НА птиц, и инфрагранулярного слоя V коры млекопитающих. В латеральном отделе клеточного слоя обнаружены клетки, имеющие общие генные маркеры с клетками дорсального мезопаллиума (HD по [6]), формирующие интрапаллиальные связи, так же как клетки слоев II и III в коре млекопитающих. Детальное рассмотрение гомологии Wulst и дорсальной коры аллигатора представлено в работе Briscoe, Ragsdale, 2018) [27]. Клетки, имеющие общие гены с клетками гранулярного слоя IV млекопитающих, были найдены в дорсальной коре другого вида рептилий черепах [67]. Вместе с тем исследование генных маркеров паллиума в эмбриогенезе ящерицы привело к иному выводу о неокортикальном прекурсоре [97]. Он представлен у ящериц небольшой областью в ростральном, медиодорсальном отделе, сравнимой по топографии с Wulst птиц, и по генным клеточным маркерам с Wulst и неокортексом млекопитающих. Большая часть дорсальной коры ящериц согласно представлению этих авторов [97] сравнима с гиппокампом и энторинальной корой. Авторы распространяют это представление и на другие виды рептилий, хотя оно не согласуется с данными о наличии прямых геникуло-кортикальных проекций в дорсальной коре черепах и ящериц, тогда как таламические проекции к предполагаемому в работе гомологу неокортекса ящериц не известны.
ЗАКЛЮЧЕНИЕ
Множественные различные пути специализации зрительной таламофугальной системы в дивергентных таксонах млекопитающих, птиц и рептилий обусловлены влиянием функциональных (эпигенетических) факторов, связанных с разнообразными экологическими нишами обитания разных видов. Различия специализации нашли отражение в огромной вариабельности организации этой системы, особенно ее кортикальных центров, у млекопитающих и зауропсидных амниот. Вместе с тем эволюционно консервативной чертой таламофугальной системы всех амниот является наличие в ней параллельных структурно-функциональных каналов, источниками которых служат сходные типы ганглиозных клеток сетчатки, дискретно проецирующихся в GLd у птиц и млекопитающих [39, 98]. У последних они представлены известными Х/Р, Y/M и W/K ретино-геникуло-кортикальными путями. Есть основания предполагать, что индивидуальные функции этих каналов у птиц, так же как у млекопитающих [43, 69, 99] обеспечиваются разными типами кальций-связывающих протеинов. Заслуживает дальнейшего изучения тот факт, что, несмотря на преобладание в главном проекционном ядре GLd голубя (DLL) CB-ir нейронов, зона PV-ir терминального нейропиля и PV-ir мелких клеток в таламореципиентном отделе Wulst (IHA/HI) более значительна, чем зона калбиндин-позитивной иннервации. В этой связи важно отметить, что выявленные в Wulst раздельные зоны представительства полей сетчатки получают афференты от популяций разных проекционных клеток в подъядрах GLd [39], но неизвестно, отличаются ли они экспрессией PV и СВ. Выявить в GLd птиц клетки-источники PV- и CB-ir проекций, их локализацию в Wulst, определить их принадлежность к проекционным или локальным типам нейронов – предмет дальнейших исследований.
Список литературы
Karten H.J. The organization of the avian telencephalon and some speculation on the phylogeny of the amniote telencephalon. Ann. N.Y. Acad. Sci. 167: 164–179. 1969.
Karten H.J. Homology and evolutionary origin of the “neocortex”. Brain Behav. Evol. 38: 264–272. 1991.
Karten H.J., Hodos W., Nauta W.J., Revzin A.M. Neural connections of the “visual Wulst” of the avian telencephalon. Experimental studies in the pigeon (Columba livia) and owl (Speotyto cunicularis). J. Comp. Neurol. 150: 253–278. 1973.
Shimizu T., Karten H.J. Central visual pathways in reptiles and birds: evolution of the visual system. In: Vision and Visual Disfunction. 2. Boston: CRP Press. 421–441. 1991.
Butler A.B., Hodos W. Comparative Vertebrate Neuroanatomy. Evolution and Adaptation. 2-nd Edition. Hoboken, New Jersey: Wiley-Interscience. 2005.
Reiner A., Perkel D.J., Bruce L.L., Butler A.B, Csillag A., et al. Avian Brain Nomenclature Forum. Revised nomenclature for avian telencephalon and some other related brainstem nuclei. J. Comp. Neurol. 473: 377–414. 2004.
Jarvis E.D.,Güntürkün O., Bruce L., Csillag A., Karten H.J., Kuenzel W., Medina L., et al. Avian brains and a new understanding of vertebrate brain evolution. Nat. Rev. Neurosci. 6: 151–159. 2005.
Braun K., Scheich H., Schachner M., Heizmann C.W. Distribution of parvalbumin, cytochrome oxidase activity and [14C] 2-deoxyglucose uptake in the brain zebra finch II Visual system. Cell Tissue Res. 240: 117–127. 1985.
Heizmann C.W., Braun K. Calcium-binding proteins: molecular and functional aspects. In: The Role of Calcium in Biological Systems. Roca Raton, FL: CRC Press Inc. 21–55. 1990.
Heyers D., Manns M., Luksch H., Güntürkün O., Mouritsen H. Calcium-binding proteins label functional streams of the visual system in a songbird. Brain Res. Bull. 75: 324–355. 2008.
Белехова М.Г., Кенигфест Н.Б., Чудинова Т.В. Активность цитохромоксидазы в центрах тектофугального и таламофугального каналов зрительной системы голубя. Журн. эвол. биохим. и физиол. 47: 73–84. 2011. [Belekhova M.G., Kenigfest N.B., Chudinova T.V. Activity of cytochrome oxidase in centers of tectofugal and thalamofugal tracts of the visual system of pigeon Columbia livia . J. Evol. Biochem. Physiol. 47 (1): 83–96. 2011. (In Russ)].
Belekhova M.G., Chudinova T.V., Rio J-P., Tostivint H., Vesselkin N.P., Kenigfest N.B. Distribution of calcium-binding proteins in the visual thalamic nuclei and related pretectal and mesencephalic nuclei in pigeons. Phylogenetic and functional determinating factors. Brain Res. 1631: 165–193. 2016.
Белехова М.Г., Васильев Д.С, Кенигфест Н.Б., Чудинова Т.В. Кальций-связывающие протеины и активность цитохромоксидазы в энтопаллиуме голубя. Сравнительный анализ межвидовой вариабельности и обсуждение в связи с дискуссией о гомологии энтопаллиума птиц. Журн. эвол. биохим. и физиол. 54: 60–72. 2018. [Belekhova M.G., Vasilyev D.S., Kenigfest N.B., Chudinova T.V. Calcium-binding proteins and cytochrome oxidase activity in the pigeon entopallium: a comparative analysis of interspecies variability as related to the discussion on avian entopallium homology. J. Evol. Biochem. Physiol. 54: 60–72. 2018. (in Russ.).]
Manns M., Freund N., Gűntűrkűn O. Development of the diencephalic relay structures of the visual thalamofugal system in pigeons. Brain Res. Bull. 66: 424–427. 2008.
Metzger M., Fernandez M.O., Miziara Ribeiro L.A., Baro J. Neuroanatomy of visual and auditory areas of the forebrain and thalamus of the barn owl. 6-th European Conference of Comparative Neurobiology, Valencia. 2010. 63.
Pfeiffer C.P., Britto L.R. Distribution of calcium-binding proteins in the chick visual system. Braz. J. Med. Biol. Res. 30: 1315–1318. 1997.
Wong-Riley M.T. Changes in the visual system of monocularly sutured or enucleated cats demonstrable with cytochrome oxidase histochemistry. Brain Res. 171: 11–28. 1979.
Gűntűrkűn O., Karten H.J. An immunocytochemical analysis of the lateral geniculate complex in the pigeon (Columba livia). J. Comp. Neurol. 314: 721–749. 1991.
Karten H.J., Hodos W. A stereotaxic atlas of the brain of the pigeon (Columba livia). Baltimore: J. Hopkins Press. 1967.
Обухов Д.К. Современные представления о структурно-функциональной организации конечного мозга птиц. Труды Санкт-Петербургского общества естествоиспытателей. Морфогенез и реактивная перестройка нервной системы. 76: 113–133. 1996. [Obuhov D.K. Sovremennye predstavleniya o strukturno-funkcional’noj organizacii konechnogo mozga ptic. Trudy Sankt-Peterburgskogo obshchestva estestvoispytatelej. Morfogenez i reaktivnaya perestrojka nervnoj sistemy. 76: 113–133. 1996.]
Dubbeldam J.L. Birds. In: The Central Nervous System of Vertebrates. 3. Springer: Berlin, Heidelberg: 1525–1636. 1998.
Suarez J., Davila J.C., Real M.A., Guirado S., Medina L. Calcium-binding proteins, neuronal nitric oxide, and GABA help to distinguish different pallial areas in the developing and adult chicken. I. Hippocampal formation and hyperpallium. J. Comp. Neurol. 497: 751–771. 2006.
Medina L. Do birds and reptiles possess homologues of mammalian visual, somatosensory, and motor cortices?. In: Evolution of Nervous Systems. 2 Non-mammalian vertebrates. Amsterdam and oth: Acad. Press. 164–185. 2007
Iwaniuk A.N., Wylie D.R.W. The evolution of stereopsis and the Wulst in caprimulgiform birds: a comparative analysis. J. Comp. Physiol. A Neuroethol. Sens. Neural Behav. Physiol. 192: 1313–1326. 2006.
Wylie D.R., Gutiérrez-Ibáňez C., Iwaniuk A. Integrating brain, behavior, and phylogeny to understand the evolution of sensory systems in birds. Front. Neurosci. 9: 281. 2015. doi: 19.3389. fnins.2015. é00281.
Jarvis E.D., Yu J., Rivas M.V., Horita H., Feenders G., Whitney O. et al. Global view of the functional molecular organization of the avian cerebrum: mirror images and functional columns. J. Comp. Neurol. 521: 3614–3665. 2013.
Briscoe S.D., Ragsdale C.W. Molecular anatomy of the alligator dorsal telencephalon. J. Comp. Neurol. 526: 1613–1646. 2018.
Miceli D., Gioani H., Repérant J., Peyrichoux J. The avian visual system. I. An anatomical study of afferent and efferent pathways. II. An electrophysiological study of the functional properties of single neurons. In: Neural Mechanisms of Behavior in the Pigeon. Plenum Publ. Corp. 223–254. 1979.
Nixdorf B.E., Bischof H-J. Afferent connections of the ectostriatum and visual Wulst in the zebra finch (Taeniopyggia guttata Gould) an HRP study. Brain Res. 248: 9–17. 1982.
Watanabe M., Ito H., Masai H. Cytoarchitecture and visual receptive neurons in the Wulst of japanise quail (Coturnix coturnicx japonica). J. Comp. Neurol. 213: 188–198. 1983.
Bagnoli P., Burkhalter A. Organization of the afferent projections to the Wulst in the pigeon. J. Comp. Neurol. 214: 103–113. 1983.
Ehrlich D., Stuchbery J. A note on the projection from the rostral thalamus to the visual hyperstriatum of the chicken (Gallus gallus). Exp. Brain Res. 62: 207–211. 1986.
Bagnoli P., Fontanesi G., Casini G., Porciatti V. Binocularity in the little owl, Athene noctua. I. Anatomical investigation of the thalamo-Wulst pathway. Brain Behav. Evol. 35: 31–39. 1990.
Miceli D., Marchand L., Repérant J., Rio J-P. Projections of the dorsolateral anterior complex and adjacent thalamic nuclei upon the visual Wulst in the pigeon. Brain Res. 518: 317–323. 1990.
Wu C.C., Karten H.J. The thalamohyperstriatal system is established by the time of hatching in chicks (Gallus gallus): a cholera toxin B subunit study. Vis. Res. 15: 349–358. 1998.
Koshiba M., Yohda M., Nakamura S. Topological relation of chick thalamofugal visual projections with hyperpallium revealed by three color tracers. Neurosci. Res. 52: 235–242. 2005.
Miceli D., Repérant J., Ward R., Rio J-P., Jay B., Medina M., Kenigfest N.B. Fine structure of the visual dorsolateral anterior thalamic nucleus of the pigeon (Columba livia): a hodological and GABA-immunocytochemical study. J. Comp. Neurol. 507: 1351–1378. 2008.
Krubichler Q., Vega-Zuniga T., Morales C., Luksch H., Marin G. The visual system of paleognathous bird: visual field, retina, topography and retino-central connections in the Chilean tinamou (Nothoprocta perdicaria). J. Comp. Neurol. 523: 226–250. 2015.
Bischof H.J., Eckmeier D., Keary N., Lowel S., Mayer U., Michael N. Multiple visual representation in the visual Wulst of a laterally eyed bird, the zebra finch (Taeniopygia guttata). PLoS One. 2016. 11. e0 154927. doi:10.137.
Boxer M.I., Stanford D. Projections to the posterior visual hyperstriatal region in the chick: an HRP study. Exp. Brain Res. 57: 494–498. 1985.
Trottier C., Repérant J., Miceli D. Anatomical evidence of a retino-thalamo-hippocampal pathway in the pigeon (Columba livia). J. Hirnforsch. B. 36. S. 489–500. 1995.
Heyers D., Manns M., Luksch H., Gűntűrkűn O., Mountsen H. A visual pathway links brain structures active during magnetic compass orientation in migratory birds. PloS ONE. 2: e. 937. doi: 10.137. 2007.
Felch D.L., Van Hooser S.D. Molecular compartmentalization of lateral geniculate nucleus in the gray squirrel (Sciurus carolinenesis). Front. Neuroanat. 6: 12. doi 10.3389. 2012.
Huber G.C., Crosby E.C. The nuclei and fibre paths of the avian diencephalon with consideration of telencephalic and certain mesencephalic centres and connections. J. Comp. Neurol. 48: 1–225. 1929.
Ahn J.H., Park J.H., Choi S.Y., Lee T-K., Cho J.H., Kim I.H., Lee J-C.,et al. The distribution of calbindin D-28k and parvalbumin immunoreactive neurons in the somatosensory area of the pigeon pallium. Anat. Histol. Embryol. 47: 64–70. 2018.
Tömbol T., Magloczky Z. Cytoarchitecture of chicken Wulst: a Golgi study on cell types and their maturation after hatching. Acta Morph. Hung. 38: 35–53. 1990.
Srivastava U.C., Gaur P. Naturally occuring neuronal plasticity in visual Wulst of the baya weaver, Ploceus phillipinus (Limnaeus, 1766) . Cell. Tissue Res. 352: 445–467. 2013.
Chand P., Maurya R.C., Srivastava U.C. Neuronal morphology and spine density of the visual Wulst of the strawberry finch Estrilda amandava. Proc. Nat. Acad. Sci. India Sect. B. Biol. Sci. 83: 627–642. 2013.
Bravo H., Pettigrew J.H. The distribution of neurons projecting from the retina and visual cortex to the thalamus and tectum opticum of the barn owl, Tyto alba, and Speotyto cunicularia. J. Comp. Neurol. 199: 419–441. 1981.
Revzin A.M. A specific visual projection area in the hyperstriatum of the pigeon (Columba livia). Brain Res. 15: 246–249. 1969.
Гусельников В.И., Моренков Э.Д., Хунь Д. К. Реакции и свойства рецептивных полей нейронов в зрительной проекционной зоне гиперстриатума голубя. Нейрофизиология. 8: 230–236. 1976. [Gusel’nikov V.I., Morenkov E.D., Hun’ D. K. Reactions and properties of receptive fields of neurons in a visual projective zone of a hyperstriatum . Nejrofiziologiya. 8: 230–236. 1976 (in Russ.).]
Моренков Э.Д., Хунь До Конг. Импульсные реакции нейронов гиперстриатального отдела мозга ворон Сorvus corone на зрительные стимулы. Журн. эвол. биохим. и физиол. 13: 69–74. 1977. [Morenkov E.D., Hun’ Do Kong. Pulse reactions of neurons of hyper striatum department of a brain of crows of Corvus corone to visual incentives. J. Evol. Biochem & physiol. 13: 69–74. 1977. (in Russ).]
Pettigrew J.D. Binocular visual pathway in the owls telencephalon. Proc. R. Soc. Lond. B Biol. Sci. 204: 435–454. 1979.
Pinto L., Baron J. Spatiotemporal frequency tuning dynamics of neurons in the owl visual Wulst. J. Neurophysiol. 103: 3424–36. 2010.
Hodos W., Bonbright J.C. Intensity difference thresholds in pigeon after lesion of the tectofugal and thalamofugal pathways. J. Comp. Physiol. Psychol. 87: 1013–31. 1974.
Budzynski C.A., Gagliardo A., Ioale P., Bingman V.P. Participation of the homing pigeon thalamofugal visual pathway in sun-compass associative learning. J. Neurosci. 15: 197–210. 2002.
Budzynski C.A., Bingman V.P. Participation of the thalamofugal visual pathway in a coarse pattern discrimination task in an open arena. Behav. Brain Res. 153: 543–556. 2004.
Shimizu T., Patton T.B., Husband S.A. Avian visual behavior and the organization o the telencephalon. Brain Behav. Evol. 75: 204–217. 2010.
Watanabe S., Mayer U., Bischof H.J. Visual Wulst analyses “where” and entopallium analyses “what” in zebra finch visual system. Behav. Brain Res. 222: 51–56. 2011.
Зорина З.А., Обидина Т.Г. Новые данные о мозге и когнитивных спообностях птиц. Биол. Бюл. 39: 601–617. 2012. [Zorina Z.A., Obidina T.G. New data about brain and cognitive abilities in birds. Biol. Byul. 39: 601–617. 2012 (in Russ).]
Nauta W.J.H., Karten H.J. A general profile of the vertebrate with side lights on the ancestry of cerebral cortex. In: The Neurosciences: Second Program. The Rockfeller Univ. Press. New York. 6–27. 1970.
Shimizu T., Cox K., Karten H.J. Intratelencephalic projections of the visual Wulst in pigeons (Columba livia). J. Comp. Neurol. 359: 551–572. 1995.
Reiner A. You are who you talk with – a commentary on Dugas-Ford et al. PNAS 2012. Brain Behav. Evol. 81: 146–149. 2013.
Karten H.J. Vertebrate brains and evolutionary connectomics: on the origins of mammalian “neocortex”. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 370 (1684). 2015. doi: 10. 1098/rstb, 2015. 0060.
Kumamoto T., Hanashima C. Neuronal subtype specification in establishing mammalian neocortical circuits. Neurosci. Res. 86: 37–49. 2014.
Dugas-Ford J., Powell J.J., Ragsdale C.W. Cell-type homologies and the origin of the neocortex. PNAS. 109: 16974–16979. 2012.
Dugas-Ford J., Ragsdale C.W. Levels of homology and problem of neocortex. Ann. Rev. Neurosci. 38: 351–368. 2015.
Wada K., Chen C-C., Jarvis E.D. Molecular profiling reveals insight into avian brain organization and functional columnar commonalities with mammals. In book: Brain Evolution by Design. Springer. 273–289. 2017.
Jones E.G. Viewpoint: the core and matrix of thalamic organization. Neurosci. 85: 331–345. 1998.
Goodchild K., Martin P.R. The distribution of calcium-binding proteins in the lateral geniculate nucleus and visual cortex of a New World monkey, the marmoset, Callithrix jacchus. Vis. Neurosci. 15: 625–642. 1998.
Hof P.R., Glezer I.I.,Conde F., Flagg R.A., Rubin M.B., Nimchinsky E.A., Vogt Weisenhorn D.M. Cellular distribution of the calcium-binding proteins parvalbumin, calbindin and calretinin in the neocortex of mammals: phylogenetic and developmental patterns. J. Chem. Neuronat. 16: 77–116. 1999.
Latawiec D., Martin K.A.C., Meskenaitl V. Termination of the geniculocortical projection in the striate cortex of macaque monkey: a quantitative immunoelectron microscopic study. J. Comp. Neurol. 419: 306–319. 2000.
Ishida J.M., Rosa M.G.P., Casagrande N.A. Does the visual system of the flying fox resemble that of primates? The distribution of calcium-binding proteins in the primary visual pathway of Pteropus poliocephalus. J. Comp. Neurol. 417: 73–87. 2000.
Park H-J., Lee S.N., Lim H.R., Kong J.H., Jeon C.J. Calcium binding proteins calbindin D 28k, calretinin, and parvalbumin in the rabbit visual cortex. Mol. Cells. 2000. 10: 206–212.
Wong P., Kaas J.H. Architectonic subdivisions of neocortex in the gray squirrel (Sciurus carolinensis). Anat. Rec. 291: 1301–1033. 2008.
Wong P., Kaas J.H. Architectonic subdivisions of neocortex in the tree shrew (Tupaia belangeri). Anat. Rec. 292: 994–1027. 2009.
Balaram P., Young N.A., Kaas J.H. Histological features of layers and sublayers in cortical visual areas V 1 and V 2 of shimpanzees, macaque monkeys, and human. Eye Brain. 6 (Suppl. 1): 5–18. 2014.
Kim H.G., Gu Y.N., Lee K.P., Kim C.W., Lee J.W., Jeong T., Jeon C.J. Immunocytochemical localization of the calcium-binding proteins calbindin D 28k, calretinin and parvalbumin in bat visual cortex. Histol. Histopathol. 31: 317–327. 2016.
Mulikin W.H., Jones J.P., Palmer L.A. Receptive-field properties and laminar distribution of X-like and Y-like simple cells in cat area 17. J. Neurophysiol. 52: 350–371. 1984.
Hendry S.H.C., Carder R.K. Neurochemical compartmentalization of monkey and human visual cortex similarities and variations in calbindin immunoreactivity across species. Vis. Neurosci. 10: 1109–1120. 1993.
Garey L.J., Winkelmann E., Brauer K. Golgi and Nissl studies of the visual cortex of the bottlenose dolphin. J. Comp. Neurol. 240: 305–321. 1985.
Morgane P.J., Glezer I.I., Jacobs M.S. Visual cortex of the dolphin: an image analysis study. J. Comp. Neurol. 273: 3–25. 1988.
Glezer I.I., Hof P.R., Morgane P.J. Comparative analysis of calcium-binding protein-immunoreactive neuronal populations in the auditory and visual systems of the bottlenose dolphin (Tursiops truncate) and the macaque monkey (Macaca fascicularis). J. Chem. Neuroanat. 15: 203–237. 1998.
Hof P.R., Sherwood C.C. The evolution of neuronal classes of the neocortex of mammals. In: Evolution of Nervous System. Amsterdam and oth: Acad. Press. 3: 114–124. 2007.
Furutani R. Laminar and cytoarchitectonic features of the cerebral cortex in the Rosso,s dolphin (Grampus griseus), striped dolphin (Stenella coeruleo alba) and bottlenose dolphin (Tursiops truncatus). J. Anat. 213: 241–248. 2008.
Butti C., Radhanti M.A., Sherwood C.C., Hof P.R. The neocortex of cetaceans: comparison with other aquatic and terrestrial species. Ann. N.Y. Acad. Sci. 1225: 47–58. 2011.
Kaas J.H. Neocortex in early mammals and its subsequent variations. Ann. N.Y. Acad. Sci. 1225: 28–36. 2011.
Kaas J.H. The evolution of brains from early mammals to human. Wires Cog. Sci. 4: 33–45. 2013.
Spocter M.A., Patzke N., Manger P. Cetacean brains. In: Reference Module in Neuroscience and Biobehavioral Psychology. Elsevier. 1–6. 2017.
Revishchin A.V., Garey L.J. Laminar distribution of cytochrome oxidase staining in cetacean isocortex. Brain Behav. Evol. 37: 355–367. 1991.
Suzuki I.K., Hirata T. Evolutionary conservation of neocortical neurogenetic program in the mammals and birds. Bioarchitecture. 2: 124–129. 2012.
Suzuki I.K., Hirata T. Neocortical neurogenesis is not really “neo”: a new evolutionary model derived from a comparative study of chick pallial development. Develop. Growth Differ. 55: 173–187. 2013.
Smith L.M., Ebner F.F., Colonnier M. The thalamocortical projection in Pseudemys turtles: a quantitative electron microscopic study. J. Comp. Neurol. 90: 445–461. 1980.
Reiner A. A comparison of neurotransmitter-specific and neuropeptide-specfic neuronal cell types present in the dorsal cortex in turtles with those present in the isocortex in mammals: implications for the evolution of isocortex. Brain Behav. Evol. 38: 53–91. 1991.
Ulinski P.S. Visual cortex of turtles. In: Evolution of Nervous System. Non-mammalian Vertebrates. Amsterdam and oth.: Acad. Press. 2: 195–203. 2007.
Treves A. Computational constraints that may have favoured the lamination of sensory cortex. J. Comput. Neurosci. 14: 271–282. 2003.
Desfilis E., Abellán A., Sentandren V., Medina L. Expression of regulatory genes in the embryonic brain of lizard and implications for understanding pallial organization and evolution. J. Comp. Neurol. 526: 166–202. 2018.
Chen Y., Naito J. Morphological properties of chick retinal ganglion cells in relation to their central projections. J. Comp. Neurol. 514: 117–130. 2009.
Johnson J.K., Casagrande V.A. Distribution of calcium-binding proteins within the parallel visual pathways of a primate (Galago crassicaudatus). J. Comp. Neurol. 356: 238–260. 1995.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


