Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 5, стр. 324-330
ВИДОВЫЕ ОСОБЕННОСТИ АКТИВНОСТИ НЕКОТОРЫХ ФЕРМЕНТОВ ГОНАД ЧЕРНОМОРСКИХ РЫБ
И. И. Чеснокова 1, *, И. И. Руднева 1
1 Институт морских биологических исследований им А.О. Ковалевского РАН
Севастополь, Россия
* E-mail: mirenri@bk.ru
Поступила в редакцию 09.12.2018
После доработки 27.02.2019
Принята к публикации 26.04.2019
Аннотация
Установлены существенные межвидовые различия активности аминотрансфераз (аланинаминотрансферазы КФ 2.6.1.2 (АЛТ) и аспартатаминотрансферазы КФ 2.6.1.1 (АСТ) и щелочной фосфатазы КФ 3.1.3.1 (ЩФ)) в гонадах 7 видов черноморских рыб в период покоя и нереста. У большинства видов активность аминотрансфераз была выше в гонадах рыб на стадии покоя по сравнению с периодом нереста, тогда как активность ЩФ имела обратную зависимость. Максимальная активность ферментов отмечена в гонадах мерланга, что может быть обусловлено его нерестом в зимний период. Не установлено выраженных различий тестируемых показателей между видами, принадлежащими к разным экологическим группам. Активность аминотрансфераз и ЩФ в гонадах рыб может служить удобным и эффективным маркером как особенностей формирования половых желез и процессов, происходящих в них в разные периоды репродуктивного цикла, так и показателем адаптационных возможностей видов к неблагоприятным условиям среды обитания, в том числе к антропогенному загрязнению.
ВВЕДЕНИЕ
Изучение межвидовых различий биохимических показателей водных организмов позволяет понять многообразие их адаптаций в разных биотопах в современных условиях. Эти отличия проявляются в разных тканях по-разному и связаны со спецификой их строения и выполняемых функций. Помимо этого, активность ферментов в органах и тканях может отражать состояние здоровья рыб, что особенно важно для диких популяций, живущих в зонах интенсивной хозяйственной деятельности человека, но информация об этом ограничена.
Авторами показаны особенности активности некоторых пищеварительных ферментов и их функционирования при разных температурных режимах в кишечнике нескольких видов пресноводных рыб, относящихся к разным экологическим группам [1]. Установлена высокая степень тканеспецифичности активности антиоксидантных ферментов, которая варьирует в широких пределах у разных морских рыб и беспозвоночных в зависимости от их филогенетического положения, видовой и экологической принадлежности, возраста и пола [2–6]. Выявлены существенные колебания активности ЩФ в тканях 35 видов морских беспозвоночных дальневосточных морей [7] и в печени черноморских рыб [8], а также активности холинэстераз [9] и аминотрансфераз [10].
Исследованию активности ферментов в гонадах рыб уделено гораздо меньше внимания, которое в основном направлено на анализ процессов гаметогенеза. В то же время, в связи с необходимостью сохранения биоразнообразия естественных популяций и выяснения факторов, на него влияющих, изучение разных аспектов воспроизводства, которое непосредственно связано с состоянием генеративного материала, приобретает особое значение. В этом плане анализ процессов, протекающих в гонадах рыб, включая ферментативные реакции, может дать информацию о состоянии половых желез, их функционировании на разных стадиях репродуктивного цикла и особенностях его протекания у представителей разных видов рыб [4, 11]. Изучение активности аминотрансфераз – ферментов, связывающих белковый и углеводный обмен, позволяет понять процессы роста и развития всего организма, в том числе созревания гонад. Не менее информативна активность ЩФ, катализирующей гидролиз эфирных связей с образованием неорганических фосфатов. Фермент присутствует в высоких концентрациях в печени, костях, кишечном эпителии и плаценте млекопитающих. Однако сведения об этом ферменте у низших позвоночных ограничены, тогда как некоторые данные свидетельствуют о необычных и специфических свойствах ЩФ, выделенных из гонад и яйцеклеток морского ежа [7], которые сохраняли активность в морской воде. Активность этих ферментов широко варьирует в тканях животных, в том числе зависит от возраста и разных патологических состояний, а также наличия токсикантов в среде. В связи с этим исследование видоспецифических особенностей активности ферментов в гонадах низших позвоночных, которые могут отражать характер процессов, происходящих в половых железах рыб в разных условиях существования и в разные периоды годового цикла, представляет несомненный интерес.
На этом основании целью настоящей работы явилось сравнительное исследование активности аминотрансфераз и ЩФ в гонадах семи видов самок черноморских рыб, относящихся к разным экологическим группам, в период покоя и во время нереста.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Объектами исследования служили 7 видов рыб (глосса (Platichthys luscus (Pallas, 1814)), европейский звездочет (Uranoscopus scaber Linnaeus, 1758), морской ерш (Scorpaena porcus Linnaeus, 1758), зеленушка рулена (Symphodus tinca (Linnaeus, 1758)), спикара (Spicara flexuosa Rafinesque, 1810), мерланг черноморский (Merlangus merlangus euxinus (Nordmann, 1840), черноморская ставрида (Trachurus mediterraneus ponticus Aleev, 1956), которых отлавливали в прибрежных водах г. Севастополя (Черное море) в период 2012–2014 гг. Некоторые особенности биологии исследуемых видов представлены в табл. 1.
Биологический анализ рыб
Проводили полный биологический анализ рыб [14]. Гонады извлекали, определяли стадию репродуктивного цикла, замораживали и хранили при температуре –20° С не более месяца в индивидуальных емкостях. Исследования проводили на особях, гонады которых находились на стадии покоя и нереста. К гонадам на стадии покоя по шкале зрелости относили особей со следующими стадиями II, II–III и VI–II, к гонадам на стадии нереста – IV–V и V.
Биохимические исследования
Для биохимического анализа ткани гонад измельчали, гомогенизировали в холодном 0.85%-ном растворе хлорида натрия, центрифугировали при 8000 об/мин. Определение активности ферментов проводили в экстракте тканей с использованием стандартных наборов реактивов “АЛТ-РФ-ОЛЬВЕКС”, “АСТ-РФ-ОЛЬВЕКС”, “ЩФ-РФ-ОЛЬВЕКС” (Россия). Активность ферментов выражали в мкмоль/(мг × час) и нмоль/(мг × с) в расчете на сырое вещество, для аминотрансфераз и ЩФ соответственно.
Полученные данные пересчитывали с учетом содержания белка в экстрактах тканей. Концентрацию белка определяли с использованием стандартного набора реактивов “ОБЩИЙ БЕЛОК-ОЛЬВЕКС”.
Статистический анализ
Результаты обрабатывали статистически, вычисляли среднее арифметическое и стандартную ошибку среднего, нормальность выборки проверяли с применением W-критерия Шапиро–Уилка, достоверность различий между выборками проводили с применением U-критерия Манна–Уитни. Различия считали достоверными при p ≤ 0.05. Корреляционный анализ между активностью исследуемых ферментов в гонадах рыб проводили с помощью компьютерной программы CURFVIT (Version 2.10-L). Корреляционный анализ проводился между средними арифметическими значениями активности каждого конкретного фермента (АЛТ, АСТ, ЩФ) у исследуемых видов рыб в период покоя и в период нереста, и между средними арифметическими значениями активности двух ферментов отдельно в период покоя и отдельно в период нереста.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Минимальная активность АЛТ отмечена в гонадах самок европейского звездочета на стадии покоя (0.061 ± 0.013 мкмоль/(мг × час) и у самок глоссы на стадии нереста (0.01 ± 0.007 мкмоль/(мг × час), максимальная активность фермента как на стадии покоя, так и на стадии нереста обнаружена в гонадах самок мерланга (0.328 ± 0.071 и 0.176 ± ± 0.021 мкмоль/(мг × час соответственно) (рис. 1). В яичниках большинства исследуемых видов (за исключением морского ерша) активность фермента проявляла тенденцию к повышению у рыб, находящихся на стадии покоя, а у спикары и черноморской ставриды этот показатель достоверно возрастал.
Рис. 1.
Активность аланинаминотрансферазы в гонадах самок черноморских рыб. Обозначения: по оси абсцисс – виды рыб, по оси ординат – активность аланинаминотрансферазы, мкмоль/(мг × час). * – различия ферментативной активности на стадиях покоя и нереста достоверны при p ≤ 0.05.
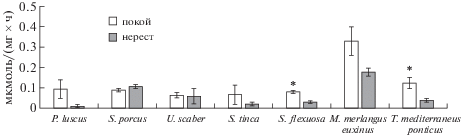
Четко выраженной зависимости активности фермента от принадлежности вида к определенной экологической группе не отмечено. Активность фермента в гонадах самок мерланга на обеих стадиях репродуктивного периода достоверно различается по отношению к соответствующим параметрам других тестируемых рыб, различия между которыми выражены в меньшей степени. Достоверная разница активности фермента была установлена в гонадах европейского звездочета на стадии нереста по сравнению с другими рыбами и по сравнению с морским ершом на стадии покоя. Достоверные отличия в активности АЛТ также получены при сравнении глоссы со спикарой и черноморской ставридой на стадии нереста, и черноморской ставриды с мерлангом на обоих стадиях. Показана умеренная корреляция между активностью АЛТ в гонадах рыб на двух стадиях развития половых желез, r = 0.62.
Изменения активности АСТ в гонадах исследуемых видов рыб сходны с таковой для активности АЛТ: самая низкая активность фермента обнаружена в гонадах самок европейского звездочета на стадии покоя (0.051 ± 0.012 мкмоль/(мг × час) и самок глоссы на стадии нереста (0.016 ± ± 0.006 мкмоль/(мг × час), самая высокая – на обеих стадиях годового цикла в гонадах самок мерланга (0.402 ± 0.055 и 0.129 ± 0.019 мкмоль/(мг × час) (рис. 2). Активность АСТ в гонадах рыб на стадии покоя (за исключением морского ерша и европейского звездочета) проявляет тенденцию к повышению, которая достоверно выражена у спикары, мерланга и черноморской ставриды.
Рис. 2.
Активность аспартатаминотрансферазы в гонадах самок черноморских рыб. Обозначения: по оси абсцисс – виды рыб, по оси ординат – активность аспартатаминотрансферазы, мкмоль/(мг × час). * – различия ферментативной активности на стадиях покоя и нереста достоверны при p ≤ 0.05.
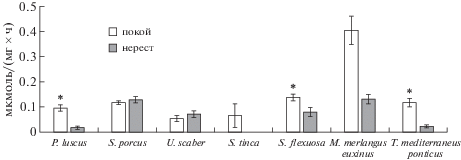
Межвидовые вариации активности АСТ в гонадах рыб проявляются в большей степени по сравнению с АЛТ. Активность фермента в гонадах глоссы и мерланга достоверно отличалась на исследуемых стадиях развития половых желез по сравнению с другими рыбами, за исключением зеленушки рулены и черноморской ставриды. Активность фермента в яичниках европейского звездочета имела достоверные различия с соответствующими параметрами всех тестируемых рыб, кроме зеленушки рулены, как в период нереста, так и в период покоя. Также установлены достоверные отличия в активности АСТ в гонадах черноморской ставриды на стадии нереста по сравнению морским ершом, спикарой и мерлангом.
Корреляция между активностью АСТ в гонадах рыб на стадии покоя и нереста существенно ниже (r = 0.16) по сравнению с АЛТ. Однако между активностью АЛТ и АСТ выявлена высокая корреляция в период покоя r = 0.95 и в период нереста r = 0.69.
Минимальная активность ЩФ обнаружена в гонадах европейского звездочета как в покое (59.5 ± ± 25.1 нмоль/(мг × с)), так и в период нереста (159 ± 59 нмоль/(мг × с)), максимальная – в гонадах зеленушки рулены на стадии покоя (803.6 ± ± 182.5 нмоль/(мг × с)) и в гонадах нерестящегося мерланга (1671.85 ± 265.9 нмоль/(мг × с)) (рис. 3). В отличие от активности аминотрансфераз, активность ЩФ выше у нерестящихся рыб, нежели у тех, чьи гонады находятся в стадии покоя, однако достоверные отличия получены только для морского ерша (р < 0.05).
Рис. 3.
Активность щелочной фосфатазы в гонадах самок черноморских рыб. Обозначения: по оси абсцисс – виды рыб, по оси ординат – активность щелочной фосфатазы, нмоль/(мг × с). * – различия ферментативной активности на стадиях покоя и нереста достоверны при p ≤ 0.05.
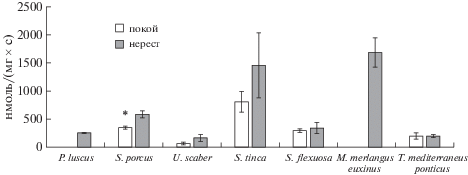
Активность фермента достоверно различается в гонадах глоссы на стадии нереста по сравнению с соответствующими показателями морского ерша, мерланга и черноморской ставриды. Существенные отличия данного показателя выявлены при сравнении данных морского ерша с европейским звездочетом на обеих стадиях, зеленушки рулены на стадии покоя, и спикары и мерланга на стадии нереста. Активность фермента в гонадах черноморской ставриды имела достоверные различия по сравнению со всеми видами, кроме спикары на обеих стадиях и европейским звездочетом на стадии покоя. Достоверная разница в активности ЩФ получена при сравнении показателей европейского звездочета на обеих стадиях с зеленушкой руленой, со спикарой на стадии покоя и мерлангом на стадии нереста. Также получена достоверность различий при сопоставлении активности ЩФ в гонадах зеленушки рулены и спикары на стадии покоя и спикары с мерлангом на стадии нереста.
Установлена корреляция между активностью фермента в период нереста и покоя r = 0.57. Между активностью аминотрансфераз и ЩФ в гонадах исследуемых видов рыб взаимосвязи не обнаружено.
ОБСУЖДЕНИЕ
Данные об активности аминотрансфераз в гонадах рыб немногочисленны. Можно предположить, что наличие аминотрансфераз в органах размножения и их участие в процессах созревания половых продуктов является древним признаком, так как у предшественника хордовых ланцетника Branchiostoma belcheri АЛТ обнаружена только в печеночном дивертикулуме и в гонадах, но отсутствует в остальных тканях, как у других хордовых [15]. Видовые отличия активности аминотрасфераз во многом являются результатом эволюционного процесса и отражают особенности приспособления видов к условиям жизни, что подтверждается значительной вариабельностью показателей у летненерестящихся рыб.
В данном исследовании изучали виды, характеризующиеся разными экологическими особенностями. Среди них были как оседлые формы (морской ерш), так и совершающие длительные миграции (черноморская ставрида), постоянно перестраивающие свой метаболизм, адаптируясь к новым условиям среды. У большинства видов (морской ерш, черноморская ставрида, мерланг, глосса, европейский звездочет, зеленушка рулена) половая принадлежность остается постоянной на протяжении всей жизни, и какие-либо изменения в гонадах связаны в основном со сменой стадий репродуктивного цикла. Однако у спикары на 3–4-м году жизни имеет место инверсия пола и на фоне сезонных изменений в гонадах происходит перестройка тканей из яичников в семенники. На активность ферментов существенное влияние оказывает возраст, при котором наступает первый нерест. Спикара достигает половой зрелости на первом-втором году жизни, мерланг – на втором, морской ерш и глосса – на третьем. Необходимо учитывать и тот факт, что у рассматриваемых видов время нереста отличается. Мерланг и глосса являются зимненерестящимися, прочие же размножаются в летний период. Тем не менее различия в активности ферментов в гонадах как среди первых, так и среди вторых существенны. Так у морского ерша, зеленушки рулены и спикары, нерест которых протекает с мая по июнь, выявлены как межвидовые отличия в активности аминотрансфераз, так и разница в исследуемых показателях на стадиях покоя и нереста: отсутствие достоверных отличий у морского ерша, и достоверно более низкие значения активности ферментов при нересте по сравнению с покоем у зеленушки-рулены и спикары. На активность ферментов в тканях животных влияет и скорость их метаболизма, обусловленная двигательной активностью. Морской ерш, европейский звездочет и глосса являются донными рыбами, ведущими малоподвижный образ жизни, однако и здесь наблюдаются различия: у первых двух видов отсутствуют достоверные отличия в активности аминотрансфераз в два исследуемых периода, а у глоссы они более выражены. В то время как у активных пловцов – черноморской ставриды, спикары и мерланга – установлена схожая тенденция – более высокие значения активности ферментов в период покоя.
В период нереста половые железы являются основным поставщиком аминотрансфераз [16]. Однако в наших исследованиях активность этих ферментов существенно выше в гонадах рыб, находящихся на стадии покоя, что, по-видимому, обусловлено завершением активных ростовых процессов в яичниках к периоду нереста. Кроме того, отмеченные нами межвидовые вариации активности аминотрансфераз могут быть следствием разного питания рыб, что существенно влияет как на активность ферментов, так и на развитие гонад [17], а также действием загрязнения среды обитания или наличием токсикантов в корме [18–20].
Очевидно, гормональный статус самок рыб варьирует в зависимости от стадии репродуктивного цикла, и, следовательно, меняется и состояние ферментных систем. Тем не менее данных, касающихся действия стероидных гормонов на активность аминотрансфераз, крайне мало. Известно, что под влиянием гормонов (тестостерона, прогестерона, синтетического эстрогена) у мозамбикской тиляпии Oreochromis mossambicus активность АЛТ и АСТ стимулировались или ингибировались [21], в то время как на неоплодотворенные икринки вьюна Misgurnus fossilis эстрон не оказывал никакого влияния [22].
У морских животных ЩФ играет важную роль в клеточном обмене фосфатов, в том числе сопряженных с процессами их абсорбции из морской воды. Эти ферменты участвуют в процессах оплодотворения и эмбриогенеза, в частности, у морских ежей [7]. Активность ЩФ у многих видов костистых рыб на всех стадиях развития гонад была обнаружена гистохимическими методами [21]. У большинства форм в созревших яичниках она была существенно выше, чем в железах на стадии покоя, что обусловлено участием данного фермента в процессе синтеза белков, необходимых для формирования икры. Однако после окончания этого процесса в зрелых яичниках роль фермента незначительна, и происходит снижение его активности [23]. В наших исследованиях также была отмечена тенденция увеличения активности фермента в яичниках нерестящихся рыб, что согласуется с данными других авторов, показавших эту закономерность в гонадах самок радужной форели Oncorhynchus mykiss, лягушкового клариевого сома Clarias batrachus, темного магхеда Tor chelynoides [24]. Такая же тенденция была обнаружена у 6 видов сельдевых, у которых активность фермента в созревающих яичниках была 2–3 раза выше, чем в гонадах этих видов на стадии покоя [23]. Активность ЩФ в зрелых половых железах снижалась, но оставалась выше по сравнению с соответствующими показателями незрелых гонад. Авторы отметили, что чем больше размеры икринок у рыб, тем ниже активность фермента, но в наших исследованиях этот факт не нашел подтверждения.
Установлено, что активность фермента в гонадах самок рыб варьировала в широких пределах, но при этом не выявлено ее зависимости от принадлежности рыб к определенной экологической группе, от размера и типа икринок (демерсальные или пелагические), от плодовитости рыб (табл. 1). Другим фактором, определяющим активность ферментов, является подвижность организмов. Так, авторами показано, что в тканях пелагического новозеландского кальмара активность ЩФ была выше, нежели у малоподвижного командорского вида, обитающего в придонном слое [25]. Но в нашем исследовании такой тенденции не выявлено: у более подвижной пелагической черноморской ставриды активность как ЩФ, так и аминотрансфераз ниже, нежели у донного хищника-засадчика – морского ерша.
Таблица 1.
Биологическая характеристика исследуемых видов и количество исследованных особей
| Вид | Экологическая группа [12, 13] | Нерест [12, 13] | Плодовитость [12, 13] | Икра* [12, 13] | Общая длина, см⚫ (наши данные) | Масса рыб, г⚫(наши данные) | Возраст, годы (наши данные) | Кол-во особей** (наши данные) |
|---|---|---|---|---|---|---|---|---|
| Platichthys luscus | донный | январь-март | от 105 тыс. до 2.5 млн. | $\frac{{1.1}}{{\text{П}}}$ | $\frac{{17.7--22.5}}{{19.7 \pm 1.1}}$ | $\frac{{59--108}}{{77 \pm 16}}$ | 2–4 | $\frac{2}{2}$ |
| Uranoscopus scaber | донный | май-август | от 18 до 125 тыс. | $\frac{{1.9}}{{\text{П}}}$ | $\frac{{16.2--23.8}}{{20.3 \pm 0.4}}$ | $\frac{{61--241}}{{139 \pm 11}}$ | 3–6 | $\frac{6}{{15}}$ |
| Scorpaena porcus | донный | май-июнь | от 2 до 177.6 тыс. | $\frac{{1.1}}{{\text{П}}}$ | $\frac{{10.4--29.1}}{{17.0 \pm 0.2}}$ | $\frac{{18--457}}{{97 \pm 5}}$ | 3+–9 | $\frac{{169}}{{27}}$ |
| Symphodus tinca | придонный | май-июнь | 12.4–57.8 тыс. | $\frac{{0.7}}{{\text{Д}}}$ | $\frac{{15.3--22.8}}{{19.0 \pm 0.3}}$ | $\frac{{51--151}}{{89 \pm 4}}$ | 5–9 | $\frac{{24}}{2}$ |
| Spicara flexuosa | придонно-пелагический | май-июнь | 2286–6626 | $\frac{{0.4}}{{\text{Д}}}$ | $\frac{{9.6--14.7}}{{12.2 \pm 0.1}}$ | $\frac{{7--30}}{{17 \pm 0.6}}$ | 1+–3+ | $\frac{{84}}{{13}}$ |
| Merlangus merlangus euxinus | придонно-пелагический | декабрь-март | 37–588 тыс. | $\frac{{1.1}}{{\text{П}}}$ | $\frac{{11.7--17.3}}{{14.9 \pm 0.3}}$ | $\frac{{11--44}}{{24 \pm 1}}$ | 1–2 | $\frac{6}{{26}}$ |
| Trachurus mediterraneus ponticus | пелагический | май-август | 150–200 тыс. | $\frac{{0.73}}{{\text{П}}}$ | $\frac{{10.0--18.4}}{{13.4 \pm 0.3}}$ | $\frac{{8--56}}{{19 \pm 1}}$ | 1–2+ | $\frac{{40}}{{23}}$ |
Примечания: * – в числителе – диаметр икринок в мм на стадии нереста, в знаменателе – тип икры (П – пелагическая, Д – демерсальная), ** – в числителе – количество особей с гонадами на стадии покоя, в знаменателе – количество особей с гонадами на стадии нереста, ⚫ – в числителе пределы значений – минимум-максимум, в знаменателе среднее арифметическое ± ошибка среднего.
На активность фермента в гонадах могла повлиять восприимчивость исследуемых видов к уровню загрязнения среды обитания, к которому ЩФ гонад очень чувствительна [20]. Морской ерш является немигрирующим видом и, как следствие этого, большую часть жизни проводит в тесном контакте с прибрежными грунтами, многие из которых в настоящее время подвержены антропогенному воздействию, в то время как мигрирующие виды – такие как мерланг, черноморская ставрида, находятся в толще воды, которая в меньшей степени содержит поллютанты, а также эти рыбы перемещаются в открытые зоны моря, которые являются более “чистыми”. Полученные в наших исследованиях различия активности ЩФ в гонадах рыб могут быть как следствием видовых особенностей развития и созревания половых желез, так и результатом разной чувствительности гонад к токсикантам, содержащимся в среде обитания.
Таким образом, активность аминотрансфераз и ЩФ в гонадах рыб может служить удобным и эффективным маркером как особенностей формирования половых желез и процессов, происходящих в них в разные периоды репродуктивного цикла, так и показателем адаптационных возможностей видов к неблагоприятным условиям среды обитания, в том числе к антропогенному загрязнению.
Список литературы
Kuz'mina V.V., Shalygin M.V., Skvortsova E.G. Effect of temperature on proteinase activities of enteral microbiota and intestinal mucosa of fish of different ecological groups. J. Evol. Biochem. Physiol. 48 (2): 140–146. 2012.
Rudneva I.I., Skuratovskaya E.N. Gender peculiarities of blood antioxidant enzyme activity of some Black Sea coastal fish species. J. Ichthyol. 49 (1): 119–122. 2009.https://doi.org/10.1134/S0032945209010159
Filho W.D. Reactive oxygen species, antioxidants and fish mitochondria. Front Biosci. 12: 1229–1237. 2007.
Rudneva I.I. Antioxidant defense in marine fish and its relationship to their ecological status. p. 31–59 in: Fish Ecology. (ed. S.P. Dempsy) Nova Science Publishers, Inc. New York. USA. 2012.
Sole M., Rodriguez S., Papiol V., Maynou F., Cartes J.E. Xenobiotic metabolism markers in marine fish with different trophic strategies and their relationship to ecological variables. Comp. Biochem. Physiol. C. 149: 83–89. 2009.
Rudneva I.I., Kuzminova N.S., Skuratovskaya E.N., Kovyrshina T.B. Comparative Study of Glutathione-S-transferase Activity in Tissues of Some Black Sea Teleosts. Int. J. Sci. Nat. 1 (1): 1–6. 2010.
Seitkalieva A.V., Menzorova N.I., Rasskazov V.A. Phosphatases of echinoderms and bivalve mollusks of the Japan and Okhotsk seas. Russ. J. Mar. Biol. 41 (1): 51–59. 2015.
Kuzminova N.S. Dependence of Alkaline Phosphatase Activity on Bioecological Parameters of Black Sea Fish. J. Ichthyol. 56 (2): 298–303. 2016.
Skuratovskaya E.N., Rudneva I.I., Kovyrshina T.B. Tissue-specific and ecological peculiarities of cholinesterase activity of the fish inhabiting the Black sea. J. Ichthyol. 53 (5): 355–358. 2013.https://doi.org/10.1134/S0032945213030120
Дорохова И.И. Видовые особенности активности аминотрансфераз в тканях черноморских рыб. Ветеринарна медицина. 96: 286–287. 2012. [Dorokhova I.I. Species peculiarities of aminotransferase activity in the black sea fishes. Veterinarna medicina. 96: 286–287. 2012 (in Russ)].
Solé M., Mañanós E., Blázquez M. Vitellogenin, sex steroid levels and gonadal biomarkers in wild Solea solea and Solea senegalensis from NW Mediterranean fishing grounds. Mar. Environ. Res. 117: 63–74. 2016.https://doi.org/10.1016/j.marenvres.2016.03.010
Болтачев А.Р., Карпова Е.П. Морские рыбы Крымского полуострова. Симферополь: Бизнес-Информ. 2012. [Boltachev A.R., Karpova E.P. Morskie ryby Krymskogo poluostrova. [Sea-fishes of the Crimean peninsula]. Simferopol: Biznes-Inform. 2012. (in Russ)].
Овен Л.С. Специфика развития половых клеток морских рыб в период размножения как показатель типа нереста и реакции на условия среды обитания. М.: Изд-во ВНИРО. 2004. [Oven L.S. Specifika razvitiya polovyh kletok morskih ryb v period razmnozheniya kak pokazatel' tipa neresta i reakcii na usloviya sredy obitaniya. [Specifics of gametes' development of the sea-fishes during reproduction period as an indices of type of spawning and reaction to enviroment conditions]. M.: Izd-vo VNIRO. 2004 (in Russ)].
Правдин И.Ф. Руководство по изучению рыб. М.: Пищ. пром-ть. 1966. [Pravdin I.F. Rukovodstvo po izucheniyu ryb. [Study guide of fishes]. M.: Pishchevaya promyshlennost. 1966. (in Russ)].
Li-Min Lun, Shi-Cui Zhang, Yu-Jun Liang. Alanine aminotransferase in Amphioxus: presence, localization and Up-regulation after acute lippolysaccharide exposure. Journal of Biochemistry & Molecular Biology. 39 (5): 511–515. 2006.https://doi.org/10.5483/BMBRep.2006.39.5.511
Srivastava A.S., Oohara I., Suzuki T., Sing S.N. Activity and expression of aspartate aminotransferase during the reproductive cycle of a fresh water fish, Clarias batrachus. Fish Physiol Biochem. 20 (3): 243–250. 1999.
Wang Ch., Hu G., Sun P., Gu W., Wang B., Xu Q., Hongbai Liu H. Effects of dietary protein at two lipid levels on growth, gonadal development, body composition and liver metabolic enzymes of brown trout (Salmo trutta fario) broodstock. Aquac. Nutr. 24 (5): 1587–1598. 2018.
Pérez M.R., Rossi A.S., Bacchetta C., Elorriaga Y., Carriquiriborde P. In situ evaluation of the toxicological impact of a wastewater effluent on the fish Prochilodus lineatus: biochemical and histological assessment Cazenave. Ecol. Indic. 84: 345–353. 2018.
Simakani P., Abolhasani M.H., Hoseini S.M. Determination of mancozeb toxicity and biochemical effects in common carp (Cyprinus carpio). Int. J. Aquat. Biol. 6 (3): 157–161. 2018.
Vaziriyan M., Banaee M., Nemadoost Haghi B., Mohiseni M. Effects of dietary exposure to aflatoxins on some plasma biochemical indices of common carp (Cyprinus carpio). Iranian J. Fish. Sci. 17 (3): 487–502. doi: . 2018.https://doi.org/10.22092/IJFS.2018.116552
Sunny F., Jacob A., Oommen O.V. Sex steroids regulated intermediary metabolism in Oreochromis mossambicus. Endocrine Research. 28 (3): 175–188. 2002.
Кусень С.И., Пашковская И.С. Влияние аминокислот, гормонов и актиномицина D на активность аминотрансфераз в неоплодотворенной икре вьюна. Укр. Биохим журнал. 45 (5): 568–577. 1973. [Kusen S.I., Pashkovskaya I.S. Vliyanie aminokislot, gormonov i aktinomicina D na aktivnost' aminotransferaz v neoplodotvorennoj ikre v’yuna [Influence of amino acids, hormones and the actinomycin D on aminotransferase activity in unfertilized caviar of a loach]. Ukr.Biochem. J. 45 (5): 568–577. 1973 (in Russ)].
Appa Rao T. Alkaline phosphatase activity in ovaries of some Clupeoides. Indian J. Fish. 1979. Vol. 26 (1 & 2). P. 253–255.
Sharma R.K., Bhat R.A. Changes in Acid Phosphatase and Alkaline Phosphatase activity in gonads of Rainbow trout. J. Chem. Biol. Phys. Sci. B. 6 (4): 1370–1374. 2016.
Розенгарт Е.В., Басова Н.Е., Суворов А.А. Щелочная фосфатаза из тканей некоторых тихоокеанских кальмаров. Доклады Академии Наук. 425 (1): 117–119. 2009. [Rozengart E.V., Basova N.E., Suvorov A.A. Alkaline phosphatase from tissues of some Pacific squids. Dokl. Akad. Nauk. 425 (1): 117–119. 2009 (in Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


