Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 5, стр. 367-370
ВЛИЯНИЕ ФАРМАКОЛОГИЧЕСКОГО ИНГИБИРОВАНИЯ ЭКСПРЕССИИ ШАПЕРОНА Hsp70 НА ПРОТЕКТИВНЫЕ ЭФФЕКТЫ ГЛЮКОЗО-РЕГУЛИРУЕМОГО БЕЛКА 78 кДа В МОДЕЛИ БОЛЕЗНИ ПАРКИНСОНА
И. В. Екимова 1, *, М. Б. Пази 1, Д. В. Белан 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: irina-ekimova@mail.ru
Поступила в редакцию 26.02.2019
После доработки 23.04.2019
Принята к публикации 26.04.2019
Основой поддержания внутриклеточного протеостаза является интегрированная работа двух важнейших молекулярных систем: системы белков теплового шока HSPs, осуществляющей конформационный контроль белков, и убиквитин-протеасомной системы деградации белков, своевременно удаляющей поврежденные или мутантные белки, при накоплении которых клетка может погибнуть. Эти системы уравновешивают биосинтез белков, фолдинг, транслокацию и утилизацию конформационно дефектных белков. Способность нейронов головного мозга регулировать протеостаз ослабевает с возрастом и при развитии нейродегенеративных заболеваний (болезней Паркинсона (БП), Альцгеймера и др.) [1]. При БП снижение активности убиквитин-протеасомной системы приводит к фатальному накоплению в нейронах головного мозга неправильно уложенного белка α-синуклеина сначала в виде олигомеров, а затем – в виде нерастворимых агрегатов и фибрилл. Хроническое накопление аберрантных форм α-синуклеина вызывает протеотоксический стресс эндоплазматического ретикулума (ЭР), заканчивающийся гибелью нейронов. Два маркера стресса ЭР – фосфорилированная серин/треониновая киназа (pPERK) и фосфорилированный эукариотический трансляционный инициирующий фактор 2α (eIF2α) PERK-сигнального каскада – выявлены в дофамин (ДА)-ергических нейронах компактной части черной субстанции (кчЧС) у пациентов со спорадической формой БП [2]. Мобилизация в клетках шаперонного механизма, основанного на цитозольном стресс–индуцируемом белке Нsp70 (HSPA1A) и глюкозо-регулируемом белке ЭР GRP78 (HSPA5), является первой линией защиты от фатальных последствий неправильной укладки полипептидных цепей и продолжительного протеотоксического стресса [1]. Кроме того, GRP78 играет ключевую роль в контроле клеточного ответа на протеотоксический стресс ЭР (unfolded protein response). Недавно нами показано, что повышение содержания Нsp70 в головном мозге путем усиления экспрессии Нsp70 или интраназальной доставки в мозг этого шаперона противодействует агрегации α-синуклеина и деструктивно-воспалительным изменениям в нигростриатной системе в лактацистиновой (ЛЦ) модели БП у животных [3]. В то же время интраназальное введение GRP78 оказывает сходный нейропротективный и противовоспалительный эффекты в этой же модели БП [4]. При моделировании БП показано, что в ответ на введение ЛЦ значительно повышается уровень Нsp70 в кчЧС [5]. Это позволило предположить, что Нsp70 может вовлекаться в молекулярные механизмы протективного действия GRP78 в модели БП. Для проверки предположения в работе оценены эффекты интраназального введения GRP78 на процесс нейродегенерации и нейровоспаления в кчЧС в условиях фармакологического ингибирования экспрессии Нsp70 в ЛЦ модели БП у крыс.
Опыты выполнены на самцах крыс популяции Вистар (n = 30) в возрасте 6 мес и массой тела 280–300 г. Манипуляции с животными осуществлялись в соответствии с протоколом, утвержденным Этическим комитетом по охране животных ИЭФБ РАН, находящимся в соответствии с принципами Базельской декларации.
Схема эксперимента. Для моделирования БП использовали специфический ингибитор ферментативной активности протеасом лактацистин (ЛЦ; Enzo Life Sciences, США), растворенный в апирогенном фосфатном буфере (pH 7.4). ЛЦ вводили животным в дозе 0.4 мкг в 1 мкл раствора билатерально в кчЧС дважды с интервалом 7 дней через заранее имплантированные направляющие канюли. Для ингибирования экспрессии стресс-индуцируемых форм HSPs использовали триптолид (Sigma, США), растворенный в 20 мкл диметилсульфоксида с добавлением 0.2 мл физиологического раствора. Ингибитор вводили внутрибрюшинно в дозе 50 мкг/кг за 40 мин до микроинъекций ЛЦ. Триптолид был также введен животным, не получавшим микроинъекцию ЛЦ. Рекомбинантный белок теплового шока GRP78 человека (Sigma, США) вводили интраназально в дозе 1.6 мкг в 8 мкл раствора через 4 ч и 28 ч после каждой микроинъекции ЛЦ, а также через 7 дней после последней микроинъекции ЛЦ. Контрольная группа животных по аналогичным схемам и в том же объеме получала растворители используемых препаратов. В экспериментальной и контрольной группах было по 6 животных.
Головной мозг для патоморфологического анализа забирали через 24 ч и 21 день после первого введения ЛЦ или растворителя. Иммуногистохимическим методом изучены изменения содержания индуцируемого белка Hsp70 (HSPA1A) и белка GRP78 (HSPA5) в нейронах кчЧС и признаки нейродегенерации и нейровоспаления в нигростриатной системе [3]. В работе использованы первые моноклональные антитела мыши против индуцируемого Hsp70 (клон 3C5, любезно предоставлен г.н.с. Б.А. Маргулисом лаборатории защитных механизмов клетки ИЦ РАН) [6], первые поликлональные антитела кролика против тирозингидроксилазы (ТГ) (1:900, Abcam, США), GRP78 (1:700, Abcam, США) или против маркера микроглиоцитов – кальций-связывающего белка Iba-1 (1:350, Abcam, США), вторые антитела против мыши или кролика, конъюгированные с биотином (1:350, VectorLab, США), и комплекс стрептавидин-пероксидаза (1:500, VectorLab, США). Визуализация реакции осуществлялась в растворе 3,3'-диаминобензидина (0.05%, Sigma, США). Содержание Hsp70 и GRP78 определялось по оптической плотности иммунореактивного вещества в нейронах кчЧС [3, 4]. Морфологический анализ признаков нейродегенерации в нигростриатной системе проводили по количеству нейронов в кчЧС и их аксонов в дорсальном стриатуме, иммунореактивных к ТГ. Оценку нейровоспаления проводили по количеству микроглиоцитов, иммунореактивных к Iba-1.
Статистический анализ полученных данных выполняли с помощью параметрического многофакторного дисперсионного анализа ANOVA. Результаты считали статистически значимыми при p < 0.05.
Проведенное исследование показало, что введение ЛЦ приводит через 24 ч к увеличению содержания Hsp70 и GRP78 на 256% и 19% (р < 0.05) соответственно в нейронах кчЧС по сравнению с контролем (см. рис. 1а). Повышение уровней Hsp70 и GRP78 свидетельствует о мобилизации шаперонной системы в ответ на ЛЦ-индуцированный протеотоксический стресс, которая направлена на рефолдинг белков или их деградацию. Превентивное введение триптолида препятствует ЛЦ-индуцированному увеличению содержания Hsp70 и не влияет на уровень GRP78 в кчЧС. В контрольных условиях триптолид не вызывает изменений в содержании Hsp70 и GRP78 в нейронах кчЧС.
Рис. 1.
Влияние триптолида на изменения содержания белков теплового шока Hsp70 и GRP78 (а), процесс нейродегенерации (б) и микроглиоз (в) в компактной части черной субстанции при интраназальном введении GRP78 в модели болезни Паркинсона у крыс. Слева представлены микрофотографии компактной части черной субстанции с иммунореактивными нейронами к Hsp70 и GRP78 (а), тирозингидроксилазе (б), и микроглиоцитами к Iba-1 (в). Масштаб – 20 мкм (а), 50 мкм (б, в). Триптолид (Трип.), лактацистин (ЛЦ). Значимость различий по отношению к контролю: * – p < 0.05, ** – p < 0.01; по отношению к эффекту ЛЦ: # – p < 0.05, ## – p < 0.01.
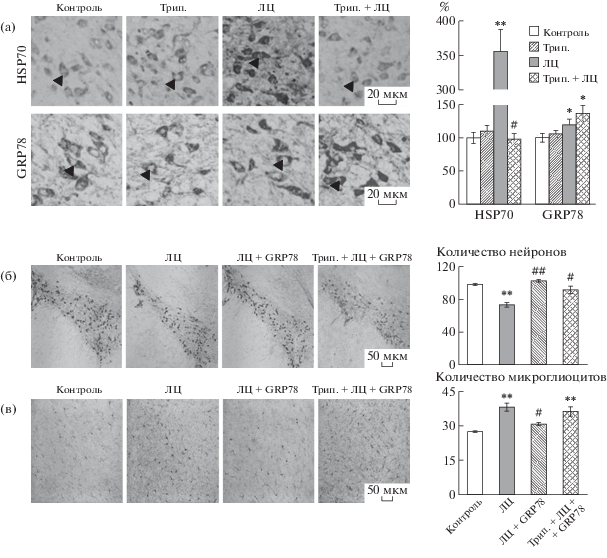
Развитие хронического протеотоксического стресса приводит через 21 день после первого введения ингибитора протеасом к уменьшению количества иммунореактивных к ТГ нейронов в кчЧС на 27% (p < 0.05) по сравнению с контролем (см. рис. 1б). В дорсальном стриатуме количество иммунореактивных к ТГ аксонов снижается на 19.4% (p < 0.05) (5695 ± 122 против 4593 ± 117). При этом деструктивные изменения в нигростриатной системе сопряжены с возрастанием на 39% (p < 0.05) количества активированных микроглиоцитов, что указывает на развитие нейровоспаления, которое может вносить существенный вклад в прогрессирование нейродегенерации (см. рис. 1в). Выявленные в исследовании деструктивно-воспалительные изменения в нигростриатной системе характерны для ранней стадии БП. Проведение курсовой терапии с помощью GRP78 в модели БП у крыс препятствует гибели нейронов в кчЧС и их аксонов в стриатуме и уменьшает в 3.2 раза (p < < 0.05) количество активированных микроглиоцитов. Следовательно, повышение конформационного контроля белков со стороны GRP78 при моделировании БП значительно уменьшает фатальные последствия протеотоксического стресса и повышает адаптивные способности нейронов. Для того чтобы исключить влияние ЛЦ-индуцированной экспрессии шаперона Hsp70 на проявление протективного эффекта экзогенного GRP78, выполнены превентивные инъекции ингибитора экспрессии индуцируемых форм HSPs триптолида. Выяснено, что при введении триптолида нейропротективное действие GRP78 сохраняется, судя по увеличению количества иммунореактивных к ТГ нейронов в кчЧС в модели БП. Однако противовоспалительный эффект GRP78 отменяется в этих условиях, на что указывает сходное с эффектом ЛЦ увеличение количества активированных микроглиоцитов в кчЧС (см. рис. 1в). Следовательно, для проявления противовоспалительного действия экзогенного GRP78 требуются высокие уровни экспрессии Hsp70. Ряд данных литературы указывает, что внутриклеточный Hsp70 обладает иммуномодуляторной функцией и способен подавлять передачу воспалительного сигнала на уровне транскрипционного фактора NF-kB, запускаемого сигнальными каскадами протеотоксического стресса ЭР [7, 8]. Нейропротективный эффект GRP78 в модели БП может быть обусловлен функциональными изменениями в PERK-зависимых каскадах стресса ЭР. Это приводит к перепрограммированию стресса ЭР в “больных” нейронах кчЧС в сторону выживания и восстановления протеостаза.
Таким образом, мы показали, что терапевтический потенциал экзогенного GRP78 ограничивается его нейропротективным действием в модели БП. Противовоспалительный эффект, выявленный при введении GRP78 модельным животным, связан с повышенной экспрессией шаперона Hsp70, который отрицательно модулирует звенья воспалительной реакции. Полученные данные позволяют сделать вывод, что протективный эффект GRP78 в модели БП достигается за счет cинергенного участия обоих шаперонов, принадлежащих к одному семейству HSP70. Полученные результаты могут являться фундаментальным обоснованием для разработки комплексной превентивной терапии БП и других нейродегенеративных заболеваний на основе препаратов белков теплового шока GRP78 и Hsp70.
Список литературы
Ciechanover A., Kwon Y.T. Protein quality control by molecular chaperones in neurodegeneration. Front Neurosci. 11: 185. 2017.
Hoozemans J.J., Van Haastert E.S., Eikelenboom P., de Vos R.A., Rozemuller J.M., Scheper W. Activation of the Unfolded Protein Response in Parkinson’s Disease. Biochem. Biophys. Res. Commun. 354: 707–711. 2007.
Ekimova I.V., Plaksina D.V., Pastukhov Y.F., Lapshi-na K.V., Lazarev V.F., Mikhaylova E.R., Polonik S.G., Pani B., Margulis B.A., Guzhova I.V., Nudler E. New HSF1 inducer as a therapeutic agent in a rodent model of Parkinson’s disease. Exp. Neurol. 306: 199–208. 2018.
Екимова И.В., Пази М.Б., Плаксина Д.В. Оценка нейропротективного потенциала глюкозо-регулируемого белка теплового шока в модели болезни Паркинсона у крыс. Рос. физиол. журн. им. И.М. Сеченова. 104 (7): 757–768. 2018. [Ekimova I.V., Pazi M.B., Plaksina D.V. Evaluation of the neuroprotective potential of glucoso-regulated heat shock protein in the model of Parkinson’s disease in rats. Russ. J. Physiol. 104 (7): 757–768. 2018. (In Russ.)].
Пастухов Ю.Ф., Екимова И.В., Гужова И.В., Романова И.В., Артюхина З.Е. Содержание шаперона Hsp70 в дофаминергических нейронах черной субстанции возрастает при протеасомной дисфункции. Рос. физиол. журн. им. И.М. Сеченова. 97 (7): 649–660. 2011. [Pastukhov Yu.F., Ekimova I.V., Guzhova I.V., Romanova I.V., Artiukhina Z.E. Content of chaperone Hsp70 in dopaminergic neurons of the black substance increases in proteasome dysfunction. Russ. J. Physiol. 97 (7): 649–660. 2011. (In Russ.)].
Lasunskaia E.B., Fridlianskaia I., Arnholdt A.V., Kanashiro M., Guzhova I., Margulis B. Sub-lethal heat shock induces plasma membrane translocation of 70-kDa heat shock protein in viable, but not in apoptotic, U-937 leukaemia cells. APMIS. 118 (3): 179–187. 2010.
Salminen A., Paimela T., Suuronen T., Kaarniranta K. Innate immunity meets with cellular stress at the IKK complex: regulation of the IKK complex by HSP70 and HSP90. Immunol. Lett. 11 7(1): 9–15. 2008.
Tanaka T., Shibazaki A., Ono R., Kaisho T. HSP70 mediates degradation of the p65 subunit of nuclear factor κB to inhibit inflammatory signaling. Sci. Signal. 7 (356): 119. 2014.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


