Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 5, стр. 377-380
НИСХОДЯЩИЕ ИНТЕРНЕЙРОНЫ В НАДГЛОТОЧНОМ ГАНГЛИИ МАДАГАСКАРСКОГО ТАРАКАНА GROMPHADORHINA PORTENTOSA
И. Ю. Северина 1, *, А. Н. Князев 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: severinaira@mail.ru
Поступила в редакцию 10.04.2019
После доработки 26.04.2019
Принята к публикации 21.05.2019
Таракановые (Blattaria) – одни из древнейших насекомых Polyneoptera, в целом сохранившие образ жизни и ряд морфологических черт с Палеозойской эры. Первые окаменелости более или менее “современных” тараканов появляются в раннем меле [1]. Это очень подвижные насекомые, ведущие преимущественно ночной образ жизни. Днем они скрываются под камнями или опавшими листьями, в трещинах на поверхности почвы, в норах грызунов, под корой пней и отмирающих деревьев. Крылатые особи сохранили способность к полету. Тараканы – полифаги, они питаются растительными и животными остатками. Так как в процессе эволюции тараканы освоили разные места обитания, их локомоторное поведение вполне закономерно различается. Такие различия, в частности, наблюдаются у двух видов тараканов: американского таракана Periplaneta americana L. (Blattaria: Blattidae) и мадагаскарского таракана Gromphadorhina portentosa Schaum (Blattaria: Blaberidae). Американский таракан (АТ) широко распространен в тропических и субтропических странах, а также в странах умеренного пояса. Этот полифаг адаптировался к различным зонам обитания от лесов до жилищ человека. АТ демонстрирует быструю маневренную ходьбу и способен к полету. Подробно описана его реакция “спасения” или убегания (escape reaction, escape behavior), которая вызывается обдуванием церок (толчки воздуха), прикосновением к антеннам или конечностям и заключается в повороте от источника опасности и побежке [2].
Мадагаскарский шипящий таракан (МТ) – крупное тропическое насекомое, обитающее на стволах и ветвях деревьев и кустов и питающееся зелеными побегами и фруктами. Особи этого вида передвигаются медленно, у них отсутствуют крылья. При опасности МТ замирает и издает громкое шипение. Извлечение звука происходит при резком сокращении брюшка, проталкивающего воздух с силой через дыхальца. Звуковые сигналы служат также для внутривидовой коммуникации (например, борьба самцов за самку) [3].
Существенные различия в поведении этих двух видов позволяют предположить существование особенностей структурной и функциональной организации нервной и сенсорных систем, обеспечивающих их локомоторное (двигательное) поведение.
Поведение насекомых определяется активностью нейронов, относящихся к разным уровням сенсомоторной интеграции. Высший интегративный центр, в котором обрабатывается мультисенсорная информация и формируются моторные команды, координирующие двигательные реакции, находится в надглоточном ганглии (мозге). Популяция нисходящих нейронов (НН) передает команды от мозга к грудным ганглиям, которые управляют ходьбой и другими двигательными реакциями. Клеточные тела и дендриты НН расположены в надглоточном ганглии, а аксоны спускаются в торакальные ганглии через шейные коннективы ипсилатерально относительно своего клеточного тела (ипсилатеральные нейроны), либо контрлатерально после пересечения средней линии в пределах мозга (контрлатеральные нейроны) [4]. У АТ была исследована общая топография НН [5] и выяснена функциональная принадлежность некоторых нейронов [5]. Однако в настоящее время не известны морфофункциональные характеристики НН мадагаскарского таракана. В ЦНС насекомых, даже у относительно далеких таксономических групп, можно идентифицировать гомологичные нейроны, которые занимают сходное положение и имеют почти одинаковые рисунки ветвления дендритов и аксонов. Поэтому задачей данной работы было выявление среди НН двух видов тараканов морфологически сходных клеток и на основе их строения оценка выполняемых ими функций. Для этого была исследована топография нисходящих нейронов МТ в сравнении с АТ, которые изучались нами ранее [4].
В надглоточном ганглии МТ тела нейронов и отростки выявляли с помощью ретроградного окрашивания хлористым никелем. Для этого у анестезированного СО2 таракана вскрывали кутикулу в шейной области и одну из шейных коннектив помещали в кювету с 2.5% раствором NiCl2. Препарат выдерживали в холодильнике в течение 2–3 суток, затем окраску проявляли рубеановой кислотой. Надглоточный ганглий фиксировали в 2% растворе глютарового альдегида. После дегидратации производили стандартную заливку даммар-ксилолом. Окрашивание проведено на 20 животных. На тотальных препаратах мозга отдельные нейроны, их аксоны и дендриты изучали под световым микроскопом (Биолам П2-1 или Stemi 2000) и фотографировали (камера Canon PS G-15). Морфологический анализ включал подсчет тел нейронов, определение их размеров, расположение и ветвление отростков.
Сравнительное исследование показало, что хотя мозг МТ более вытянут в латеральном направлении, чем мозг АТ, общий паттерн расположения тел клеток и траектория отхождения основных отростков сходны у обоих видов. Размеры клеточных тел НН в надглоточном ганглии у МТ меньше, чем у АТ (20–45 мкм и 30–50 мкм в диаметре соответственно). Общее количество тел нисходящих нейронов в мозге МТ, подсчитанное на 6 препаратах, варьировало от 96 до 123 единиц, при этом 79–98 единиц было обнаружено в протоцеребруме, 15–21 – в дейтоцеребруме, 2–4 – в тритоцеребруме. У АТ было выявлено практически такое же число НН: в протоцеребруме 76–89, в дейтоцеребруме 17–28, в тритоцеребруме от 2 до 4 штук. Выявлено, что у обоих видов тараканов количество ипсилатеральных НН значительно превышает количество контрлатеральных. В дорсальной области протоцеребрума МТ тела нейронов расположены около каликсов грибовидных тел (рис. 1а). Клетки собраны в группы аналогично группам у АТ [4, 5], контрлатерально находятся группы: c1, c2, c3; ипсилатерально: i1, i2, i3, обнаружены и отдельно лежащие нейроны. Дендриты НН ветвятся в пределах дорсальных областей протоцеребрума и дейтоцеребрума. При этом не было обнаружено разветвлений дендритов в оптических и антеннальных долях, грибовидном теле, центральном комплексе. В группе c3 обращает на себя внимание крупный (40–45 мкм в диаметре) нейрон (рис. 1а). Его тело локализовано медиально в протоцеребруме. Основной нейрит идет вдоль дорсальной поверхности в дейтоцеребрум, давая многочисленные тонкие ответвления. Далее нейрит переходит на противоположную сторону ганглия и ветвится в вентролатеральном направлении. Аксон нисходит по контрлатеральной коннективе. Этот нейрон, по-видимому, гомологичен механочувствительному нейрону DMIa-1, идентифицированному у АТ, у которого он играет основную роль в реакции убегания в ответ на прикосновение к антенне [6].
Рис. 1.
Нисходящие нейроны в надглоточном ганглии мадагаскарского таракана Gromphadorhina portentosa. а – вид с дорсальной стороны, отмечены ипсилатеральные группы (i1, i2,i3) и контрлатеральные группы (с1, с2, с3); АН – антеннальный нерв, ОД – оптическая доля . Выделенная в рамке область представлена справа при большем увеличении; Н – нейрон, гомологичный механочувствительному нейрону американского таракана. Масштаб 100 мкм. б – вид с вентральной стороны, отмечены группы i5, i5n; АД – антеннальная доля. Масштаб 100 мкм. Белые стрелки – направление движения красителя по коннективам
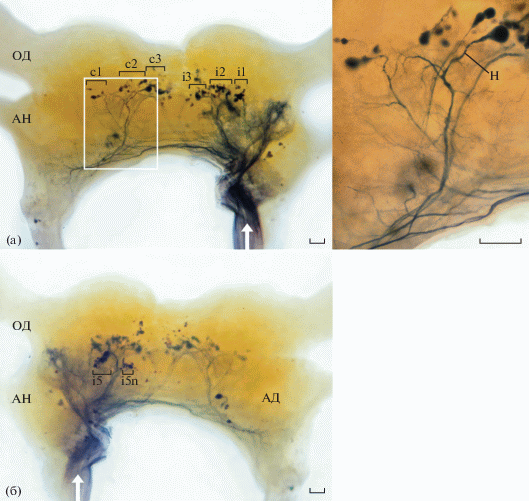
Как и другие представители отряда, МТ, по-видимому, использует тактильные входы от антенн для ориентации в пространстве. В настоящее время нет данных о том, что осязательное возбуждение антенн у МТ может вызвать реакцию избегания, хотя показано, что электрическая стимуляция антенн у особей этого вида вызывает поворот и движение [7]. Наши наблюдения за поведением МТ показали, что при касании антенн таракан делает несколько шагов в сторону, противоположную стимулу. Требуется дополнительное морфо-функциональное исследование обнаруженного нами нейрона, чтобы определить, является ли его основной модальностью именно механорецепция.
На вентральной поверхности протоцеребрума МТ обнаружены две группы нейронов по 9–12 клеток в каждой, которые имеют ипсилатеральные отростки (рис. 1б). Эти группы сопоставимы с группами i5 и i5n, описанными у АТ [5], сверчка [8] и стрекозы [4]. У сверчка нейроны групп i5 и i5n получают входы от зрительной и слуховой систем и участвуют в контроле угла поворота при ориентации к источнику пения [8]. Для тараканов до сих пор нет сведений, что нейроны группы i5 и i5n получают какую-либо зрительную информацию, и их функция неизвестна.
Полученные результаты показывают, что количество и расположение НН в надглоточном ганглии МТ сходно с таковым у АТ. Многие нейроны у этих видов имеют сходную топографию и структурные особенности. По-видимому, местоположение тела клетки и морфология НН только частично указывают на то, в какие реакции может быть вовлечен НН. Большинство НН чувствительны к стимулам нескольких сенсорных модальностей и могут участвовать в реализации разных реакций в зависимости от состояния организма, текущего поведения, условий среды. Можно предположить, что у тараканов, различающихся поведением, морфологически сходные НН выполняют разные функции для обеспечения адекватной и характерной для каждого вида формы локомоторного поведения и используются в нейронных сетях сходной структурной, но разной функциональной конфигурации. Недавно было показано, что существующая у тараканов нейронная сеть, передающая информацию от церок до торакальных ганглиев, имеет морфологическое и физиологическое сходство у АТ и МТ. Однако у АТ обдувание церок вызывает очень быструю реакцию избегания, включающую поворот от стимула и побежку, а у МТ этот путь не включен в систему поведения избегания [9].
В целом проведенное сравнение двух видов тараканов позволяет сделать вывод, что различие в месте обитания по-разному повлияло на эволюцию поведения, несмотря на то, что нейронная структурная основа их поведенческих реакций (топография нейронов) в процессе эволюции этих видов осталась без изменений.
Список литературы
Анисюткин Л.Н. Отряд таракановые (Dictyoptera) – эволюция и систематика. РЭТ-инфо. 2 (58): 6–8. 2006. [Anisyutkin L.N. Otryad tarakanovye (Dictyoptera) – evolyuciya i sistematika [Order Blattodea (Dictyoptera) – evolution and phylogeny]. RET-info. 2 (58): 6–8. 2006 (in Russ)].
Camhi J.M. Escape behavior in the cockroach: distributed neural processing. Experientia. 44: 401–408. 1988.
Nelson M.C., Fraser J. Sound production in cockroach, Gromphadorina portentosa: evidence for communication by hissing. Behav. Ecol. Sociobiol. 6: 305–314. 1980.
Северина И.Ю., Исавнина И.Л., Князев А.Н. Топография восходящих и нисходящих нейронов надглоточного, мезо- и метаторакальных ганглиев у древне- и новокрылых насекомых. Ж. эвол. биохим. и физиол. 52 (5): 362–369. 2016. [Severina I.Yu., Isavnina I.L., Knyazev A.N. Topographic anatomy of ascending and descending neurons of the supraesophageal, meso- and metathoracic ganglia in paleo- and neopterous insects. J. Evol. Biochem. Physiol. 52 (5): 362–369. 2016 (in Russ)].
Okada R., Sakura M., Mizunami M. Distribution of dendrites of descending neurons and its implications for the basic organization of the cockroach brain. J. Comp. Neurol. 458: 158–174. 2003.
Burdohan J.A., Comer C.M. Cellular organization of an antennal mechanosensory pathway in the cockroach, Periplaneta Americana. J Neurosci. 16: 5830–5843. 1996.
Erickson J.C., Herrera M., Bustamaante M., Shingiro A., Bowen T. Effective stimulus parameters for directed locomotion in Madagascar hissing cockroach biobot. PLoS ONE 10 (8): e0134348. 2015.
Staudacher E., Schildberger K. Gating of sensory responses of descending brain neurons during walking in crickets. J. Exp. Biol. 201: 559–572. 1998.
McGorry C.A., Newman C.N., Triblehorn J.D. Neural responses from the wind-sensitive interneuron population in four cockroach species. J. Insect physiology. 66: 59–70. 2014.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


