Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 6, стр. 398-406
ЖИРНОКИСЛОТНЫЙ СОСТАВ ГОНАД И ПОЛОВЫХ ПРОДУКТОВ ДВУСТВОРЧАТОГО МОЛЛЮСКА Mytilus galloprovincialis LAM. (1819) ИЗ ЧЕРНОГО МОРЯ НА РАЗНЫХ СТАДИЯХ ПОЛОВОЙ ЗРЕЛОСТИ
Л. Л. Капранова 1, *, М. В. Нехорошев 1, Л. В. Малахова 1, В. И. Рябушко 1, С. В. Капранов 1, Т. В. Кузнецова 2
1 Институт морских биологических исследований им. А.О. Ковалевского РАН
Севастополь, Россия
2 Санкт-Петербургский научно-исследовательский центр экологической безопасности РАН
Санкт-Петербург, Россия
* E-mail: rabushko2006@yandex.ru
Поступила в редакцию 01.11.2018
После доработки 19.03.2019
Принята к публикации 29.03.2019
Аннотация
В работе впервые исследован жирнокислотный состав (ЖК-состав) половых продуктов – сперматозоидов и яйцеклеток – и характер динамики жирных кислот (ЖК) в гонадах на разных стадиях полового созревания мидии Mytilus galloprovincialis. Этот средиземноморский вид мидии в настоящее время успешно культивируется в Черном море. На выделенных и идентифицированных 22 жирных кислотах (ЖК) с длиной цепи от 14 до 22 углеродных атомов показано, что ЖК-состав гонад мидий зависит от стадии половой зрелости. На основании сравнения состава жирных кислот, соотношения их относительных концентраций установлено, что на долю насыщенных жирных кислот (НЖК) приходилось 100% в женских гонадах на 1–3 стадии и на 1 и 5 стадии – в мужских гонадах. Относительное содержание НЖК в яйцеклетках выше, чем в сперматозоидах. Мононенасыщенные жирные кислоты (МНЖК) и полиненасыщенные жирные кислоты (ПНЖК) характерны как для мужских гонад, так и для сперматозоидов, в которых их суммарное содержание выше, чем в женских гонадах и яйцеклетках. Содержание ЖК в гонадах и половых продуктах мидии позволило охарактеризовать особенности липидного обмена в их генеративных органах на протяжении природного цикла размножения.
ВВЕДЕНИЕ
Развитие биохимических исследований, проводимых на мидиях, представляет практический интерес для совершенствования воспроизводства морских гидробионтов и повышения эффективности биотехнологии аквакультуры в области получения биоактивных веществ липидной природы и последующего их применения в клинической практике [1, 2]. В недавних наших работах [3, 4] показано, что половые продукты мидии содержат повышенные концентрации тестостерона. В последние десятилетия интерес к такого рода исследованиям обусловлен также обнаружением в организме мидий различных биологически активных соединений, вплоть до обладающих противоопухолевой активностью [5]. Так, ранее нами найдено, что экстракт липидной фракции, полученный из гонад мидий, обладает высокой противоопухолевой активностью in vivo [6].
В современной литературе имеется немало работ по данной и схожей тематике [7–13], однако информации о ЖК-составе сперматозоидов и яйцеклеток мидии, а также о динамике их содержания в гонадах в зависимости от стадии половой зрелости, крайне недостаточно. Эти показатели являются свидетельством биохимических изменений в организме мидий во время гаметогенеза. Так, например, известно, что ЖК семейства омега-6 и омега-3 выполняют важную физиологическую роль при биосинтезе простагландинов [14].
Изучение изменения концентрации ЖК в гонадах и половых продуктах мидии позволит объяснить интенсивность метаболических процессов, происходящих в организме этих животных, а также выделить факторы, влияющие на эти процессы. Целью настоящей работы являлось определение ЖК-состава гонад и половых продуктов культивируемой в Черном море мидии Mytilus galloprovincialis Lam. (1819) в зависимости от стадии половой зрелости, а также оценка изменения относительного содержания насыщенных и ненасыщенных ЖК в условной схеме “гонады–половые продукты”.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Объект исследований. Объектом исследований выбран двустворчатый моллюск Mytilus galloprovincialis Lam. (1819), собранный в весенне-осенний период 2018 г. с коллекторов мидийно-устричной фермы, размещенной в акватории Карантинной бухты (г. Севастополь, Крым). Для исследования гонад отбирали по 40–60 экземпляров свежевыловленных мидий с длиной раковины 5–6 см и в возрасте 1.5–2 года со времени оседания личинок на коллекторы. В этот сезон моллюски находились преимущественно на преднерестовой стадии развития, однако в каждой выборке встречались мидии с гонадами на разных стадиях созревания. Для исследования отбирали группы моллюсков, находящихся на определенной стадии половой зрелости. Из очищенных мидий извлекали гонады и определяли стадию зрелости на свежих мазках под микроскопом [15, 16]. Гонады группировали таким образом, чтобы на одной репродуктивной стадии присутствовали гонады трех разных мидий. Измерения проводили в трех повторностях.
Яйцеклетки и сперматозоиды получали из примерно ста свежевыловленных моллюсков, которые очищали и выдерживали в профильтрованной морской воде не менее 4 часов для опорожнения пищеварительного тракта. Затем моллюсков рассаживали в пластиковые стаканы объемом 0.5 л по 1 экз. в каждый и заливали отфильтрованной морской водой, нагретой до 25°С, стимулируя тем самым нерест [17]. Яйцеклетки после нереста осаждались на дно в виде ярко-оранжевого осадка, сперматозоиды выметывались в воду в виде белого облака. Яйцеклетки собирали с помощью дозатора и переносили в пробирки, сперматозоиды отделяли на центрифуге при 1500 об./мин. до полного их осаждения, верхний водный слой отбрасывали. Непосредственно после отбора проб гонад и половых продуктов из них экстрагировали общие липиды.
Экстракция липидов и получение метиловых эфиров ЖК. Подготовку образцов для получения метиловых эфиров ЖК (МЭЖК) из тканей начинали с экстракции липидов. Для этого гонады и половые продукты от каждой мидии тщательно растирали в ступке с 5 мл смеси этанол: хлороформ (1:1) до однородной массы в течение 10 мин. Гомогенат с двукратным объемом дистиллированной воды центрифугировали 10 мин при 1500 об./мин. Капилляром отбирали нижний хлороформный слой. Хлороформную фракцию упаривали на роторном испарителе, к остатку добавляли 5 мл свежеприготовленного раствора щелочи в метаноле (10 мл 3 N раствора NaOH и 90 мл 90% метанола). Полученный раствор кипятили с обратным холодильником до полного омыления в течение 1.5 часа. После этого к раствору добавляли несколько капель 1% спиртового раствора фенолфталеина, экстрагировали три раза гексаном порциями по 5 мл, к окрашенному щелочному раствору добавляли несколько капель 0.1 N соляной кислоты и два-три раза экстрагировали гексаном порциями по 5 мл. Собирали гексановый слой. После упаривания растворителя на роторном испарителе МЭЖК продували аргоном и хранили в морозильной камере при температуре минус 3°С не более 7 дней. Непосредственно перед анализом МЭЖК растворяли в 0.5 мл перегнанного гексана [18]. Полученные таким образом МЭЖК из сперматозоидов перед вводом в испаритель хроматографа разбавляли в 50 раз, а из яйцеклеток – в 100 раз.
Идентификация метиловых эфиров ЖК. Идентификация МЭЖК была выполнена в Центре коллективного пользования “Спектрометрия и хроматография” ФГБУН ИМБИ им. А.О. Ковалевского РАН (г. Севастополь) с использованием газового хроматографа Кристалл 5000 (ЗАО СКБ “Хроматэк”, Россия) с масс-спектрометрическим детектором в режиме ионизации электронным ударом 70 эВ и капиллярной колонкой DB-5ms (5%-фенил – 95%-диметилполисилоксан) UltraInert фирмы “Agilent Technologies” длиной 30 м, с внутренним диаметром 0.25 мм и толщиной пленки фазы 0.25 мкм, газ носитель – гелий, скорость потока– 1 мл/мин. Ввод пробы осуществляли без деления потока, температура инжектора составляла 280°С. Температура колонки: начальная температура 60°С, задержка 1.0 мин, промежуточная температура (1) 180°С, скорость подъема 20°C/мин, промежуточная температура (2) 290°С, скорость подъема 5°С/мин, конечная температура 325°С, скорость подъема 5°С/мин, задержка 10 мин. Объем вводимой пробы 1.0 мкл. Детектирование МЭЖК проводилось по полному ионному току [19]. Идентификацию ЖК осуществляли, сравнивая масс-спектры МЭЖК с масс-спектрами библиотеки NIST14 Национального Института Стандартов и Технологий США с высокой степенью совпадения [19]. Относительное содержание индивидуальных ЖК определяли в процентах от общего содержания ЖК в исследуемом образце.
Данные по относительному содержанию ЖК в пробах анализировали с использованием t-критерия Стьюдента и непараметрического критерия Колмогорова-Смирнова для пар независимых выборок. Различия между средними в выборках считались статистически значимыми при р < 0.05 и сомнительными при 0.05 ≤ р < 0.10.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ОБСУЖДЕНИЕ
Жирнокислотный состав сперматозоидов и яйцеклеток мидии в зависимости от стадии полового созревания. На хроматограммах (рис. 1, 2) представлен состав МЭЖК сперматозоидов и яйцеклеток мидии. Сумма всех идентифицированных нами НЖК в сперматозоидах составила 31.4%, в яйцеклетках – 42.4% (табл. 1). Содержание в яйцеклетках такой основной НЖК, как стеариновая (С18:0), было в два раза выше, чем в сперматозоидах. НЖК участвуют в образовании клеточных мембран как яйцеклеток, так и сперматозоидов [20, 21]. Наблюдаемое значительное преобладание их в женских половых продуктах, вероятно, связано с наличием в яйцеклетках запасных жиров, необходимых для развития зародыша.
Рис. 1.
Хроматограмма МЭЖК, выделенных из сперматозоидов мидии Mytilus galloprovincialis Черного моря. Отмечены кислоты: 1 – миристиновая (С14:0), 2 – 4,8,12-триметилтридекановая, 3 – пентадециловая (С15:0), 4 – пальмитолеиновая (С16:1ω9), 5 – пальмитиновая (С16:0), 6 – маргариновая (С17:0), 7 – стеаридоновая (С18:4ω3), 8 – 11,14-октадекадиеновая (С18:2ω4), 9 – α-линоленовая (С18:3ω3), 10 – стеариновая (С18:0), 11 – арахидоновая (C20:4ω6), 12 – эйкозапентаеновая (C20:5ω3), 13 – гондоевая (C20:1ω9), 14 – цервоновая (С22:6ω3).
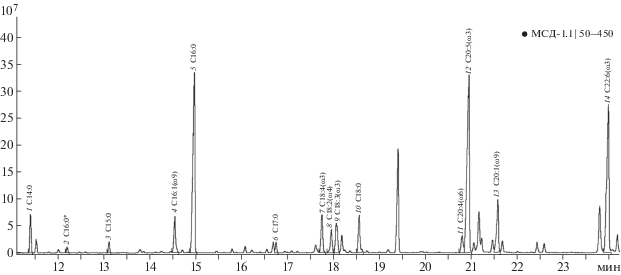
Рис. 2.
Хроматограмма МЭЖК, выделенных из яйцеклеток мидии Mytilus galloprovincialis Черного моря. Отмечены кислоты: 1 – миристиновая (С14:0), 2 – 4,8,12-триметилтридекановая, 3 – пентадециловая (С15:0), 4 – пальмитолеиновая (С16:1ω9), 5 – пальмитиновая (С16:0), 6 – маргариновая (С17:0), 7 – стеаридоновая (С18:4ω3), 8 – 11,14-октадекадиеновая (С18:2ω4), 9 – α-линоленовая (С18:3ω3), 10 – стеариновая (С18:0), 11 – арахидоновая (C20:4ω6), 12 – эйкозапентаеновая (C20:5ω3), 13 – гондоевая (C20:1ω9), 14 – цервоновая (С22:6ω3).
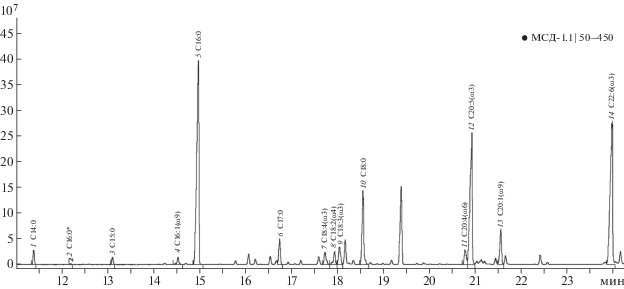
Таблица 1.
Содержание основных жирных кислот сперматозоидов, яйцеклеток и гонад разных стадий половой зрелости Mytilus galloprovincialis
| Некоторые идентифицированные жирные кислоты, % от суммы всех кислот | Сперма-тозоиды | Яйце-клетки | 2 м | 3 м | 4 м | 4 ж | 5 ж |
|---|---|---|---|---|---|---|---|
| Миристиновая (С14:0), или 1-тетрадекановая | 3.1 ± 0.25*† | 1.3 ± 0.04*† | 5.4 ± 0.32 | 3.4 ± 0.14 | 4.4 ± 0.18 | 11.12 ± 1.05 | 18.8 ± 0.49 |
| Пентадециловая (С15:0), или 1-пентадекановая | 0.9 ± 0.01*† | 0.8 ± 0.01*† | 1.40 ± 0.01 | 0.90 ± 0.04 | 1.40 ± 0.07 | 2.1 ± 0.02 | н.о. |
| Пальмитиновая (С16:0), или 1-гексадекановая | 22.4 ± 0.6*† | 30.3 ± 0.8*† | 31.2 ± 1.27 | 23.6 ± 1.13 | 28.4 ± 0.57 | 50.3 ± 2.62 | 12.4 ± 0.42 |
| Пальмитолеиновая (С16:1ω9), или 9-гексадеценовая | 3.7 ± 0.8 | 1.0 ± 0.04 | 11.8 ± 0.49 | 7.0 ± 0.37 | 5.1 ± 0.16 | н.о. | 11.9 ± 0.71 |
| Маргариновая (С17:0), или 1-гептадекановая | 0.5 ± 0.2*† | 1.1 ± 0.2*† | 1.50 ± 0.07 | 1.40 ± 0.06 | н.о. | 0.8 ± 0.04 | н.о. |
| Стеариновая (С18:0), или 1-октадекановая | 4.0 ± 0.8† | 8.9 ± 0.23† | 4.30 ± 0.10 | 3.80 ± 0.01 | 5.3 ± 0.23 | 16.7 ± 0.64 | 11.2 ± 0.71 |
| Элаидиновая (С18:1ω9), или 9-октадеценовая | н.о. | н.о. | 3.8 ± 0.32 | 4.2 ± 0.18 | 28.4 ± 0.78 | н.о. | 12 ± 0.71 |
| Линолевая( С18:2ω6), или 9,12-октадекадиеновая | н.о. | н.о. | 3.7 ± 0.21 | 3.20 ± 0.16 | 2.90 ± 0.21 | н.о. | 11.8 ± 0.71 |
| α-Линоленовая (С18:3ω3), или 9,12,15-октадекатриеновая | 4.0 ± 0.16 | 2.5 ± 0.07 | н.о. | н.о. | н.о. | н.о. | н.о. |
| Пиноленовая (С18:3ω6), или 5,9,12-октадекатриеновая | н.о. | н.о. | 3.6 ± 0.10 | 3.60 ± 0.18 | 5.0 ± 0.21 | н.о. | н.о. |
| Стеаридоновая (С18:4ω3), или 6,9,12,15-октадекатетраеновая | 4.0 ± 0.88 | 1.7 ± 0.01 | н.о. | н.о. | н.о. | н.о. | н.о. |
| Гондоевая (C20:1ω9), или 11-эйкозеновая | 6.1 ± 0.01 | 4.2 ± 0.6 | н.о. | н.о. | 2.4 ± 0.19 | 1.2 ± 0.01 | н.о. |
| Арахидоновая (C20:4ω6), или 5,8,11,14-эйкозатетраеновая | 2.2 ± 0.1† | 2.1 ± 0.1† | 0.10 ± 0.07 | 0.20 ± 0.04 | 0.10 ± 0.04 | н.о. | н.о. |
| Тимнодоновая (C20:5ω3), или 5,8,11,14,17-эйкозапентаеновая | 26.0 ± 0.7*† | 20.0 ± 0.7*† | 13.30 | 16.70 ± 0.07 | 6.2 ± 0.24 | 15.2 ± 0.71 | 12.9 ± 0.49 |
| Эруковая (C22:1ω9), или 13-докозеновая | н.о. | н.о. | 0.20 ± 0.03 | 0.10 ± 0.04 | н.о. | 2.3 ± 0.06 | н.о. |
| Цервоновая (С22:6ω3), или 4,7,10,13,16,19-докозагексаеновая кислота | 20.0 ± 0.07 | 24.4 ± 0.07 | 15.3 ± 0.28 | 29.9 ± 0.42 | 7.4 ± 0.39 | н.о. | 8.8 ± 0.04 |
| Сумма всех идентифицированных насыщенных жирных кислот (НЖК) | 31.4 | 42.4 | 44.3 | 33.6 | 42.8 | 81.32 | 42.6 |
| Сумма всех идентифицированных мононенасыщенных жирных кислот (МНЖК) | 9.8 | 5.1 | 15.8 | 11.3 | 33.5 | 3.5 | 13.9 |
| Сумма всех идентифицированных полиненасыщенных жирных кислот (ПНЖК) | 58.8 | 52.4 | 38.6 | 56.7 | 25.3 | 15.2 | 33.5 |
| Все омега-3 жирные кислоты (Общ. ω3) | 54.2 | 24.2 | 14.9 | 18.6 | 1.4 | 15.2 | 12.9 |
| Все омега-6 жирные кислоты (Общ. ω6) | 2.2 | 2.1 | 1.2 | 1.4 | 8.0 | 11.6 |
Примечание. Данные представлены в процентах от суммы всех ЖК как среднее ± ошибка среднего. 2 м, 3 м, 4 м–вторая, третья, четвертая стадии зрелости гонад мужских особей; 4 ж, 5 ж –четвертая и пятая стадии зрелости гонад женских особей, * – достоверные отличия согласно t-критерию Стьюдента; † – сомнительные отличия согласно критерию Колмогорова-Смирнова; н.о. – не обнаружено.
Необходимо отметить наличие в половых продуктах нехарактерной для мидий насыщенной 4,8,12-триметилтридекановой кислоты: в сперматозоидах ее относительное содержание составило 0.5%, а в яйцеклетках – 0.1%, что свидетельствует о возможном присутствии в среде, в которой проходил нерест, бактерий, для которых характерно наличие этой ЖК [22].
МНЖК в сперматозоидах мидий были представлены пальмитолеиновой (С16:1ω9, 3.7%) и гондоевой (C20:1ω9, 6.1%) кислотами. В яйцеклетках содержание этих кислот ниже, чем в сперматозоидах, и составило соответственно 1.0% и 4.2%.
Основные ПНЖК в сперматозоидах и яйцеклетках – эйкозапентаеновая (C20:5ω3) и цервоновая (С22:6ω3). Суммарное содержание всех ПНЖК в сперматозоидах достигало 58.8%, а в женских половых продуктах – 52.4%. В сумме ПНЖК около половины составляла эйкозапентаеновая кислота (C20:5ω3) – одна из нескольких омега-3 ПНЖК, которая, как известно, защищает структуру клеток от злокачественного перерождения [23]. Ее содержание в яйцеклетках и сперматозоидах мидии составило 20 и 26% соответственно. Вероятен факт превращения эйкозапентаеновой (C20:5ω3) кислоты в простагландины под действием ферментов [14], являющихся медиаторами с выраженным физиологическим эффектом.
Сперматозоиды и яйцеклетки мидии являются источником незаменимой арахидоновой (C20:4ω6) кислоты. Ее концентрация в мужских и женских половых продуктах примерно одинакова – 2%. В гонадах арахидоновая (C20:4ω6) кислота не была обнаружена. Человеческий организм может синтезировать ее из незаменимой омега-6-ненасыщенной линолевой кислоты [24]. В наших исследованиях линолевая кислота (С18:2ω6) в гонадах мидий была обнаружена практически на всех стадиях полового созревания, хотя в половых продуктах она не найдена. В сперматозоидах и яйцеклетках мидии нами обнаружена 11,14-октадекадиеновая (С18:2ω4) кислота – 2.5% и 1.7% соответственно.
До настоящего времени разработка химического синтеза арахидоновой (C20:4ω6) кислоты является чрезвычайно важной проблемой, поскольку ее выделение, например, из коры надпочечников человека, представляет значительные трудности, а в растительных маслах арахидоновая кислота практически отсутствует [25].
Жирнокислотный состав гонад мидии в зависимости от стадии половой зрелости. ЖК-состав гонад мидии изменяется в процессе полового созревания (табл. 1). В женских гонадах на ранних стадиях половой зрелости (с первой по третью) и в мужских (на первой и на пятой стадиях) существенно преобладают насыщенные ЖК (рис. 3). Основными (табл. 1) являются миристиновая (С14:0), пальмитиновая (С16:0) и стеариновая (С18:0). Лауриновая кислота (С12:0) идентифицирована на 2, 3 и 4 стадиях полового созревания в женских гонадах в количествах 0.30 ± 0.01, 1.1 ± 0.07 и 0.10 ± 0.04% соответственно и на 5 стадии в мужских гонадах – 2.5 ± 0.08%. Тридециловая (С13:0) кислота была обнаружена в женских гонадах на 2, 3 и 4 стадиях (0.80 ± 0.03%; 1.5 ± 0.04%; 0.10 ± 0.04%) и на 5 стадии в мужских гонадах (4.0 ± 0.14%), а трикозановая (С23:0) кислота в равных концентрациях (0.30 ± 0.01%) на 2 и 3 стадиях полового созревания исключительно в мужских гонадах. Содержание лигноцериновой (С24:0) кислоты на 2 стадии полового созревания в женских гонадах не превышала 0.40 ± 0.04%, а в мужских на 2 и 4 стадиях соответственно составила 0.20 ± 0.03% и 3.3 ± 0.14%. Содержание лауриновой (С12:0), тридециловой (С13:0), трикозановой (С23:0) и лигноцериновой (С24:0) кислот не отображены в табл. 1, но их вклад учтен в общей сумме всех идентифицированных насыщенных жирных кислот (НЖК). Содержание НЖК со второй по четвертую стадию полового созревания в женских гонадах было выше на 20%, чем в мужских гонадах в этот же период развития.
Рис. 3.
ЖК-состав (в % от общей суммы всех ЖК) сперматозоидов, яйцеклеток и гонад разных стадий половой зрелости мидии Mytilus galloprovincialis Черного моря.
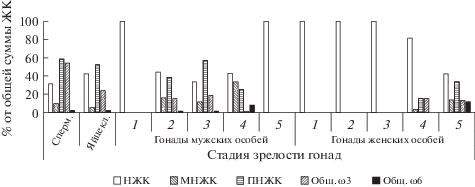
На первой стадии полового созревания в мужских гонадах и с первой по третью стадии полового созревания в женских МНЖК и ПНЖК отсутствовали. Начиная со второй стадии, в мужских гонадах количество МНЖК и ПНЖК оказалось значительно выше, чем в женских, в которых МНЖК и ПНЖК были обнаружены только на четвертой и пятой стадиях. Такие кислоты, как эйкозадиеновая (C20:2ω6) и эйкозатриеновая (С20:3ω3), содержание которых не превышало 2%, найдены как в мужских, так и в женских гонадах лишь на 2–4 стадиях полового созревания.
Из литературных источников известно [26], что в гонадах мидии M. galloprovincialis, обитающей в прибрежной акватории Южной Африки с выраженными апвеллингами, обнаружено высокое содержание ПНЖК: арахидоновой (C20:4ω6), эйкозапентаеновой (C20:5ω3) и цервоновой (С22:6ω3) – кислот, необходимых для поддержания структуры и функционирования клеточных мембран. В связи с этим следует отметить, что в исследовании ЖК фосфолипидов мышечной ткани M. edulis из Белого и Черного морей было установлено, что изменение индекса ненасыщенности (ИН), в разных условиях существования мидии, не превышает 15–20% [20]. Такое ограничение позволяет поддерживать жидкостность мембран на уровне, необходимом для нормальной жизнедеятельности клетки [27, 28]. Результаты, полученные при исследовании устрицы Ostrea edulis у берегов Испании, показали сезонную вариабельность ЖК-состава в ее органах [29].
Различия в ЖК-составе у разных видов двустворчатых моллюсков объясняются выбором пищевых ресурсов, так как большая часть ЖК поступает в ткани мидий из микроводорослей [30–33]. Поскольку у двустворчатых моллюсков ограничен или вообще отсутствует синтез С20–С22 ПНЖК с более чем тремя двойными связями, они приобретают большинство полиненасыщенных ЖК, в частности, эйкозапентаеновую (C20:5ω3) и докозагексаеновую (С22:6ω3), из обогащенной этими кислотами пищи [34]. Наличие докозагексаеновой кислоты у мидии отражает способность к адаптациям с характерными структурными и функциональными механизмами “перестройки”, протекающими в биологических мембранах в ответ на изменение условий окружающей среды (температура, соленость и другие факторы) [35–37].
Присутствие эйкозапентаеновой (C20:5ω3) кислоты в высоких концентрациях (в наших исследованиях ее содержание в половых продуктах составило более 20%) является показателем потребления моллюсками диатомовых микроводорослей. Наличие ЖК с нечетным числом атомов в цепи (пентадециловой (С15:0), маргариновой (С17:0)) и с разветвленной цепью (4,8,12-триметилтридекановой) является биомаркером потребления мидиями бактерий [22].
ВЫВОДЫ
С помощью хромато-масс-спектрометрии впервые проведены анализ и идентификация ЖК-состава гонад, яйцеклеток и сперматозоидов мидии Mytilus galloprovincialis, культивируемой в Черном море. Установлено, что в исследованных органах и клетках мидии присутствует широкий спектр ЖК, из которых в настоящей работе выделены и идентифицированы 22. Особое биотехнологическое значение представляют половые продукты мидий, в которых относительное содержание ЖК достигает максимальных значений по сравнению с гонадами. В яйцеклетках содержание НЖК выше, чем в сперматозоидах. ПНЖК как в сперматозоидах, так и в яйцеклетках доминируют над НЖК и МНЖК. ЖК-состав гонад зависит от стадии полового созревания. С первой по четвертую стадии половой зрелости в женских гонадах преобладают НЖК. В мужских гонадах, начиная со второй стадии половой зрелости, в значительных количествах представлены МНЖК и ПНЖК. В женских гонадах МНЖК и ПНЖК отмечены нами только на 4 и 5 стадиях половой зрелости.
Таким образом, содержание ЖК в гонадах и половых продуктах мидий зависит от половой принадлежности и стадии полового созревания и соответствует природному сезонному циклу размножения этих животных. При этом следует отметить доступность мидий в качестве ценной сырьевой базы для получения биологически активных веществ различной природы.
Список литературы
Lipids in Aquatic Ecosystems (Eds. M.T. Arts, M.T. Brett, M.J. Kainz). Dordrecht. Springer. 2009.
The Mollusca. Volume 2 (Ed. P.W. Hochachka). New York. Academic Press. 1983.
Никонова Л.Л., Нехорошев М.В. Способ получения биологически активного вещества из средиземноморской мидии, Mytilus galloprovincialis Lam. Пат. Российская Федерация 2599834. 20.10.2016. [Nikonova L.L., Nekhoroshev M.V. Sposob polucheniya biolo-gicheski aktivnogo veshchestva iz sredizemnomorskoj midii, Mytilus galloprovincialis Lam. [The art of process of receiving biologically active agent from the Mediterranean mussel, Mytilus galloprovincialis Lam]. Patent Russian Federation 2599834. 10.20.2016 (in Russ).]
Никонова Л.Л., Нехорошев М.В., Рябушко В.И. Общий тестостерон и эстрадиол в гонадах и половых продуктах двустворчатого моллюска Mytilus galloprovincialis Lam. Ж. эвол. биохим. и физиол. 53 (6): 459–461. 2017. [Nikonova L.L., Nekhoroshev M.V., Ryabush-ko V.I. Total testosterone and estradiol in the gonads and gametes of the mussel Mytilus galloprovincialis Lam. J. Evol. Biochem. Physiol. 53 (6): 459–461. 2017 (in Russ).]
Апрышко Г.Н., Нехорошев М.В. Противоопухолевые препараты из морских организмов. Севастополь. 2000. [Apryshko G.N., Nekhoroshev M.V. Protivoopuholevye preparaty iz morskih organizmov. [Antineoplastic medicines from marine organisms]. Sevastopol. 2000 (in Russ).]
Капранова Л.Л., Рябушко В.И., Нехорошев М.В., Апрышко Г.И. Способ получения вещества из гонад мидий M. galloprovincialis, обладающего противоопухолевой активностью. Пат. Российская Федерация 2674033. 04.12.2018. [Kapranova L.L., Ryabushko V.I., Nekhoroshev M.V., Apryshko G.I. Sposob polucheniya veshchestva iz gonad midij M. galloprovincialis, obladayushchego protivoopuholevoj aktivnost’yu. [The art of process of receiving substance from gonads of mussels of M. galloprovincialis having antineoplastic activity]. Patent Russian Federation 2674033. 12.04.2018 (in Russ).]
Gabbott P.A. Developmental and seasonal metabolic activities in marine mollusks. The Mollusca. Volume 2 (Ed. P. Hochachka). P. 165–217. New York. Academic Press. 1983.
Parrish C.C. Essential fatty acids in aquatic food webs. Lipids in Aquatic Ecosystems (Eds. M.T. Arts, M.T. Brett, M. Kainz). p. 309–326. Dordrecht. Springer. 2009.
Berge J.-P., Barnathan G. Fatty acids from lipids of marine organisms: molecular biodiversity, roles as biomarkers, biologically active compounds, and economical aspects. Marine Biotechnology. Volume 1. Advances in Biochemical Engineering/Biotechnology Series. (Eds R. Ulber, Y. Le Gal). 96: 49–125. Berlin. Springer. 2005.
Conquer J.A., Martin J.B., Tummon I., Watson L., Tekpetey F. Fatty acid analysis of blood serum, seminal plasma, and spermatozoa of normozoospermic vs. asthenozoospermic males. Lipids. 34 (8): 793–799. 1999.
Marine Biotechnology. Volume 1. Advances in Biochemical Engineering/Biotechnology Series. (Eds. Y. Le Gal, R. Ulber). Berlin. Springer. 2005.
Besnard J.-Y., Lubet P., Nouvelot A. Seasonal variations of the fatty acid content of the neutral lipids and phospholipids in the female gonad of Pecten maximus L. Comp. Biochem. Physiol. B. 93: 21–26. 1989.
Dridi S., Salah Romdhane M., Elcafsi M. Seasonal variation in weight and biochemical composition of the Pacific oyster, Crassostrea gigas, in relation to the gametogenic cycle and environmental conditions of the Bizert lagoon, Tunisia. Aquacult. 263: 238–248. 2007.
Жиры рыб в диетотерапии гиперлипопротеидемий и гипертонии: обзорная информация. Под ред. И.М. Рослого. Издание Всесоюзного научно-исследовательского института медицинской и медико-технической информации Министерства здравоохранения СССР. M. 1988. [Zhiry ryb v dietoterapii giperlipoproteidemij i gipertonii: obzornaya informaciya. (pod red. I.M. Roslogo). [Fats of fishes in a dietary therapy of hyperlipoproteinemia and a hypertension: survey information. Ed. I.M. Roslyi)] M.: Vsesoyuznu nauchno-issledovatel’skyi institut medicinskoj i mediko-tekhnicheskoj informacii Ministerstva zdravoohraneniya SSSR. 1988. (in Russ).]
Пиркова А.В. Размножение мидии Mytilus galloprovincialis Lam. и элементы биотехнологии ее культивирования: автореф. дис. канд. биол. наук. Севастополь. 1994. [Pirkova A.V. Razmnozhenie midii Mytilus galloprovincialis Lam. i elementy biotekhnologii ee kul’tivirovaniya: Avtoref. kand. Diss. biol. nauk. [Reproduction of a mussel of Mytilus galloprovincialis Lam. and elements of biotechnology of its cultivation: PhD dissertation abstract]. Sevastopol. 1994 (in Russ).]
Золотницкий А.П. Экологические закономерности размножения мидии (Mytilus galloprovincialis Lam.) в различных районах Черного моря. Ученые записки Крымского федерального университета имени В.И. Вернадского. Сер. Биология, химия. 18 (2): 21–33. 2005. [Zolotnitsky A.P. Ekologicheskie zakonomernosti razmnozheniya midii (Mytilus galloprovincialis Lam.) v razlichnyh rajonah Chernogo morya. [Ecological regularities of reproduction of a mussel (Mytilus galloprovincialis Lam.) in various regions of the Black Sea]. Scientific Notes of V.I. Vernadsky Crimean Federal University. Biology. Chemistry. 18 (2): 21–33. 2005 (in Russ).]
Караванцева Н.В., Поспелова Н.В., Бобко Н.И. Нехорошев М.В. Методика отбора половых продуктов мидии Mytilus galloprovincialis Lam. Системы контроля окружающей среды. 17: 184–187. 2012. [Karavantse-va N.V., Pospelova N.V., Bobko N.I., Nehoroshev M.V. Technique for collection of mussel Mytilus galloprovincialis Lam. gametes. Sistemy kontrolya okruzhayushchej sredy [Environment control systems]. 17: 184–187. 2012. (in Russ).]
Кейтс М. Техника липидологии: Выделение, анализ и идентификация липидов. М: Мир. 1975. [Kates M. Techniques of lipidology: isolation, analysis and identification of lipids. North-Holland Pub. Co. 1972. (Russ Ed.: Kates M. Tekhnika lipidologii: Vydelenie, analiz i identifikaciya lipidov. M: Mir. 1975).]
Хасанов В.В., Рыжова Г.Л., Дычко К.А., Куряева Т.Т. Состав жирных кислот и стероидов растительных масел. Химия растительного сырья. 3: 27–31. 2006. [Khasanov V.V., Ryzhova G.L., Dychko K.A., Kuryaeva T.T. Sostav zhirnyh kislot i steroidov rastitel’nyh masel [Composition of fatty acids and steroids of vegetable oils]. Himiya rastitelnogo syrya [Chemistry of vegetable raw materials]. 3: 27–31. 2006 (in Russ).]
Чеботарева М.А., Забелинский С.А., Шуколюкова Е.П., Кривченко А.И. Предел изменения индекса ненасыщенности жирнокислотного состава фосфолипидов при адаптациях моллюсков к биогенным и абиогенным факторам внешней среды. Ж. эвол. биохим. и физиол. 47 (5): 383–387. 2011. [Chebotareva M.A., Zabelinskii S.A., Shukolyukova E.P., Krivchenko A.I. Limit of change in unsaturation index of fatty acid composition of phospholipids at adaptation of molluscs to biogenic and abiogenic environmental factors. J. Evol. Biochem. Physiol. 47 (5): 383–387. 2011 (in Russ).]
Фокина Н.Н., Нефедова З.А., Немова Н.Н. Липидный состав мидий Mytilus edulis L. Белого моря. Влияние некоторых факторов среды обитания. Петрозаводск. 2010. [Fokina N.N., Nefedova Z.A., Nemova N.N. Lipidnyj sostav midij Mytilus edulis L. Belogo morya. Vliyanie nekotoryh faktorov sredy obitaniya [Lipidic structure of mussels Mytilus edulis L. in White Sea. Influence of some environment factors]. Petrozavodsk. 2010 (in Russ).]
Gosling E. Marine Bivalve Molluscs. Chichester. Wiley-Blackwell. 2015.
Гаврисюк В.К. Применение Омега-3 полиненасыщенных жирных кислот в медицине. Укр. пульмон. журн. 3: 5–10. 2001. [Gavrisyuk V.K. Primenenie Omega-3 polinenasyshchennyh zhirnyh kislot v medicine. [Application the Omega-3 of polyunsaturates fatty acids in medicine]. Ukr. pul’mon. zhurn. [Ukrainian pulmonary journal]. 3: 5–10. 2001 (in Russ).]
Уайт А., Хендлер Ф., Смит Э., Хилл Р., Леман И. Основы биохимии. М.: Мир. 1981. [White A., Handler Ph., Smith E.L., Hill R.L, Lehman I.R. Principles of Biochemistry (sixth edition). McGraw-Hill Inс. 1978. (Russ Ed.: White A., Handler Ph., Smith E.L., Hill R.L, Lehman I.R. Osnovy biohimii. M.: Mir. 1981).]
Майофис Л.С. Химия и технология химико-фармацевтических препаратов. Л.: Медгиз. 1968. [Mayofis L.S. Himiya i tekhnologiya himiko-farmacevticheskih preparatov. [Chemistry and technology of chemical and pharmaceutical medicines]. L.: Medgiz. 1968. (in Russ).]
Puccinelli E., McQuaid C.D., Noyon M. Spatio-temporal variation in effects of upwelling on the fatty acid composition of benthic filter feeders in the southern Benguela ecosystem: Not all upwelling is equal. PLoS One. 11 (8). 2016.
Крепс Е.М. Липиды клеточных мембран. Л.: Наука. 1981. [Kreps E.M. Lipidy kletochnyh membrane [Lipids of cellular membranes]. L.: Nauka. 1981 (in Russ).]
Fernández A., Grienke U., Soler-Vila A., Guihéneuf F., Stengel D.B., Tasdemir D. Seasonal and geographical variations in the biochemical composition of the blue mussel (Mytilus edulis L.) from Ireland. Food Chem. 177: 43–52. 2015.
Abad M., Ruiz C., Martinez D., Mosquera G., Sánchez J.L. Seasonal variations of lipid classes and fatty acids in flat oyster, Ostrea edulis, from San Cibran (Galicia, Spain). Comp. Biochem. Physiol. 110: 109–118. 1995.
Kraffe E., Grall J., Le Duff M., Soudant P., Marty Y. A striking parallel between cardiolipin fatty acid composition and phylogenetic belonging in marine bivalves: a possible adaptive evolution? Lipids. 43: 961–970. 2008.
Martínez Pita I., Sánchez Lazo C., García F.J. Influence of microalga lipid composition on the sexual maturation of Mytilus galloprovincialis: a hatchery study // Aquacult. Nutr. 22: 202–216. 2014.
Ezgeta-Balić D., Najdek M., Peharda M., Blažina M. Seasonal fatty acid profile analysis to trace origin of food sources of four commercially important bivalves. Aquacult. 334–337: 89–100. 2012.
Поспелова Н.В., Трощенко О.А., Субботин А.А. Изменчивость кормовой базы двустворчатых моллюсков в двухлетнем цикле выращивания на мидийно-устричной ферме (Черное море, Голубой залив). Ученые записки Крымского федерального университета имени В.И. Вернадского. Сер. Биология. Химия. 4 (70): 148–164. 2018. [Pospelova N.V., Tro-shchenko О.А., Subbotin А.А. Variability of food reserve of bivalves in the two-year growing cycle on the mussel-oyster farm (Black sea, Blue gulf). Scientific Notes of V.I. Vernadsky Crimean Federal University. Biology. Chemistry. 4 (70): 148–164. 2018 (in Russ).]
Patil V., Källqvist T., Olsen E., Vogt G., Gislerød H.R. Fatty acid composition of 12 microalgae for possible use in aquaculture feed. Aquacult Int. 15: 1–9. 2007.
Orban E., Di Lena G., Nevigato T., Casini I., Marzetti A., Caproni R. Seasonal changes in meat content, condition index and chemical composition of mussels (Mytilus galloprovincialis) cultured in two different Italian sites. Food Chem. 77: 57–65. 2002.
Dernekbaşı S., Öksüz A., Çelik M. Y., Karayücel I., Karayücel S. The fatty acid composition of cultured mussels (Mytilus galloprovincialis Lamarck, 1819) in offshore longline system in the Black Sea. J. Aquacult. Marine Biol. 2 (6). 2015.
Narváez M., Freites L., Guevara M., Mendoza J., Gu-derley H., Lodeiros C.J., Salazar G. Food availability and reproduction affects lipid and fatty acid composition of the brown mussel, Perna perna, raised in suspension culture. Comp. Biochem. Physiol. B. 149: 293–302. 2008.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


