Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 6, стр. 443-446
РЕГУЛЯТОРНЫЕ ЭФФЕКТЫ ИНТРАНАЗАЛЬНО ВВОДИМЫХ С-ПЕПТИДА И ИНСУЛИНА НА ТИРЕОИДНЫЙ И АНДРОГЕННЫЙ СТАТУС У САМЦОВ КРЫС СО СРЕДНЕТЯЖЕЛОЙ ФОРМОЙ ДИАБЕТА 1-ГО ТИПА
К. В. Деркач 1, В. М. Бондарева 1, А. О. Шпаков 1, *
1 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии
и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 21.06.2019
После доработки 25.07.2019
Принята к публикации 15.08.2019
В настоящее время имеются свидетельства того, что С-пептид проинсулина, продукт биосинтеза инсулина в панкреатических β-клетках, контролирует множество физиологических и биохимических процессов в организме [1]. Свои регуляторные эффекты С-пептид может осуществлять самостоятельно или путем образования комплексов с инсулином, усиливая и модулируя тем самым действие инсулина на ткани-мишени [2]. При сахарном диабете 1-го типа (СД1) с характерным для него дефицитом инсулина и С-пептида показан восстанавливающий эффект С-пептида на функции сосудов, на нервную и выделительную системы, установлен его антиоксидантный и противовоспалительный эффекты в различных тканях [3].
Нами ранее показано, что одним из подходов для коррекции метаболических и гормональных нарушений при СД1 является интраназальный способ введения С-пептида и его смеси с инсулином [4, 5]. Это обусловлено восстановлением уровней С-пептида и инсулина в ЦНС и нормализацией центральной регуляции ими физиологических и биохимических процессов в организме. Совместное использование С-пептида и инсулина более эффективно, чем их применение по отдельности. Это может быть обусловлено синергизмом их эффектов на клеточные сигнальные каскады или повышенной активностью гетероолигомерных комплексов инсулина и С-пептида в сравнении с их гомоолигомерными комплексами. Нами показано, что при обработке крыс с СД1 смесью С-пептида и инсулина, взятых в эквимолярных количествах, ослабляется гипергликемия и частично восстанавливается активность аденилатциклазной системы в тканях-мишенях [5], а в случае крыс с декомпенсированным СД2 улучшается чувствительность тканей к инсулину и глюкозе [4]. В основе этого лежит нормализация активности компонентов 3-фосфоинозитидного каскада в гипоталамических нейронах [6]. Поскольку эти нейроны играют ключевую роль в регуляции гипоталамо-гипофизарно-тиреоидной и -гонадной осей, то интраназальное введение С-пептида и его смеси с инсулином может улучшить тиреоидный и андрогенный статус у крыс с СД1, нарушенный при этой диабетической патологии. Однако такие данные в настоящее время отсутствуют. Необходимо отметить, что, как было показано нами ранее, длительное введение интраназального инсулина крысам с СД1 стимулирует у них выброс тиреотропного гормона (ТТГ) и восстанавливает уровни тиреоидных гормонов [7].
Целью работы было изучить влияние лечения самцов крыс Wistar со среднетяжелым СД1 интраназально вводимыми С-пептидом и инсулином и их смеси на уровни ТТГ, тиреоидных гормонов и тестостерона. Как известно, ТТГ, вырабатываемый тиреотрофами гипофиза в ответ на стимуляцию гипоталамическим фактором тиролиберином, индуцирует продукцию тироксина тиреоцитами щитовидной железы. Затем тироксин с помощью 2-дейодиназы превращается в трийодтиронин, основной эффекторный гормон тиреоидной оси. Тестостерон, продуцируемый клетками Лейдига семенников в ответ на стимуляцию гонадотропинами, является основным эффекторным гормоном гонадной оси у мужчин.
Для исследований были взяты трехмесячные самцы крыс Wistar. Все эксперименты проводили в соответствии с правилами, утвержденными Этическим Комитетом ИЭФБ РАН (30.12.2015 г.), и требованиями Директивы 1986 Европейского парламента. СД1 индуцировали однократной обработкой крыс стрептозотоцином (“Sigma”, США) в дозе 50 мг/кг, растворяя его в 0.1 М Na+-цитратном буфере (pH 4.5). Через 5 нед отбирали крыс с уровнем глюкозы выше 15 мМ и рандомизировали их на 4 группы, в каждой по 5 крыс. Контрольной группе вместо стрептозотоцина вводили буфер. Были сформированы следующие группы (во всех n = 5): контроль (К), диабетические крысы, получавшие физиологический раствор (Д), обработанные интраназально вводимым С-пептидом в дозе 36 мкг/крысу (ДС), интраназально вводимым инсулином в дозе 0.5 МЕ/крысу (ДИ) или их смесью в тех же дозах (ДСИ). Продолжительность лечения составила 7 суток. Уровень глюкозы в крови, полученной из хвостовой вены, измеряли с помощью тест-полосок One Touch Ultra (США). Уровни инсулина и ТТГ оценивали с использованием иммуноферментных наборов Rat Insulin ELISA (“Mercodia AB”, Швеция) и Rat TSH ELISA (“Cusabio Biotech. Co., Ltd.”, Wuhan, China). Содержание гликированного гемоглобина (HbA1c) измеряли с помощью набора Multi Test HbA1c System (“Polymer Technology Systems, Inc.”, США). Уровни свободного (fT4) и общего (tT4) тироксина, свободного (fT3) и общего трийодтиронина (tT3) и тестостерона оценивали с помощью наборов фирмы “Иммунотех” (Россия). Измерения оптической плотности проводили с использованием спектрофотометра Anthos Absorbance Reader 2020 (“Anthos Labtec Instruments”, Австрия). Забор крови для определения уровней ТТГ и тиреоидных гормонов проводили на седьмой день эксперимента, в 13.00, через 3 ч после интраназального введения препаратов, в то время как уровень тестостерона измеряли в 13.00 до начала и на третий, пятый и седьмой дни эксперимента. Данные представлены как M ± SD. Нормальность распределения проверяли с помощью критерия Шапиро–Уилка. Для сравнения двух выборок с нормальным распределением использовали t-критерий Стьюдента, для сравнения трех и более групп – дисперсионный анализ с поправкой Бонферрони. Статистически значимыми считали отличия при p < 0.05.
У крыс с СД1 масса тела была значительно снижена в сравнении с контролем. В диабетических группах перед лечением она составила 197 ± 6 г (n = = 20), что почти в полтора раза ниже, чем в контроле (296 ± 10 г, n = 5). При лечении диабетических крыс С-пептидом и инсулином отмечали тенденцию к повышению массы тела, хотя ни в одном случае различия с группой Д не были статистически значимыми (табл. 1). В диабетических группах перед началом лечения отмечали сильно выраженную гипергликемию и относительный дефицит инсулина. Так, уровень постпрандиальной глюкозы в них составил 20.4 ± 0.8 мМ (n = 20), что в 4.5 раза выше, чем в контроле (4.5 ± 0.4 мМ, n = 5). Содержание HbA1c у диабетических крыс было значительно повышено в сравнении с контрольными животными (10.7 ± 0.9%, n = 20, vs. 4.2 ± 0.4%, n = = 5, p < 0.05). В то же время уровень инсулина в крови диабетических крыс был ниже, чем в контроле (0.19 ± 0.04 нг/мл, n = 20, vs. 0.71 ± 0.19 мМ, n = 5, p < 0.05). При лечении инсулином и смесью С-пептида и инсулина ослаблялась гипергликемия и снижался уровень HbA1c, однако в группах ДИ и ДСИ статистически значимо от группы Д отличалось только содержание HbA1c. При этом уровни инсулина при всех вариантах лечения не менялись (табл. 1).
Таблица 1.
Масса тела и уровни глюкозы, HbA1c, инсулина, ТТГ и тиреоидных гормонов у крыс со среднетяжелой формой СД1 и влияние на них лечения интраназально вводимыми С-пептидом (36 мкг/кг), инсулином (0.5 МЕ/крысу) и их смесью
| Показатель | К, n = 5 | Д, n = 5 | ДС, n = 5 | ДИ, n = 5 | ДСИ, n = 5 |
|---|---|---|---|---|---|
| Масса тела, г | 323 ± 11 | 204 ± 14* | 214 ± 18* | 223 ± 17* | 224 ± 14* |
| Глюкоза, мМ | 4.3 ± 0.3 | 21.7 ± 3.9* | 18.0 ± 3.7* | 17.5 ± 2.7* | 17.0 ± 3.1* |
| HbA1c, % | 4.1 ± 0.3 | 10.5 ± 1.8* | 8.8 ± 0.6* | 7.7 ± 1.2*# | 7.8 ± 0.9*# |
| Инсулин, нг/мл | 0.82 ± 0.18 | 0.15 ± 0.05* | 0.16 ± 0.06* | 0.13 ± 0.06* | 0.17 ± 0.09* |
| ТТГ, мкМЕ/мл | 0.57 ± 0.21 | 0.27 ± 0.13 | 0.31 ± 0.14 | 0.50 ± 0.19 | 0.67 ± 0.23# |
| fT4, пМ | 29.8 ± 3.9 | 18.8 ± 2.2* | 21.1 ± 4.1 | 24.5 ± 3.6# | 24.1 ± 3.1# |
| tT4, нМ | 129 ± 16 | 75 ± 12* | 87 ± 17* | 94 ± 15* | 108 ± 16# |
| fT3, пМ | 4.3 ± 0.4 | 2.6 ± 0.3* | 2.5 ± 0.4* | 3.4 ± 0.4*# | 3.8 ± 0.6# |
| tT3, нМ | 2.8 ± 0.3 | 2.0 ± 0.3* | 2.1 ± 0.5* | 2.3 ± 0.3* | 2.7 ± 0.5 |
Исследование тиреоидной системы показало, что у диабетических крыс достоверно снижены уровни тиреоидных гормонов, а также имеется тенденция к снижению уровня ТТГ, хотя различия с контролем в этом случае не были статистически значимыми (p = 0.053) (табл. 1). Лечение инсулином и его смесью с С-пептидом частично восстанавливало эти показатели, в то время как С-пептид в отдельности был не эффективен. Основываясь на этих результатах и на данных, полученных нами ранее при исследовании длительного введения диабетическим крысам одного интраназального инсулина [7], можно заключить, что поступающий в структуры мозга инсулин положительно влияет на гипоталамические нейроны, продуцирующие тиролиберин, и это приводит к повышению уровня ТТГ и усилению его регуляторного влияния на синтез и секрецию тиреоидных гормонов щитовидной железой. В комплексе с С-пептидом инсулин действует более эффективно, на что указывает обнаруженное нами усиление его стимулирующего эффекта на тиреоидную ось в группе ДИ (табл. 1).
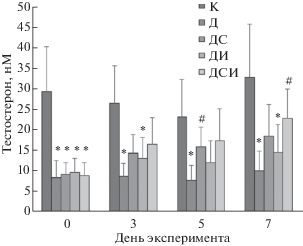
Уровни тестостерона во всех диабетических группах до начала лечения были значимо снижены и составляли в среднем около 30% от таковых в контроле (рис. 1). Через 3 и 5 дней после начала лечения отмечали повышение уровня тестостерона во всех группах, в наибольшей степени в группах ДС и ДСИ. По окончании эксперимента, на седьмой день, уровни тестостерона в группах ДС и ДСИ превышали таковые в группе Д на 83 и 126%, причем различия между группами Д и ДСИ были статистически значимы (рис. 1). При повышении продолжительности лечения восстанавливающий эффект С-пептида как при раздельном применении, так и в смеси с инсулином, не только сохранялся, но даже усиливался, в то время как соответствующий эффект инсулина, напротив, ослабевал, и к седьмому дню становился небольшим (рис. 1). Это может быть обусловлено тем, что С-пептид в комплексе с эндогенным или дополнительно вводимым инсулином активирует сигнальные пути в гипоталамических нейронах, ответственные за продукцию гонадолиберина и активацию гонадной оси.
Рис. 1.
Влияние лечения крыс с СД1 с помощью интраназально вводимых С-пептида и инсулина на уровни тестостерона в крови животных
Принятые сокращения: контрольная группа (К); крысы с сахарным диабетом 1-го типа без лечения (Д); диабетические крысы, получавшие в течение семи дней лечение интраназально вводимыми С-пептидом (ДС) или инсулином (ДИ) или их смесью (ДСИ). Взятие крови для измерения концентрации тестостерона осуществляли за день до начала эксперимента (точка “0”), а также на третий, пятый и седьмой дни эксперимента (в 13.00). * – различия между контрольной и диабетическими группами статистически значимы при p < 0.05; # – различия между группой Д и группами ДС, ДИ и ДСИ статистически значимы при p < 0.05. Все значения представлены как M ± SD.
Таким образом, совместное интраназальное введение инсулина и С-пептида оказывает выраженный восстанавливающий эффект на продукцию тиреоидных гормонов и тестостерона у самцов крыс со среднетяжелой формой СД1. Монотерапия инсулином эффективно влияла только на восстановление продукции тиреоидных гормонов, в то время как монотерапия С-пептидом – на восстановление синтеза тестостерона, причем в обоих случаях монотерапия менее эффективна, чем комбинированная терапия. Совокупность полученных данных свидетельствует о синергизме стимулирующих эффектов инсулина и С-пептида на гипоталамические звенья тиреоидной и гонадной осей, что дает дополнительные свидетельства в пользу гипотезы о функциональной важности образования гетероолигомерных комплексов между инсулином и С-пептидом [2], в том числе для осуществления гипоталамической регуляции эндокринных функций.
Список литературы
Wahren J., Kallas A., Sima A.A. The clinical potential of C-peptide replacement in type 1 diabetes. Diabetes. 61 (4): 761–772. 2012.
Landreh M., Johansson J., Jörnvall H. C-peptide: a molecule balancing insulin states in secretion and diabetes-associated depository conditions. Horm. Metab. Res. 45 (11): 769–773. 2013.
Luppi P., Drain P. Autocrine C-peptide mechanism underlying INS1 beta cell adaptation to oxidative stress. Diabetes Metab. Res. Rev. 30: 599–609. 2014.
Derkach K.V., Bondareva V.M., Shpakov A.O. Coadministration of intranasally delivered insulin and proinsulin C-peptide to rats with the types 1 and 2 diabetes mellitus restores their metabolic parameters. Adv. Gerontol. 8 (2): 139–146. 2018.
Derkach K.V., Bondareva V.M., Perminova A.A., Shpakov A.O. C-peptide and insulin during combined intranasal administration improve the metabolic parameters and activity of the adenylate cyclase system in the hypothalamus, myocardium, and epididymal fat of rats with type 2 diabetes. Cell Tiss. Biol. 13 (3): 228–236. 2019.
Derkach K.V., Perminova A.A., Buzanakov D.M., Shpakov A.O. Intranasal administration of proinsulin C-peptide enhances the stimulating effect of insulin on insulin system activity in the hypothalamus of diabetic rats. Bull. Exp. Biol. Med. 167 (3): 351–355. 2019.
Derkach K.V., Bogush I.V., Berstein L.M., Shpakov A.O. The influence of intranasal insulin on hypothalamic-pituitary-thyroid axis in normal and diabetic rats. Horm. Metab. Res. 47 (2): 916–924. 2015.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


