Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 6, стр. 433-442
ОСОБЕННОСТИ ИЗМЕНЕНИЯ АВТОНОМНОЙ РЕГУЛЯЦИИ МЫШЕЧНЫХ ЭФФЕКТОРОВ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ В ОНТОГЕНЕЗЕ ЧЕЛОВЕКА
В. П. Нестеров 1, *, А. И. Бурдыгин 1, С. В. Нестеров 1, К. Б. Иванов 1, С. М. Коротков 1, К. В. Соболь 1, И. В. Шемарова 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: nesterov@iephb.ru
Поступила в редакцию 21.06.2018
После доработки 17.07.2019
Принята к публикации 07.08.2019
Аннотация
Исследование посвящено экспериментальной проверке гипотезы авторов о том, что в процессе онтогенеза у пожилых людей формируется эндогенный функциональный механизм предохранения мышечных эффекторов сердечно-сосудистой системы (ССС) от негативного воздействия избыточной активности симпатического нейромедиаторного норадреналина путем его частичной замены гуморальными катехоламинами. Данное исследование выполнено с помощью разработанного нами метода артериальной пьезопульсометрии, позволяющего оценивать показатели кардиогемодинамики, а также спектральной мощности колебаний параметров VmaxPP и TNN пульсовых волн АД крови, вызванных регуляторным воздействием вегетативной нервной, а также эндокринной систем. Предполагается, что такая замена имеет важное значение для повышения метаболической устойчивости ССС пожилых людей к условиям возрастного нарастания кислородной недостаточности, а также для снижения вероятности возникновения тахиаритмий, стенокардии и других патологических состояний сердца при воздействии психоэмоциональных и физических стрессорных факторов.
ВВЕДЕНИЕ
Заболевания cердечно-сосудистой системы (ССС) у человека являются основной причиной смертности. Ведущим фактором патогенеза сердечно-сосудистых заболеваний является кислородная недостаточность, возникающая в основном при развитии ишемической болезни сердца (ИБС), а также в процессе естественного старения организма, когда сокращается и снабжение миокарда кислородом, и эффективность его использования. Кислородная недостаточность (КН) в ССС прежде всего угнетает энергопродуцирующие процессы окислительного фосфорилирования в митохондриях (М), нарушая их энергетическую функцию в кардиомиоцитах (КМ) и гладкомышечных клетках (ГМК) кровеносных сосудов. Как следствие, снижается эффективность энергозависимых процессов в миоцитах, например, активного мембранного транспорта катионов, обеспечивающего мембранный электрогенез и электромеханическое сопряжение. В итоге это может привести к ослаблению сократительной способности миокарда и снижению насосной функции сердца в целом. Может возникнуть сердечная недостаточность, крайним проявлением которой может стать острый инфаркт миокарда (ОИМ). У пожилых людей к снижению инотропного ресурса миокарда добавляются возрастные изменения характера регуляции ССС со стороны вегетативной (автономной) нервной, а также эндокринной систем. Одним из наиболее заметных среди таких изменений у пожилых людей является нарастание дефицита активации мышечных эффекторов ССС через β-адренорецепторы их поверхностной мембраны (“β-adrenergic desensitization”) [1, 2].
В последнее время при оценке функционального состояния и характера вегетативной регуляции ССС у человека широкое распространение получили пульсометрические методы и среди них одним из наиболее точных является разработанный нами вариант метода дифференциальной сфигмографии – метод артериальной пьезопульсометрии (АПП) [3]. С помощью этого метода ранее нами было показано, что в первые 10 минут в группе практически здоровых молодых людей воздействие экспериментальной острой гипоксии (ОГ; 8% О2) лучше переносят испытуемые с относительным нарастанием парасимпатического (vagal) влияния на миокард, по сравнению с симпатическим влиянием [4]. Применение вейвлет-преобразования при спектральном анализе вариабельности сердечного ритма (СР) испытуемых подтвердило смещение индекса баланса вегетативной регуляции мышечных эффекторов СCC – SVIx у части наиболее резистентных к воздействию ОГ молодых людей в сторону увеличения активности парасимпатического звена регуляции относительно симпатического, по сравнению с большинством испытуемых [5]. Результаты наших более поздних исследований также свидетельствовали о значительном относительном снижении уровня активности симпатической регуляции ССС (уменьшение индекса SVIx) у пожилых людей, по сравнению с молодыми [3]. Сопоставление этих результатов позволило нам предположить, что описанная “β-adrenergic desensitization” в ССС у пожилых людей может являться не только следствием возрастного нарушения у них состояния вегетативной нервной системы (ВНС). В процессе онтогенеза могли выработаться эндогенные адаптационные функциональные механизмы предохранения сердца стареющих людей от возможного резкого деструктивного возрастания активности периферических эфферентов симпатической нервной регуляции мышечных эффекторов их CCC, что может случиться при внезапном действии различных психоэмоциональных и физических стрессоров. Такое предположение согласовывалось со сложившимся в литературе представлением о том, что у лиц с эмоциональной неустойчивостью и с более высоким содержанием адреналина в крови воздействие ОГ существенно сдвигает баланс активности центральных механизмов регуляции в сторону усиления симпатического влияния, что вызывает у них выраженную психоэмоциональную стресс-реакцию, в отличие от более устойчивых к гипоксии испытуемых [6]. Предполагая возможное участие ВНС в кардиопротекции у пожилых людей, мы учитывали усиливающийся в последнее время интерес к выявлению эндогенных молекулярных механизмов, сформированных у ряда позвоночных животных в процессе их эволюции и направленных на защиту и адаптацию их сердца к условиям воздействия периодически возникающей природной КН [7]. В экспериментах на собаках впервые была использована способность симпатических эфферентов ВНС стимулировать тахиаритмию и даже фибрилляцию желудочков, вызванную реперфузией сердца [8], а также было установлено, что парасимпатическая стимуляция оказывает противоположное защитное действие на сердце [9]. Бета-блокаторы, снижающие чувствительность β-рецепторов мышечных эффекторов ССС к воздействию симпатических эфферентов ВНС, широко используются в кардиологии для снижения риска внезапной смерти пациентов при ОИМ и в постинфарктный период [10]. Однако из-за ограниченных возможностей используемых пульсометрических методов пока не удалось достаточно полно исследовать функциональные механизмы периферического симпатовагального комплекса вегетативной регуляции мышечных структур ССС у человека, которые обеспечивали бы поддержание адекватного потребностям его организма АД крови. На основании изложенного мы поставили перед собой задачу применить метод АПП для сравнительного неинвазивного изучения возрастных особенностей кардиогемодинамики (КГД) и характера автономной регуляции мышечных эффекторов ССС у лиц пожилого и старческого (более 80 лет) возраста. Форсажная симпатоадреналовая активация этих эффекторов, происходящая у пожилых людей при воздействии разных стрессорных факторов, может привести к возникновению тахиаритмий, гипертензии и других состояний ССС, которые могут стать причиной гипертонического криза, ОИМ и других патологий, опасных для их жизни. Целью данной работы явилось выявление у пожилых людей возможных эндогенных функциональных механизмов защиты их ССС от воздействия экстремальных и стрессорных условий, а также от нарастающей с годами кислородной недостаточности. Относительный рост популяции пожилых людей в мире и возрастающее воздействие на них различных негативных стрессорных факторов определяют актуальность такого исследования.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
В данной работе использованы данные, полученные при пульсометрическом обследовании функционального состояния ССС у практически здоровых (без патологии ССС в анамнезе) 116 добровольцев (мужчины и женщины) в возрасте 18–85 лет в нормальных условиях физического и эмоционального покоя. Было выполнено свыше 160 сеансов обследования, в каждом из которых стандартная регистрация длилась 5–10 мин, что позволяло проанализировать до 600 пульсовых волн АД крови. Это обеспечивало необходимую статистическую точность анализа параметров волн АД. Результаты индивидуального анализа в данной работе объединяли в соответствующие возрастные группы; исследовали центральные (aorta и а. carotis) и периферические (a. radialis) артериальные сосуды. Были использованы также данные, полученные ранее на молодых (18–25 л.) практически здоровых некурящих добровольцах-мужчинах, которые дали информированное согласие принять участие в исследовании воздействия кислородно-азотной нормобарической газовой смеси – экспериментальной острой гипоксии (ОГ; 8–9% О2) на характер автономной регуляции их ССС [4, 5]. Обследование проводили с помощью разработанного нами (Патенты РФ на изобретение) метода артериальной пьезопульсометрии (АПП) и изготовленного в ООО “ВАСА-ПУЛЬС” (г. Санкт-Петербург) соответствующего экспериментального компьютерного комплекса (АПП-2 – “Пьезопульсар”). Аппаратную базу комплекса составляли два синхронно функционирующих пьезокерамических датчика и адаптер-преобразователь, осуществляющий интерфейс между датчиками и персональным компьютером. Комплекс прошел клинические испытания в ФМИЦ им. В.А. Алмазова МЗ РФ, а также в Клинической больнице РАН (г. Санкт-Петербург), которые показали, что данный вариант метода дифференциальной сфигмографии адекватно отражает функциональные свойства ССС у человека и достоверно оценивает их количественные показатели [11].
Специально разработанное программное обеспечение визуализировало локальные изменения пульсового давления (ПД) крови (ПД = РР = = САД – ДАД, где РР – англ. pulse pressure [mm Hg]) в виде двух (или одной, по выбору) дифференциальных пульсограмм. Осуществлялись непрерывная запись, преобразование, математическая обработка и отображение получаемых результатов на мониторе ПК c последующим их сохранением на жестком диске ПК в виде файлов. Разработка методологии АПП была начата нами инициативно еще в 90-е годы ХХ века [12], однако без соответствующей поддержки она развивалась медленно, а ее результаты, как нам представляется, были недостаточно полно изложены в публикациях. Поэтому мы решили в этой статье несколько расширить описание метода АПП.
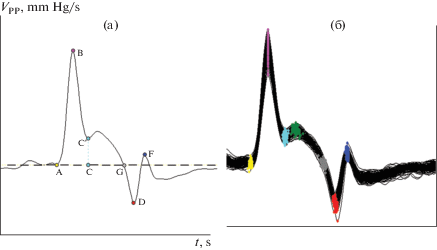
На рис. 1 представлены два графика одного кардиоцикла, построенных на основе артериальной пьезопульсограммы (I), где по оси Y отложена скорость изменения пульсового АД – VPP = dPР/dt [mm Hg/s], а по оси “Х” – время – t [s], и, для сравнения, представлен график (II), соответствующий обычной сфигмограмме, где по оси Y отложены значения РР [mm Hg], а по оси Х – время t [s]. Пьезопульсограмма графически отражает скорость изменения пульсового АД на разных этапах сердечных циклов в течение всего периода обследования и представляет каждый цикл в виде волнообразного контура с характерными перегибами и пересечениями с нулевой линией. Это позволяет нам с высокой точностью анализировать как частотно-, так и амплитудно-временные параметры таких графиков на основе разработанных компьютерных алгоритмов выделения расчетных (кодирующих) точек. На рис. 2 представлены два вида графиков пульсовых волн АД крови, объединяющих все зарегистрированные кардиоциклы одной пьезопульсограммы: А – дифференциальный график усредненного кардиоцикла с расчетными точками, где по оси “Y” отложена скорость изменения АД – VPP, а по оси “Х” – время – t, и Б – вспомогательный график пульсовых волн АД всех кардиоциклов этой же пьезопульсограммы, полученный путем наложения всех зарегистрированных графиков отдельных кардиоциклов и их выравнивания по абсциссе точки “В” для компьютерного построения и анализа графика “А”. Использование точки “В” – абсолютного положительного экстремума, наибольшего по амплитуде и четко выделяемого на дифференциальном графике пульсовой волны АД крови, является отличительной особенностью нашей разработки. На эту точку никогда не накладывается отраженная от периферического сосудистого сопротивления (ПСС) пульсовая волна (ОПВ) и, следовательно, ОПВ не оказывает влияния на параметр “В”, что существенно повышает точность оценки показателей КГД, по сравнению с большинством пульсометрических методов, использующих плетизмографические датчики и иные алгоритмы анализа. Расчетные точки дифференциального графика пульсовой волны АД, используемые в нашей работе (рис. 2): “А” – начало периода изгнания крови (открытие аортального клапана; в этой точке АД соответствует ДАД); “В” – точка абсолютного положительного экстремума пульсовой волны АД, оцениваемая как величина максимальной скорости роста РР – VmaxPP [mm Hg/s]; “С” – момент достижения максимальной величины систолического АД (САД) в фазу изгнания крови из левого желудочка сердца (ЛЖС), если площадь CG ≤ 0; “D” – момент развития максимальной скорости падения АД перед закрытием аортального клапана, принимается за окончание изгнания крови из ЛЖС (отрицательный экстремум); “F” – момент достижения максимальной скорости прироста дикротического АД, вызванного волной давления крови, отраженной от закрытого аортального клапана. “G” – момент достижения максимальной величины ПАД в фазу изгнания крови из ЛЖС, если площадь CG > 0. В этом случае величина ПАД из-за наложения ОПВ увеличивается относительно САД на величину, пропорциональную AIx, и при компьютерной калибровке сигнала с помощью тонометра условно принимается за САД. На рисунках 1 и 2 можно видеть, что абсцисса точки “В” точно фиксирует момент достижения максимальной скорости прироста АД во время систолы, а ее ордината определяет величину максимальной скорости прироста АД в этот момент – VmaxPP. Этот параметр в условиях стандартной процедуры обследования использовалcя нами в качестве меры при количественной неинвазивной сравнительной оценке сократительной способности миокарда. Применение величины максимальной скорости развития силы при одиночном сокращении препаратов фазных мышц позвоночных животных в опытах in vitro является признанным способом оценки сократительной способности мышц [13]. Анализ графиков пульсовых волн АД, обусловленных в основном фазными сокращениями миокарда ЛЖС, циклично выбрасывающего ударный объем крови в аорту, подтвердил правомочность применения такого методического приема для неинвазивной сравнительной оценки сократительной способности миокарда ЛЖС у человека. Зависимость изменения величины VPP от времени определяет математически однозначное расположение точки “А” на графиках кардиоциклов (рис. 1 и 2) как точки начала анакротической фазы изгнания крови, соответствующей моменту открытия аортального клапана. В этой точке АД крови соответствует диастолическому давлению (ДАД) и величины РР и VPP равны нулю. Это позволяет провести через эту точку горизонтальную изолинию, определяющую площади под и/или над кривой дифференциального графика и отражающую прирост или уменьшение АД крови в артерии при прохождении по ней пульсовой волны АД. Используя интегрирование по этим площадям усредненного графика кардиоцикла, оценивали широкий спектр показателей КГД и анализировали динамику их возрастных изменений. Средняя величина РР в единицах компьютерной “оцифровки” определялась по уровню точки “А” как площадь АBС под графиком на временнóм промежутке между точками “А” и “С”, если площадь CG ≤ 0, или как площадь ABG между точками “А” и “G”, если площадь CG > 0. Аналогичный методический прием применялся при оценке относительной величины – индекса аугментации (AIx), который характеризовал наложение ОПВ на систолическую волну АД и оценивался в % от величины РР (AIx = = ΔPP × 100/PP [%]). Для обеспечения наибольшей точности результатов выполняли процедуру дополнительного визуального уточнения положения точек на графике усредненного кардиоцикла и в случае необходимости корректировали их расположение. Далее осуществляли автоматическую расстановку точек на графике каждой распознанной пульсации с учетом их положения на усредненном графике. Момент регистрации точки “В” на графиках каждого кардиоцикла с помощью разработанного нами ПО уверенно оценивался с точностью ±1 дискрет, что составляет ±1 мс при частоте дискретизации, сигнала равной 1 кГц.
Рис. 1.
График кардиоцикла артериальной пьезопульсограммы (I), зарегистрированной с лучевой артерии (a. radialis) мужчины 72 лет и, для сравнения, соответствующая сфигмограмма (II). зарегистрированная с помощью комплекса “SphygmoCor Px”.
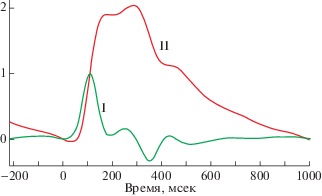
Рис. 2.
А – график усредненного кардиоцикла с расчетными точками, построенный на основе пьезопульсограммы, зарегистрированной с сонной артерии (a. carotis) пожилого (83 г.) мужчины, где по оси Y отложены значения VPP (скорости изменения пульсового артериального давления крови), а по оси Х – время t (s). Б – объединенный (вспомогательный) график пульсовой волны АД этого же мужчины, полученный путем наложения графиков всех отдельных кардиоциклов этой пьезопульсограммы и их выравнивания по абсциссе точки “В” для компьютерного построения и анализа графика А. Вариабельность величины VmaxPP отражается в вертикальном разбросе точек “В” на графике Б.
Вычисление амплитудно-временных характеристик регистрируемого сигнала дополняли процедурой его калибровки по показаниям, снимаемым автоматическим сфигмоманометром (“Microlife”, model: BP; Heerbrugg, Switzerland) с плечевой артерии в привычных и удобных единицах измерения АД крови – мм рт. ст. (mm Hg). Соотнося измеренную величину РР со средней величиной пульсового давления, вычисленной в этот же период по площади АВG или АВС в единицах компьютерной “оцифровки”, определяли калибровочный коэффициент пропорциональности, с помощью которого единицы “оцифровки” автоматически пересчитывали и во всех расчетах АД выражали в mm Hg. Для определения параметров КГД – ED [%], AIx [%], VmaxPP [mm Hg/s] и др., а также скоростей распространения пульсовых волн АД крови вдоль аорты – Vao и лучевой артерии – Var (англ. pulse wave velocity – PWV [m/s]), условно характеризующих механическую жесткость их стенок (“arterial stiffness”), нами были разработаны специальные способы и алгоритмы, описанные в патентах и статьях [3, 11, 14].
Разработанный нами метод АПП позволил использовать вариабельность экстремальной точки “В” для определения и частотно-, и амплитудно-временных параметров, характеризующих функциональную активность периферических механизмов автономной регуляции мышечных эффекторов ССС. На рисунке 2 (график “Б”) можно видеть вертикальный разброс точек “В”, наглядно отражающий вариабельность параметра VmaxPP. При оценке вариабельности сердечного ритма (СР) через колебания длительности отдельных кардиоинтервалов пульсограмм – TNN (наш аналог интервала RR комплекса QRS ЭКГ), их графики также накладывались, но выравнивались по ординате точки “В”, что отражается в горизонтальном разбросе этих точек. Проводили одновременно спектральный анализ вариабельности этих параметров в двух разных артериях с целью сравнительной оценки степени участия симпатической и парасимпатической систем в автономной регуляции показателей кардиогемодинамики, а также в поддержании миогенного тонуса стенок этих артерий. Величины спектральной мощности колебаний параметров TNN и VmaxPP пульсовых волн АД определяли по частотным диапазонам, рекомендованным Международными стандартами для оценки вариабельности СР по TNN [15, 16]. При этом мы исходили из собственных, а также ранее установленных данных литературы [17], свидетельствующих о сходстве волновой структуры колебаний СР и АД. Анализировали 4 частотных диапазона: высокочастотный (HF; 0.15–0.4 Гц), низкочастотный (LF; 0.04–0.15 Гц), очень низкочастотный (VLF; 0.015–0.04 Гц), а также ультранизкочастотный (ULF), ограниченный частотами 0.003–0.015 Гц (в этом случае время регистрации пульсограммы увеличивалось до 10 мин). В данной работе бóльшее внимание уделено диапазонам HF и LF, которые в краткосрочных периодах обследования лучше изучены и вместе составляют основную (при расчетах их сумму принимают за 100%) спектральную мощность колебаний параметров пульсовых волн АД, вызванную регуляторным воздействием эфферентов ВНС (short-term regulation of the cardiovascular system by ANS). Мы исследовали также относительную величину – индекс симпатовагального баланса – SVIx = [LF]n/[HF]n, где [LF]n и [HF]n – нормализованные спектральные мощности частотных диапазонов. Нормализация, т.е. исключение непериодических эктопических и случайных колебаний АД на графиках, выполнялась путем выбора фрагментов пульсограмм для анализа без видимых нарушений нормальной (“beat-to-beat”) последовательности пульсовых волн. С этой же целью использовали метод математического преобразования по Lomb-Scargle (Lomb-Scargle periodogram, LSP) [18]. Этот метод позволял более точно, по сравнению с распространенным методом Фурье (Fast Fourier transform), судить об относительной вовлеченности симпатического и парасимпатического отделов ВНС в процесс автономной регуляции ССС у пожилых людей с характерными для них аритмиями. Основные результаты представлены в виде средней величины ± стандартная ошибка среднего; о статистической достоверности различий между средними значениями судили по t-критерию Cтьюдента, различия считали достоверными при * – p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
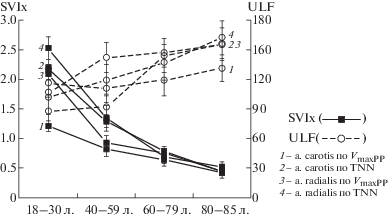
Выполненное комплексное сравнительное пульсометрическое исследование позволило количественно описать характер возрастных изменений функционального состояния миокарда и артериальных сосудов при естественном старении организма человека. Результаты показали, что существенные различия между разными по возрасту группами обнаруживаются и в отношении частотно-, и в отношении амплитудно-временных показателей КГД, отражающих пульсовые изменения АД крови. Эти изменения, предшествующие тем, которые обусловлены развитием сердечной патологии, дали возможность выявить характер участия ВНС в адаптации кардиомиоцитов и ГМК ССС к нарастающей с возрастом кислородной недостаточности. Ранее нами было показано [11], что старение организма, как правило, сопровождается определенно направленными изменениями средних величин регистрируемых параметров КГД и показателей Vao и Var и в центральных эластических (aorta и a. carotis), и в периферических мышечно-эластических (a. radialis) артериях. Расширение возрастного диапазона обследования до 85 лет обнаружило нарушение этой тенденции, происходящее со средними величинами VmaxPP , характеризующими сократительную способность миокарда ЛЖС. И в центральной, и в периферической артериях при переходе из предпоследнего – III (60–79 л.) возрастного этапа в старейший – IV (80–85 л.) вместо ожидаемого снижения сократимости миокарда ЛЖС регистрировалось ее статистически достоверное (p < 0.05) возрастание (табл. 1). Можно предположить, что на протяжении II и III возрастных этапов онтогенеза лиц обследованной когорты происходил своеобразный естественный отбор физически более крепких и выносливых индивидуумов. Функциональное состояние систем (в т.ч. и ССС) их организмов и здоровый образ жизни обеспечивали им возможность продолжения активной деятельности на IV и, возможно, на более старшем по возрасту этапе жизни.
Анализ динамической структуры пульсовых волн АД показал, что в центральной короткой эластической a. carotis пожилых людей III и IV возрастных этапов систолическая волна АД успевает пробежать расстояние от аортального клапана до периферического сосудистого сопротивления и обратно в виде отраженной пульсовой волны (ОПВ) за время достаточное, чтобы наложиться на катакроту исходной систолической волны АД еще до закрытия аортального клапана. Поэтому регистрируемая волна ПД (РР) на этих этапах в a. carotis включает в себя и полную систолическую волну АД, образованную выбросом крови в аорту при сокращении миокарда ЛЖС, и максимальную по величине надбавку ΔPP за счет наложения ОПВ, оцениваемую программно как индекс аугментации в % от величины ПАД – Aix = ΔPP × 100/PP [%] (на III этапе Aix = 19.5%; на IV – Aix = 21.6% от РР). На предыдущих возрастных этапах регистрировалось нарастание величин AIx в a. carotis от 7,6% в молодой группе (I эт.) до 12.2% в группе II этапа и в a. radialis от 1.3% (I эт.) до 3.9% на IV этапе, свидетельствуя о возрастном увеличении жесткости (stiffness) стенок этих артерий. Возрастное увеличение жесткости артериальных стенок было подтверждено прямым измерением скорости (Var) распространения пульсовой волны АД по a. radialis. В то же время можно видеть, что на всех возрастных этапах в периферической a. radialis регистрируется дополнительный, по сравнению с центральной a. carotis, прирост величины VmaxPP – ΔVmaxPP = VmaxPPrad–VmaxPPcar (ΔIэт = 34; ΔIIэт = 39; ΔIIIэт = 29; ΔIVэт = 33 [mm Hg/s]). Этот прирост также мог быть обусловлен ускорением распространения волны ПАД в дистальном мышечном участке a. radialis из-за поддержания бóльшего миогенного тонуса, увеличивающего жесткость стенки этой артерии и амплитуду пульсовой волны, по сравнению с центральной a. carotis. Функциональным механизмом относительного роста VmaxPP в a. radialis могло быть влияние симпатического эфферента ВНС на мембранные адренорецепторы ГМК в стенках концевых артерий. Для проверки такого заключения нами были исследованы возрастные изменения показателей, характеризующих функциональную активность эфферентных волокон ВНС, обеспечивающих краткосрочную регуляцию мышечных эффекторов ССС. Результаты, представленные в табл. 1, показали, что в ходе онтогенеза от I до IV возрастного этапа включительно у обследованных лиц в обеих артериях сохранялась общая для вариабельных параметров (VmaxPP и TNN) пульсовых волн АД устойчивая тенденция снижения активности симпатической регуляции и повышения активности парасимпатической регуляции, что определяло снижение величины индекса симпатовагального баланса (SVIx = LF/HF) их вегетативной регуляции. Эти результаты количественно свидетельствовали о характере и функциональной значимости вегетативной регуляции мышечных эффекторов ССС для адекватного кровоснабжения органов и тканей организма стареющего человека.
Таблица 1.
Возрастная зависимость показателей кардиогемодинамики и спектральной мощности колебаний параметров VmaxPP и TNN пульсовых волн АД крови в диапазоне 0.003 – 0.4 Гц
| Показатели\Возрастные этапы | I этап (18–30 л.) | II этап (40–59 л.) | III этап (60–79 л.) | IV этап (80–85 л.) |
|---|---|---|---|---|
| ЧСС (TNN [ms]) | 79(760 ± 21) | 63(976 ± 19)* | 65(923 ± 21) | 63 (953 ± 19) |
| САД/ДАД [mm Hg] | 113/71 | 118/72 | 127/73 | 131/72 |
| Vao [m/s] | 6.03 ± 0.12 | 7.03 ± 0.08* | 7.59 ± 0.15* | 9.52 ± 0.11* |
| a. carotis (n/m) | 36/53 | 28/36 | 27/30 | 12/32 |
| VmaxPP [mm Hg/s] | 592 ± 33 | 572 ± 32 | 561 ± 36 | 736 ± 32* |
| AIx [%] | 7.6 ± 2.6 | 12.2 ± 2.4* | 19.5 ± 2.3* | 21.6 ± 1.9 |
| HF (по VmaxPP) | 158 ± 15 | 176 ± 16 | 186 ± 18 | 207 ± 17 |
| LF – $ \ll $ – | 141 ± 14 | 145 ± 14 | 118 ± 11 | 87 ± 9 |
| VLF – $ \ll $ – | 57 ± 5 | 39 ± 4 | 44 ± 5 | 49 ± 4 |
| ULF – $ \ll $ – | 116 ± 17 | 111 ± 15 | 119 ± 16 | 131 ± 13 |
| SVIx = LF/HF | 1.21 ± 0.09 | 0.82 ± 0.12* | 0.64 ± 0.11 | 0.42 ± 0.09 |
| HF (по TNN) | 181 ± 18 | 154 ± 16 | 155 ± 15 | 190 ± 17 |
| LF – $ \ll $ – | 219 ± 22 | 191 ± 19 | 123 ± 13 | 83 ± 9 |
| VLF – $ \ll $ – | 34 ± 4 | 71 ± 8 | 74 ± 7 | 70 ± 7 |
| ULF – $ \ll $ – | 88 ± 14 | 92 ± 13 | 144 ± 17* | 156 ± 16 |
| SVIx = LF/HF | 2.19 ± 0.13 | 1.29 ± 0.11* | 0.78 ± 0.09* | 0.44 ± 0.08* |
| a. radialis (n/m) | 47/55 | 28/36 | 27/35 | 14/41 |
| Var [m/s] | 6.11 ± 0.04 | 6.69 ± 0.07* | 7.12 ± 0.03* | 7.63 ± 0.04* |
| VmaxPP [mm Hg/s] | 626 ± 29 | 611 ± 39 | 590 ± 25 | 769 ± 34* |
| AIx [%] | 1.3 ± 1.4 | 2.9 ± 1.5 | 3.3 ± 1.5 | З.9 ± 1.6 |
| HF (по VmaxPP) | 136 ± 14 | 157 ± 15 | 162 ± 17 | 171 ± 16 |
| LF – $ \ll $ – | 181 ± 19 | 144 ± 14 | 122 ± 13 | 77 ± 8* |
| VLF – $ \ll $ – | 60 ± 7 | 49 ± 5 | 28 ± 4* | 68 ± 7* |
| ULF – $ \ll $ – | 107 ± 17 | 142 ± 15 | 147 ± 15 | 155 ± 16 |
| SVIx = LF/HF | 2.09 ± 0.12 | 0.93 ± 0.11* | 0.75 ± 0.11 | 0.45 ± 0.09 |
| HF (по TNN) | 190 ± 20 | 152 ± 16 | 174 ± 18 | 192 ± 19 |
| LF – $ \ll $ – | 228 ± 24 | 204 ± 21 | 117 ± 13* | 99 ± 10 |
| VLF – $ \ll $ – | 65 ± 8 | 89 ± 9 | 88 ± 9 | 50 ± 7 |
| ULF – $ \ll $ – | 102 ± 18 | 119 ± 16 | 137 ± 18 | 162 ± 17 |
| SVIx = LF/HF | 2.52 ± 0.19 | 1.34 ± 0.21* | 0.69 ± 0.11* | 0.52 ± 0.09 |
Примечание: n – число обследованных лиц данного возрастного этапа (общее число = 116). m – количество сеансов обследования на данном этапе (общее количество = 167); HF. LF. VLF и ULF – спектральная мощность колебаний параметров пульсовых волн АД в соответствующих частотных диапазонах; размерность показателей: для параметра VmaxPP – [(mm Hg/s)2] и для параметра TNN – [ms2]. Оценивалась статистическая достоверность отличий показателей относительно величин предыдущих возрастных этапов.
Полученные результаты в показали, что если ограничиться только изучением краткосрочной вегетативной регуляции функций мышечных эффекторов ССС, мы можем столкнуться, как уже было cказано выше, с непонятными противоположно направленными возрастными изменениями изучаемых величин. С одной стороны, имеем направленное возрастное снижение средних величин LF и SVIx по обоим параметрам, а с другой – статистически достоверный прирост величины VmaxPP в старшей IV возрастной группе обследуемых на фоне направленного снижения в более молодых группах. Складывалось впечатление, что на IV возрастном этапе проявляется дополнительный регуляторный фактор, усиливающий инотропную функцию сердца. Поэтому было решено проанализировать участие эндокринной системы в более низкочастотной регуляции мышечных эффекторов ССС. С этой целью в исследование был включен анализ спектральной мощности колебаний изучаемых параметров в диапазоне ультранизких частот (ULF) с более продолжительным периодом колебаний (~1–6 мин), по сравнению с периодами волн, характерными для регулирующего воздействия периферических эфферентов ВНС (~2.5–25 сек). Как видно из табл. 1, спектральная мощность колебаний параметров пульсовых волн АД в диапазоне ULF в условиях покоя соизмерима по величине с таковой параметров волн, характерных для краткосрочной вегетативной регуляции мышечных эффекторов ССС. Направление вектора нарастания активности гуморальной регуляции в сторону увеличения возраста свидетельствует об определенной закономерности формирования общего паттерна автономной регуляции мышечных структур ССС и о значимости участия обеих систем в нейрогуморальной регуляции функций этих структур у пожилых людей. Это, по-видимому, способствует улучшению кровоснабжения их органов и тканей при возрастном нарастании КН в обычных условиях покоя. Из данных, представленных в табл. 1 и показанных на рис. 3, следует, что в процессе онтогенеза по мере увеличения возраста обследованных лиц снижается активность эфферентов ВНС в диапазоне LF и увеличивается активность в диапазоне HF. Эти изменения сопровождаются возрастанием регуляторной активности гуморальных катехоламинов (ГК) – норадреналина (НАг) и, в основном (80%) – адреналина (Аг), циклически выделяющихся в кровь из хромаффинных клеток мозгового вещества надпочечников. Гуморальные катехоламины, как и норадреналин (НАн) – нейромедиатор симпатического отдела ВНС, входят в состав единой симпатоадреналовой системы быстрого реагирования на стрессовую ситуацию. ГК при всех условиях реализуют свое регуляторное действие на мышечные эффекторы ССС через те же адренорецепторы (АР) на поверхности клеток-мишеней, которые используются и симпатическими эфферентами ВНС. У пожилых людей (старше 60 лет), согласно нашим данным (табл. 1), активность ГК в нормальных условиях покоя начинает превышать активность симпатической нервной регуляции. Это свидетельствует о том, что ГК могут играть, по-видимому, более важную роль, по сравнению с ВНС, в обеспечении работоспособности сердца в условиях возрастного нарастания КН. Действительно, как мы сегодня знаем, ГК, возбуждая КМ через β1-АР, повышают ЧСС и силу сокращений миокарда ЛЖС и соответственно увеличивают сердечный выброс, повышая производительность сердца как насоса. Гуморальный адреналин (Аг), количественно преобладая над норадреналином (НАг) при базальной секреции из коры надпочечников, и почти на порядок ускоряя метаболизм мышечных эффекторов ССС, по сравнению с норадреналином, значительно усиливает активность организма. При этом прессорный эффект ГК реализуется не полностью из-за возбуждения β2-АР на мембране ГМК стенок концевых артерий, что расширяет эти сосуды. Происходит также активация вагусного нерва, включающего барорецепторный депрессорный рефлекс и снижающего ЧСС. На основании изложенного мы можем сделать общее заключение, что у пожилых людей, по-видимому, происходит частичная замена ставшего менее эффективным (из-за “β-adrenergic desensitization”) и более опасным (увеличивается вероятность возникновения тахиаритмий) механизма быстрой вегетативной активации миоцитов ССС нейромедиаторным норадреналином на более замедленное и устойчивое воздействие гуморальных катехоламинов. Такая замена, сочетанная с относительным возрастанием активности парасимпатических периферических эфферентов ВНС в мышечных структурах сердца [19], имеет, как мы полагаем, важное регуляторное значение. Она может рассматриваться как эндогенный функциональный кардиопротекторный механизм, повышающий метаболическую устойчивость ССС пожилых людей к условиям нарастания КН, а также снижающий вероятность возникновения тахиаритмий и других сердечных патологий при неожиданном воздействии психоэмоциональных и/или физических стрессорных факторов.
Список литературы
White M., Roden R., Minobe W., Khan M.F., Larrabee P., Wollmering M., Port J.D., Anderson F., Campbell D., Feldman A.M. Age-related changes in β-adrenergic neuroeffectors system in the human heart. Circulation. 90: 1225–1238. 1994. https://doi.org/10.1161/01.CIR.90.3.122
Ferrara N., Komici K., Corbi G., Pagano G., Furgi G., Rengo C., Femminella G.D., Leosco D., Bonaduce D. β-adrenergic receptor responsiveness in aging heart and clinical implications. Front Physiol. 4: 1–10. 2014.
Nesterov V. P., Burdygin A. I., Nesterov S. V. New possibilities for pulsometric analysis of the functional state of cardiovascular system in humans. Human Physiology. 43 (6): 653–661. 2017. https://doi.org/10.1134/S036211971704011
Нестеров С.В. Особенности вегетативной регуляции сердечного ритма в условиях воздействия острой экспериментальной гипоксии. Физиология человека. 31 (1): 82–87. 2005. [Nesterov S.V. Autonomic regulation of the heart rate in humans under conditions of acute experimental hypoxia. Human Physiology. 31 (1): 82–87. 2005 (in Russ).]
Нестеров С.В., Нестеров. В.П. Сохранение уровня парасимпатического влияния на сердце у человека в условиях острой гипоксии как показатель высокой гипоксической устойчивости. Вейвлет-анализ. Ж. эвол. биохим. и физиол. 43 (1): 101–103. 2007. [Nesterov S.V., Nesterov V.P. Preservation of level of parasympathetic effect on human heart under conditions of acute hypoxia as an index of high hypoxic resistance. Wavelet-analysis. J. Evol. Biochem. Physiol. 43 (1): 101–103. 2007 (in Russ).]
Сороко С.И. Значение стресс-реакции в интегративном ответе организма человека на острое гипоксическое воздействие. Вестник РАЕН. 20 (4): 88–95. 2016 [Soroko S. Role of stress reaction in integrative human body response to acute hypoxia. Vestnik RAEN. 20 (4): 88–95. 2016 (in Russ).]
Шемарова И.В., Нестеров В.П., Коротков С.М., Силкин Ю.А. Эволюционные аспекты кардиопротекции. Ж. эвол. биохим. и физиол. 54 (1): 9–19. 2018 [Shemarova I.V., Nesterov V.P., Korotkov S.M., Sylkin Yu.A. Evolutionary aspects of cardioprotection. J. Evol. Biochem. Physiol. 54 (1): 9–19. 2018 (in Russ).]
Miyazaki T., Zipes D. Pericardial prostaglandin biosynthesis prevents the increased incidence of reperfusion-induced ventricular fibrillation produced by efferent sympathetic stimulation in dogs. Circulation. 82: 1008–1019. 1990.
Vanoli E., De Ferrari G., Stramba-Badiale M., Hull S., Foreman R., Schwartz P. Vagal stimulation and prevention of sudden death in conscious dogs with a healed myocardial infarction. Circ. Res. 68: 1471–1478. 1991.
Hjalmarson A. Effects of beta blockade on sudden cardiac death during acute myocardial infarction and the postinfarction period. Am. J. Cardiol. 80: 35J–39J. 1997.
Нестеров В.П., Баллюзек М.Ф., Конради А.О., Бурдыгин А.И., Коротков С.М., Шемарова И.В., Цыгвинцев С.Н., Нестеров С.В. Осложненная инсультом кардиогемодинамика в пожилом возрасте. Успехи геронтологии. 29 (1): 107–115. 2016 [Nesterov V.P., Konradi A.O., Ballyzek M.F., Burdygin A.I., Korotkov S.M., Shemarova I.V., Cygvinzev S.N., Nesterov S.V. Stroke-complicated cardiohemodynamics in old age. Advances in gerontology. 29 (1): 107–115. 2016 (in Russ).]
Нестеров В.П., Хирманов В.Н., Нестеров С.В., Тюрина Т.В., Бурдыгин А.И. Пульсометрическое изучение функционального состояния сердечно-сосудистой системы в условиях, провоцирующих развитие нейрогенных обмороков. Бюлл. эксперим. биол. и мед. 132 (9): 310–314. 2001 [Nesterov V.P., Khirmanov V.N., Nesterov S.V., Tyurina T.V., Burdygin A.I. Pulsometric study of the functional state of cardiovascular system under conditions provoking neurogenic syncopes. Bulletin of Experimental Biology and Medicine. 132 (9): 310–314. 2001 (in Russ).]
Nesterov V.P. The significance of Na+ in EC coupling in muscle. Adv. Exp. Med. Biol. 311: 19–29. 1992.
Нестеров В.П., Бурдыгин А.И., Нестеров С.В., Филенко С.А., Цыгвинцев С.Н. Возрастные особенности динамической структуры волны пульсового артериального давления крови человека. Ж. эвол. биохим. и физиол. 45 (5): 505–510. 2009 [Nesterov V.P., Burdygin A.I., Nesterov S.V., Filenko S.A., Tsygvintsev S.N. Age-related peculiarities of dynamic structure of wave of the human arterial blood pressure. J. Evol. Biochem. Physiol. 45 (5): 505–510. 2009 (in Russ).]
Heart rate variability. Standarts of measurement, physiological interpretation, and clinical use / Task Forse of The European Society of Cardiology and The North American Society of Pacing and Electrophysiology. Eur. Heart J. 17 (3): 354. 1995.
Котельников С.А., Ноздрачев А.Д., Одинак М.М., Шустов, Е.Б., Коваленко, И.Ю., Давыденко, В.Ю. Вариабельность ритма сердца: представления о механизмах. Физиология человека. 28 (1): 130–143. 2002 [Kotelnikov S.A., Nozdrachev A.D., Odinak M.M., Shustov E.B., Kovalenko I.Iu., Davydenko V.Iu. Variability in heart rhythm: approaches to mechanisms. Human Physiology. 28 (1): 130–143. 2002 (in Russ).]
Taylor J.A., Eckberg D.L. Fundamental relations between short-term RR interval and arterial pressure oscillations in humans. Circulation. 93: 1527–1532. 1996.
Skotte J.H., Kristiansen J. Heart rate variability analysis using robust period detection. BioMed. Eng. OnLine. 13: 138. 2014.
Zang W.J., Chen L.N., Yu X.J. Progress in the study of vagal control of cardiac ventricles. Acta Physiologica Sinica. 57 (6): 659–672. 2005.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии