Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 6, стр. 459-462
ПРЕДОБРАБОТКА КРЫС АЛЛОСТЕРИЧЕСКИМ АГОНИСТОМ РЕЦЕПТОРА ЛЮТЕИНИЗИРУЮЩЕГО ГОРМОНА УСИЛИВАЕТ СТИМУЛЯЦИЮ ПРОДУКЦИИ ТЕСТОСТЕРОНА ХОРИОНИЧЕСКИМ ГОНАДОТРОПИНОМ
А. О. Шпаков 1, *, А. А. Бахтюков 1, Д. В. Дарьин 2, К. В. Деркач 1
1 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии
и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 28.03.2019
После доработки 19.04.2019
Принята к публикации 26.04.2019
Аннотация
В клинике лютеинизирующий гормон (ЛГ) и хорионический гонадотропин (ХГ) используют как активаторы рецептора ЛГ, что приводит к стимуляции стероидогенеза в гонадах. Однако применяемые в высоких дозах препараты гонадотропинов вызывают ряд побочных эффектов. Нами показано, что после предварительной обработки самцов крыс ТП03, аллостерическим агонистом рецептора ЛГ (7.5–25 мг/кг), достоверно усиливался стимулирующий продукцию тестостерона эффект ХГ, взятого в дозе 50 МЕ/крысу, которая вдвое ниже дозы, вызывающей максимальный стероидогенный эффект. Это, как мы полагаем, обусловлено как аддитивностью эффектов ХГ и ТП03, так и потенцирующим воздействием ТП03 на сигнальные пути ХГ. Через 3 ч после введения ХГ крысам с предобработкой ТП03, паттерн активации генов стероидогенных ферментов и рецептора ЛГ менялся специфично, затрагивая в основном экспрессию гена 3β-дегидрогеназы. Полученные данные указывают на перспективность совместного применения ТП03 и гонадотропинов, позволяющего снизить эффективную дозу гонадотропина.
Применение лютеинизирующего гормона (ЛГ) и хорионического гонадотропина (ХГ) для коррекции гипогонадотропных состояний и во вспомогательных репродуктивных технологиях сопряжено со многими побочными эффектами, среди которых развитие резистентности к ЛГ и ХГ, нарушение функций гипоталамических звеньев гонадной оси, синдром гиперстимуляции яичников [1, 2]. Эти эффекты обусловлены использованием высоких доз гонадотропинов, намного превосходящих их физиологические концентрации. Вследствие этого актуальной задачей является разработка подходов для снижения доз препаратов ЛГ и ХГ без снижения их эффективности. Наряду с гонадотропинами в последние годы разрабатываются низкомолекулярные аллостерические агонисты рецептора ЛГ на основе тиенопиримидиновых производных (ТП) [3–5]. В отличие от ЛГ и ХГ, которые взаимодействуют со значительным по размеру эктодоменом рецептора, ТП проникают внутрь его трансмембранного канала и связываются с расположенным там аллостерическим сайтом [3]. Поскольку сайты связывания гонадотропинов и ТП различаются, то при совместном воздействии на клетки-мишени они не конкурируют между собой за связывание с рецептором, и их эффекты характеризуются частичной аддитивностью, что продемонстрировано нами и другими авторами в условиях in vitro [3, 5]. Однако совместные эффекты гонадотропинов и ТП в условиях in vivo не изучены, и данные о возможности усиления стероидогенного эффекта ЛГ и ХГ в присутствии ТП отсутствуют. Цель работы состояла в изучении влияния предварительной обработки самцов крыс с помощью различных доз синтезированного и изученного нами ранее соединения ТП03 с активностью агониста рецептора ЛГ на стимулирующий продукцию тестостерона (Т) эффект ХГ.
Для исследований использовали половозрелых самцов крыс Wistar (три месяца, масса тела 316 ± 17 г). ХГ человека (Московский эндокринологический завод, Россия) вводили подкожно в дозах 50 и 100 МЕ/крысу, в то время как ТП03 вводили внутрибрюшинно в дозах 7.5, 15 и 25 мг/кг. Синтез и физико-химические характеристики ТП03 были описаны нами ранее [5]. Проводимые эксперименты удовлетворяли требованиям Комитета по био-этике ИЭФБ РАН и European Communities Council Directive 1986 (86/609/EEC). Животным сначала вводили ТП03 (в 10.00) и через 1 ч (в 11.00) проводили инъекцию ХГ. Концентрацию Т в крови оценивали непосредственно перед введением ТП03 (10.00) и ХГ (11.00) и далее через 1 (12.00) и 3 ч (14.00) после введения ХГ. Образцы крови для измерения уровня Т забирали из хвостовой вены крыс под местным наркозом, концентрацию Т определяли с помощью набора “Тестостерон-ИФА” (Алкор-Био, Россия). После последнего забора крови животных декапитировали и иссекали ткани семенников для оценки экспрессии в них целевых генов.
Экспрессию генов оценивали с помощью количественной ПЦР с обратной транскрипцией, для чего из семенников с помощью “TRIzol Reagent” (Thermo Fisher Scientific Inc., США) выделяли тотальную РНК. Кодирующую ДНК получали обратной транскрипцией с использованием набора “MMLV RT Kit” (Евроген, Россия). Амплификацию проводили в 25 мкл смеси, содержащей 10 нг ПЦР-продукта, 0.4 мкМ прямого и обратного праймеров, используя 5 мкл реагента “qPCRmix-HS SYBR+LowROX” (Евроген, Россия). Амплификационный сигнал детектировали с помощью прибора “7500 Real-Time PCR System” (Thermo Fisher Scientific Inc., США). Экспрессию генов, кодирующих рецептор ЛГ (Lhr), StAR-белок (Star), цитохромы Р450scc (Cyp11a1) и Р450-17α (Cyp17a1), дегидрогеназы 3β-HSD (Hsd3b) и 17β-HSD (Hsd17b), определяли с помощью следующих праймеров: Lhr – CTGCGCTGTCCTGGCC (For) и CGACCTCATTAAGTCCCCTGAA (Rev); Star – AAGGCTGGAAGAAGGAAAGC (For) и CACCTGGCACCACCTTACTT (Rev); Cyp11a1 – TATTCCGC-TTTGCCTTTGAG (For) и CACGATCTCCTCCAACATCC (Rev); Hsd3b – AGGCCTGTGTCCAAG-CTAGTGT (For) и CTCGGCCATCTTTTTGCTGTAT (Rev); Cyp17a1 – CATCCCCCACAAGGCTAAC (For) и TGTGTCCTTGGGGACAGTAAA (Rev); Hsd17b – CCTTTGGCTTTGCCATGAGA (For) и CAATCCATCCTGCTCCAACCT (Rev). В качестве рефересных использовали гены глицеральдегидфосфатдегидрогеназы (Gapdh) и β-актина (Actb). Анализ результатов проводили с использованием метода ΔΔСt. Значения RQ рассчитывали по отношению к контрольной группе.
Статистический анализ проводили с помощью программы “Microsoft Office Excel 2007”. Данные представляли как среднее значение ± SD. Нормальность распределения проверяли с помощью критерия Шапиро–Уилка. Для сравнения двух выборок с нормальным распределением использовали t-критерий Стьюдента, для сравнения трех и более групп – дисперсионный анализ с поправкой Бонферрони. Данные, не удовлетворяющие критериям нормального распределения, обрабатывали с применением U-критерия Манна–Уитни. Статистически значимыми считали отличия при уровне значимости p<0.05.
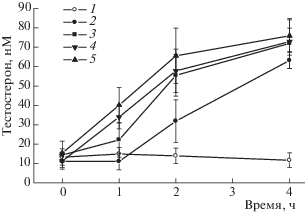
На начальном этапе оценивали стероидогенные эффекты ХГ и ТП03, которые были взяты в дозах 100 МЕ/крысу и 25 мг/кг, вызывающих, в соответствии с нашими ранними результатами [6], максимальный стероидогенный эффект. Через 3 ч после обработки ХГ и ТП03 приросты концентрации Т над его уровнем в контроле составили 111 ± 14 и 39 ± 6 нМ, что указывает на более высокую эффективность ХГ в сравнении с ТП03. В то же время известно, что применение высоких доз ХГ снижает экспрессию рецептора ЛГ и провоцирует развитие резистентности клеток Лейдига к гонадотропинам, ослабляя в них стероидогенез [1]. Это свидетельствует о необходимости снижения доз ХГ, что, однако, снижает и стероидогенный эффект гонадотропина. Так, через 3 ч после обработки ХГ в дозе 50 МЕ/крысу прирост концентрации Т составил 52 ± 5 нМ, что на 53% ниже, чем при использовании дозы 100 МЕ/крысу. Следует отметить, что снижение доз ТП03 также ослабляет его стероидогенный эффект. Так, при использовании дозы 15 мг/кг прирост концентрации Т через 3 ч снижался, в сравнении с дозой 25 мг/кг, на 20%, при использовании дозы 7.5 мг/кг – на 63%.
Для оценки возможности усиления стероидогенного эффекта ХГ, взятого в дозе 50 МЕ/крысу, изучали влияние на него предварительной обработки самцов крыс с помощью ТП03 в дозах 7.5, 15 и 25 мг/кг. ТП03 вводили за 1 ч до гонадотропина, чтобы обеспечить достижение этим гидрофобным соединением клеток Лейдига и его эффективное связывание с локализованными в них рецепторами ЛГ. Установлено, что на фоне обработки крыс всеми исследованными дозами ТП03 стимулирующий эффект ХГ на продукцию Т усиливался. При этом через 1 ч после введения ХГ потенцирующий эффект ТП03 на стероидогенную активность гонадотропина был выражен в большей степени, чем через 3 ч (рис. 1). Это указывает на то, что ТП03 меняет динамику развития стимулирующего эффекта ХГ, но в меньшей степени влияет на его максимальный стероидогенный эффект. Несмотря на значительные различия в эффективности доз 7.5 и 15 мг/кг ТП03 на уровень Т, обе дозы демонстрировали сходную эффективность в отношении усиления стероидогенного эффекта ХГ (рис. 1). Это может быть обусловлено тем, что в основе усиливающего действия ТП03 лежит не только независимая активация рецепторов ЛГ гонадотропином и ТП, но и потенцирующий эффект ТП03 на сигнальные пути ХГ, что отчетливо прослеживается при использовании низкой дозы ТП03.
Рис. 1.
Стимулирующий эффект ХГ на уровень тестостерона в крови крыс и влияние на него предварительной обработки животных ТП03, низкомолекулярным агонистом рецептора ЛГ.
1 – контроль; 2 – ХГ, 50 МЕ/крысу; 3 – ХГ + ТП03, 7.5 мг/кг; 4 – ХГ + ТП03, 15 мг/кг; 5 – ХГ + ТП03, 25 мг/кг. Время указано с момента введения ТП03 или его растворителя (контроль), ХГ вводили через 1 ч после ТП03. Данные представлены как M ± SD, n = 5.
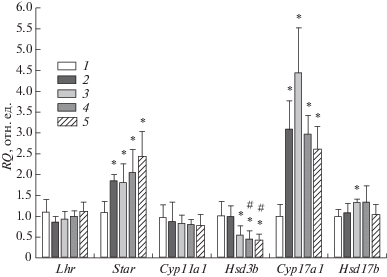
В семенниках крыс, обработанных последовательно ТП03 и ХГ, экспрессия гена Hsd3b, кодирующего 3β-дегидрогеназу, которая катализирует синтез прогестерона, снижалась в среднем в два раза по сравнению с этим показателем у крыс без обработки ТП03 (рис. 2). Экспрессия генов Star и Cyp17a1, кодирующих белок StAR, транспортирующий холестерин в митохондрии, и цитохром Р450-17α, катализирующий превращение прогестерона в андростендион, повышалась под влиянием ХГ, хотя и в различной степени, как у крыс, предварительно обработанных ТП03, так и без такой обработки (рис. 2). Эти данные свидетельствуют о том, что после предварительной обработки крыс с помощью различных доз ТП03 паттерн ХГ-индуцированной регуляции экспрессии генов стероидогенеза в семенниках животных менялся избирательно и в основном затрагивал экспрессию гена 3β‑дегидрогеназы. Известно, что при длительном введении высоких доз ХГ экспрессия гена рецептора ЛГ снижается [1]. В нашем случае, через 3 ч после обработки 50 МЕ/крысу ХГ крыс, которым предварительно вводили ТП03, экспрессия гена Lhr существенно не менялась, что указывает на сохранение чувствительности тканей семенников к гонадотропинам с ЛГ-активностью (рис. 2).
Рис. 2.
Влияние обработки крыс ХГ и совместно ХГ и ТП03 на экспрессию генов Lhr, Star, Cyp11a, Hsd3b, Cyp17a и Hsd7b в семенниках крыс.
1 – контроль; 2 – ХГ, 50 МЕ/крысу; 3 – ХГ + ТП03, 7.5 мг/кг; 4 – ХГ + ТП03, 15 мг/кг; 5 – ХГ + ТП03, 25 мг/кг. * – p < 0.05 по сравнению с контролем. Данные представлены как M ± SD, n = 5.
Таким образом, при введении 50 МЕ/крысу ХГ самцам крыс, которых предварительно обрабатывали ТП03 с активностью агониста рецептора ЛГ, стимулирующий продукцию Т эффект гонадотропина усиливается, что может быть обусловлено как аддитивностью эффектов ХГ и низкомолекулярного агониста, так и потенцирующим действием последнего на сигнальные пути гонадотропина. Одним из предполагаемых механизмов потенцирующего действия ТП03 может являться его функционирование как низкомолекулярного шаперона рецептора ЛГ. Известно, что гидрофобные по природе низкомолекулярные агонисты рецептора ЛГ способны преодолевать плазматическую мембрану и связываться с еще “незрелыми” формами рецептора ЛГ, расположенными внутри клетки [7]. Это не только приводит к стабилизации структуры рецептора, но и способствует его транслокации в мембрану, что повышает чувствительность клеток Лейдига к гонадотропинам. Обнаружение способности соединения ТП03 усиливать стимулирующий эффект ХГ, что характерно для положительных аллостерических модуляторов (ПАМ), при наличии у него собственной агонистической активности позволяет по фармакологическим свойствам отнести ТП03 к классу аго-ПАМ. Необходимо отметить, что аго-ПАМ представляют большой интерес для фармакологии, поскольку способны сравнительно мягко и избирательно активировать внутриклеточные сигнальные каскады, и при этом усиливать стимулирующие эффекты ортостерических лигандов [8]. Полученные данные важны для разработки новых подходов, направленных на усиление стероидогенного эффекта ЛГ и ХГ, и указывают на перспективность совместного применения гонадотропинов с ЛГ-активностью и низкомолекулярных агонистов рецептора ЛГ тиенопиримидиновой природы.
Список литературы
van de Lagemaat R., Raafs B.C., van Koppen C., Timmers C.M., Mulders S.M., Hanssen R.G. Prevention of the onset of ovarian hyperstimulation syndrome (OHSS) in the rat after ovulation induction with a low molecular weight agonist of the LH receptor compared with hCG and rec-LH. Endocrinology. 152 (11):4350–4357. 2011. https://doi.org/10.1210/en.2011-1077
Шпаков А.О. Гонадотропины – от теории к клинической практике. Санкт-Петербург: Издательство Политехнического университета. 2018. ISBN 978-5-7422-6330-2 [Shpakov A.O. Gonadotropiny – ot teorii k klinicheskoj praktike [Gonadotropins – from the theory to clinical practice]. Sankt-Peterburg: Izdatel’stvo Politehnicheskogo universiteta [Saint Petersburg. Polytechnic University Publishing House] 2018 (in Russ)].
van Koppen C.J., Zaman G.J., Timmers C.M., Kelder J., Mosselman S., van de Lagemaat R., Smit M.J., Hanssen R.G. A signaling-selective, nanomolar potent allosteric low molecular weight agonist for the human luteinizing hormone receptor. Naunyn Schmiedebergs Arch. Pharmacol. 378 (5): 503–514. 2008. https://doi.org/10.1007/s00210-008-0318-3
Nataraja S.G., Yu H.N., Palmer S.S. Discovery and Development of Small Molecule Allosteric Modulators of Glycoprotein Hormone Receptors. Front. Endocrinol. (Lausanne). 6: 142. 2015. https://doi.org/10.3389/fendo.2015.00142
Derkach K.V., Dar’in D.V., Bakhtyukov A.A., Lobanov P.S., Shpakov A.O. In vitro and in vivo studies of functional activity of new low molecular weight agonists of the luteinizing hormone receptor. Biochemistry (Moscow). Suppl. Ser. A: Membrane and Cell Biology. 10 (4): 294–300. 2016. https://doi.org/10.1134/S1990747816030132
Derkach K.V., Bakhtyukov A.A., Shpakov A.A., Dar’in D.V., Shpakov A.O. Specificity of heterotrimeric G protein regulation by human chorionic gonadotropin and low-molecular agonist of luteinizing hormone receptor. Cell Tissue Biol. 11 (6): 475–482. 2017. https://doi.org/10.1134/S1990519X17060037
Newton C.L., Whay A.M., McArdle C.A., Zhang M., van Koppen C.J., van de Lagemaat R., Segaloff D.L., Millar R.P. Rescue of expression and signaling of human luteinizing hormone G protein-coupled receptor mutants with an allosterically binding small-molecule agonist. Proc. Natl. Acad. Sci. USA. 108 (17): 7172–77176. 2011. https://doi.org/10.1073/pnas.1015723108
van der Westhuizen E.T., Valant C., Sexton P.M., Christopoulos A. Endogenous allosteric modulators of G protein-coupled receptors. J. Pharmacol. Exp. Ther. 353: 246–260. 2015. https://doi.org/10.1124/jpet.114.221606
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


