Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 1, стр. 3-12
ДИНАМИКА КАРОТИНОИДОВ В ТКАНЯХ МОЛЛЮСКА-ФИЛЬТРАТОРА CERASTODERMA GLAUCUM (BRUGUIERE, 1789) В ГОДОВОМ ЦИКЛЕ
А. В. Бородина 1, *, П. А. Задорожный 2
1 ФИЦ ИнБЮМ РАН
299011 Севастополь, Россия
2 Институт химии ДВО РАН
690022 Владивосток, Россия
* E-mail: borodinaav@mail.ru
Поступила в редакцию 06.06.2019
После доработки 29.07.2019
Принята к публикации 10.10.2019
Аннотация
Исследована годовая динамика каротиноидов моллюска-фильтратора Cerastoderma glaucum, обитающего в Казачьей бухте Черного моря. Состав каротиноидов представлен 11 свободными и 4-мя этерифицированными каротиноидами. В течение всего года в тканях присутствуют β-каротин, гетероксантин и мактраксантин, а также эфиры последних двух каротиноидов, их суммарная доля составила 50‒65% от суммы каротиноидов. Видоспецифичным каротиноидом является мактраксантин. Присутствие оставшихся фракций каротиноидов непостоянно и подверженно сезонным колебаниям. Выявлены отличия в составе каротиноидов у C. glaucum в сравнении с видами рода Cerastoderma из других ареалов обитания. Обсуждаются отличия в составе каротиноидов с другим моллюском–фильтратором: A. kagoshimensis (Tokunaga, 1906). Несмотря на сходный тип питания и место обитания, качественный состав и сезонные изменения содержания каротиноидов у этих двух видов существенно различаются.
ВВЕДЕНИЕ
Каротиноиды – пигменты автотрофного, в основном, растительного происхождения, которые в тканях консументов (последующих звеньях пищевой цепи) подвергаются накоплению и метаболической трансформации в соответствии с видовой спецификой трофического звена. В растительной клетке каротиноиды играют важную роль в процессе фотосинтеза, фотозащиты, выполняют антиоксидантную и другие функции. У животных функции этих соединений являются предметом интенсивного изучения, в настоящее время известны антиоксидантная, гепатопротекторная, мембранно-стабилизирующая и другие свойства каротиноидов [1, 2]. На сегодняшний день установлено строение более 750 природных соединений каротиноидного ряда, однако их метаболическая трансформация, происходящая в каждом трофическом звене, остается все еще малоизученной [2]. При этом открываются широкие возможности как в поиске и обнаружении новых соединений, так и выяснения функциональной значимости этих БАВ у изучаемых видов.
Массовый черноморский вид Cardium (=Ceras-toderma) lamarki Cerastoderma glaucum (Poiret, 1789) (в ранних работах Cardium edule Linnaeus, 1758, Cerastoderma lamarcki Reeve, 1843) широко распространен в акватории Черного моря, его обитание на илистом грунте побережья Севастополя были отмечены еще С.А. Зерновым в 1910 г. [3, 4]. Моллюск средиземноморского происхождения считается коренным представителем черноморской малакофауны [5]. Он относится к эвригалинному виду, однако избегает солености ниже 8‰, часто встречается в местах с кратковременным сероводородным заражением, при этом отсутствует в местах с пониженным содержанием кислорода и постоянным сероводородным заражением [4]. По типу питания этот моллюск относится к типичному облигатному сестенофагу, однако при увеличении пищевой конкуренции он может питаться из водной толщи [6]. Исследования последнего столетия показали, что под действием абиотических и биотических факторов моллюски рода Cerastoderma имеют значительную межвидовую изменчивость, которая позволяет им адаптироваться к обновляющимся экологическим условиям существования [7]. Исследования каротиноидного состава Cerastoderma glaucum очень скудны: в 70–80-х годах прошлого столетия эта информация ограничивалась исследованиями этого вида, обитающего на Британских островах [8, 9]. Были высказаны предположения о наличии в составе этого вида сложноэфирных фракций каротиноидов, β-каротина, лютеина и комплекса ксантофиллов неустановленного строения [8, 9]. Среди последних в гепатопанкреасе моллюска предположительно был идентифицирован гетероксантин [9]. Факторы, влияющие на метаболизм каротиноидов, например, места обитания и сезонность [10], не исследованы. В 2017 г. нами был впервые изучен состав каротиноидов моллюска C. glaucum, обитающего на Севастопольском побережье [11]. В этой работе были обнаружены отличия в составе каротиноидов этого моллюска от описанного ранее в [8–10].
Одним из наиболее успешных среди двустворчатых моллюсков-фильтраторов по адаптации к изменяющимся внешним условиям обитания является вселенец в Черное море Anadara kagoshimensis (Tokunaga, 1906). У этого моллюска выражена устойчивость к гипоксии, разного рода биотическим и абиотическим загрязнениям, пищевой депривации, что связано с эффективной работой антиоксидантной системы и гемоглобина [12–14]. По типу и способу питания он близок к C. glaucum, так как тоже обитает в разрыхленном грунте и фильтрует образующуюся взвесь, для передвижения также использует свою ногу, которая у этого моллюска не только обеспечивает ему активный образ жизни, но и имеет ряд физиологических и метаболических особенностей [13]. Исследования состава каротиноидов A. kagoshimensis, обитающего в Черном море, происходили на протяжении ряда лет [16, 17]. Были обнаружены некоторые отличия как в качественном составе каротиноидов, так и в их соотношении, по сравнению с видовым аналогом из Тихоокеанского региона, это же было отмечено и для каротиноидного состава черноморской мидии Mytilus galloprovincialis [16]. В связи с этим для углубления понимания функциональной роли каротиноидов в физиологических процессах моллюсков важно отметить необходимость изучения как каротиноидного состава массовых видов моллюсков, так и изучения факторов, влияющих на этот метаболизм.
Целью данной работы явилось изучение влияния сезонности на накопление и метаболизм каротиноидов в тканях моллюска-фильтратора C. glaucum, обитающего в Черном море, и сопоставление этих данных с данными для сходного по типу питания и условиям обитания вида A. kagoshimensis, исследованного нами ранее.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Объектом исследования являлись двустворчатые моллюски-фильтраторы Cerastoderma glaucum (Bruguière, 1789), обитающие в Казачьей бухте г. Севастополя. Пробы отбирали ежемесячно на протяжении 2018 г. [18], кроме августа месяца. Причинами этого были высокая температура и влажность воздуха, приведшая к деструкции пигментов [18]. Количество экземпляров, отобранных в течение месяца (одна точка отбора), составило от 5 до 15.
Лабораторная обработка тканей моллюсков для определения суммарного содержания каротиноидов (ССК) и дальнейшего проведения тонкослойной хроматографии (ТСХ), подготовка и хранение проб проводились с соблюдением мер предосторожности, рекомендуемых при работе с пигментами [18].
Спектрофотометрические методы. Мягкие ткани гомогенизировали, содержание суммарных каротиноидов измеряли, как описано в [19]. ССК определяли спектрофотометрическим методом. Спектры общего экстракта каротиноидов и индивидуальных фракций записывали на спектрофотометре СФ-2000.
Суммарный экстракт каротиноидов для дальнейшего разделения и идентификации методами высокоэффективной жидкостной хроматографии (ВЭЖХ) и масс-спектрометрии (МС) запаивали в ампулы в атмосфере азота и транспортировали в Институт химии ДВО РАН при низкой температуре.
Хроматографические методы и масс-спектрометрия. Разделение пигментов проводили методами ТСХ и ВЭЖХ. При проведении ТСХ использовали пластины фирмы “Sorbfil” (Россия, Краснодар). Ацетоновые экстракты мягких тканей моллюска упаривали в вакууме, растворяли в хлороформе и разделяли на пластинках с силикагелем в системе: ацетон:гексан (2:8). Разделение пигментов проводилось при температуре воздуха 18–20°С.
ВЭЖХ проводили на хроматографе Shimadzu LC-20 с детектором со встроенной фотодиодной матрицей SPD-M20A, на колонке ZorbaxSil 250*4.6 мм, скорость потока элюента 1 мл/мин, в градиенте гексан-ацетон (0–20 мин гексан:ацетон 8:2, с 20 по 25 мин градиент до 80% ацетона в системе, 25–35 мин – гексан:ацетон 2:8). Фракции основных каротиноидов собирали (примерно 10–15 разделений), объединяли, упаривали досуха на роторном испарителе при 40°C, перерастворяли в метаноле и записывали масс-спектр с помощью масс-спектрометрического детектора низкого разрешения Shimadzu LCMS-2010EV, источник APCI, режим регистрации положительных ионов. Концентрации индивидуальных каротиноидов определяли с помощью ВЭЖХ, результаты концентрации 0.3% и ниже отмечены как “следы”. Оценка количественного содержания каротиноидов была основана на результатах ВЭЖХ с учетом коэффициента ${\text{A}}_{{{\text{1cm}}}}^{{1\% }}$ 2500 при 450 нм. Соотношение максимумов III/II, % в спектрах поглощения рассчитывали, как описано в [20].
Омыление каротиноидов проводили, перерастворяя их в 5%-ном растворе KOH в метаноле.
Статистический анализ. Статистическая обработка и графическое оформление полученной информации проводились при помощи пакета “Grapher-7”. Результаты расчета суммарных каротиноидов представлены как среднее арифметическое ($\bar {x}$) и стандартная ошибка средней ($S\bar {x}$).
РЕЗУЛЬТАТЫ
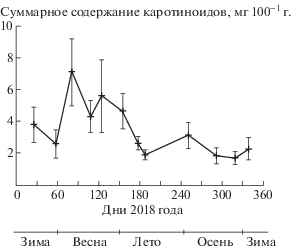
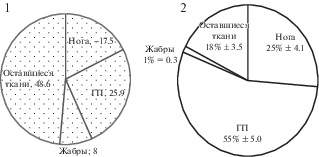
Каротиноиды C. glaucum. Внешний вид моллюска свидетельствует о хорошо развитой ноге, окрашенной в яркий (как правило) оранжевый цвет (рис. 1), вероятней всего, связанный с повышенным содержанием каротиноидов. С учетом массово-размерных характеристик внутренних органов, уровень ССК в ноге уступает лишь гепатопанкреасу, что характерно для большинства двустворчатых моллюсков (рис. 2). Отметим, что в жабрах содержится только относительно небольшая доля ССК. На рис. 3 показана годовая динамика суммарных каротиноидов C. glaucum. Максимальное накопление каротиноидов происходит весной и небольшое колебание в сторону увеличения отмечено в августе–сентябре. Изменение содержания ССК в тканях зависит от общего ССК в организме в целом и также подвержено сезонным и другим колебаниям. Увеличение ССК в мягких тканях моллюска совпадало с периодом созревания гонад и нерестом. Гонады окрашены в ярко желтый-оранжевый цвет и их хорошо видно на рис. 1.
Рис. 2.
Весовые характеристики C. glaucum-1; Распределение суммарного содержания каротиноидов по тканям C. glaucum-2.
Идентификация каротиноидов была проведена с помощью спектров поглощения в ультрафиолетовой и видимой областях, хроматографических и масс-спектрометрических данных:
β-каротин – время удерживания (Rt) 2.72 мин, максимумы поглощения в элюенте (λmax) 425, 449, 479, отношение %III/II 41, масса иона [M + H] + 537;
Эфир гетероксантина – Rt 2.88 мин (30.5 мин после омыления), λmax 426, 447, 477, %III/II 42;
Эфир мактраксантина – Rt 2.95 мин (33.0 мин после омыления), λmax 418, 441, 470, %III/II 88, [M + H] + 637 (после омыления);
Эфир фукоксантина – Rt 3.73 мин, λmax 448, (468), %III/II 0;
Эфир мактраксантина – Rt 3.89 мин (32.8 мин после омыления), λmax 417, 441, 470, %III/II 90, [M + H] + 637 (после омыления);
Лютеин – Rt 12.98 мин, λmax 424, 446, 475, %III/II 66, [M + H] + 569;
Зеаксантин – Rt 13.82 мин, λmax 451, 478, %III/II 16, [M + H] + 569;
Диатоксантин – Rt 14.70 мин, λmax 449, 476, %III/II 62;
Аллоксантин – Rt 15.60 мин, λmax 424 448, 477, %III/II 68;
Диадиноксантин – Rt 18.34 мин, λmax 424, 446, 475, %III/II 66, [M + H] + 583;
Фукоксантин – Rt 25.00 мин, λmax 449, (469), %III/II 0, %III/II 66, [M + H] + 659, [M+Na]+ 681, выделенная фракция неразделима со стандартом, выделенным из Laminaria sp.;
Виолаксантин – Rt 26.31 мин, λmax 418, 441, 471, %III/II 92, [M + H] + 601;
Неоксантин – Rt 29.10 мин, λmax 415, 438, 461, %III/II 80, [M + H] + 601;
Гетероксантин – Rt 30.45 мин, λmax 425, 449, 478, %III/II 58, [M + H] + 601;
Мактраксантин – Rt 32.88 мин, λmax 418, 442, 471, %III/II 91, [M + H] + 637;
Всего обнаружено и идентифицировано 11 свободных и 4 фракции этерифицированных каротиноидов. Ежемесячная динамика содержания индивидуальных каротиноидов представлена в табл. 1.
Таблица 1.
Динамика каротиноидов у моллюска C. glaucum в течение 2018 г.
| № п/п | Название каротиноида | Концентрация каротиноида в тканях Cerastodermaglaucum, в % за каждый месяц 2018 г. | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| январь | февраль | март | апрель | май | июнь | июль | сентябрь | октябрь | ноябрь | декабрь | ||
| 1 | β-каротин | 5.5 ± 0.7 | 7.7 ± 1.1 | 7.0 ± 1.2 | 6.8 ± 0.9 | 6.5 ± 1.3 | 4.6 ± 0.8 | 5.6 ± 1.2 | 3.7 ± 0.6 | 4.1 ± 0.8 | 2.8 ± 0.4 | 3.2 ± 0.4 |
| 2 | Эфир гетероксантина | 0.7 ± 0.5 | 1.1 ± 0.4 | 1.5 ± 0.3 | 1.7 ± 0.5 | 1.9 ± 0.8 | 1.1 ± 0.6 | 0.5 ± 0.2 | 0.4 ± 0.2 | следы | следы | следы |
| 3 | Эфир мактраксантина | 23.3 ± 2.4 | 20.6 ± 1.2 | 22.3 ± 1.6 | 23.6 ± 1.8 | 24.7 ± 1.6 | 23.5 ± 2.0 | 22.8 ± 3.4 | 31.3 ± 3.2 | 25.5 ± 3.2 | 19.8 ± 1.6 | 26.0 ± 3.0 |
| 4 | Эфир фукоксантина | 0.9 ± 0.4 | 1.8 ± 0.6 | 1.5 ± 0.5 | 1.3 ± 0.4 | 1.1 ± 0.4 | 0.8 ± 0.3 | 0.6 ± 0.2 | следы | 0.4 ± 0.2 | 0.6 ± 0.2 | 0.5 ± 0.3 |
| 5 | Эфиры мактраксантина | 4.5 ± 1.1 | 1.7 ± 0.6 | 2.3 ± 1.0 | 2.6 ± 0.6 | 3.0 ± 0.7 | 12.7 ± 3.5 | 13.8 ± 4.1 | 6.6 ± 2.2 | 7.2 ± 3.2 | 7.8 ± 2.8 | 7.4 ± 1.4 |
| 6 | Лютеин | 2.8 ± 0.4 | 4.6 ± 1.2 | 3.0 ± 0.7 | 2.0 ± 0.7 | 1.5 ± 0.5 | 1.3 ± 0.4 | 0.4 ± 0.1 | 1.2 ± 0.4 | 0.9 ± 0.4 | 0.6 ± 0.2 | 1.0 ± 0.3 |
| 7 | Зеаксантин | 0.9 ± 0.3 | 1.4 ± 1.3 | 1.1 ± 0.5 | 0.9 ± 0.3 | 0.6 ± 0.3 | следы | 0.4 ± 0.1 | следы | – | – | 0.4±0.1 |
| 8 | Диатоксантин | 5.2 ± 1.1 | 1.6 ± 0.1 | 1.4 ± 0.2 | 1.3 ± 0.3 | 1.1 ± 0.4 | 0.8 ± 0.3 | 3.2 ± 0.6 | 0.6 ± 0.2 | 3.1 ± 0.8 | 5.5 ± 0.9 | 8.8 ± 2.3 |
| 9 | Аллоксантин | 11.3 ± 2.1 | 2.8 ± 0.3 | 2.6 ± 0.5 | 2.5 ± 0.6 | 2.4 ± 1.1 | 0.8 ± 0.4 | 2.3 ± 0.9 | 3.2 ± 0.6 | 7.6 ± 1.8 | 12.2 ± 2.2 | 20.1 ± 2.6 |
| 10 | Диадиноксантин | 4.0 ± 0.6 | 5.8 ± 0.4 | 6.7 ± 1.4 | 7.3 ± 0.9 | 7.8 ± 2.2 | 2.1 ± 0.6 | 1.1 ± 0.5 | 1.5 ± 1.2 | 2.2 ± 0.6 | 2.9 ± 0.8 | 2.3 ± 0.8 |
| 11 | Фукоксантин | 4.5 ± 1.0 | 8.7 ± 2.1 | 6.3 ± 1.8 | 5.2 ± 0.4 | 4.4 ± 0.6 | 1.8 ± 0.5 | 2.1 ± 0.3 | следы | 0.6 ± 0.2 | 0.9 ± 0.4 | следы |
| 12 | Виолаксантин | 0.7 ± 0.5 | 1.4 ± 0.8 | – | – | – | 0.8 ± 0.4 | 0.7 ± 0.2 | 0.6 ± 0.1 | – | – | – |
| 13 | Неоксантин | 0.4 ± 0.2 | 0.9 ± 0.3 | – | – | – | 0.4 ± 0.2 | 1.1 ± 0.6 | следы | – | – | – |
| 12 | Гетероксантин | 25.0 ± 2.6 | 30.9 ± 2.5 | 32.4 ± 4.4 | 33.9 ± 5.3 | 35.4 ± 2.8 | 27.6 ± 2.4 | 23.0 ± 2.8 | 28.1 ± 4.1 | 28.9 ± 5.2 | 29.5 ± 3.6 | 19.1 ± 2.6 |
| 13 | Мактраксантин | 2.5 ± 0.2 | 2.6 ± 0.2 | 2.4 ± 0.6 | 2.3 ± 0.2 | 2.2 ± 0.3 | 2.5 ± 0.4 | 1.8 ± 0.3 | 2.4 ± 0.3 | 3.9 ± 0.4 | 5.5 ± 0.3 | 2.4 ± 0.2 |
| Неидентифицированные | 7.8 | 6.4 | 9.5 | 8.6 | 8.0 | 18.9 | 21.3 | 19.2 | 15.6 | 11.7 | 8.8 | |
В течение годового цикла в тканях моллюска постоянно присутствовали β-каротин, мактраксантин, гетероксантин и эфиры двух последних каротиноидов, они составляли около 50–60% от суммы всех пигментов. Ряд каротиноидов у C. glaucum присутствовал не постоянно, а только в отдельные месяцы – это зеаксантин, лютеин, диадиноксантин, диатоксантин, аллоксантин и фукоксантин, включая его эфир, которые составляют в сумме около 10–20%. С учетом неидентифицированных каротиноидов (6–22%) реальная суммарная доля минорных фракций существенно выше. В течение года можно выделить период увеличения их суммарного количества (с марта по июль), затем небольшое снижение и изменение в качественном составе (июль–сентябрь), после чего в октябре–ноябре снова рост их количества (табл. 1).
Каротиноиды A. kagoshimensis. На основании проведенных ранее исследований по изучению влияния фактора сезонности на изменение состава каротиноидов в индивидуальных тканях моллюска-фильтратора A. kagoshimensis, обитающего на Севастопольском побережье Черного моря [17], мы представляем динамику каротиноидов для организма моллюска в целом (табл. 2). Дополнением к этой таблице могут быть данные по гонадам, полученные в 2015 г. в период нереста моллюска (июль–август) [21]. В этот период отсутствовал пектенол А, на фоне увеличения содержания пектенолона, а уровень суммарных каротиноидов снижался до 3.9 ± 0.5 мг ⋅ 100–1 [21].
Таблица 2.
Динамика каротиноидов у моллюска Anadara kagoshimensis в период с февраля по июнь 2007 г.
| Показатель | Динамика каротиноидов | |||||
|---|---|---|---|---|---|---|
| Февраль | Март | Апрель | Май | Июнь | ||
| Суммарное содержание каротиноидов, мг*100–1 | 4.6 ± 1.5 | 2.5 ± 0.5 | 2.0 ± 0.9 | 4.2 ± 1.3 | 4.8 ± 1.8 | |
| № п/п | Название каротиноида | Доля каждого каротиноида в тканях A. kagoshimensis, (в %) от их суммы; февраль–июнь 2007 г. | ||||
| 1 | β-каротин | – | 4.5 ± 0.9 | 3.4 ± 0.5 | 3.1 ± 0.7 | 5.8 ± 1.5 |
| 2 | Транс-пектенолон | 22.3 ± 2.2 | 21.6 ± 1.7 | 22.1 ± 2.9 | 16.8 ± 1.6 | 18.3 ± 3.5 |
| 3 | Цис-пектенолон | 2.8 ± 1.1 | 2.7 ± 0.5 | 2.1 ± 0.6 | 2.4 ± 1.1 | 2.2 ± 0.7 |
| 4 | Зеаксантин | 3.1 ± 1.5 | 3.8 ± 1.2 | 2.3 ± 0.9 | 2.1 ± 0.5 | 2.6 ± 0.8 |
| 5 | Аллоксантин | 24.3 ± 2.2 | 19.2 ± 3.3 | 21.0 ± 4.1 | 19.3 ± 3.5 | 20.1 ± 3.2 |
| 6 | Диатоксантин | 10.2 ± 1.1 | 8.1 ± 2.5 | 8.2 ± 2.1 | 8.4 ± 1.8 | 8.5 ± 2.4 |
| 7 | Пектенол А | – | 5.7 ± 3.5 | 10.4 ± 2.8 | 6.3 ± 3.4 | 5.8 ± 2.7 |
| 8 | Сумма эфиров каротиноидов | 35.5 ± 4.5 | 31.3 ± 5.3 | 30.0 ± 7.3 | 39.2 ± 8.5 | 35.6 ± 6.5 |
| Неопределенные | 1.8 | 3.1 | 0.5 | 2.4 | 1.1 | |
ОБСУЖДЕНИЕ
Динамика суммарных каротиноидов. Исследования ССК у C. glaucum показало увеличение этого показателя в весенний и осенний периоды (рис. 3), что скорее всего вызвано сменой состава фитопланктона и бентосных водорослей [22]. После зимы, с появлением все более теплых и солнечных дней, происходит максимальное развитие как микроводорослей, так и зоопланктона, что обеспечивает разнообразную кормовую базу для бентосных моллюсков-фильтраторов [22]. У C. glaucum с апреля–мая начинают созревать гонады [23], что также влияет на увеличение ССК, вплоть до нереста. В нерестовый период происходит активное участие каротиноидов в различных процессах: от репродуктивных до защитных, восстановительных клеточных механизмов, поэтому летом, в разгар нереста, мы наблюдаем некоторое снижение уровня ССК в организме моллюска. В сентябре наступает смена температурных режимов, происходящие апвелинги приводят к обогащению вод питательными веществами и, как следствие, наступают смена состава фитопланктона и его бурное развитие [22]. По всей вероятности, с этим связан второй максимум в годовой динамике суммарных каротиноидов C. glaucum. Его невысокие показатели скорее всего вызваны нивелирующим влиянием нереста этих моллюсков в данный период.
Несколько иначе выглядит зависимость содержания ССК у анадары от зимнего, весеннего и летнего сезона [16]. Как было отмечено ранее, для этого вида характерно увеличение содержания каротиноидов в феврале и в мае–июне, что по времени совпадает с развитием диатомовых микроводорослей, их двустадийной сукцессией, о чем сообщалось ранее [16]. В период нереста также для этого вида моллюсков было отмечено некоторое снижение общего уровня ССК.
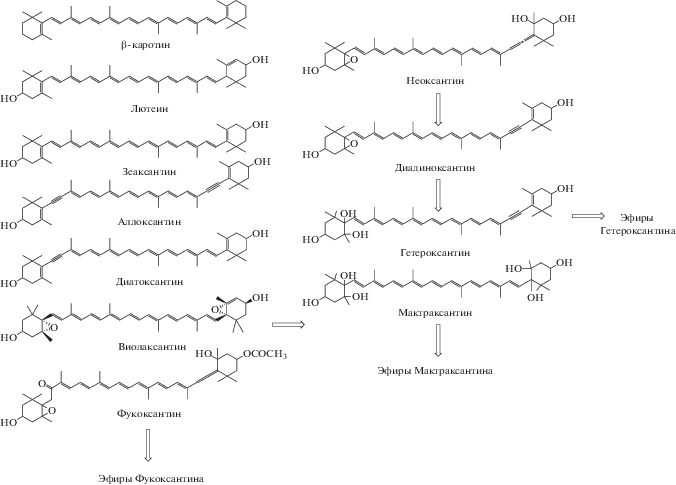
Динамика качественного состава каротиноидов. Состав каротиноидов моллюска C. glaucum представлен 11-ю соединениями и 4-мя их эфирами. Структурные формулы приведены на рис. 4. Большинство каротиноидов C. glaucum относятся к растительным пигментам, которые может получить моллюск с пищей, профильтровывая фитопланктон. Так, например, β-каротин характерен для многих видов микроводорослей, относящихся к отделам и классам Cyanophyta, Prochlorophyta, Chlorophyceae, Prasinophyceae, Euglenophyta, Eustigmatophyta, Raphidophyceae, что делает его доступным в спектре питания круглый год, а колебания в концентрации могут быть вызваны вариантами численности видов микроводорослей, синтезирующих этот каротиноид и употребляемых моллюском. Диатоксантин, диадиноксантин, фукоксантин, являются характерными пигментами для диатомовых и многих динофитовых видов микроводорослей, встречаются также у представителей Prymnesiophyceae, Chysophyceae и Raphidophyceae [24]. Лютеин и зеаксантин являются характерными для зеленых микроводорослей, однако источником зеаксантина может быть также и зоопланктон. Известно, что гетероксантин был открыт в 70-х годах прошлого столетия у желто-зеленых жгутиковых микроводорослей [25], которые синтезируют также диадиноксантин и диатоксантин. Однако высокая концентрация гетероксантина в течение всего года, несмотря на смену состава фитопланктона во время сезонных сукцессий, наводит на мысль о существовании дополнительного механизма метаболических преобразований в тканях C. glaucum. Ранее такой механизм преобразований был предложен для мидии M. edulis норвежскими учеными, которые считали, что предшественником может выступать диадиноксантин, у которого 5,6-эпокси-группа превращается в дополнительные две гидрокси-группы и образуется гетероксантин [26] (рис. 4). Исходя из структурного состава кароти-ноидов, неоксантин мог бы выступать предшественником образования диадиноксантина, в случае отсутствия или нехватки его в пищевом спектре моллюска.
В составе фитопланктона можно встретить микроводоросли, синтезирующие и аллоксантин (Cryptophyta) [24, 27]. Их численность невелика, и это может быть причиной непостоянной концентрации этого ксантофилла в тканях моллюска. Сравнение годовой динамики каротиноидов у C. glaucum (табл. 1) и известных сезонных изменений фитопланктона и бентосных микроводорослей для Севастопольского побережья [22] позволяет предположить прямое влияние сезонных сукцессий на динамику большинства каротиноидов моллюска C. glaucum.
Мактраксантин – единственный каротиноид, не синтезируемый микроводорослями, его впервые обнаружили в составе моллюсков Mactra chi-nensis в 1983 году [28]. Вероятным предшественником мактраксантина может быть широко распространенный у фотосинтезирующих организмов виолоксантин. Однако наличие такой трансформации у моллюсков пока не подтверждено.
Отличия в составе каротиноидов C. glaucum из черноморского региона и других ареалов обитания этого вида [8, 9] могут быть объяснены многими причинами. Климатические отличия регионов, гидрохимические отличия среды обитания влияют не только на пищевые цепи питания моллюсков. Под действием ряда внешних факторов моллюски могут приобретать изменения в наборе ферментов, что может привести к различной способности к усвоению тех или иных каротиноидов. Данная область является практически неисследованной. Существенной причиной отличия в литературных данных по составу каротиноидов для одного и того же вида моллюска мог стать прогресс в методах разделения и идентификации каротиноидов в 80–90-х годах прошлого столетия [19]. Совершенствование хроматографических и масс-спектрометрических методов послужило причиной для многих повторных исследований в области биохимии каротиноидов, что позволило открыть не только новые виды этих соединений, но и уточнить многие до конца неизученные механизмы их трансформации [1, 15].
Другой вид сестенофага – моллюск-вселенец в Черное море, A. kagoshimensis, несмотря на схожий образ жизни и спектр питания, накапливал всего 6 свободных (без учета изомеризации пектенолона) и 4 этерифицированных каротиноидов [20] (табл. 2). На протяжении трех сезонов наблюдалось лишь небольшое колебание фракций β-каротина и пектенола А. Изменение содержания последнего в летние месяцы может быть вызвано общей нагрузкой на организм в период нереста [20]. Представленные результаты показывают динамику фракций каротиноидов в организме анадары в целом, чего не было показано в предыдущих опубликованных работах [15, 16, 20]. Это дает возможность для объективного сравнения состава каротиноидов A. kagoshimensis как с видовыми аналогами из других регионов Мирового океана, так и с другими видами. В отличие от C. glaucum, для A. kagoshimensis характерны более устойчивый качественный состав каротиноидов и менее выраженные сезонные изменения количества каротиноидов.
ЗАКЛЮЧЕНИЕ
Динамика суммарных каротиноидов в течение года у Cerastoderma glaucum связана, в первую очередь, с сезонными изменениями в спектре питания и репродуктивным циклом моллюска.
Качественный состав каротиноидов C. glaucum представлен 11-ю каротиноидами и 4-мя эфирами, большая их часть имеет растительное происхождение и накапливается без дальнейшего метаболического преобразования. Трансформация происходит с образованием мактраксантина и его эфиров, а также эфиров фукоксантина и гетероксантина. Самую высокую концентрацию в тканях моллюска имеет гетероксантин, причем на протяжении всего годового цикла, поэтому возможно наличие дополнительного преобразования для получения этого каротиноида: неоксантин → диадиноксантин → гетероксантин. Среди постоянных каротиноидов, присутствующих независимо от годового цикла: β-каротин, гетероксантин и мактраксантин, а также эфиры последних двух каротиноидов, эта группа пигментов в течение года составляла 50–65% от суммы всех каротиноидов. Накопление всех остальных каротиноидов сильно зависит от спектра питания, который в свою очередь подвержен сезонным изменениям. Так, отмечено, что в более холодные периоды года в тканях C. glaucum накапливаются фукоксантин и его эфиры, характерные для диатомовых и ряда динофитовых видов микроводорослей, а в более теплые месяцы происходит снижение их концентрации (вплоть до исчезновения) и появление диадиноксантина, лютеина и зеаксантина, характерных более для теплолюбивых зеленых и желто-зеленых жгутиковых микроводорослей.
Несмотря на схожесть в образе жизни и спектре питания, другой моллюск-фильтратор, A. kagoshimensis не обладал столь очевидной и сильной зависимостью от сезонных изменений. В его тканях существуют следующие процессы трансформации растительных каротиноидов: диатоксантин → пектенол А → пектенолон (цис-; транс-), а сезонным колебаниям подвержены только содержания β-каротина и пектенола А.
Из сравнения результатов исследований обоих видов моллюсков можно отметить, что сезонным колебаниям каротиноидов в большей степени подвергаются моллюски с наиболее широким спектром накопления различных растительных каротиноидов.
Список литературы
Britton G., Liaaen-Jensen S., Pfander H. (Eds.). Caro-tenoids. Vol. 3. Biosynthesis and Metabolism. Basel: Birkhäuser Verlag. 1998.
Britton G., Liaaen-Jensen S., Pfander H. (Eds.). Carotenoids. Vol. 4. Natural Functions. Basel: Birkhäuser Verlag. 2008.
Киселёва М.И., Ревков П.К., Копытов Ю.П. Современное состояние и многолетние изменения зообентоса Стрелецкой бухты (район Севастополя). Гидробиологический журнал. 33 (1): 3–13. 1997. [Kiseleva M.I., Revkov N.K., Kopytov Y.P. Modern State and Long-Term Changes in Zoobenthos of the Streletskaya Bight (Sevastopol Region). Hydrobiological Journal. 33 (1): 3–13. 1997 (in Russ)].
Савикин А.И., Набоженко М.В. Распространение двустворчатого моллюска Cerastoderma glaucum (Pioret, 1789) (Bivalvia: Cardidae) в Таганрогском заливе Азовского моря. Вестник Южного науч. Центра РАН. 6 (4): 105–107. 2010. [Savikin A.I., Nabozhen-ko M.V. Distribution of bivalve mollusk Cerastoderma glaucum (Poiret, 1789) (Bivalvia: Cardiidae) in Taganrog Bay of the Azov Sea. Vestnik Yuzhnogo nauch. Centra RAN. 6 (4): 105–107. 2010.]
Набоженко М.В. Реконструкция и динамика таксоценоза двустворчатых моллюсков (Mollusca: Bivalvia) Азовского моря в позднем галоцене в связи с изменением солености. Труды Зоологического института РАН. Прилож. 3: 182–191. 2013. [Nabozhen-ko M.V. Reconstruction and dinamics of bivalves taxocenoses (Mollusca: Bivalvia) of the sea of Azov in late holocene in connection with change of salinity. Proceedings of the Zoological Institute RAN. Prilozhenie 3: 182–191. 2013 (in Russ)].
Андреева С.И., Андреев Н.И. Эволюционные преобразования двустворчатых моллюсков Аральского моря в условиях экологического кризиса. Омск: Изд-во Омского государственного педагогического университета. 2003. [Andreeva S.I., Andreev N.I. Evo-lyucionnye preobrazovaniya dvustvorchatyh mollyuskov Aral’skogo morya v usloviyah ekologicheskogo krizisa. [Evolutionary transformations of bivalve mollusks of the Aral Sea in conditions of ecological crisis] Omsk: Izd-vo Omskogo gosudarstvennogo pedagogicheskogo universiteta. 2003 (in Russ)].
Андреева С.И. Современные Cerastoderma (Bivalvia, Cardiidae) Аральского моря: Систематика, изменчивость, эволюция. Омск: Изд-во Омского государственного педагогического университета. 2000 [Andreeva S.I. Sovremennye Cerastoderma (Bivalvia, Cardiidae) Aral’skogo morya: Sistematika, izmenchivost’, evolyuciya. [Modern Cerastoderma (Bivalvia, Cardiidae) of the Aral Sea: Systematics, variability, evolution]. Omsk: Izd-vo Omskogo gosudarstvennogo pedagogi-cheskogo universiteta. 2000.]
Goodwin T.W. The biochemistry of the carotenoids: animals. London; New York: Chapman and Hall. 1984.
Boyden C.R. Comparative studies on Cerastoderma edule (L.) and Cerastoderma glaucum (Poiret): PhD thesis. Department of Zoology & Comparative Physiology, Queen Mary College. London. 1970.
Stancher B., Zonta F., Favretto L.G. High-performance liquid chromatography of carotenoids from some marine shellfish. J. of Chromatography. 440: 37–46. 1988.
Бородина А.В. Особенности накопления каротиноидов некоторыми черноморскими моллюсками-фильтраторами in vivo. Материалы научных мероприятий, приуроч. к 15-летию Южного научного центра Российской академии наук, г. Ростов-на-Дону, 13–16 декабря, 2017 г. Ростов-н/Д. 351–353. 2017. [Borodina A.V. Osobennosti nakopleniya karotinoidov nekotorymi chernomorskimi mollyuskami-filtratorami in vivo. Materialy nauchnyh meropriyatij, priuroch. k 15‑letiyu Yuzhnogo nauchnogo centra Rossijskoj akademii nauk, g. Rostov-na-Donu, 13–16 dekabrya, 2017. [Features of carotenoid accumulation by some Black Sea filter-feeding bivalves in vivo. Materials of scientific events to the 15th anniversary of the Southern Scientific Center of the Russian Academy of Sciences, Rostov-on-Don, December 13–16, 2017] Rostov-n/D. 351–353. 2017 (in Russ)].
Gostiukhina O.L., Golovina I.V. Comparative Analysis of Antioxidant Complex of the Black Sea Mollusks Mytilus galloprovincialis, Anadara inaequivalvis and Crassostrea gigas. Hydrobiological Journal. 49 (3): 77–84. 2013.
Шульман Г.Е., Солдатов А.А. (ред). Черноморские моллюски: элементы сравнительной и экологической биохимии. Севастополь: ЭКОСИ-Гидрофизика. 2014 [Shulman G.E., Soldatov A.A. (red). Chernomorskie mollyuski: elementy sravnitel’noj i ekologicheskoj biohimii. [Black Sea mollusks: elements of comparative and ecological biochemistry]. Sevastopol: EKOSI-Gidrofizika. 2014 (in Russ)].
Гостюхина О.Л., Андреенко Т.И. Ферментное и низкомолекулярное звенья антиоксидантного комплекса двух видов черноморских моллюсков с разной устойчивостью к окислительному стрессу: Mytilus galloprovincialis Lam. и Anadara kagoshimensis (Tokunaga, 1906). Журнал общей биологии. 79 (6): 482–492. 2018. [Gostyukhina O.L., Andreenko T.I. Enzymatic and low-molecular weight units of antioxidant complex in two species of the Black Sea mollusks with different resistance to oxidative stress: Mytilus galloprovincialis Lam. and Anadara kagoshimensis (Tokunaga, 1906). Zhurnal obshchej biologii. 79 (6): 482–492. 2018 (in Russ)].
Soldatov A.A., Gostyukhina O.L., Borodina A.V., Golovi-na I.V. Glutathione antioxidant complex and carotenoid composition in tissues of the bivalve mollusk Anadara kagoshimensis (Tokunaga, 1906). J. Evol. Biochem. Physiol. 53 (4): 289–297. 2017.
Бородина А.В. Солдатов А.А. Каротиноиды тканей массовых видов черноморских моллюсков. С. 87–168. в кн. Черноморские моллюски: элементы сравнительной и экологической биохимии. Шульман Г.Е., Солдатов А.А. (ред.) Севастополь: ЭКОСИ-Гидрофизика. 2014. [Borodina A.V. Soldatov A.A. Karotinoidy tkanej massovyh vidov chernomorskih mollyuskov. S. 87–168. v kn. Chernomorskie mollyuski: elementy sravnitelnoj i ekologicheskoj biohimii. Shulman G.E., Soldatov A.A. (red.) [Carotenoids of tissues of dominant species of Black Sea shellfish. p. 87–168. In book Black Sea clams: elements of comparative and ecological biochemistry. Shulman G.E., Soldatov A.A. (Eds.)]. Sevastopol: EKOSI-Gidrofizika. 2014 (in Russ)].
Borodina A.V., Soldatov A.A. The Qualitative Composition of Carotenoids and Their Seasonal Dynamics in Tissues of the Bivalve Anadara kagoshimensis (Tokunaga, 1906). Rus. J. of Marine Biology. 42 (2): 166–178. 2016.
Maoka T., Akimoto N. Natural product chemistry in carotenoid some experimental techniques for structural elucidation and analysis of natural carotenoids. Carotenoid Science (Mini-review). 13: 10–17. 2008.
Карнаухов В.Н. Биологические функции каротиноидов. М.: Наука. 1988. [Karnaukhov V.N. Biologicheskie funkcii karotinoidov [Biological functions of carotinoids]. M.: Nauka. 1988 (in Russ)].
Britton G., Liaaen-Jensen S., Pfander H. (Eds.). Carotenoids. Vol. 1 A. Isolation and Analysis. Basel: Birkhäuser Verlag. 1995.
Borodina A.V. Carotenoids in the Gonads of the Bivalved Mollusk Anadara kagoshimensis (Tokunaga, 1906). J. Evol. Biochem. Physiol. 54 (4): 267–272. 2018.
Токарев Ю.Н., Финенко З.З., Шадрин Н.В. (ред). Микроводоросли Черного моря: проблемы биоразнообразия, сохранения и биотехнологического использования. Севастополь: ЭКОСИ–Гидрофизика. 2008. [Tokarev Yu.N., Finenko Z.Z., Shadrin N.V. (red). Mikrovodorosli Chyornogo morya: problemy bioraznoobraziya, sohraneniya i biotekhnologicheskogo ispol’zovaniya [Black Sea microalgae: biodiversity, conservation and biotechnology use issues]. Sevastopol: EKOSI–Gidrofizika. 2008 (in Russ)].
Михайлова Т.В. Особенности размножения Cerastoderma glaucum (Mollusca, Bivalvia) в Черном море. Экология моря. 23: 64–68. 1986. [Mikhailova T.V. Osobennosti razmnozheniya Cerastoderma glaucum (Mollusca, Bivalvia) v Chyornom more [Features of the reproduction of Cerastoderma glaucum (Mollusca, Bivalvia) in the Black Sea]. Ekologiya morya. 23: 64–68. 1986 (in Russ)].
Jeffrey S.W., Mantoura R.F.C., Bjørnland T. Phytoplankton pigments in oceanography: guidelines to modern methods. Paris. 1997.
Strain H.H., Svec W.A., Katz J.J. Structure of heteroxanthin, a unique xanthophyll from the Xanthophyceae (Heterokontae). J. of the Chemical Society D Chemical Communications. 876–877. 1970.
Partali V., Tangen K., Liaaen-Jensen S. Carotenoids in food chain studies – III. Resorption and metabolic transformation of carotenoids in Mytilus edulis (Edible mussel). Comp. Biochem. Physiol. 92B (2): 239–246. 1989.
Takaichi S. Carotenoids in Algae: Distributions, Biosyntheses and Functions. Mar. Drugs. 9: 1101–1118. 2011.
Matsuno T., Sakaguchi S. A novel marine carotenoid, mactraxanthin from the Japanese Edible Surf clam. Tetrahedron Letters. 24 (9): 911–912. 1983.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии