Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 1, стр. 24-31
ЛЕПТИНОВАЯ СИГНАЛЬНАЯ СИСТЕМА В СЕМЕННИКАХ КРЫС С РАЗЛИЧНЫМ ПО СТЕПЕНИ ТЯЖЕСТИ САХАРНЫМ ДИАБЕТОМ 2-ГО ТИПА
К. В. Деркач 1, А. А. Бахтюков 1, Викас Рой 2, А. Ю. Грязнов 1, 3, Л. В. Баюнова 1, А. О. Шпаков 1, *
1 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии и биохимии
им. И.М. Сеченова РАН
Санкт-Петербург, Россия
2 Университет Мизорама
Мизорам, Аиджал, Индия
3 Центр планирования семьи и репродукции
Пушкин, Санкт-Петербург, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 27.07.2019
После доработки 29.09.2019
Принята к публикации 15.10.2019
Аннотация
Лептин – один из важнейших регуляторов репродуктивной системы, мишенями которого являются все звенья гипоталамо-гипофизарно-гонадной оси. В условиях сахарного диабета 2-го типа (СД2) функции мужской репродуктивной системы нарушаются, что может быть обусловлено изменениями активности лептиновой системы в семенниках. Целью работы было изучить уровень лептина и функциональное состояние лептиновой системы в семенниках самцов крыс Wistar с различным по тяжести СД2, индуцированным высокожировой диетой и низкими дозами стрептозотоцина. У крыс с сильно выраженным СД2 (Д-СВ), наряду с гипергликемией, нарушенной толерантностью к глюкозе, инсулиновой резистентностью, повышенными уровнями гликированного гемоглобина и свободных жирных кислот, отмечали отчетливо выраженную гиперлептинемию, снижение уровня тестостерона в крови, снижение количества сперматозоидов и повышение доли морфологически дефектных форм. В семенниках крыс группы Д-СВ был повышен уровень лептина, снижено число лептиновых рецепторов и ослаблено фосфорилирование эффекторных компонентов лептинового сигналинга – транскрипционного фактора STAT3 по Tyr705 и Akt-киназы по Ser473. У крыс с умеренно выраженным СД2 (Д-УВ) метаболические и гормональные нарушения, а также снижение уровня тестостерона в крови и изменения показателей спермограммы были выражены слабее. Уровень лептина в крови был достоверно выше такового в контроле только после глюкозной нагрузки. В семенниках крыс группы Д-УВ статистически значимых различий в уровне лептина и его рецептора и в фосфорилировании STAT3 и Akt-киназы с таковыми в контроле выявлено не было. Таким образом, патологические изменения стероидогенеза и сперматогенеза у самцов крыс с СД2 определяются степенью метаболических и гормональных нарушений, а также функциональным состоянием лептиновых сигнальных путей в семенниках, выраженность нарушений в которых положительно коррелирует с системной гиперлептинемией.
ВВЕДЕНИЕ
Сахарный диабет 2-го типа (СД2) и тесно ассоциированный с ним метаболический синдром (МС) в настоящее время являются наиболее часто встречающимися эндокринопатиями, распространение которых в мире приобретает характер пандемии. В условиях СД2 и МС развиваются заболевания сердечно-сосудистой, выделительной и нервной систем. В последние годы значительное внимание уделяется ассоциированным с этими метаболическими расстройствами дисфункциям репродуктивной системы. У пациентов-мужчин, страдающих СД2 и МС, развиваются признаки вторичного гипогонадизма, снижается уровень тестостерона (Т), нарушается сперматогенез, что, в конечном итоге, приводит к бесплодию [1–4]. Эти репродуктивные дисфункции связывают как с системными метаболическими нарушениями, типичными для СД2 и МС, так и с негативным влиянием гипергликемии, гиперинсулинемии и дислипидемии на различные звенья гипоталамо-гипофизарно-гонадной (ГГГ) оси, а также на процессы дифференцировки и созревания сперматозоидов [5–7]. Несмотря на прогресс, достигнутый в изучении дисфункций репродуктивной системы у мужчин с СД2 и МС, молекулярные механизмы и факторы, ответственные за их возникновение и развитие, изучены недостаточно. При этом как клинические, так и экспериментальные данные о степени, выраженности и механизмах нарушений стероидогенеза и сперматогенеза при СД2 и МС противоречивы, что во многом обусловлено различиями в этиопатогенезе, продолжительности и степени тяжести этих метаболических расстройств, наличием сопутствующих им заболеваний [1, 2, 8].
Важную роль в контроле стероидогенеза и сперматогенеза играют лептин и его сигнальная система, причем свои регуляторные эффекты лептин осуществляет на всех уровнях функционирования ГГГ оси [9–12]. Достаточно подробно изучено влияние лептина на гипоталамические нейроны, экспрессирующие лептиновые рецепторы, через которые лептин стимулирует синтез и секрецию гонадолиберина, рилизинг-фактора лютеинизирующего и фолликулостимулирующего гормонов [13, 14]. Сравнительно недавно было показано, что лептин может непосредственно влиять на стероидогенные клетки Лейдига и сперматогенные клетки, в которых локализованы основные компоненты лептиновой сигнальной системы. В семенниках лептин стимулирует синтез Т и способствует созреванию сперматозоидов, повышая мужскую фертильность [9–12]. Часть лептина синтезируется в семенниках de novo, в то время как другая поступает из кровотока [9, 15, 16]. Предполагают, что лептиновый сигналинг в семенниках может нарушаться как в условиях дефицита лептина при голодании, так и при гиперлептинемии, характерной для ожирения, МС и СД2, когда из-за избытка поступления лептина в семенники чувствительность к нему тестикулярных клеток может снижаться [10, 11]. Однако функциональная активность лептиновой системы в семенниках при различных по тяжести формах СД2 остается не исследованной.
В связи с вышесказанным, целью исследования было изучить уровни лептина и функциональное состояние лептиновой системы в семенниках самцов крыс с различным по степени тяжести СД2, вызванным высокожировой диетой и обработкой низкими дозами стрептозотоцина (СТЗ), и оценить, как активность этой системы соотносится с уровнем Т в крови и показателями спермограммы у контрольных и диабетических крыс.
МАТЕРИАЛ И МЕТОДИКА
Для экспериментов использовали самцов крыс линии Wistar, которые в начале эксперимента имели возраст 2.5 мес и массу тела 180–200 г. Животных содержали в стандартных условиях (соотношение день/ночь составило 12 ч/12 ч, температура 24 ± 4°C), со свободным доступом к стандартному корму и воде. Эксперименты выполняли в строгом соответствии с требованиями Комитета по биоэтике ИЭФБ РАН, European Communities Council Directive 1986 (86/609/EEC) и “Guide for the Care and Use of Laboratory Animals”.
Для моделирования среднетяжелой формы СД2 самцы крыс Wistar (n = 32) сначала в течение двух месяцев получали диету с высоким содержанием насыщенных жиров. Один килограмм высокожировой смеси содержал 524 г свиного сала, 417 г творога, 50 г свиной печени, 5.3 г метионина, 1.85 г пекарских дрожжей, 1.85 г поваренной соли [17]. Затем крыс обрабатывали СТЗ (“Sigma”, США) в дозе 30 мг/кг, после чего продолжали содержать на высокожировой диете еще в течение месяца. Контрольная группа (К, n = 12) в те же сроки получала стандартный корм и вместо СТЗ была обработана его растворителем, 0.1 М цитратным буфером (pH 4.5). На протяжении всего эксперимента у крыс контролировали массу тела и уровень постпрандиальной глюкозы, который определяли с помощью тест-полосок “One Touch Ultra” (США) и глюкометра “Life Scan Johnson & Johnson” (Дания) через 2 ч после еды в образцах крови, полученной из хвостовой вены. В крови с помощью набора “Multi Test HbA1c System” (“Polymer Technology Systems, Inc.”, США) также измеряли уровень гликированного гемоглобина.
За неделю до окончания эксперимента у крыс с повышенной массой тела и уровнями постпрандиальной глюкозы (>7 мМ) и гликированного гемоглобина (HbA1c > 5.5%) (n = 17) с помощью глюкозотолерантного теста (ГТТ) оценивали чувствительность к глюкозе и инсулину. Для этого крысам после 12-ти часового голодания в/б вводили глюкозу (2 г/кг), после чего в течение 120 мин измеряли концентрацию глюкозы в крови. Перед введением глюкозы и через 120 мин после глюкозной нагрузки измеряли уровни инсулина и лептина в крови, которые оценивали с помощью наборов “Rat Insulin ELISA kit” (“Mercodia AB”, Швеция) и “ELISA kit for Leptin” (“Cloud-Clone Corp.”, США). На основании показателей ГТТ и индекса инсулиновой резистентности (ИР), рассчитанного как произведение концентраций глюкозы и инсулина, формировали две группы крыс – с сильно выраженным (группа Д-СВ, n = 6) и умеренно выраженным (Д-УВ, n = 6) СД2, которые существенно различались по уровням гипергликемии, гиперинсулинемии и гиперлептинемии, а также по значениям площади под кривыми “концентрация глюкозы(мМ)–время(мин)” (AUC0–120) в ГТТ. По окончании эксперимента самцов крыс декапитировали под наркозом, оценивали массу жира и семенников, забирали образцы крови и ткани семенников для дальнейших исследований. Концентрацию Т в крови определяли, используя набор “Тестостерон-ИФА” (“Алкор-Био”, Россия), концентрацию свободных жирных кислот с помощью набора “NEFA FS” (“DiaSys”, Германия).
Содержание лептина и лептиновых рецепторов в семенниках оценивали с помощью наборов “ELISA kit for Leptin, Rat” и “ELISA kit for Leptin Receptor, Rat” (“Cloud-Clone Corp.”, США). Для этого образцы тканей семенников гомогенизировали в соотношении 1:10 в лизирующем буфере, содержащем 20 мМ Tris-HCl (pH 7.5), 150 мМ NaCl, 2 мМ ЭДТА, 2 мМ ЭГТА, 0.25 M сахарозы, 0.5% Triton X‑100, 0.5% дезоксихолата натрия, 15 мМ NaF, 10 мМ глицерофосфата натрия, 10 мМ пирофосфата натрия, 1 мМ Na3VO4, 1 мМ фенилметилсульфонилфторида, 0.02% азида натрия и ингибиторы протеаз (“Sigma-Aldrich”, США), как описано ранее [18]. Полученный гомогенат центрифугировали (10 000 g, 5 мин), и в супернатанте измеряли содержание лептина и его рецептора в соответствии с инструкциями фирмы “Cloud-Clone Corp.” (США), которое выражали в пг/мг сырой ткани.
Идентификацию фосфорилированных форм Akt-киназы и STAT3-белка проводили с помощью вестерн-блоттинга, как описано ранее для гипоталамуса [18]. Ткани семенников гомогенизировали (1:20) в 20 мМ Tris-HCl-буфере (pH 6.8), который содержал 25 мМ ЭДТА, 0.1% Triton X-100, коктейль ингибиторов протеаз и фосфатаз. Полученный гомогенат центрифугировали (100 g, 10 мин), к супернатанту в соотношении 3:1 добавляли 200 мМ Tris-HCl-буфер (pH 6.8), содержащий 400 мМ β-меркаптоэтанола, 4% додецилсульфат натрия, 40% глицерин и 0.01% бромфеноловый синий. Пробы нагревали до 95°С (3 мин), разделяли в 10% поли-акриламидном геле и переносили на нитроцеллюлозную мембрану (0.45 мкм, “Bio-Rad”, США). Мембраны в течение 1 ч обрабатывали 5%-ным раствором сухого обезжиренного молока в TBS–Tween-20-буфере (pH 7.6) и в течение ночи (+4°С) инкубировали с первичными антителами Anti-Akt, Anti-Phospho(Ser473)-Akt, Anti-STAT3, Anti-Phospho-STAT3 (Tyr705) (разведение 1:1000), Anti-GAPDH (1:2000) (“Cell Signaling Technology”, США). В качестве вторичных антител использовали goat anti-rabbit IgG HRP (1:5000) (“Cell Signaling Technology”, США). В качестве стандарта использовали иммуноокрашивание глицеральдегид-3-фосфатдегидрогеназы (GAPDH). Визуализацию осуществляли с помощью набора для иммунохемилюминесценции “Novex ECL Reagents” (“Invitrogen”, США).
Показатели спермограммы оценивали при выводе самцов крыс из эксперимента. Для этого из каудальной части эпидидимиса извлекали 5 мг эпидидимальных сперматозоидов, помещали их в 195 мкл среды фертилизации “Quinn’s AdvantageTM Medium With HEPES” (“In Vitro Fertilization Inc., Cooper Surgical Company”, США) и инкубировали в ней в течение 30 мин при 37°С. Для оценки морфологии сперматозоидов исследовали мазок на предметном стекле с последующей окраской азуром и эозином с использованием набора реагентов “Спермо-Дифф-200” (ООО “Фирма Синтакон”, Россия). Осуществляли подсчет морфологически дефектных форм, включающих сперматозоиды с извитым хвостом или дефектами головки, в расчете на 100 сперматозоидов в каждом препарате. Фотографии препаратов получали с использованием микроскопа “Axio Lab.A1 MAT” (“Carl Zeiss”, Германия) со встроенной телевизионной камерой и программы Axio-Vision 4.8 при увеличении ×1000.
Статистический анализ данных проводили с помощью программы “Microsoft Office Excel 2007”. Данные представлены, как M ± SD, для данных по вестер-блоттингу, как M ± SEM. Нормальность распределения проверяли с помощью критерия Шапиро-Уилка. Для сравнения выборок с нормальным распределением использовали t-критерий Стьюдента. Достоверными считали отличия при уровне значимости p < 0.05.
РЕЗУЛЬТАТЫ
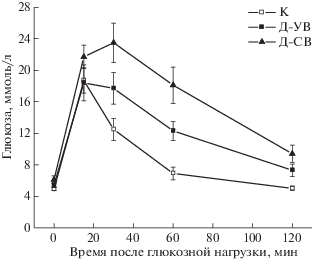
У крыс как с сильно выраженным, так и с умеренно выраженным СД2 отмечали повышение массы тела, жировой ткани и ее доли в общей массе тела, повышение в крови уровней гликированного гемоглобина, постпрандиальной глюкозы и свободных жирных кислот, причем различия с контролем были в большей степени выражены у животных группы Д-СВ (табл. 1). Масса яичек в группах Д-СВ и Д-УВ не отличалось от таковой в контроле. Уровень глюкозы натощак был статистически значимо повышен только у крыс группы Д-СВ, в то время как уровни инсулина натощак в обеих группах не отличались от их значений в контроле. В ГТТ было показано, что у крыс группы Д-СВ была нарушена толерантность к глюкозе, о чем свидетельствовало повышение (на 89%) значения AUC0–120 для кривых зависимости концентрации глюкозы (мМ) от времени (мин) в сравнении с контролем (1995 ± 204 против 1057 ± 88 отн. ед., p < 0.05). У крыс группы Д-УВ значение AUC0–120 (1487 ± 139, p < 0.05 с контролем) превышало этот показатель в контроле на 41% и было ниже такового в группе Д-СВ на 25%, что свидетельствует о менее выраженном нарушении толерантности к глюкозе в группе Д-УВ в сравнении с группой Д-СВ (рис. 1). Через 120 мин после нагрузки уровень инсулина в группе Д-СВ повышался на 61% (p < 0.05 с контролем), что в сочетании с повышенным уровнем глюкозы в той же временной точке указывает на развитие ИР. В группе Д-УВ через 120 мин после глюкозной нагрузки также отмечали достоверно повышенный уровень глюкозы и тенденцию к повышению уровня инсулина. При этом индекс ИР, рассчитанный как произведение концентраций глюкозы и инсулина, в обеих группах статистически значимо превышал таковой в группе К – в группе Д-СВ он был выше в среднем в три раза, в группе Д-УВ – в два раза. Крысы группы Д-СВ характеризовались отчетливо выраженной гиперлептинемией, причем уровень лептина превосходил таковой как в контроле, так и в группе Д-УВ. Через 120 мин после нагрузки уровень лептина в крови повышался во всех группах, но в группах Д‑СВ и Д-УВ концентрация этого адипокина была на 101 и 42% выше, чем в контроле.
Таблица 1.
Масса тела, жировой ткани и яичек, метаболические и гормональные показатели у самцов крыс с СД2, вызванным высокожировой диетой и низкой дозой СТЗ
| Показатель | К, n = 6 | Д-УВ, n = 6 | Д-СВ, n = 6 |
|---|---|---|---|
| Масса тела, г | 353.7 ± 10.7 | 388.5 ± 15.4* | 405.5 ± 11.5* |
| Масса жира, г | 11.6 ± 1.3 | 20.4 ± 1.9* | 22.9 ± 3.2* |
| Доля жира, % | 3.3 ± 0.3 | 5.2 ± 0.3* | 5.7 ± 0.7* |
| Масса яичек, г | 3.80 ± 0.15 | 3.70 ± 0.30 | 3.67 ± 0.23 |
| Глюкоза натощак, мМ | 4.8 ± 0.3 | 5.4 ± 0.3*# | 6.2 ± 0.6* |
| Постпрандиальная глюкоза, мМ | 5.1 ± 0.2 | 7.1 ± 0.6*# | 9.2 ± 1.2* |
| HbA1c, % | 4.10 ± 0.22 | 5.98 ± 0.32*# | 7.18 ± 0.62* |
| Инсулин натощак, нг/мл | 1.02 ± 0.28 | 1.23 ± 0.25 | 1.19 ± 0.24 |
| Инсулин после нагрузки глюкозой, нг/млa | 1.49 ± 0.26 | 1.89 ± 0.44 | 2.40 ± 0.29* |
| Индекс ИР, отн. ед. | 7.41 ± 1.61 | 13.58 ± 1.90*# | 22.45 ± 2.73* |
| Лептин натощак, нг/мл | 3.56 ± 0.59 | 4.38 ± 0.40# | 6.24 ± 0.89* |
| Лептин после нагрузки глюкозой, нг/млa | 5.31 ± 0.70 | 7.52 ± 0.70*# | 10.67 ± 1.16* |
| Свободные жирные кислоты, ммоль/л | 0.14 ± 0.03 | 0.54 ± 0.07* | 0.63 ± 0.13* |
| Тестостерон, нмоль/л | 17.2 ± 4.5 | 13.5 ± 2.2 | 10.4 ± 1.9* |
Рис. 1.
Изменение концентрации глюкозы в крови самцов крыс с различным по степени тяжести СД2 при проведении глюкозотолерантного теста.
Принятые на рисунках 1, 2 и 3 сокращения: К – контрольная группа; Д-УВ – крысы с умеренно выраженным сахарным диабетом 2-го типа; Д-СВ – крысы с сильно выраженным сахарным диабетом 2-го типа.
Значения представлены как M ± SD, n = 6.
Изучение андрогенного статуса показало, что у самцов крыс группы Д-СВ уровень Т был снижен в сравнении с контролем на 40%, в то время как в группе Д-УВ это снижение составило 22% и различия с группой К не были статистически значимыми (табл. 1). Исследование спермограмм обнаружило значительное снижение числа сперматозоидов в обеих диабетических группах (табл. 2). В то же время доля морфологически дефектных форм сперматозоидов была достоверно выше в группе Д-СВ, но в группе Д-УВ статистически значимо не отличалась от контроля. Доля сперматозоидов с поступательным прямолинейным движением во всех группах была сопоставимой (табл. 2). Однако с учетом снижения общего числа сперматозоидов число морфологически нормальных форм сперматозоидов и их форм с поступательным прямолинейным движением у крыс группы Д-СВ была существенно ниже, чем в контроле. Таким образом, у крыс со среднетяжелой формой СД2 на фоне метаболических и гормональных нарушений имелись андрогенный дефицит и нарушения сперматогенеза, которые были ассоциированы с отчетливо выраженной гиперлептинемией. У крыс группы Д-УВ, которые имели повышенные уровни лептина только в условиях нагрузки глюкозой, отмечали тенденцию к нарушению стероидогенеза и сперматогенеза.
Таблица 2.
Показатели спермограммы у самцов крыс с различным по степени тяжести СД2 в сравнении с таковыми у контрольных животных
| К, n = 6 | Д-УВ, n = 6 | Д-СВ, n = 6 | |
|---|---|---|---|
| Количество сперматозоидов, ×106/мл | 27.1 ± 2.2 | 20.5 ± 2.1* | 17.8 ± 4.8* |
| Доля сперматозоидов с поступательным прямолинейным движением, % | 32.3±5.4 | 33.3 ± 4.5 | 28.0 ± 4.9 |
| Доля сперматозоидов с морфологическими дефектами хвоста и головки, % | 28.7 ± 4.8 | 33.7 ± 4.7# | 48.8 ± 6.3* |
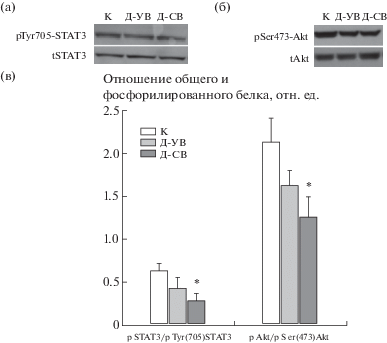
Основываясь на данных о возможной роли лептиновой сигнальной системы в семенниках в регуляции стероидогенеза и сперматогенеза, были изучены уровни лептина, лептинового рецептора и активность (по степени фосфорилирования) основных эффекторных звеньев лептиновой системы – транскрипционного фактора STAT3-белка и серин/треониновой Akt-киназы в семенниках контрольных и диабетических крыс. С помощью метода ИФА было показано, что интратестикулярный уровень лептина у крыс группы Д-СВ был выше, чем в контроле, в то время как содержание лептиновых рецепторов, напротив, снижалось (рис. 2). В группе Д-УВ отмечали тенденцию к повышению уровня лептина и снижению уровня его рецепторов, но различия с группой К не были статистически значимыми. В группе Д-СВ снижалось соотношение фосфорилированных форм STAT3 по остатку Tyr705 и Akt-киназы по остатку Ser473 к нефосфорилированным формам этих белков, в то время как в группе Д-УВ различий с контролем выявлено не было, хотя и отмечалась тенденция к снижению соотношения фосфо(Ser473)Akt/общая Akt (рис. 3). Таким образом, в семенниках крыс с сильно выраженным СД2, но не с умеренно выраженным СД2, отмечали снижение содержания лептинового рецептора и функциональной активности нижележащих звеньев лептинового сигналинга, STAT3 и Akt-киназы, что было ассоциировано с системной и внутритестикулярной гиперлептинемией и указывало на снижение чувствительности репродуктивных тканей к лептину.
Рис. 2.
Содержание лептина и лептиновых рецепторов в семенниках самцов крыс с СД2, вызванным высокожировой диетой и низкой дозой стрептозотоцина.
* – различия между группой К и группами Д-УВ и Д‑СВ статистически значимы при p < 0.05. Значения представлены как M ± SD, n = 6.
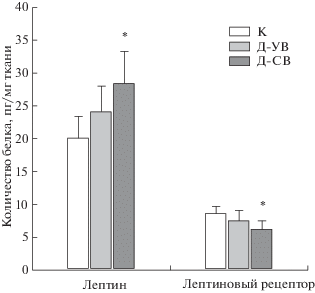
Рис. 3.
Фосфорилирование STAT3 и Akt-киназы в семенниках крыс с различным по тяжести СД2 в сравнении с контрольными животными.
а – вестерн-блоттинг с антителами к STAT3 (tSTAT3) и его Tyr705-фосфорилированной форме (pTyr705-STAT3); б – вестерн-блоттинг с антителами к Akt-киназе (tAkt) и ее Ser473-фосфорилированной форме (pSer473-Akt); в – гистограмма иммуноблотов, полученная с помощью денситометрии.
* – различия между группой К и группами Д-УВ и Д-СВ статистически значимы при p < 0.05. Значения представлены, как M ± SEM, n = 6.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Общепринято, что СД2 и МС характеризуются нарушенной толерантностью к глюкозе, ИР и дислипидемией, которые являются основными патогенетическими факторами, ведущими к развитию осложнений этих заболеваний, в том числе со стороны репродуктивной системы. В то же время в последние годы большое внимание стали уделять функциональным нарушениям, возникающим в условиях СД2 и МС в сигнальных системах, регулируемых адипокинами, в первую очередь лептином [11]. Поскольку у пациентов с СД2 и МС повышается масса абдоминального жира, вырабатывающего лептин, это приводит к развитию у них системной гиперлептинемии, что приводит к снижению чувствительности тканей к лептину.
Ранее нами на моделях СД2 и МС у грызунов было показано, что транспорт лептина в мозг, осуществляемый через гематоэнцефалический барьер (ГЭБ) рецептор-опосредуемым способом, в значительной степени снижается, что приводит к дефициту лептина в различных структурах мозга, в том числе в гипоталамусе, его основной мишени в ЦНС [18, 19]. Так, соотношение уровней интрагипоталамческого и циркулирующего в крови лептина у крыс и мышей с СД2, вызванным высокожировой диетой, снижалось в сравнении с контролем в 6 и 3 раза соответственно, что свидетельствует об ингибировании транспорта лептина через ГЭБ [19]. В отличие от ГЭБ, гематотестикулярный барьер является легко проницаемым для лептина, причем сам лептин влияет на целостность и функциональную активность этого барьера [20]. Таким образом, можно ожидать положительную корреляцию между уровнями лептина в кровотоке и семенниках, что и доказывают полученные нами данные, согласно которым соотношение уровней интратестикулярного и циркулирующего в крови лептина в группах К, Д-СВ и Д-УВ были сопоставимыми и составили 5.70 ± 0.38, 4.57 ± 0.32 и 5.50 ± 0.44 усл. ед.. Определенный вклад в суммарный пул интратестикулярного лептина может вносить его синтез в семенниках de novo, но доля лептина, синтезируемого в семенниках, не очень велика [9, 15, 16].
Значительное повышение уровня лептина в семенниках в условиях системной гиперлептинемии приводит к развитию лептиновой резистентности тестикулярных клеток. В пользу этого свидетельствует снижение числа лептиновых рецепторов в семенниках крыс со среднетяжелым СД2 и ослабление активности транскрипционного фактора STAT3 и Akt-киназы. Необходимо отметить, что STAT3 и Akt-киназа являются ключевыми эффекторными звеньями лептинового сигнального пути в различных типах тканей и клеток, включая клетки Лейдига и Сертоли в семенниках [15, 21, 22]. Ослабление регуляторного влияния лептина на тестикулярные клетки и, как следствие, снижение активности STAT3-зависимого пути и 3-фосфо-инозитидного пути, включающего в качестве эффекторного компонента Akt-киназу, приводят к снижению экспрессии Akt- и STAT3-зависимых генов, в том числе ответственных за стероидогенез и созревание сперматозоидов [9, 11, 12]. Этим, по крайней мере, частично, может быть обусловлено снижение уровня Т в крови крыс группы Д-СВ, а также выявленные нами нарушения сперматогенеза, что иллюстрируется уменьшением на 34% общего числа сперматозоидов и повышением доли их морфологически дефектных форм.
Развитие лептиновой резистентности в семенниках вследствие длительного повышения уровня лептина в крови и вызываемое этим ослабление стероидогенеза, как можно полагать, не зависят от этиологии гиперлептинемии. Другими авторами показано, что хроническая гиперлептинемия у самцов крыс, обработанных в неонатальном периоде глутаматом, приводит к гипогонадизму и андрогенному дефициту. Интересно отметить, что в клетках Лейдига, изолированных из семенников крыс с глутамат-индуцированной гиперлептинемией, подавлялась как базальная, так и стимулированная гонадотропинами продукция Т и его предшественников [23]. В пользу важности лептина для нормального протекания стероидогенеза и сперматогенеза свидетельствует то, что у ob/ob(–/–)-мышей, нокаутных по гену лептина, подавлена продукция Т и отсутствуют морфологически нормальные сперматозоиды в семявыносящих канальцах [24].
Изучение умеренно выраженной формы СД2, которая характеризовалась менее выраженными метаболическими и гормональными нарушениями, в том числе отсутствием “базальной” гиперлептинемии, показало, что в этом случае нарушения стероидогенеза и сперматогенеза выражены в небольшой степени. Эти данные не только указывают на то, что снижение фертильности находится в прямой зависимости от тяжести СД2, но и свидетельствуют о возможных взаимосвязях между выраженностью гиперлептинемии и изменениями функциональной активности семенников. Нами показано, что отсутствие «базальной» и снижение стимулированной глюкозной нагрузкой системной гиперлептинемии в группе Д-УВ способствовали сохранению вблизи контрольного уровня числа лептиновых рецепторов и активности фактора STAT3 и Akt-киназы, что предотвращало ослабление лептинового сигналинга в семенниках в условиях СД2.
Таким образом, патологические изменения сперматогенеза и стероидогенеза, а следовательно, и фертильность самцов крыс в значительной степени зависят от выраженности метаболических и гормональных нарушений при СД2, а также от функционального состояния лептиновых сигнальных путей в семенниках, степень нарушений в которых положительно коррелирует с системной гиперлептинемией.
Список литературы
Шпаков А.О. Функциональное состояние гипоталамо-гипофизарно-гонадной системы при сахарном диабете. Проблемы эндокринологии. 56(5): 23–29. 2010. [Shpakov A.O. The functional state of the hypothalamic-pituitary-gonadal system in diabetes mellitus. Probl. Endokrinol. (Mosk.). 56(5): 23–29. 2010. (in Russ.)]
Jangir R.N., Jain G.C. Diabetes mellitus induced impairment of male reproductive functions: a review. Curr. Diabetes Rev. 10(3): 147–157. 2014.
Di Vincenzo A., Busetto L., Vettor R., Rossato M. Obesity, Male Reproductive Function and Bariatric Surgery. Front. Endocrinol. (Lausanne). 9: 769. 2018. https://doi.org/10.3389/fendo.2018.00769
Fink J., Matsumoto M., Tamura Y. Potential application of testosterone replacement therapy as treatment for obesity and type 2 diabetes in men. Steroids. 138: 161–166. 2018. https://doi.org/10.1016/j.steroids.2018.08.002
Ding G.L., Liu Y., Liu M.E., Pan J.X., Guo M.X., Sheng J.Z., Huang H.F. The effects of diabetes on male fertility and epigenetic regulation during spermatogenesis. Asian J. Androl. 17(6): 948–953. 2015. https://doi.org/10.4103/1008-682X.150844
Шпаков А.О. Гонадотропины – от теории к клинической практике. СПб. ПОЛИТЕХ-ПРЕСС. 2018. [Shpakov A.O. Gonadotropins – from theory to clinical practice. St. Petersburg. POLYTECH-PRESS. 2018. (in Russ.)]
Maresch C.C., Stute D.C., Alves M.G., Oliveira P.F., de Kretser D.M., Linn T. Diabetes-induced hyperglycemia impairs male reproductive function: a systematic review. Hum. Reprod. Update. 24(1): 86–105. 2018. https://doi.org/10.1093/humupd/dmx033
Isidro M.L. Sexual dysfunction in men with type 2 diabetes. Postgrad. Med. J. 88(1037): 152–159. 2012. https://doi.org/10.1136/postgradmedj-2011-130069
Roumaud P., Martin L.J. Roles of leptin, adiponectin and resistin in the transcriptional regulation of steroidogenic genes contributing to decreased Leydig cells function in obesity. Horm. Mol. Biol. Clin. Investig. 24(1): 25–45. 2015. https://doi.org/10.1515/hmbci-2015-0046
Elfassy Y., Bastard J.P., McAvoy C., Fellahi S., Dupont J., Levy R. Adipokines in Semen: Physiopathology and Effects on Spermatozoas. Int. J. Endocrinol. 2018: 3906490. 2018. https://doi.org/10.1155/2018/3906490
Shpakov A.O., Ryzhov Ju.R., Bakhtyukov A.A., Derkach K.V. The regulation of the male hypothalamic-pituitary-gonadal axis and testosterone production by adipokines. Advances in Testosterone Action. Rijeka. Croatia. Intech Open Access Publisher. Chapter 2: 25–57. 2018. ISBN 978-953-51-6241-4. https://doi.org/10.5772/intechopen.76321.
Syriou V., Papanikolaou D., Kozyraki A., Goulis D.G. Cytokines and male infertility. Eur. Cytokine Netw. 29(3): 73–82. 2018. https://doi.org/10.1684/ecn.2018.0412
Manfredi-Lozano M., Roa J., Ruiz-Pino F., Piet R., Garcia-Galiano D., Pineda R., Zamora A., Leon S., Sanchez-Garrido M.A., Romero-Ruiz A., Dieguez C., Vazquez M.J., Herbison A.E., Pinilla L., Tena-Sempere M. Defining a novel leptin-melanocortin-kisspeptin pathway involved in the metabolic control of puberty. Mol. Metab. 5(10): 844–857. 2016. https://doi.org/10.1016/j.molmet.2016.08.003
Egan O.K., Inglis M.A., Anderson G.M. Leptin signaling in AgRP neurons modulates puberty onset and adult fertility in mice. J. Neurosci. 37(14): 3875–3886. 2017. https://doi.org/10.1523/JNEUROSCI.3138-16.2017
Ishikawa T., Fujioka H., Ishimura T., Takenaka A., Fujisawa M. Expression of leptin and leptin receptor in the testis of fertile and infertile patients. Andrologia. 39(1): 22–27. 2007. https://doi.org/10.1111/j.1439-0272.2006.00754.x
Müller L., Kowalewski M.P., Reichler I.M., Kollár E., Balogh O. Different expression of leptin and IGF1 in the adult and prepubertal testis in dogs. Reprod. Domest. Anim. 52. Suppl. 2: 187–192. 2017. https://doi.org/10.1111/rda.12896
Derkach K.V., Bondareva V.M., Chistyakova O.V., Berstein L.M., Shpakov A.O. The effect of long-term intranasal serotonin treatment on metabolic parameters and hormonal signaling in rats with high-fat diet/low-dose streptozotocin-induced type 2 diabetes. Int. J. Endocrinol. 2015: 245459. 2015. https://doi.org/10.1155/2015/245459
Derkach K., Zakharova I., Zorina I., Bakhtyukov A., Romanova I., Bayunova L., Shpakov A. The evidence of metabolic-improving effect of metformin in Ay/a mice with genetically-induced melanocortin obesity and the contribution of hypothalamic mechanisms to this effect. PLOS One. 14(3): e0213779. 2019. https://doi.org/10.1371/journal.pone.0213779
Romanova I.V., Derkach K.V., Mikhrina A.L., Sukhov I.B., Mikhailova E.V., Shpakovc A.O. The leptin, dopamine and serotonin receptors in hypothalamic POMC-neurons in normal and obese rodents. Neurochem. Res. 43(4): 821–837. 2018. https://doi.org/10.1007/s11064-018-2485-z
Wang X., Zhang X., Hu L., Li H. Exogenous leptin affects sperm parameters and impairs blood testis barrier integrity in adult male mice. Reprod. Biol. Endocrinol. 16(1): 55. 2018. https://doi.org/10.1186/s12958-018-0368-4
Herrid M., O’Shea T., McFarlane J.R. Ontogeny of leptin and its receptor expression in mouse testis during the postnatal period. Mol. Reprod. Dev. 75(5): 874–880. 2008. https://doi.org/10.1002/mrd.20796
Landry D.A., Sormany F., Haché J., Roumaud P., Martin L.J. Steroidogenic genes expressions are repressed by high levels of leptin and the JAK/STAT signaling pathway in MA-10 Leydig cells. Mol. Cell. Biochem. 433(1–2): 79–95. 2017. https://doi.org/10.1007/s11010-017-3017-x
Giovambattista A., Suescun M.O., Nessralla C.C., França L.R., Spinedi E., Calandra R.S. Modulatory effects of leptin on Leydig cell function of normal and hyperleptinemic rats. Neuroendocrinology. 78(5): 270–279. 2003. https://doi.org/10.1159/000074448
Martins F.F., Aguila M.B., Mandarim-de-Lacerda C.A. Impaired steroidogenesis in the testis of leptin-deficient mice (ob/ob–/–). Acta Histochem. 119(5): 508–515. 2017. https://doi.org/10.1016/j.acthis.2017.05.003
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


