Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 1, стр. 42-47
ВЛИЯЕТ ЛИ ПРЕДСЕРДНАЯ ЭЛЕКТРИЧЕСКАЯ СТИМУЛЯЦИЯ НА ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕПОЛЯРИЗАЦИИ ЖЕЛУДОЧКА СЕРДЦА РАДУЖНОЙ ФОРЕЛИ Oncorhynchus mykiss?
Н. А. Киблер 1, *, В. П. Нужный 1, С. Н. Харин 1, Д. Н. Шмаков 1
1 Институт физиологии Коми научного центра Уральского отделения Российской академии наук,
ФИЦ Коми НЦ УрО РАН
167982 Республика Коми, г. Сыктывкар, ул. Первомайская, д. 50, Россия
* E-mail: natanadya@mail.ru
Поступила в редакцию 14.02.2019
После доработки 21.06.2019
Принята к публикации 24.07.2019
Аннотация
Исследована деполяризация желудочка сердца радужной форели Oncorhynchus mykiss (n = 14) при увеличении частоты сердечных сокращений. Показано, что при навязанном суправентрикулярном ритме от 30 до 60 уд/мин волна деполяризации от очагов наиболее раннего возбуждения, расположенных вблизи атриовентрикулярного отверстия, первоначально распространяется на субэндокардиальный трабекулярный слой некомпактного миокарда, и далее движется по направлению к эпикарду и вдоль стенки. Это свидетельствует о некоторых предпочтительных путях проведения возбуждения от пейсмекерной зоны к субэндокардиальным сердечным миоцитам. Независимо от частоты сердечного ритма, основная закономерность возбуждения желудочка сердца радужной форели заключается в движении волны деполяризации с захватом всей толщи стенок миокарда с опережающей по времени активацией субэндокарда по сравнению с субэпикардом от дорсальных областей основания в базоапикальном и вентральном направлениях. При ритме с частотой 50–60 уд/мин движение волны деполяризации в базальных отделах желудочка инвертируется на вентродорсальное направление.
ВВЕДЕНИЕ
При исследовании адаптации организма рыб к различным условиям среды обитания особое внимание уделяется деятельности сердечно-сосудистой системы, так как ее нарушение является одним из основных факторов, ограничивающих жизнедеятельность организма в изменившихся условиях. На любые стрессогенные изменения окружающей среды возникает комплекс физиологических реакций, связанных преимущественно с увеличением сердечного выброса, который реализуется за счет увеличения частоты сердечных сокращений (ЧСС) [1]. Природная изменчивость ЧСС как фактора увеличения насосной функции реализуется через увеличение электрической и механической гетерогенности сердца [2]. Неоднородность сердца тесно связана с эволюцией развития системы. Тем самым чем она сложнее, тем более выражена ее гетерогенность, обусловливающая многообразие механизмов реагирования на различные стимулы [3]. Строение сердца рыб свидетельствует о законченной морфологически и функционально эволюционно-детерминированной структуре миокарда, которая обеспечивает работу сердца рыб в широком диапазоне изменений условий окружающей среды. Стенка желудочка сердца рыб состоит из губчатого и компактного миокарда, степень развития которого зависит от среды обитания и образа жизни животного [4]. Известно, что эктотермные позвоночные животные имеют относительно медленный синусно-предсердный ритм сердца [5], недостаточно развитую проводящую систему сердца и низкий уровень метаболических реакций [6]. Вместе с тем ряд исследователей [7] обнаружили в трабекулах сердца у рыб Danio rerio мышечные пучки, подобные проводящей системе Гиса–Пуркинье у млекопитающих. Факторами, ограничивающими адаптацию организма рыб к изменившимся факторам среды обитания, являются частота сердечного ритма [8, 9] и пространственно-временная организация процесса возбуждения миокарда, которая во многом определяет сократительную и насосную функцию сердца [10]. К настоящему времени изучена последовательность деполяризации миокарда желудочка у костистых рыб: щуки, европейского хариуса [10], карпа [11] и трески [12] при синусно-предсердном ритме в экспериментах in situ. Установлено, что у подвижных видов рыб (европейского хариуса, щуки) волна деполяризации от ранних очагов возбуждения, расположенных в субэндокардиальных слоях основания желудочка вблизи атриовентрикулярного отверстия, движется по направлению к эпикарду и вдоль стенки основания и далее по направлению к вентральным областям основания и верхушки желудочка [10]. Для малоподвижных видов костистых рыб (карпа, трески), у которых стенка желудочка имеет тонкий компактный слой и толстый губчатый слой, характерен трансмуральный градиент деполяризации от эндокарда к эпикарду во всех областях желудочка [11, 12]. Вместе с тем остается открытым вопрос о том, каким образом изменится процесс деполяризации миокарда желудочка рыб при предсердной искусственной электрической стимуляции и при какой частоте сердечных сокращений сохранится физиологическая последовательность возбуждения миокарда, присущая для синусно-предсердного ритма, обеспечивающая функциональную деятельность сердца рыб.
Цель работы – изучение закономерностей процесса возбуждения миокарда желудочка радужной форели Oncorhynchus mykiss (Walbaum, 1792) при искусственной предсердной электрической стимуляции.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Исследование выполнено в соответствии с международными правилами обращения с экспериментальными животными [13] и одобрено локальным этическим комитетом Института физиологии Коми НЦ УрО РАН.
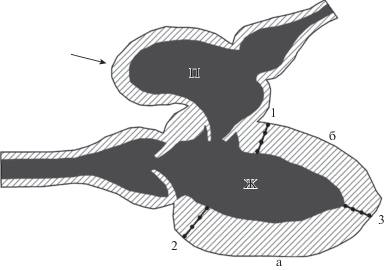
Эксперименты проведены на 14 радужных форелях O. mykiss обоего пола массой тела 1.1 ± 0.2 кг (масса сердца – 2.1 ± 0.8 г; масса желудочка – 1.9 ± ± 0.8 г), адаптированных в садках прудового хозяйства к естественной температуре воды 5–7°С. Для обездвиживания рыбу оглушали. Затем животных фиксировали в дорсальном положении тела в лотке, наполненном речной водой при температуре 5–7°С. В ротовую полость вставляли резиновый шланг, по которому для обеспечения искусственного дыхания через жабры под небольшим давлением непрерывно пропускали речную воду из пруда через аэратор, также при температуре 5–7°С. Продольным разрезом вскрывали грудную полость и перикард, затем обнажали сердце. В миокард желудочка перпендикулярно его стенкам вводили 3 интрамуральные иглы, состоящие из 4 макроэлектродов, расположенных на одинаковых расстояниях вдоль центральной иглы (рис. 1). Две иглы располагались на вентральной и дорсальной сторонах основания желудочка, а третья игла была введена в область верхушки желудочка (рис. 1). От электродов регистрировали униполярные электрограммы (ЭГ) с помощью 128-канальной кардиотопографической установки (разработана АОЗТ СП “Геософт-Истлинк (“Геолинк”) совместно с Институтом физиологии Коми НЦ УрО РАН при участии АОЗТ “ВНИИМП-ВИТА”). Температура тела экспериментальных животных в процессе исследования поддерживалась в пределах 5–7°С.
Рис. 1.
Схема расположения интрамуральных игл в желудочке сердца радужной форели. Сагиттальная плоскость: П – предсердие сердца; Ж – желудочек; а – вентральная и б – дорсальная стороны желудочка; 1–2 – расположение интрамуральных игл в основании; 3 – игла в области верхушечки желудочка. Стрелкой показано место нанесения электрического стимула.
В каждом миокардиальном отведении определяли момент активации (время деполяризации) (по показателю dV/dt min в период комплекса QRS). Дисперсию времени активации определяли как разность между максимальным и минимальным значениями каждого показателя.
Частоту сердечных сокращений изменяли посредством электрокардиостимуляции при помощи диагностического электрокардиостимулятора ЧЭЭКС п-3 “Вектор-МС”. Стимулировали предсердие (рис. 1) стимулами длительностью 2 мс и амплитудой 2–4 V в диапазоне от исходного синусно-предсердного ритма до максимальной частоты сердечных сокращений, при которой возникали нарушения деятельности сердца – от 30 уд/мин до 60 уд/мин с шагом 10 уд/мин. Результаты статистически анализировали с помощью программы BIOSTAT 4.03. с использованием критерия Уилкоксона и Манна–Уитни [14].
Различия признавались достоверными при уровне значимости p < 0.05. Данные представлены как среднее ± стандартное отклонение (М ± σ).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изначальная частота сердечных сокращений при t = 5–7°C находилась в пределах от 18 до 27 уд/мин. Исследованные животные отличались по усвоению частотного ритма. Так, у шести особей неусвоение частотного ритма произошло после 40 уд/мин, у четырех – после 50 уд/мин и у четырех – после 60 уд/мин. При синусно-предсердном ритме от очагов наиболее раннего возбуждения, расположенных вблизи атриовентрикулярного отверстия, волна деполяризации первоначально распространяется на субэндокардиальные слои трабекулярной области и далее движется по направлению к эпикарду и вдоль стенки с опережающей незначительной разницей по времени возбуждения субэндокарда, по сравнению с субэпикардом. Это свидетельствует о некоторых предпочтительных путях проведения возбуждения от пейсмекерной зоны к субэндокардиальным сердечным миоцитам [7]. Так, волна деполяризации от области основания желудочка на его дорсальной стороне (рис. 1, 1) продвигалась по направлению к его верхушке (рис. 1, 3) и одновременно к вентральным областям основания (рис. 1, 2). При возбуждении толщи стенок желудочка в некоторых областях имелся незначительный трансмуральный градиент деполяризации, и субэндокардиальные слои в зонах введения электродов возбуждались на 6–9 мс раньше субэпикардиальных слоев (p < 0.05).
Основная закономерность активации миокарда желудочка у радужной форели, как и у других видов костистых рыб, заключается в движении волны деполяризации от очагов наиболее раннего возбуждения, расположенных вблизи атриовентрикулярного отверстия. Далее она первоначально распространяется на субэндокардиальные слои в некомпактной трабекулярной области и затем движется по направлению к эпикарду с одновременным продвижением вдоль стенок желудочка сердца от его дорсальных областей в базоапикальном и вентральном направлениях с незначительным опережением по времени возбуждения субэндокарда, по сравнению с субэпикардом [10–12]. Такие закономерности распространения волны деполяризации и соответствующая последовательность охвата возбуждением, вероятнее всего, обусловлены в основном миогенным характером передачи возбуждения в основной массе миокарда желудочка рыб [10]. Существенного трансмурального градиента деполяризации, обнаруженного ранее в миокарде желудочка карпа [11] и трески [12], у радужной форели мы не наблюдали.
При навязанных ритмах (n = 12) движение волны активации также происходило от дорсальной области основания сердца к верхушке и к вентральным областям с базоапикальным и дорсовентральным градиентами деполяризации, то есть, как и при синусно-предсердном ритме (рис. 2). Так, в области основания (электрод 1, рис. 1) субэндокардиальные слои деполяризовались приблизительно на 5 мс раньше субэпикардиальных. Отрицательная форма внеклеточных потенциалов свидетельствует, что электрод находился вблизи зоны раннего возбуждения. В области основания на вентральной стороне желудочка (электрод 2, рис. 1) субэндокардиальные, интрамуральные и субэпикардиальные слои возбуждались почти одновременно. Подобная закономерность наблюдается и при активации толщи миокарда верхушки желудочка (электрод 3, рис. 1). Положительная форма внеклеточных потенциалов в области верхушки желудочка свидетельствует, что в данной области завершается процесс деполяризации миокарда. Достоверной разницы по времени возбуждения субэндокардиальных, интрамуральных и субэпикардиальных слоев миокарда, по сравнению с синусно-предсердным ритмом, не выявлено. При увеличении частоты стимуляции от 30 до 60 уд/мин выявлены разнонаправленные изменения времени прихода волны деполяризации к регистрируемым электродам (n = 12), по сравнению с синусно-предсердным ритмом. При навязанной частоте 50–60 уд/мин выявлено изменение траектории движения волны деполяризации в основании желудочка с дорсовентрального на вентродорсальное направление. В результате этого первоначально возбуждались области миокарда в зоне введения первого электрода, затем второго и далее почти одновременно третьего (расположение электродов на рис. 1). Общая последовательность распространения волны возбуждения желудочка форели значимо не изменялись при увеличении ЧСС, по сравнению с синусно-предсердным ритмом.
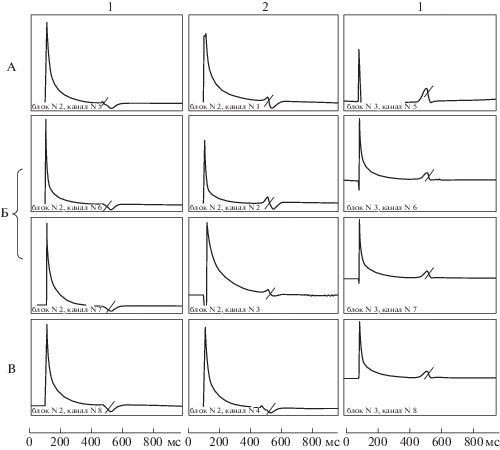
Рис. 2.
Электрограммы (ЭГ) при навязанном ритме 30 уд/мин от интрамуральных игольчатых электродов, введенных в желудочек сердца радужной форели. 1 – дорсальная, 2 – вентральная стороны основания, 3 – область верхушечки. А – субэндокард, Б – интрамуральные слои, В – субэпикард. Момент прибытия волны возбуждения к электродам отмечен пересекающими ЭГ линиями. Слева от ЭГ расположен стимулирующий импульс. Время в миллисекундах.
Ранее нами было показано [2], что природная изменчивость ЧСС, обеспечивающая функциональную деятельность сердца в экстремальных условиях, реализуется через электрическую гетерогенность миокарда. В данном исследовании гетерогенность деполяризации желудочка сердца у радужной форели не претерпевала существенных изменений. Выявленная в эксперименте функциональная гомогенность деполяризации миокарда, вероятно, вызвана практически одновременным открытием Na+ и потенциал зависимых Са2+ каналов, что увеличивает вклад кальциевого компонента деполяризующего тока и улучшает межклеточное взаимодействие [15].
Кроме того, у рыб существует двунаправленная регуляция частоты сердечных сокращений (учащение или замедление) со стороны парасимпатической нервной системы [16]. Роль ускорительного эффекта холинэргической стимуляции в данном случае реализуется в основном входящим Na+ током. Взаимодействие ацетилхолина с М-холинорецепторами вызывает гиперполяризацию мембраны, в результате чего потенциалозависимый Na+ ток возрастает. Последующая инактивация ионных каналов происходит с определенной задержкой, и возросший натриевый ток, обеспечивая определенную степень деполяризации, приводит к увеличению ритма сердца [17]. При снижении INa после инактивации натриевых каналов вклад кальциевой компоненты деполяризующего тока (IСa) увеличивается, что определяет его ключевую роль в распространении волны деполяризации в миокарде [15].
Таким образом, у исследованных рыб не обнаружено существенных отличий в пространственно-временной последовательности активации желудочка сердца при навязанном ритме до 50 уд/мин, по сравнению с синусно-предсердным ритмом. В миокарде желудочка волна деполяризации движется вдоль стенок желудочка сердца с одномоментным захватом всей их толщи и в ограниченных областях под небольшим углом к субэндокардиальной и субэпикардиальной поверхностям. Электрическая стимуляция предсердий с частотой выше 50 уд/мин вызывает десинхронизацию в пространственно-временном соотношении процессов деполяризации в виде инверсии направления движения волны деполяризации в базальных отделах с дорсовентрального на вентродорсальное, что, вероятно, влияет на последовательность сокращения трабекул некомпактного миокарда. При предсердной электрической стимуляции у радужной форели при температуре водной среды 5–7°C максимальная частота сердечных сокращений составила 60 уд/мин, выше которой деятельность сердца сопровождалась нарушением его электрофизиологических параметров. Не исключено, что при других диапазонах температур эти закономерности соблюдаться не будут, так как показатели ионных токов в клетках миокарда рыб подвержены воздействию колебаний температуры [18]. Кроме того, при исследовании влияния температуры на морфометрические показатели миокарда самцов радужной форели показано [4], что относительная масса желудочка у животных, акклиматизированных к 4°С, была значительно больше, чем у особей, адаптированных к 12°С, а компактный миокард акклиматизированных к холодной температуре воды рыб был более тонким, в то время как количество губчатого миокарда было увеличено. Вопрос о том, каким образом морфологические показатели желудочка сердца рыб, изменяющиеся в зависимости от температуры окружающей среды, отразятся на возбуждении их миокарда, остается открытым.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена в рамках темы “Сравнительно-физиологическое исследование пространственно-временной организации электрофизиологических процессов и сократимости миокарда позвоночных животных” (№ ГР АААА-А17-117012310154-6) по Программе ФНИ на 2013–2020 гг.
Список литературы
Farrell A.P., Eliason E., Sandblom E., Clark T.D. Fish cardiorespiratory physiology in an era of climate change. Can. J. Zool. 87(10): 835–851. 2009.
Kibler N.A., Nuzhny V.P., Achmetzhynova S.V., Shmakov D.N. Effects of heart rate on the pump function and Electrophysiological Characteristics of the Heart in the Frog Rana temporaria. Int. J. Biomed. 7(1): 46–50. 2017.
Бигдай Е.В., Самойлов В.О. Гетерогенность механизмов обонятельной трансдукции у лягушки Rana Temporaria. Ж. эвол. биохим. физиол. 40(2): 112–117. 2004. [Bigdaĭ E.V., Samoĭ lov V.O. Heterogeneity of olfactory transduction mechanisms in the frog Rana temporaria. J. Evol. Biochem. Physiol. 40(2): 112–117. 2004(in Russ)].
Klaiman J.M., Fenna A.J., Shiels H.A., Macri J., Gillis T.E. Cardiac remodeling in fish: strategies to maintain heart function during temperature Change. PLoS One. 6: e24464. 2011.
Moorman A.F.M., Christoffels V.M. Cardiac chamber formation: development, genes and evolution. Physiol. Rev. 83: 1223–1267. 2003.
Jensen J., Wang T., Christoffels V.M., Moorman A.F.M. Evolution and development of the building plan of the vertebrate heart. Biochim. Biophys. Acta. 1833: 783–794. 2013.
Sedmera D., Reckova M., DeAlmeida A., Sedmerova M., Biermann M., Volejnik J., Sarre A., Raddatz E., McCar-thy R.A., Gourdie R.G., Thompson R.P. Functional and morphological evidence for a ventricular conduction system in zebrafish and Xenopus hearts. Am. J. Physiol. Heart Circ. Physiol. 284: 1152–1160. 2003.
Casselman M.T., Anttila K., Farrell A.P. Using maximum heart rate as a rapid screening tool to determine optimum temperature for aerobic scope in Pacific salmon Oncorhynchus spp. J. Fish Biol. 80: З58–377. 2012.
Gradill K.J., Shawn R., Garnerl S.R., Chris C., Wil-son C.C., Anthony P., Farrell A.P., Neffl B.D. Relationship between cardiac performance and environment across populations of Atlantic salmon (Salmo salar): a common garden experiment implicates local adaptation. Evol. Ecol. 30: 877–886. 2016.
Шмаков Д.Н., Рощевский М.П. Активация миокарда. Сыктывкар: Изд-во ИФ КНЦ УрО РАН. 1997. [Shmakov D.N., Roshchevskij M.P. Aktivaciya miokarda. [Activation of a myocardium]. Syktyvkar: IF KNC UrO RAN. 1997 (in Russ)].
Вайкшнорайте М.А. Последовательность активации миокарда желудочка карпа (Cyprinus Carpio). Росc физиол. журн. им И.М. Сеченова. 104(2): 238–244. 2018. [Vaykshnorayte M.A. Activation pattern of the ventricular myocardium in carp (Cyprinus carpio). Russ J Physiol. 104(2): 238–244. 2018 (in Russ)].
Вайкшнорайте М.А., Витязев В.А., Азаров Я.Э. Последовательность активации миокарда желудочка атлантической трески (Gadus morhua marisalbi). Известия Коми научного центра УРО РАН. 32(4): 31–35. 2018. [Vaykshnorayte M.A., Vityazev V.A., Azarov Ya.E. The sequence of activation of ventricular myocardium in atlantic cod (Gadus morhua marisalbi). Izvestiya Komi nauchnogo centra URO RAN. 32(4): 31–35. 2018. (In Russ)].
Brown M.J., Symonowicz C., Medina L.V., Bratcher N.A., Buckmaster C.A., Klein H., Anderson L.C. Culture of Care: Organizational Responsibilities. In: Weichbrod R.H., Thompson GAH, Norton J.N., editors. Management of Animal Care and Use Programs in Research, Education, and Testing. 2nd edition. Chapter 2. Boca Raton (FL): CRC Press/Taylor & Francis. 2018.
Гублер Е.В., Генкин А.А. Применение непараметрических критериев статистики в медико-биологических исследованиях. Л. 1973. [Gubler E.V., Genkin A.A. Primenenie neparametricheskih kriteriev statistiki v mediko-biologicheskih issledovaniyah. [Application of non-parametric statistical criteria in medical and biological research] L. 1973 (in Russ)].
Глухов А.В., Егоров Ю.В., Розенштраух Л.В. Электрофизиологические механизмы устойчивости ритма сердца гибернирующих млекопитающих во время гипотермии. Успехи физиологических наук. 45(1): 3–26. 2014. [Glukhov A.V., Egorov Iu.V., Rozenshtraukh L.V. Electrophysiological mechanisms of heart rate stability of the hibernating mammals during hypothermia. Usp Fiziol Nauk. 45(1): 3–26. 2014 (in Russ)].
Копылова Г.Н., Самонина Г.Е., Мандрико Е.В., Крупнова Е.П. О некоторых механизмах двунаправленной парасимпатической регуляции сердечного ритма у костистых рыб. Физиол. ж. им. И.М. Сеченова. 76(10): 1470–1473. 1990. [Kopylova G.N., Samonina G.E., Mandriko E.V., Krupnova E.P. The mechanisms of the bidirectional parasympathetic regulation of the heart rhythm in teleosts. Fiziol Zh SSSR Im I. M. Sechenova. 76(10): 1470–1473. 1990 (in Russ)].
Копылова Г.Н., Крупнова Е.Н., Самонина Г.Е. Парасимпатическая регуляция сердца костистых рыб и факторы, определяющие регуляторную направленность хронотропного эффекта. Физиол. ж. им. И.М. Сеченова. 75(7): 936–941. 1989. [Kopylova G.N., Krupnova E.N., Samonina G.E. Parasympathetic regulation of the heart in teleosts and factors determining the regulatory direction of the chronotropic effect. Fiziol Zh SSSR Im I M Sechenova. 75(7): 936–941. 1989 (in Russ)].
Abramochkin D.V., Vornanen M. Seasonal acclimatization of the cardiac potassium currents (IK1 and IKr) in an arctic marine teleost, the navaga cod (Eleginus navaga). J. Comp. Physiol. B. 185: 883–890. 2015.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


