Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 1, стр. 77-80
ЭКСПЕРИМЕНТАЛЬНАЯ АНОСМИЯ НАРУШАЕТ РЕАКЦИЮ ИЗБЕГАНИЯ РАСТВОРОВ ЭТАНОЛА У МЫШЕЙ ИНБРЕДНОЙ ЛИНИИ 129P3/J
Е. А. Лукина 1, В. О. Муровец 1, *, В. А. Золотарев 1
1 Институт физиологии им. И.П. Павлова Российской академии наук
Санкт-Петербург, Россия
* E-mail: murovetsvo@infran.ru
Поступила в редакцию 29.05.2019
После доработки 17.07.2019
Принята к публикации 22.07.2019
Выявление калорийной растительной пищи и дискриминация потенциально токсичных продуктов были, по-видимому, главными факторами эволюции вкусовой сенсорной системы травоядных и всеядных млекопитающих. На основе направленного отбора из семейства tas-генов позвоночных появились два основных типа мембранных белков вкусовых рецепторов: гетеродимерные T1R для распознавания веществ со сладким вкусом, прежде всего углеводов (T1R2+3), и вкусом аминокислот (T1R1+3), и более многочисленные рецепторы горького вкуса T2R, позволяющие обнаружить потенциально ядовитые вещества, например, алкалоиды и танины [1]. Очевидную защитную функцию выполняет также обонятельная и в особенности соматосенсорная система, включающая рецепторы тройничного нерва в носоглотке и ротовой полости [2].
Низкие концентрации этанола можно рассматривать как естественный химический стимул, который появляется в процессе брожения и может быть индикатором созревания плодов [3]. В то же время алкоголь обладает местным раздражающим действием, и большинство млекопитающих при первом контакте негативно реагируют на него. Так, действие паров алкоголя на обонятельные рецепторы обычно вызывает у грызунов реакцию избегания, которая устраняется после удаления обонятельных луковиц [2]. Установлено, что некоторые виды млекопитающих, включая людей и грызунов, способны различать сладкий и горький компоненты вкуса алкоголя [4]. Особый интерес исследователей вызывает наследственная связь между склонностью к потреблению сладкого и повышенным потреблением алкоголя. В частности, алкогольная зависимость у людей коррелирует со степенью предпочтения сладких, но не горьких растворов [5]. Кроме того, выявлена связь между предпочтением алкоголя и полиморфизмом гена Tas1r3. Адаптация млекопитающих к определенным рационам привела к накоплению в популяциях полиморфизмов генов вкусовых рецепторов, что реализовалось в образовании рецепторов с разной аффинностью к вкусовому агенту. В силу генетического дрейфа отдельные мутации закрепились в генотипе инбредных линий лабораторных мышей, у которых в настоящее время выявлено несколько фенотипов вкусовых предпочтений. В частности, мыши линии C57BL/6 (гомозиготные носители доминантных аллелей гена Tas1r3) чувствительны к низким концентрациям сладкого и предпочитают воде 10% раствор этанола, в то же время линии DBA и 129P3 (гомозиготные по рецессивной аллели Tas1r3) предпочитают более концентрированные сладкие растворы и отвергают эту и даже более низкие концентрации алкоголя [4, 6, 7]. Хотя долгое время признавалось, что алкоголь является комплексным хемосенсорным стимулом, наличие у него запаха и раздражающего действия при тестировании вкусового предпочтения, как правило, не учитывалось.
Целью настоящего исследования было выяснение влияния запаха этанола на восприятие его сладкой и горькой вкусовых модальностей мышами инбредной линии 129P3/J, известной как модель низкого потребления алкоголя [1]. Предпочитающая алкоголь линия С57BL/6ByJ была выбрана в качестве контроля. В большинстве предшествующих работ животные имели длительный доступ к растворам этанола, что предполагает наряду с хемосенсорным восприятием развитие постабсорбционных эффектов алкоголя (метаболических, наркотических и т.д.). В данной работе для оценки хемосенсорного предпочтения или отвергания субстанций был использован тест краткого доступа, в котором контакт животного с раствором ограничивался несколькими секундами при относительно небольшом числе попыток, в результате чего объем выпитого раствора уменьшался и уменьшалось его постабсорбционное воздействие.
Исследование, одобренное комиссией по био-этике Института физиологии им. И.П. Павлова РАН, проводили на 4–5-месячных мышах обоего пола инбредных линий 129P3/J (129; 24 самца и 8 самок) и C57BL/6ByJ (B6; 15 самцов и 8 самок), выращенных в виварии института (происходят от родительских групп, приобретенных в Jackson Laboratory, США). Хемосенсорное предпочтение растворов этанола (1.25–20%, Pharmco-Aaper, США), сахарозы (1–32%, ЗАО Вектон, С.-Петербург), и гидрохлорида хинина (хинин, 0.01–1 мМ, Sigma, США) оценивали в тесте краткого доступа (ТКД) путем подсчета лакательных движений, сделанных животным за 5-ти секундную попытку [6]. Во время эксперимента 5–6 разведений вещества, чередующихся с дистиллированной водой, предъявлялись животному трижды автоматизированным устройством, густометром Davis MS–160 (DiLog Instruments, США). Чтобы мотивировать питье воды и растворов этанола и хинина, перед опытом животное полностью лишали доступа к воде в течение 23 ч; перед тестом с сахарозой водный рацион в течение 23 ч ограничивался 1.5 мл [6]. Экспериментам предшествовало двухдневное обучение с водой. Для выработки условно-рефлекторной вкусовой аверзии (УРВА) животным после 23-ч водной депривации давали доступ к 10% этанолу на 30 мин, после чего внутрибрюшинно инъецировали раствор LiCl (Sigma, США) в дозе 0.23 г/кг [6]. Процедуру повторяли через двое суток, и еще через 2 дня проводили повторное тестирование предпочтения вкусовых агентов. Временное подавление обоняния (аносмию) производили у наивных животных под эфирным наркозом путем последовательного введения в обе ноздри 5 мкл 5% лидокаина и 5 мкл 3–5% ZnSO4 (ЗАО Вектон, С.-Петербург). Контрольной группе вводили 5 мкл физиологического раствора и 5 мкл 5% лидокаина [2]. Через 1–4 дня для оценки эффективности аносмии после 24 часового голодания проводился тест поиска скрытой приманки (cookie-test). На следующий день начинались обучение и тестирование в густометре по описанной выше схеме.
Экспериментальные данные (количество лакательных движений при предъявлении одной и той же концентрации вещества) усреднялись по трем попыткам в сессии. Порогом предпочтения или отвергания считалась такая концентрация вкусового агента, которая провоцировала реакцию, значимо отличавшуюся от реакций на воду, предъявленную в той же экспериментальной сессии. Статистические сравнения проводили в программе Statistica® 7.0 (StatSoft Inc., США) с использованием многофакторного дисперсионного анализа, ANOVA, где факторами были аносмия, УРВА и концентрация вкусового агента. Предварительный статистический анализ показал нормальный характер распределения числа лакательных движений в ежедневных попытках в каждой из групп (тест Колмогорова–Смирнова), а также отсутствие внутригрупповых межполовых различий, поэтому данные, полученные от животных разных полов, анализировали совместно. Последующие множественные сравнения осуществлялись с использованием теста Тьюки. Различия считались статистически значимыми при p < 0.05.
Результаты экспериментов обобщены на рис. 1. В целом, как показал дисперсионный анализ, реакция мышей линии 129 на тестовые вещества (этанол, сахарозу и хинин) зависела от их концентрации и сохранности обоняния, а также изменялась после выработки УРВА 10% этанола (результаты ANOVA см. в подписи к рис. 1). Для контрольной линии B6 ANOVA также подтвердил наличие эффектов аносмии и концентрации при отсутствии значимого взаимодействия факторов.
Рис. 1.
Влияние экспериментальной аносмии на потребление растворов этилового спирта, сахарозы и хинина в тесте краткого доступа, а также на перенос УРВА к 10% этанолу у мышей инбредных линий 129P3/J (129) и C57BL6/ByJ (B6). На графиках по оси абсцисс – концентрация тестируемого вещества (сахарозы и этанола – %, хинина – мМ), по оси ординат – число лакательных движений, сделанных животным во время краткого (5 с) предъявления вещества.
Статистические сравнения проведены с помощью многофакторного дисперсионного анализа: (а) эффект аносмии – F(1, 38) = 26.91, p < 0.0001, эффект аверзии – F(1, 38) = 24.20, p < 0.0001, эффект концентрации – F(5, 190) = 49.68, p < 0.0001; взаимодействие аносмии и концентрации – F(5, 190) = 9.59, p < 0.0001, взаимодействие аверзии и концентрации – F(5, 190) = 9.99, p < 0.0001, взаимодействие всех трех факторов – F(5, 190) = 7.72, p < 0.0001; (б) эффект аносмии – F(1, 12) = = 9.23, p < 0.01, эффект концентрации – F(5, 60) = 8.01, p < 0.0001; (в) эффект аверзии – F(1, 31) = 16.46, p < 0.0005, эффект концентрации – F(6, 186) = 6.42, p < 0.0001; взаимодействие аносмии и концентрации – F(6, 186) = 11.99, p < 0.0001, взаимодействие аверзии и концентрации – F(6, 186) = 3.08, p < 0.01; (г) эффект аносмии – F(1, 50) = 25.27, p < 0.0001, эффект концентрации: F(5, 250) = 107.91, p < 0.0001, взаимодействие аносмии и концентрации – F(5, 250) = 10.80, p < 0.0001, взаимодействие аносмии, аверзии и концентрации – F(5, 250) = 4.98, p < 0.00025. Не указанные эффекты и взаимодействия не имели статистической значимости. Парные сравнения между группами произведены с помощью теста Тьюки: эффект аносмии: * – p < 0.05, ** p < 0.01, *** p < 0.001; эффект аверзии: # – p < 0.05, ## p < 0.01, ### p < 0.001.
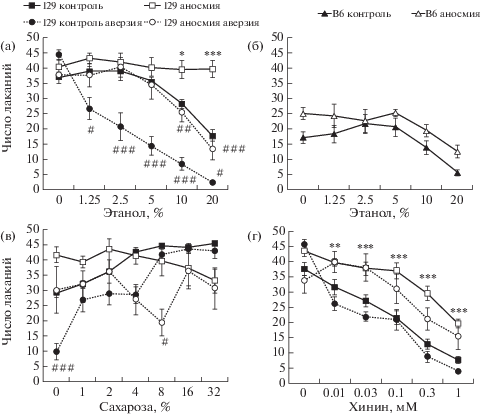
Наивные интактные мыши линии 129 нейтрально реагировали на этанол от минимальной концентрации до 5% включительно, но отвергали его более концентрированные растворы. Таким образом, порогом отвергания в данной экспериментальной модели можно считать концентрацию 10% (p < 0.01, n = 11, тест Тьюки; рис. 1а). Как и ожидалось, мыши линии 129 предпочитали растворы сахарозы и отвергали хинин (рис. 1в, г). Порог отвергания хинина был определен как 0.01 мМ (p < 0.01, n = 18, тест Тьюки). Мыши контрольной линии B6, которые при длительной экспозиции, как известно, предпочитают слабые растворы алкоголя воде [1, 4], в наших экспериментах нейтрально реагировали на растворы этанола, включая концентрацию 10%, но отвергали более концентрированные растворы (рис. 1б).
Известно, что грызуны способны различать сладкую и горькую составляющие вкуса этанола. Анализ литературы показывает, что биологическое значение вкусовых сигналов при потреблении алкоголя не вполне очевидно, по крайней мере, для избегающих его популяций. В частности, у мышей линии B6, предпочитающих низкие и средние концентрации алкоголя, после выработки УРВА к 10% этанолу снижалось потребление как сладких, так и горьких веществ, что известно как феномен переноса аверзии. Однако для линии DBA, имеющей ту же рецессивную аллель гена Tas1r3, что и линия 129, и избегающей алкоголь, подобный перенос аверзии не был характерен [4]. В наших опытах наивные мыши линии 129 избегали высокие концентрации алкоголя, а после выработки УРВА к 10% раствору этанола существенно уменьшали его потребление во всем диапазоне концентраций (рис. 1а). Выявленный на фоне УРВА порог узнавания этанола (1.25%) был почти на порядок ниже, чем порог отвергания (10%), т.е. полученные нами данные показывают, что наивные мыши 129 способны распознавать этанол в концентрации 1.25–5%, но биологическое значение имеет концентрация 10% и выше, провоцирующая реакцию избегания. Как и у линии DBA [4], у линии 129 мы не наблюдали переноса аверзии этанола на потребление сахарозы или хинина (рис. 1в, 1г).
Временное нарушение обоняния (аносмия), вызванное у линии 129 орошением эпителия носовой полости раствором ZnSO4, сопровождалось значительными изменениями реакции на этанол. Животные-аносмики не избегали высокие концентрации алкоголя и реагировали нейтрально во всем диапазоне предъявленных концентраций вплоть до 20%. Выработка у аносмиков УРВА к 10% этанолу приводила к умеренному снижению потребления лишь высоких концентраций этанола (10–20%), воспроизводя реакцию наивных интактных животных. Установленный порог узнавания для аносмиков был 10% (p < 0.01, n = 10, тест Тьюки). Это наблюдение ставит под сомнение участие вкусовой и тригеминальной системы в распознавании этанола в диапазоне 1.25–5%. Полученные результаты свидетельствуют, что низкие концентрации алкоголя воспринимаются только посредством обоняния и не провоцирует безусловнорефлекторного отвергания. Только после обусловливания отвергания алкоголя введением хлорида лития животное начинает избегать запах растворов с низкой концентрацией. Интересно, что если у животных с нормальным обонянием не наблюдалось переноса аверзии к этанолу на сахарозу либо хинин, то у аносмиков на фоне УРВА к 10% этанолу достоверно снижалось потребление сахарозы в концентрации 8% (рис. 1в). На фоне аносмии наблюдалось увеличение потребления горьких растворов во всем диапазоне концентраций, что может свидетельствовать о восприятии мышами запаха хинина, либо об ослаблении негативной вкусовой реакции на горькое после утраты обоняния. В то же время переноса аверзии к этанолу на потребление хинина мы не наблюдали ни у интактных мышей, ни при аносмии.
В целом проведенное исследование показало, что в зависимости от генотипа лабораторных мышей обоняние играет разную роль при запуске врожденных реакций избегания этанола. Негативная реакция наивных мышей инбредной линии 129 на растворы этанола концентрацией 10% и выше в ТКД связана исключительно с восприятием запаха, хотя с помощью обоняния животные способны различать и низкие концентрации (≤5%). Реакция на алкоголь у мышей, принадлежащих линии B6, не зависит от восприятия его запаха. У линии 129 вкусовое восприятие не имеет существенного значения для реализации врожденных реакций на алкоголь. Животные этой линии ассоциируют вкус алкоголя со сладким, но не различают его горькой модальности. Возможно, определенную роль в формировании врожденных реакций на этанол, помимо ольфакторного восприятия, играет соматосенсорная реакция, опосредуемая окончаниями тройничного нерва в слизистой оболочке носовой и ротовой полости, что может стать предметом отдельного исследования.
Список литературы
Bachmanov A.A., Bosak N.P., Floriano W.B., Inoue M., Li X., Lin C., Murovets V.O., Reed D.R., Zolotarev V.A., Beauchamp G.K. Genetics of sweet taste preferences. Flavour. Fragr. J. 26(4): 286–294. 2011.
Nachman M., Larue C., Le Magnen J. The role of olfactory and orosensory factors in the alcohol preference of inbred strains of mice. Physiology and Behavior. 6: 53–95. 1971.
Dudley R. Ethanol, fruit ripening, and the historical origins of human alcoholism in primate frugivory. Integr. Comp. Biology. 44(4): 315–323. 2004.
Blizard D.A. Sweet and bitter taste of ethanol in C57BL/6 and DBA2/J mouse strains. Behav. Genet. 37: 146–159. 2007.
Kampov-Polevoy A.B., Garbutt J.C., Khalitov E. Family history of alcoholism and response to sweets. Alcohol Clin. Exp. Res. 27: 1743–1749. 2003.
Murovets V.O., Zolotarev V.A., Bachmanov A.A. The role of the Sac locus in the alcohol taste preference in inbred mouse strains. Doklady Biological Sciences. 432(1): 181–183. 2010.
Bachmanov A.A., Reed D.R., Li X., Li S., Beauchamp G.K., Tordoff M.G. Voluntary ethanol consumption by mice: genome–wide analysis of quantitative trait loci and their interactions in a C57BL/6ByJ x 129P3/J F2 intercross. Genome Res. 12(8): 1257–1268. 2002.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


