Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 1, стр. 48-54
ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ ПАРАМЕТРЫ РАЗЛИЧНЫХ УЧАСТКОВ БРЮШИНЫ КРЫСЫ
А. Г. Марков 1, *, А. А. Федорова 1, Е. О. Усольцева 2, Н. М. Круглова 1, Д. В. Бурдин 1, S. Amasheh 3
1 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
2 Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта
Санкт-Петербург, Россия
3 Institute of Veterinary Physiology, Department of Veterinary Medicine, Freie University
Berlin, Germany
* E-mail: markov_51@mail.ru
Поступила в редакцию 12.03.2019
После доработки 21.06.2019
Принята к публикации 14.08.2019
Аннотация
Брюшина выстилает стенки, покрывает и поддерживает органы брюшной полости. Слой мезотелиальных клеток является функциональным барьером и обеспечивает векторный транспорт между серозной жидкостью брюшной полости и тканевой жидкостью. Основываясь на анатомической локализации, можно выделить три участка брюшины крысы: париетальный, висцеральный и диафрагмальный. Однако сравнительный анализ их барьерных и транспортных свойств не проводился. Электрофизиологические параметры трех различных участков брюшины крысы были исследованы в камере Уссинга. Отдельно был проведен анализ их гистологического строения. Париетальная брюшина крысы характеризуется наибольшей величиной трансмезотелиального потенциала (2.2 ± 0.3 мВ), тока “короткого замыкания” (19.8 ± 1.7 мкА/см2) и трансмезотелиального сопротивления (94.9 ± 3.5 Ом см2) по сравнению с другими участками брюшины. Добавление уабаина (1 мМ) с апикальной и базолатеральной сторон париетальной и висцеральной брюшины приводило к увеличению трансмезотелиального сопротивления. Препарат париетальной брюшины состоял из слоя мезотелиальных клеток и прилегающих поперечно-полосатых мышечных волокон с небольшими прослойками рыхлой соединительной ткани. Диафрагмальный и висцеральный препараты в своем составе имели два слоя мезотелиальных клеток. В диафрагмальном участке они были разделены мышечными волокнами и большими участками рыхлой соединительной ткани, в висцеральной – жировой и соединительной тканями. Таким образом, париетальный и висцеральный участки брюшины крысы вносят различный вклад в процесс трансмезотелиального транспорта. Париетальный листок брюшины демонстрирует выраженные барьерные и транспортные свойства и может рассматриваться как объект для изучения молекулярного взаимодействия Na/K-АТФазы и белков плотных контактов – клаудинов.
ВВЕДЕНИЕ
Одним из самых больших по площади поверхности тканевых барьеров в теле животных является серозная оболочка, которая выстилает стенки брюшной полости и поверхность внутренних органов. Висцеральный (покрывающий органы) и париетальный (пристеночный) листки брюшины образуют полость, содержащую серозную жидкость. В настоящее время мезотелий считается основной структурой, которая вносит решающий вклад в трансмезотелиальный направленный транспорт ионов и воды [1]. Широко распространенный электрофизиологический метод (камера Уссинга) позволяет оценить транспорт ионов (ток “короткого замыкания”) и барьерные свойства эпителия (трансэпителиальное сопротивление) [2–4]. Основные представления о проницаемости брюшины получены на овцах [5–7]. В мезотелии брюшины овец показана экспрессия Na/K-АТФазы и белков плотных контактов (клаудин-1 и -2) [5], что на молекулярном уровне свидетельствует об участии мезотелия в регуляции состава серозной жидкости.
Вместе с тем одним из важных модельных объектов, используемых для изучения последствий различных заболеваний брюшины, а также механизмов перитонеального диализа, является брюшина крысы [8–10]. Основываясь на анатомической локализации, в брюшине крысы выделяют висцеральный (брыжейка) и париетальный листки, а также диафрагмальный участок брюшины. Данные об электрофизиологических параметрах различных участков брюшины крысы ограничены. Так, было установлено, что трансмезотелиальное сопротивление диафрагмального участка и брыжейки крыс составляет около 10 Ом см2 [11]. В первичной культуре клеток мезотелия париетальной брюшины крысы зарегистрирована близкая величина [8]. По этим параметрам брюшину относят к типам ткани с низкими барьерными свойствами. Однако сравнительного исследования основных параметров барьерных и транспортных свойств различных участков брюшины крысы до настоящего времени не было проведено. Кроме того, в процитированных статьях не представлен весь спектр электрофизиологических параметров брюшины крысы, что необходимо для понимания механизмов формирования состава серозной жидкости и роли перитонеального диализа в поддержании ее гомеостаза. Таким образом, целью данного исследования было сравнительное изучение электрофизиологических параметров и морфологической структуры различных участков брюшины крысы.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
В экспериментах использовали самцов крыс Вистар (Rattus norvegicus) (180–200 г, N = 11). Животных содержали в условиях вивария на стандартном рационе со свободным доступом к пище и воде. Исследования выполняли в соответствии с правилами, принятыми организациями по работе с лабораторными животными FELASA и RusLASA. Животных умерщвляли путем цервикальной дислокации, затем проводили манипуляции по получению различных участков брюшины. Для приготовления необходимых растворов использовались реактивы фирмы Sigma Aldrich (Германия), если не указано другого. Экспериментальная работа была проведена с соблюдением “Правил проведения работ с использованием экспериментальных животных”, Хельсинкской декларации 1975 г. и ее пересмотренного варианта 2000 г.
Для стандартизации условий проведения экспериментов использовали принцип картирования, т.е., пространственной привязки мест взятия ткани от определенных анатомических точек [12]. Точкой отсчета для выделения фрагмента висцеральной брюшины являлось место впадения подвздошной кишки в толстую кишку. Препарат висцеральной брюшины представлял собой область брыжейки подвздошной кишки, выделенной на расстоянии трех сантиметров от точки отсчета и ограниченный двумя ветвями мезентериальных сосудов. Для иссечения париетальной брюшины за точку отсчета принимали белую линию живота животного. Брали участок передней брюшной стенки, одна сторона которого была на расстоянии 0.5 см, а другая – на расстоянии 3 см от точки отсчета. Диафрагмальный участок брюшины представлял собой часть диафрагмы крысы.
Изучение трансэпителиального сопротивления в камере Уссинга. После подготовки париетальные (n = 16), висцеральные (n = 15) и диафрагмальные (n = 13) препараты брюшины были установлены в камерах Уссинга, как описано ранее [4]. Диаметр каждого участка составлял 0.13 см2. Камеры были стабилизированы по температуре (37°C), постоянно проводилась аэрация раствора Кребса–Рингера (в ммоль/л: 119 NaCl; 5 KCl; 1.2 MgCl2 ⋅ 6H2O; 25 NaHCO3; 0.4 NaH2PO4 ⋅ H2O; 1.6 Na2HPO4 ⋅ 7H2O; 1.2 CaCl2) карбогеном (95% О2 и 5% СО2). Регистрацию электрофизиологических параметров осуществляли парой электродов по току и парой электродов по напряжению, которые через предусилитель EVC3 соединялись с фиксатором напряжения и тока EVC4000 (World Precision Instruments, США). Регистрация тока “короткого замыкания” осуществлялась при фиксации напряжения на нулевом уровне (0 мВ). Для определения сопротивления ткани регистрировали величину тока “короткого замыкания” при фиксации напряжения на 10 мВ. Трансмезотелиальное сопротивление рассчитывали по закону Ома, учитывая площадь апертуры камеры (0.126 см2), и выражали в Ом см2.
После адаптации ткани в камере Уссинга (5 мин) начинали регистрацию электрофизиологических параметров ткани. Каждые пять минут в течение двадцати пяти минут определяли значения напряжения, тока и рассчитывали сопротивление, подсчитывая среднее значение для каждого параметра за этот промежуток времени. Полученную величину принимали за отдельное событие для дальнейшей статистической обработки ткани. Во всех экспериментах образцы ткани в камере были ориентированы идентично.
Для сопоставления характеристик серозной оболочки крыс и овцы была проведена тестовая аппликации уабаина. Для этого в камеру с апикальной и базолатеральной стороны ткани париетальной и висцеральной брюшины добавляли уабаин, концентрация которого в омывающем растворе составляла 1 мМ.
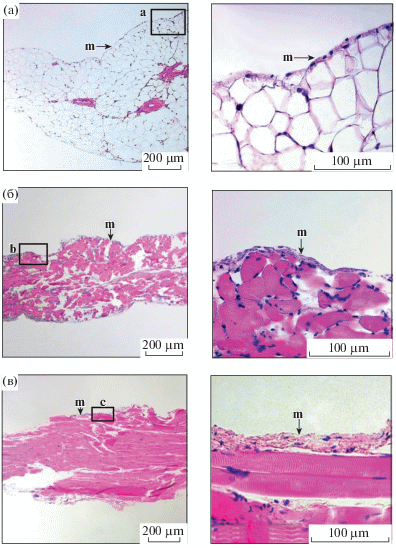
Гистологический анализ проводился в соответствии со стандартным протоколом, как было описано ранее [13]. Фрагменты ткани фиксировали в забуференном 10% формалине (3 ч, 22°С) с последующей длительной отмывкой от фиксатора сначала в проточной воде, а затем в фосфатном буфере (PBS) с Ca2+ и Mg2+. Потом образцы проводили через ряд спиртов возрастающей концентрации для обезвоживания и заключали в парафин по стандартной методике. Полученные с помощью микротома срезы (5 мкм) монтировали на предметные стекла и проводили процедуру депарафинизации ксилолом (две смены ксилола, по 5 мин при комнатной температуре). Удаляли ксилол, помещая предметные стекла поочередно в спирты нисходящей концентрации вплоть до 40%, промыв стекла в дистиллированной воде, переносили в краситель. Срезы окрашивали гематоксилином Эрлиха (5 мин). После окрашивания следовали промывание в дистиллированной, затем в проточной воде, дифференцировка в 1% солянокислом спирте, восстановление в аммиачной воде и окончательное промывание в дистиллированной воде. Затем стекла помещали в водный раствор эозина (3 мин). Далее следовало обезвоживание срезов в спиртах восходящей концентрации, просветление срезов в двух сменах ксилола и заключение в бальзам. Монтаж покровных стекол на срезах осуществляется при помощи Corbit-Balsam (Hecht, Германия). Оценку гистологической структуры ткани проводили на световом микроскопе фирмы Leitz (Германия).
Статистическая обработка результатов. Статистический анализ был выполнен с использованием непарного t-критерия Стьюдента (программное обеспечение GraphPad Prism 6.01, Graphpad Software Inc., (San Diego, CA, США)). Данные выражены в виде среднего ± ошибка среднего. Уровень достоверности p < 0.05 принимался как статистический значимый. Проверка на нормальность распределения проводилась с помощью теста Шапиро‒Уилка.
РЕЗУЛЬТАТЫ
Трансмезотелиальный потенциал. В 63% случаев препарат париетальной брюшины имел положительный заряд на поверхности мезотелия относительно субэпителиальных слоев ткани. Величина трансмезотелиального потенциала составляла 2.2 ± ± 0.3 мВ (n = 11). В остальных случаях поверхность мезотелия имела отрицательный заряд; трансмезотелиальный потенциал был равен 0.67 ± 0.08 мВ (n = 5). В противоположность этому только 46% препаратов висцеральной брюшины имели положительный заряд на поверхности мезотелия; трансмезотелиальный потенциал был достоверно меньше аналогичного параметра в париетальной брюшине, составляя 0.17 ± 0.02 мВ (n = 7, p < 0.0001, t = 5.595). В тех случаях, когда поверхность мезотелия висцеральной брюшины была отрицательной, величина потенциала также была достоверно меньше аналогичного показателя париетальной брюшины и была равна 0.41 ± 0.06 мВ (n = 8, p = = 0.009, t = 2.694). Заряд поверхности диафрагмального участка брюшины в половине случаев был положительным (62%), в другой половине (38%) – отрицательным. Его величина составляла 0.56 ± 0.08 и 0.65 ± 0.05 мВ, соответственно (n = 8 и 5) (рис. 1а).
Рис. 1.
Электрофизиологические параметры различных участков брюшины: а – трансмезотелиальный потенциал, б – ток “короткого замыкания” (Isc), в – трансмезотелиальное сопротивление.
* – p ≤ 0.05; ** – p ≤ 0.01; **** – p ≤ 0.001.
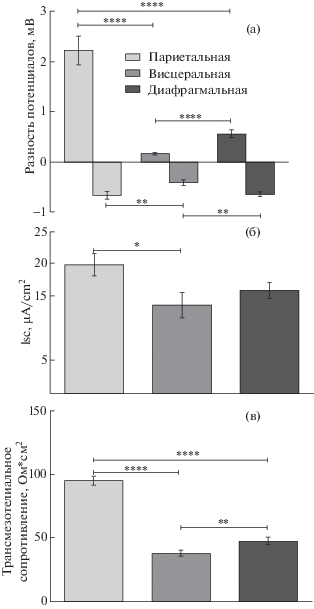
Ток “короткого замыкания”. Величина тока “короткого замыкания” была наибольшей в препаратах париетальной брюшины – 19.8 ± 1.7 мкА/см2 (n = 16). В висцеральной брюшине ток был достоверно меньше относительно париетальной брюшины, составляя 13.5 ± 1.9 мкА/ (n = 15, p = 0.0178, t = = 2.402). Значение тока “короткого замыкания” (15.9 ± 1.3 мкА/см2, n = 13) диафрагмального участка брюшины не имело статистически значимых отличий от париетальной и висцеральной брюшины (рис. 1б).
Трансмезотелиальное сопротивление. Трансмезотелиальное сопротивление в париетальной брюшине имело величину 94.9 ± 3.5 Ом см2 (n = 16). В висцеральной брюшине трансмезотелиальное сопротивление составляло 38.0 ± 2.3 Ом см2 и было достоверно меньше по сравнению с париетальной брюшиной (n = 15, p < 0.0001, t = 13.12). В диафрагмальной брюшине трансмезотелиальное сопротивление составило 47.8 ± 2.7 Ом см2, то есть достоверно больше, чем в висцеральной, но меньше, чем в париетальной брюшине (n = 11; p = 0.0067, t = = 2.758 и p < 0.0001, t = 9.815, соответственно) (рис. 1в).
Тестовое действие уабаина. Добавление уабаина (1 мМ) с апикальной и базолатеральной сторон париетальной брюшины вызывало в обоих случаях увеличение трансмезотелиального сопротивления с 52 до 55 Ом см2, и с 52 до 57 Ом см2 соответственно. Аппликация уабаина на препарат висцеральной брюшины с апикальной стороны привела к увеличению траснмезотелиального сопротивления с 42 до 48 Ом см2. Его действие с базолатеральной стороны висцеральной брюшины приводило к аналогичному эффекту, т.e. к повышению сопротивления с 48 до 57 Ом см2.
Светооптическая микроскопия. Гистологический анализ различных препаратов брюшины выявил их структурные различия. Мезотелий париетальной брюшины представлен уплощенными полигональными клетками. Субмезотелиальный слой представлен поперечно-полосатыми мышечными волокнами с небольшими прослойками рыхлой соединительной ткани. Висцеральная брюшина представляет собой структуру, состоящую из двух соединенных листков пристеночной брюшины (дупликатура). Поэтому в препарате висцеральной брюшины определяются два слоя мезотелиальных клеток, которые имеют кубическую форму. Между мезотелием располагается жировая и соединительная ткань, которые пронизаны кровеносными и лимфатическими сосудами. Препарат диафрагмальной брюшины также имеет два слоя плоских клеток мезотелия, которые разделены между собой поперечно-полосатыми мышечными волокнами и большими участками рыхлой соединительной ткани (рис. 2).
ОБСУЖДЕНИЕ
В результате проведенных исследований было установлено, что электрофизиологические параметры различных участков брюшины различаются между собой. Париетальная брюшина характеризуется наибольшей величиной трансмезотелиального потенциала, тока “короткого замыкания” и трансмезотелиального сопротивления. Трансмезотелиальная разность потенциалов рассматривается как один из факторов, обеспечивающих парацеллюлярную диффузию ионов. Возможно, что высокий, относительно других участков этой структуры, трансмезотелиальный потенциал в париетальном листке является одним из условий усиленного обмена ионами в данном участке брюшины. Привлекает к себе внимание также тот факт, что для всех участков брюшины, хотя и в разной степени, характерна отличающаяся по знаку поляризация поверхности мезотелия. Можно отметить обратное соотношение в знаке поляризации поверхности мезотелия в париетальном и висцеральном листках брюшины. Для париетального участка преобладающим был положительный знак на поверхности мезотелия, для висцерального участка – отрицательный. В первичной культуре мезотелиальных клеток висцеральной брюшины человека зарегистрировали транмезотелиальный потенциал с положительным зарядом на апикальной стороне клеток [14]. Выскажем предположение, что изменение этого параметра отражает динамику перераспределения ионных потоков между различными жидкостными компартментами, в которую участки брюшины могут вносить разный вклад.
Париетальная брюшина характеризуется также наибольшей среди исследованных участков величиной трансмезотелиального сопротивления. В париетальной части брюшины человека, а также в первичной культуре мезотелиальных клеток висцеральной брюшины человека трансмезотелиальное сопротивление составляло около 20 Ом см2 [14, 15]. Аналогичные значения трансмезотелиального сопротивления были зарегистрированы в висцеральном слое брюшины овцы [5–7]. В первичной культуре клеток париетального мезотелия крыс сопротивление было равно 14 Ом см2. В наших экспериментах в париетальном участке брюшины было зарегистрировано сопротивление около 100 Ом см2. Необходимо отметить, что трансмезотелиальное сопротивление ткани обусловлено самим эпителием (эпителиальное сопротивление), а также субэпителиальной тканью (субэпителиальное сопротивление), сопротивление которой может вносить существенный вклад в общее трансэпителиальное сопротивление ткани [12]. При исследовании гистологического строения париетальной брюшины крысы было показано наличие хорошо развитого слоя поперечно-полосатых мышечных волокон, который может вносить вклад в высокое субэпителиальное сопротивление этого участка брюшины. Тем не менее величина тока “короткого замыкания”, отражающая интенсивность активного транспорта ионов через мезотелий, подтверждает, что париетальный участок брюшины участвует в векторном транспорте между тканевой и серозной жидкостями.
Необходимым молекулярным компонентом обеспечения направленного транспорта являются плотные контакты, которые вносят вклад в патофизиологические процессы в различных серозных оболочках, что, например, было показано при воспалении плевры [13, 16]. Данные об экспрессии белков плотных контактов в мезотелии брюшины немногочисленны. В первичной культуре клеток мезотелия париетальной брюшины крысы обнаружен клаудин-1 и -2, а также структурный белок плотных контактов окклюдин [8]. В первичной культуре клеток мезотелия париетальной брюшины человека идентифицирован клаудин-1, клаудин-2 (в ядре), клаудин-8, а также окклюдин и ZO-1 [17]. Клаудин-1 вносит вклад в снижение проницаемости эпителия [18, 19]. Клаудин-8 предотвращает обратный ток ионов натрия по парацеллюлярному пути в эпителии [20]. Клаудин-2 известен как порообразующий белок, обеспечивающий диффузию молекул воды и ионов натрия [21, 22]. Учитывая, что клаудины образуют кластеры функционально связанных белков [23], полученные данные свидетельствуют о включении клаудинов в обеспечение барьерных и транспортных свойств мезотелия париетальной брюшины.
Важнейшей предпосылкой для транспортных свойств мезотелия является наличие ионных насосов и переносчиков в составе плазматической мембраны. В висцеральной брюшине овец было показано, что уабаин (блокатор Na/K-АТФазы) увеличивает трансмезотелиальное сопротивление при добавлении с апикальной и базолатеральной стороны [5]. Низкие концентрации уабаина стимулируют формирование эпителиального барьера в линии клеток IPEC-J2 [24]. Тестовые аппликации уабаина в проведенных опытах также привели к повышению трансмезотелиального сопротивления в париетальной и висцеральной брюшине крысы. Наличие клаудинов и Na/K-АТФазы в мезотелии брюшины является необходимым условием формирования эпителиального фенотипа клеток, основой для возможного их молекулярного взаимодействия и синергизма барьерных свойств мезотелия и ионного транспорта.
В выборе модельного объекта для изучения направленного транспорта необходимо учитывать также анатомические особенности ткани. Для монтирования в камеру Уссинга выбирался участок, имеющий значительную площадь, находящийся между корнем брыжейки и ее свободным краем, обволакивающим соответствующий сегмент кишки. В этом участке брыжейка представляет собой структуру, образованную соединительной тканью, покрытую с двух сторон слоем мезотелиальных клеток. Таким образом, регистрация электрофизиологических характеристик при использовании брыжейки происходит между двумя апикальными поверхностями мезотелия. Следовательно, на образце висцеральной брюшины невозможно определить векторность транспортных процессов между апикальной и базолатеральной стороной мезотелия. Стоит отметить, что брыжейка (висцеральный листок брюшины) в настоящее время рассматривается как отдельный орган с отличительными анатомическими и функциональными особенностями [25]. Таким образом, париетальный листок брюшины следует рассматривать в качестве модельного объекта для изучения барьерных и векторных транспортных свойств брюшины и межмолекулярного взаимодействия различных транспортных систем мезотелия.
Список литературы
Yung S., Chan T.M. Mesothelial cells. Perit. Dial. Int. 2: 110–115. 2007.
Stockmann M., Gitter A.H., Sorgenfrei D., Fromm M., Schulzke J.D. Low edge damage container insert that adjusts intestinal forceps biopsies into Ussing chamber systems. Pflügers Arch. 438: 107–112. 1999.
Amasheh S., Meiri N., Gitter A.H., Schöneberg T., Mankertz J., Schulzke J.D., Fromm M. Claudin-2 expression induces cation-selective channels in tight junctions of epithelial cells. J Cell Sci. 115: 4969–4976. 2002.
Markov A.G., Falchuk E.L., Kruglova N.M., Radloff J., Amasheh S. Claudin expression in follicle-associated epithelium of rat Peyer’s patches defines a major restriction of the paracellular pathway. Acta Physiol. (Oxf). 216: 112–119. 2016.
Zarogiannis S., Liakopoulos V., Hatzoglou C., Kourti P., Vogiatzidis K., Potamianos S., Eleftheriadis T., Gourgoulianis K., Molyvdas P.A., Stefanidis I. Effect of sodium-potassium pump inhibition by ouabain on the permeability of isolated visceral sheep peritoneum. Adv. Perit. Dial. 23: 43–47. 2007.
Karioti A., Hatzoglou C., Zarogiannis S., Deligiorgi T., Liakopoulos V., Kourti P., Giannopoulou M., Gourgoulianis K., Molyvdas P.A., Stefanidis I. Rapid effect of dexamethasone on the permeability of visceral sheep peritoneum. Adv. Perit. Dial. 24: 2–6. 2008.
Karioti A., Hatzoglou C., Zarogiannis S., Deligiorgi T., Kourti P., Giannopoulou M., Arampatzis S., Liakopoulos V., Gourgoulianis K., Molyvdas P.A., Stefanidis I. Spironolactone increases permeability of visceral sheep peritoneum. Adv. Perit. Dial. 25: 16–19. 2009.
Debray-García Y., Sánchez E.I., Rodríguez-Muñoz R., Venegas M.A., Velazquez J., Reyes J.L. Diabetes and exposure to peritoneal dialysis solutions alter tight junction proteins and glucose transporters of rat peritoneal mesothelial cells. Life Sci. 161: 78–89. 2016.
Kawanishi K., Yamato M., Sakiyama R., Okano T., Nitta K. Peritoneal cell sheets composed of mesothelial cells and fibroblasts prevent intra-abdominal adhesion formation in a rat model. J. Tissue Eng. Regen. Med. 10: 855–866. 2016.
Igarashi Y., Morishita Y., Yoshizawa H., Imai R., Imai T., Hirahara I., Akimoto T., Ookawara S., Ishibashi K., Muto S., Nagata D. The association between soluble intercellular adhesion molecule-1 levels in drained dialysate and peritoneal injury in peritoneal dialysis. Ren. Fail. 39: 392–399. 2017.
Simon M. Peritoneal mesothelium in vitro: an electrophysiologic study. Perit. Dial. Int. 16: 393–397. 1996.
Markov A.G., Veshnyakova A., Fromm M., Amasheh M., Amasheh S. Segmental expression of claudin proteins correlates with tight junction barrier properties in rat intestine. J. Comp. Physiol. B. 180: 591–598. 2010.
Markov A.G., Voronkova M.A., Volgin G.N., Yablonsky P.K., Fromm M., Amasheh S. Tight junction proteins contribute to barrier properties in human pleura. Resp. Physiol. Neurobiol. 175: 331–335. 2011.
Li F.K., To C.H., Leung J.K., Chan T.M., Lai K.N. Electrophysiology and glucose transport of human peritoneal mesothelial cells: implications for peritoneal dialysis. Perit. Dial. Int. 21: 115–121. 2001.
Stefanidis I., Liakopoulos V., Kourti P., Zarogiannis S., Poultsidi A., Mertems P.R., Salmas M., Hatzoglou C., Gourgoulianis K., Molyvdas P.A. Amiloride-sensitive sodium channels on the parietal human peritoneum: evidence by ussing-type chamber experiments. ASAIO J. 53: 335–338. 2007.
Markov A.G., Amasheh S. Tight junction physiology of pleural mesothelium. Front. Physiol. 5: 221. 2014.
Retana C., Sanchez E., Perez-Lopez A., Cruz A., Lagunas J., Cruz C., Vital S., Reyes J.L. Alterations of intercellular junctions in peritoneal mesothelial cells from patients undergoing dialysis: effect of retinoic Acid. Perit. Dial. Int. 35: 275–287. 2015.
Amasheh S., Milatz S., Krug S.M., Markov A.G., Günzel D., Amasheh M., Fromm M. Tight junction proteins as channel formers and barrier builders. Ann. N. Y. Acad. Sci. 1165: 211–229. 2009.
Furuse M., Hata M., Furuse K., Yoshida Y., Haratake A., Sugitani Y., Noda T., Kubo A., Tsukita S. Claudin-based tight junctions are crucial for the mammalian epidermal barrier: a lesson from claudin-1-deficient mice. J. Cell Biol. 156: 1099–1111. 2002.
Amasheh S., Milatz S., Krug S.M., Bergs M., Amasheh M., Schulzke J.D., Fromm M. Na+ absorption defends from paracellular back-leakage by claudin-8 upregulation. Biochem. Biophys. Res. Commun. 378: 45–50. 2009.
Amasheh S., Meiri N., Gitter A.H., Schöneberg T., Mankertz J., Schulzke J.D., Fromm M. Claudin-2 expression induces cation-selective channels in tight junctions of epithelial cells. J Cell Sci. 115: 4969–4976. 2002.
Rosenthal R., Milatz S., Krug S.M., Oelrich B., Schulzke J.D., Amasheh S., Günzel D., Fromm M. Claudin-2, a component of the tight junction, forms a paracellular water channel. J. Cell Sci. 123: 1913–1921. 2010.
Markov A.G., Aschenbach J.R., Amasheh S. Claudin clusters as determinants of epithelial barrier function. IUBMBLife. 67: 29–35. 2015.
Федорова А.А., Cornelius V., Amasheh S., Кривой И.И., Марков А.Г. Низкие концентрации уабаина стимулируют формирование эпителиального барьера в линии клеток IPEC-J2. Ж. эвол. биохим. и физиол. 55(3): 226–228. 2019. [Fedorova A.A., Cornelius V., Amasheh S., Krivoi I.I., Markov A.G. Low Ouabain Concentrations Stimulate Epithelial Barrier Formation in IPEC-J2 Cells. J. Evol. Biochem. Physiol 55(3): 226–228. 2019 (In Russ.)]
Coffey J.C., O’Leary D.P. The mesentery: structure, function, and role in disease. Lancet Gastroenterol. Hepatol. 1: 238–247. 2016.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии