Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 1, стр. 81-84
ФАГОЦИТОЗ АПОПТОТИЧЕСКИХ СУБСТРАТОВ СОПРОВОЖДАЕТСЯ ПРОЛИФЕРАЦИЕЙ АСТРОГЛИАЛЬНЫХ КЛЕТОК МОЗГА КРЫС В ПЕРВИЧНОЙ КУЛЬТУРЕ
Т. В. Соколова 1, Д. С. Васильев 1, М. П. Рычкова 1, Н. Ф. Аврова 1, М. Г. Ефимова 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: yefimova3@gmail.com
Поступила в редакцию 22.04.2019
После доработки 15.08.2019
Принята к публикации 09.10.2019
Астроциты являются наиболее многочисленными клетками нейроглии, количество которых достигает 40% от общей популяции клеток головного мозга [1]. Создавая специфическое микроокружение для нейронов, астроциты обеспечивают условия для генерации и передачи нервных импульсов и осуществляют опорную, трофическую и секреторную функции. Астроцитам также отводится важная роль в синаптогенезе и ликвидации синапсов, которая реализуется в процессе специфического фагоцитоза, опосредованного рецепторами MEGF10 (Multiple EGF-Like Domains 10) и рецепторной тирозинкиназой MERTK (Mer proto-oncogene Tyrosine Kinase) [2].
Недавние исследования свидетельствуют в пользу того, что белки MEGF10 и MERTK также ответственны за реализацию фагоцитоза поврежденных и апоптотических нейронов, которые образуются при старении и патологических состояниях ЦНС, таких как ишемия, заболевание Гентингтона и болезнь Альцгеймера [1]. Известно, что фагоцитарная активность астроцитов снижается при старении, что негативно сказывается на функциональной активности мозга. В то же время гипер-активация фагоцитоза, осуществляемого астроцитами, а также микроглиальными клетками мозга, может приводить к повреждению синапсов при болезни Альцгеймера [1], а также нейронов при инсульте. Кроме этого, для патологических состояний мозга характерно накопление астроцитов в местах локального повреждения, что способствует развитию астроглиоза, т.e. процессу замещения мертвых нейронов клетками астроглии. Этиология астроглиоза является предметом активного обсуждения; при этом пролиферативная активность астроцитов рассматривается как составная часть ответа мозга на повреждение (injury-induced response) [3].
Для профессиональных фагоцитов тканей (макрофагов) поглощение бактерий в процессе фагоцитоза является контрольным фактором, приводящим к переходу клетки-фагоцита из фазы G1 к фазе S [4]. При этом наблюдается присутствие митотических фигур, несмотря на то, что традиционно макрофаги рассматривают в качестве постмитотических клеток [4]. В связи с этими данными целью настоящей работы явилось выяснение вопроса о том, в какой мере фагоцитарная активность могла бы способствовать пролиферации астроцитов.
Исследования проводили на первичной культуре клеток астроглии, которую выделяли из мозга новорожденных крыс по методу [5]. Клетки культивировали в среде DMEM (Биолот, Россия) содержащей 10% инактивированную фетальную сыворотку (Биолот, Россия) и антибиотиками (пенициллин G 50 Ед/мл и стрептомицин 50 мкг/мл, Биолот Россия) на чашках Петри (Ø3.5 cм, Orange scientific,), в течение 14 дней при 37°С и 5% СО2 до достижения 75% конфлюентности. После чего клетки промывали и инкубировали в среде DMEM, содержащей 2% сыворотки, и добавляли субстраты фагоцитоза в соотношении 1:10 (клетка/субстрат фагоцитоза; подсчет проводили с использованием камеры Фукса-Розенталя). В качестве субстратов фагоцитоза использовали суммарную фракцию нейронов коры мозга крысы, обработанных ультрафилетом для инициирования апоптоза [6] и изолированную фракцию наружных сегментов палочек (НСП) сетчатки крысы [7]. Оба субстрата фагоцитоза конъюгировали с флуоресцеин-изотиоцианатом (FITC, Merck, Германия) согласно инструкции фирмы-производителя. Астроциты инкубировали с субстратами фагоцитоза в течение 2, 4 и 6 ч, после чего излишки субстрата отмывали охлажденным фосфатно-солевым раствором (PBS) и проводили фиксацию клеток в течение 3–5 мин в 4% растворе параформальдегида (PFA), приготовленного на PBS. После промывки препаратов раствором PBS проводили окраску ядер 0.001% раствором Hoechst 33258/PBS (Serva, Германия). Клетки анализировали на флуоресцентном микроскопе Zeiss Imager.A1, Axio (Германия); изображение регистрировали с помощью камеры AxioCamMRc (Zeiss, Германия). Митотическую активность клеток оценивали согласно общепринятым морфологическим критериям в приложении для флуоресцентной микроскопии [8]. Подсчет ядер проводили с помощью программного обеспечения ImageJ (NIH, США). Морфологическим критерием для оценки поглощения субстрата астроцитами служило наличие флуоресцентной метки FITC в перинуклеарной области клетки, где осуществляется взаимодействие с лизосомами окрашенных красителем фрагментов нейронов или НСП. Статистическую обработку результатов проводили c помощью программного обеспечения GraphPadPrism на основании однофакторного дисперсионного анализа (ANOVA) с использованием теста Бонферрони.
В первой серии опытов мы оценили способность культивируемых астроцитов захватывать и поглощать препараты апоптотических нейронов и препараты НСП крысы при различных сроках инкубации клеток с субстратами фагоцитоза (2, 4 и 6 ч). Как оказалось, во все изученные временные интервалы астроциты мозга крысы обладают способностью захватывать фрагменты апоптотических нейронов и препараты НСП (рис. 1). Последние также являются субстратом апоптотического типа за счет того, что связывают Аннексин V [9]. Во все временные интервалы флуоресцентная метка присутствовала как в перинуклеарной области астроцитов, где происходит переваривание захваченных субстратов фагоцитоза, так и на периферии, где преимущественно происходит связывание субстрата с плазматической мембраной фагоцита, что свидетельствует в пользу непрерывности процесса фагоцитоза (рис. 1а, 1б). Согласно данным количественного анализа, фрагменты апоптотических нейронов поглощаются более эффективно, чем фрагменты НСП. Так, в ходе четырехчасовой инкубации 40.0 ± 4.0% астроцитов содержат фрагменты апоптотических нейронов в перинуклеарной области, в то время как препараты НСП обнаруживаются в этом компартменте только у 17.6 ± 3.0% клеток (рис. 1в). Более высокая эффективность поглощения фрагментов апоптотических нейронов, по-видимому, определяется координированным взаимодействием двух рецепторов MEGF10 и MERTK, ответственных за фагоцитоз апоптотических нейронов астроцитами, в то время как захват фрагментов НСП опосредуется исключительно тирозинкиназой MERTK in vitro и in vivo [9].
Рис. 1.
Фагоцитоз фрагментов апоптотических нейронов и наружных сегментов палочек сопровождается пролиферативной активностью астроглиальных клеток мозга крысы в первичной культуре.
Примечание: а, б, г, д – масштаб: 10 мкм.
Используемые сокращения: НСП – наружные сегменты палочек, ФАН – фрагменты апоптотических нейронов, М – митотическая фигура.
а и б – стрелками отмечены субстраты фагоцитоза на периферии астроцитов с наконечниками стрелок – субстрат фагоцитоза в перинуклеарной области астроцитов.
а – фагоцитоз НСП астроцитами мозга крысы, б – фагоцитоз ФАН астроцитами мозга крысы, в – количественная оценка фагоцитарной активности астроцитов при различных временах инкубации астроцитов с НСП и ФАН, г–е – митотические фигуры в астроцитах, г – контроль (отсутствие фагоцитоза), д – при фагоцитозе НСП, е – при фагоцитозе ФАН, ж – количественная оценка митотических фигур в астроцитах, в контроле и после инкубации с НСП и ФАН.
в – по вертикальной оси дано относительное количество клеток (%), содержащих НСП и ФАН в перинуклеарной области, по горизонтальной оси представлено время инкубации, в часах.
ж – по вертикальной оси дано относительное количество митотических клеток (%) от их общего числа, по горизонтальной оси представлено время инкубации, в часах.
*, ** – различия достоверны, * Р < 0.05; ** – Р < 0.001.
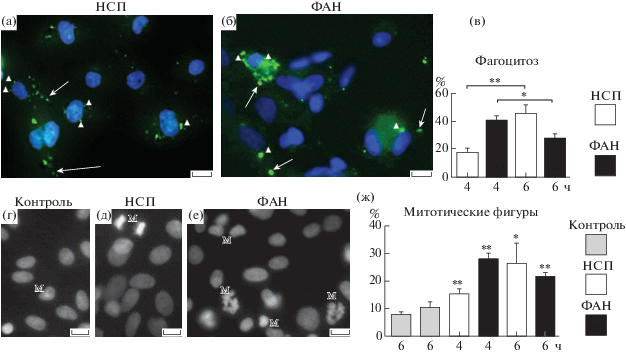
При более длительной инкубации количество клеток, содержащих захваченные НСП, возрастало: так к 6 ч инкубации уже 46.0 ± 5.0% клеток содержали фрагменты НСП (рис. 1в). В то же время число клеток, содержащих фрагменты апоптотических нейронов, к 6 ч инкубации снижалось до 28.0 ± 3.0% (рис. 1в). Такое снижение могло быть обусловлено как насыщением рецепторов, ответственных за поглощение апоптотических субстратов, так и активацией процессов деградации, опосредуемых лизосомальным аппаратом клетки.
В следующей части исследования мы проанализировали количество митотических фигур в контрольных препаратах астроцитов и в препаратах клеток, осуществляющих фагоцитоз НСП и апоптотических нейронов. Поскольку анализ фагоцитарной активности проводился в обедненной ростовой среде, в предварительных экспериментах мы проанализировали количество митотических фигур в препаратах клеток, выдержанных 2, 4 и 6 ч в среде, содержащей 2% инактивированной фетальной сыворотки, оно составляло: 7.9 ± 1.3%, 7.9 ± 0.9% и 10.4 ± 2.0% соответственно. Мы сравнили их число с числом митотических фигур в контрольных препаратах клеток, культивируемых в полной ростовой среде, оно было равно 7.8 ± 0.9% от общего количества клеток. Таким образом, количество митотических фигур в контрольных препаратах астроцитов варьировало незначительно.
В препаратах астроцитов, инкубируемых с апоптотическими субстратами, количество митотических фигур значительно возрастало (рис. 1г, 1д, 1е). Так, к 4 часам инкубации c препаратами апоптотических нейронов митотические фигуры наблюдали у 26.7 ± 7.3% клеток, а к 6 часам инкубации их число несколько уменьшалось, составляя 21.6 ± 1.6% от общего количества клеток. В результате 4- и 6‑часовой инкубации астроцитов с фрагментами НСП число митотических фигур составляло 15.7 ± ± 1.6% и 27.9 ± 2.4% соответственно. Сравнение гистограмм, приведенных на рис. 1в и 1ж, позволяет сделать заключение о том, что количество митотических фигур возрастает с увеличением эффективности захвата субстрата фагоцитоза астроцитами. Так, захват фрагментов апоптотических нейронов астроцитами максимален при 4 ч инкубации; в этот же период наблюдается наибольшее число митотических фигур, к 6 ч эти показатели снижаются. В свою очередь максимальный захват НСП отмечается при 6-часовой инкубации, при которой число митотических фигур в клетках астроглии также достигает максимального значения (рис. 1в, 1ж).
Таким образом, результаты проведенного исследования свидетельствуют о том, что фагоцитоз апоптотических субстратов клетками астроглии сопровождается пролиферацией астроцитов, подобно тому, как это происходит в случае профессиональных фагоцитов тканей [4]. Молекулярные механизмы, лежащие в основе этого процесса, неясны. Исследования последних лет указывают на то, что клеточный цикл находится под контролем ряда сигнальных белков, к числу которых относятся фосфоинозитид-3-киназа (PI3K) и “малые” G‑белки семейства RhoГТФаз (RhoGTPases) [4]. Поскольку активация PI3K и RhoGTPases также является необходимым условием для реализации фагоцитоза, можно полагать, что запуск фагоцитарного процесса потенциально влияет на пролиферацию клеток-фагоцитов [4]. Пролиферация астроглии является отягощающим фактором при развитии патологических состояний ЦНС, сопровождающихся дегенеративными изменениями нервных клеток. Понимание молекулярных механизмов, приводящих к запуску пролиферативной программы в ответ на поглощение апоптотических субстратов, может способствовать созданию новых подходов к коррекции патологических состояний ЦНС, сопровождающихся реактивным астроглиозом.
Список литературы
Jung Y.J., Chung W.S. Phagocytic Roles of Glial Cells in Healthy and Diseased Brains. Biomol. Ther. (Seoul). 26(4): 350–357. 2018.
Cahoy J.D., Emery B., Kaushal A., Foo L.C., Zama-nian J.L., Christopherson K.S., Xing Y., Lubischer J.L., Krieg P.A., Krupenko S.A., Thompson W.J., Barres B.A. A transcriptome database for astrocytes, neurons, and oligodendrocytes: a new resource for understanding brain development and function. J. Neurosci. 28(1): 264–278. 2008.
Karve I.P., Taylor J.M., Crack P.J. The contribution of astrocytes and microglia to traumatic brain injury. Br. J. Pharmacol. 173(4): 692–702. 2016.
Luo Y., Tucker S.C., Casadevall A. Fc- and complement-receptor activation stimulates cell cycle progression of macrophage cells from G1 to S. J. Immunol. 174(11): 7226–7233. 2005.
Hamprecht B., Löffler F. Primary glial cultures as a model for studying hormone action. Methods Enzymol. 109: 341–345. 1985.
Shenoy U.V., Richards E.M., Huang X.C., Sumners C. Angiotensin II type 2 receptor-mediated apoptosis of cultured neurons from newborn rat brain. Endocrinology. 140(1): 500–509. 1999.
Yefimova M.G., Messaddeq N., Harnois T., Meunier A.C., Clarhaut J., Noblanc A., Weickert J.L., Cantereau A., Philippe M., Bourmeyster N., Benzakour O. A chimerical phagocytosis model reveals the recruitment by Sertoli cells of autophagy for the degradation of ingested illegitimate substrates. Autophagy. 9(5): 653–666. 2013.
Rieder C.L., Khodjakov A. Mitosis through the microscope: advances in seeing inside live dividing cells. Science. 30(5616): 91–96. 2003.
Feng W., Yasumura D., Matthes M.T., LaVail M.M., Vollrath D. Mertk triggers uptake of photoreceptor outer segments during phagocytosis by cultured retinal pigment epithelial cells. J. Biol. Chem. 277(19): 17016–17022. 2002.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


