Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 2, стр. 108-118
АКТИВНОСТЬ СУПЕРОКСИДДИСМУТАЗЫ И КАТАЛАЗЫ В ТКАНЯХ ТРЕХ ВИДОВ ЧЕРНОМОРСКИХ ДВУСТВОРЧАТЫХ МОЛЛЮСКОВ: CERASTODERMA GLAUCUM (BRUGUIERE, 1789), ANADARA KAGOSHIMENSIS (TOKUNAGA, 1906) И MYTILUS GALLOPROVINCIALIS LAM. В СВЯЗИ С АДАПТАЦИЕЙ К УСЛОВИЯМ ИХ ОБИТАНИЯ
О. Л. Гостюхина 1, *, Т. И. Андреенко 1
Федеральное государственное бюджетное учреждение науки
Федеральный исследовательский центр “Институт биологии южных морей имени А.О. Ковалевского РАН”
299011 Севастополь, просп. Нахимова, 2, Россия
* E-mail: gostolga@yandex.ru
Поступила в редакцию 29.05.2019
После доработки 21.06.2019
Принята к публикации 09.10.2019
Аннотация
Исследовали тканевые и видовые особенности активности супероксиддисмутазы (СОД) и каталазы, а также содержания продуктов, реагирующих с тиобарбитуровой кислотой (ТБК-активных продуктов), у трех видов черноморских двустворчатых моллюсков – сердцевидки Cerastoderma glaucum, мидии Mytilus galloprovincialis и анадары Anadara kagoshimensis, отличающихся высокой устойчивостью к окислительному стрессу в естественных условиях обитания. Исследовали гепатопанкреас, жабры и ногу моллюсков. Ткани сердцевидки отличались существенно меньшим содержанием ТБК-активных продуктов, чем у анадары и мидии, значение этого показателя возрастало в ряду сердцевидка – анадара – мидия. Из трех видов моллюсков наиболее высокой активностью обоих ферментов во всех исследованных тканях отличалась сердцевидка. Анадара и сердцевидка, способные зарываться в грунт, имели близкую тканевую специфику – у каждого из видов наибольшая активность ферментов выявлена в жабрах. Анадара существенно превосходила мидию по активности СОД и каталазы в жабрах, но уступала мидии в активности СОД в гепатопанкреасе и ноге. Выявленные особенности отражают разную устойчивость исследованных моллюсков к окислительной нагрузке в естественных условиях обитания. Наиболее высокая чувствительность к окислительному стрессу характерна для мидии. Сердцевидка, напротив, отличалась наибольшей устойчивостью к окислительной нагрузке, а анадара занимала среднее положение. Эти видовые особенности позволяют исследованным моллюскам успешно адаптироваться к окислительному стрессу, нередко возникающему в донных биотопах Черного моря.
ВВЕДЕНИЕ
Система антиоксидантной (АО) защиты – один из важнейших элементов формирования адаптаций гидробионтов в условиях окислительного стресса (ОС). Эта система обеспечивает неспецифический отклик организма на окислительный стресс, возникающий при действии самых разных экологических и антропогенных факторов в водной среде, ее показатели широко применяются в оценке состояния здоровья водных организмов и среды в целом [14, 28, 30, 36]. Двустворчатые моллюски-фильтраторы – одни из наиболее устойчивых гидробионтов к действию ОС разного генеза. Выявлена высокая способность двустворчатых моллюсков к детоксикации активных форм кислорода (АФК) [25, 32, 36, 40], что связывают с эффективностью их защитных систем, и в том числе АО системы. Состояние АО комплекса и перекисного окисления липидов (ПОЛ) двустворок зависит как от эндогенных процессов, так и от факторов внешней среды [28, 31, 36]. Особенности системы АО защиты и соотношение ее показателей с уровнем ПОЛ в значительной мере определяют устойчивость этих животных к окислительному стрессу [24, 28, 36, 40]. В этой связи актуально сравнительное исследование АО комплекса и ПОЛ у двустворчатых моллюсков с высокой устойчивостью к неблагоприятным факторам, – в частности, у черноморских мидии Mytilus galloprovincialis, анадары Anadara kagoshimensis, сердцевидки Cerastoderma glaucum. Это массовые эврибионтные моллюски, широко распространенные в Азово-Черноморском бассейне и других районах Мирового океана, играющие важную роль в морских экосистемах [12, 26, 43].
Моллюски рода Cerasroderma отличаются высокой выживаемостью в неблагоприятных условиях, выдерживают значительные колебания солености – 5–38‰ и температуры – 0–25°С, а также гипоксию, обсыхание и другие неблагоприятные воздействия [19, 26]. C. glaucum населяет биотопы с высокой загрязненностью [2], превосходит других бентосных животных по устойчивости к загрязнению тяжелыми металлами [25, 32], органическими поллютантами [41], что во многом связывают с высокой активностью АО ферментов СОД и каталазы [25, 32].
Анадара длительно выживает при аноксии [34, 43], в среде с крайне низким уровнем кислорода в течение 5–7 дней [43]. АО комплекс анадары более эффективен по сравнению с мидией и устрицей Черного моря, что выражается в более высоком содержании глутатиона и активности глутатионпероксидазы в ноге, повышенной активности СОД и каталазы в жабрах и в более низком уровне ПОЛ во всех исследованных тканях [21, 23], а также активном участии в АО защите анадары как ферментного, так и низкомолекулярного звена [24].
Мидия Mytilus sp. достаточно устойчива к действию широкого ряда поллютантов, комплексного влияния загрязнения и гипоксии, включена в программы биомониторинга для оценки качества водной среды, для чего разработан ряд широко применяемых биомаркеров, таких как СОД, каталаза, глутатионтрансфераза [28, 30, 33, 36, 42]. В гипоксических условиях мидия способна переходить к анаэробному обмену, хотя и при более высоком уровне кислорода в среде, чем для анадары [43].
Состояние АО комплекса и ПОЛ у моллюсков в естественных условиях обитания имеет, как правило, выраженную тканевую и видовую специфику [5, 6, 23, 24]. Так, установлены специфические особенности АО системы и ПОЛ у мидии, анадары и устрицы Черного моря [21, 23, 24], ряда видов дальневосточных моллюсков [5], анадары и мидии Средиземного моря [43]. Вызывает интерес и то, что выраженные различия АО параметров показаны и у моллюсков одного и того же или близких видов – в тканях трех цветовых морф мидии M. galloprovincialis [13], двух видов дрейссен из Рыбинского водохранилища [6]. У близкородственных видов сердцевидок C. glaucum и C. edule были выявлены различия в потреблении ими кислорода, а также в поведении и выживаемости в экстремальных условиях при обсыхании, аноксии [19]. В отношении влияния загрязнения подчеркивается, что разная аккумулирующая способность (на примере трех видов моллюсков C. edule, Crassostrea gigas и Ruditapes philippinarum) также может быть связана с физиологическими различиями между этими видами и может служить индикатором стресса у этих животных [17].
Такой подход и определил цель нашего исследования – выявить особенности и провести сравнительный анализ активности АО ферментов супероксиддисмутазы и каталазы, а также содержания продуктов ПОЛ в тканях трех видов черноморских двустворчатых моллюсков, устойчивых к окислительному стрессу, – сердцевидки, анадары и мидии.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Материалом исследования служили половозрелые особи двустворчатых моллюсков – сердцевидки C. glaucum (Bivalvia: Cardiidae), анадары A. kagoshimensis (Bivalvia: Arcidae) и мидии M. galloprovincialis (Bivalvia: Mytilidae) с длиной раковины 26–29, 30–34 и 55–58 мм соответственно. Моллюски были собраны в начале–середине мая 2018 г. в прибрежной зоне бухты Казачья (район Севастополя, Черное море). Особей каждого вида собирали в их природных местообитаниях: сердцевидку – на мелководье, в нескольких метрах от уреза воды, на глубине 0.5–0.7 м на илисто-песчаном грунте, а анадару и мидию – в более глубокой части бухты на глубине 2.0–2.5 м; анадару собирали со дна, а мидию – как со дна, так и с твердых субстратов (прибрежные скалы). Особей сердцевидки и анадары выкапывали с помощью перфорированной емкости, так как моллюски были немного погружены в грунт. Температура воды на малой глубине, где собирали сердцевидку, составила 17.4°С, а на большей глубине, где обитали анадара и мидия, – 16.6°С. Концентрация кислорода для этих местообитаний составила 0.85–0.9 мл О2/л и 2.9–3.1 мл О2/л соответственно. Измерения проводили с помощью кислородомера Starter 300D (производство Ohaus, США).
Известно, что показатели АО комплекса и ПОЛ весьма чувствительны к сезонным колебаниям параметров водной среды – температуры, концентрации кислорода, солености, содержания поллютантов и др., а также к изменениям в физиологическом состоянии моллюсков и, в первую очередь, к состоянию нереста [28, 31, 38]. Как было показано нами ранее [38], физиолого-биохимические изменения в организме мидии при нересте оказывают влияние на состояние АО комплекса и ПОЛ моллюска – в большей степени гепатопанкреаса, чем жабр. Многие двустворчатые моллюски относятся к видам, нерестящимся круглогодично с большей или меньшей интенсивностью. Однако наиболее активный нерест у моллюсков происходит в определенные сезоны года – пики нереста: у мидии – в марте–апреле и октябре–ноябре [15], у анадары – с июня по сентябрь [16], у сердцевидки интенсивный гаметогенез – в марте–начале апреля, а первый вымет гамет – в середине мая, второй – в августе [10]. Поэтому для унификации величин абиотических факторов, а также во избежание влияния активного нерестового состояния на АО комплекс и уровень ПОЛ в тканях моллюсков, их собирали почти одновременно в короткий промежуток времени в начале–середине мая: особей сердцевидки – в самом начале мая, до начала активного вымета гамет; мидию и анадару – в середине мая, когда у этих моллюсков еще не наступает пик нереста.
После сбора моллюсков содержали в аквариумах с проточной морской водой в течение двух суток для снятия стресса после транспортировки. Исследуемые ткани моллюсков – гепатопанкреас, жабры и мышечную ткань (ногу) – гомогенизировали при температуре 0–4°С с использованием ледяной бани. Гомогенаты центрифугировали при 3200 g в течение 15 мин с помощью рефрижераторной центрифуги К-23D (Германия). В приготовленных супернатантах определяли активность АО ферментов – супероксиддисмутазы (СОД) по реакции ингибирования восстановления нитросинего тетразолия в присутствии НАДН и феназинметасульфата, длина волны 540 нм [11]. Активность каталазы измеряли по интенсивности желтой окраски в результате реакции остаточных количеств пероксида водорода (после взаимодействия с ферментом) с молибдатом аммония при длине волны 410 нм [3]. Активность СОД выражали в мкмоль НАДН в минуту на 1 мг белка, каталазы – в мкмоль пероксида водорода в минуту на 1 мг белка. Интенсивность перекисного окисления липидов (ПОЛ) оценивали по накоплению продуктов, реагирующих с тиобарбитуровой кислотой (ТБК-активных продуктов), при длине волны 532 нм, их содержание выражали в микромолях малонового диальдегида (МДА) на 1 г сырой ткани [35]. Содержание белка определяли по методу Лоури с реактивом Фолина–Чокальтеу [29].
Измерения оптической плотности растворов проводили на спектрофотометре СФ-2000. Активность ферментов измеряли при температуре 25°С. Статистическую обработку выполняли с помощью пакета программ Past3. Объем выборок составлял 12–16 особей. Нормальность распределения оценивали по W-критерию Шапиро-Уилка. Достоверность полученных различий рассчитывали с помощью U-критерия Манна-Уитни. Различия считали статистически значимыми при значении р ≤ 0.05. Результаты представлены как средняя ± ошибка средней (M ± m).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
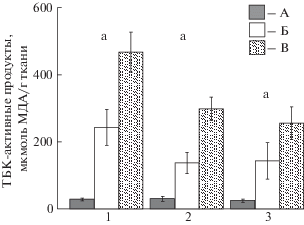
Сердцевидка отличалась наименьшим содержанием ТБК-активных продуктов – во всех исследованных тканях эта величина была в 4.5–16 раз ниже (p ≤ 0.001), чем у анадары и мидии (рис. 1). Значение этого показателя уменьшалось в ряду моллюсков мидия – анадара – сердцевидка. Наибольшие отличия наблюдались между сердцевидкой и мидией – в 10–16 раз (p ≤ 0.001), при этом наиболее выраженные – в гепатопанкреасе, а наименьшие – между мидией и анадарой – 1.8–2.1 раза (p ≤ 0.05–0.01) (все ткани).
Рис. 1.
Содержание ТБК-активных продуктов в тканях сердцевидки Cerastoderma glaucum, анадары Anadara kagoshimensis, мидии Mytilus galloprovincialis (1 – гепатопанкреас, 2 – жабры, 3 – нога; А – сердцевидка, Б – анадара, В – мидия; отличия достоверны при p ≤ 0.05–0.001: a – между всеми видами, b – между сердцевидкой и анадарой, c – между сердцевидкой и мидией, d – между мидией и анадарой).
Наибольшую активность обоих исследованных ферментов зарегистрировали в жабрах сердцевидки. Активность СОД была в 5.8–11.6 раза выше (p ≤ 0.001) по сравнению с жабрами двух других видов (рис. 2). При этом, как и в случае ТБК-активных продуктов, наиболее выраженные отличия найдены между сердцевидкой и мидией (11.6 раза) (p ≤ 0.001), в то время как жабры мидии и анадары отличались по этому показателю только вдвое (p ≤ 0.05).
Рис. 2.
Активность СОД в тканях сердцевидки Cerastoderma glaucum, анадары Anadara kagoshimensis, мидии Mytilus galloprovincialis. Обозначения – как на рис. 1.
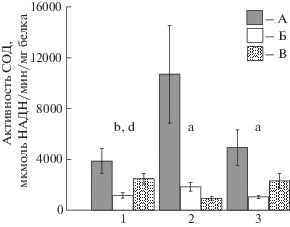
В гепатопанкреасе сердцевидки активность СОД превышала таковую у анадары в 3.3 раза (p ≤ 0.05), а у мидии – в 1.5 раза, но в этом случае отличия не были достоверными. Сердцевидка отличалась наиболее высокой активностью СОД и в ноге – в 2.1 и 4.7 раза больше (p ≤ 0.05–0.01), чем у мидии и анадары соответственно.
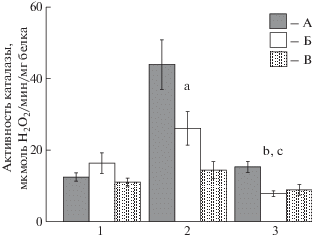
Самая высокая активность каталазы из трех исследованных тканей зафиксирована в жабрах моллюсков каждого из видов, она снижалась в ряду сердцевидка – анадара – мидия (рис. 3). Как и в случае других показателей, наибольшие отличия по каталазе в жабрах обнаружены между сердцевидкой и мидией – в 3.1 раза (p ≤ 0.01), а между остальными моллюсками – в 1.7–1.8 раза (p ≤ 0.05). Активность фермента была выше у сердцевидки и в ткани ноги – в 1.7–2.0 раза (p ≤ 0.05) по сравнению с особями других двух видов. В отличие от жабр и ноги, в гепатопанкреасе моллюсков всех исследованных видов каталаза проявляла близкую активность, значимых отличий не установлено.
Рис. 3.
Активность каталазы в тканях сердцевидки Cerastoderma glaucum, анадары Anadara kagoshimensis, мидии Mytilus galloprovincialis. Обозначения – как на рис. 1.
Для дополнительной оценки эффективности системы СОД-каталаза было рассчитано соотношение величин активности этих ферментов (табл. 1). Наиболее высокие значения коэффициента отмечены у сердцевидки во всех исследованных тканях. В жабрах сердцевидки коэффициент в 3.5–3.8 раза выше, чем у анадары и мидии, а в гепатопанкреасе – в 4.4 раза больше по сравнению с анадарой. В остальных случаях отличия были меньше – в 1.4–2.4 раза.
Таблица 1.
Значения соотношения активности СОД/каталаза в тканях сердцевидки Cerastoderma glaucum, анадары Anadara kagoshimensis, мидии Mytilus galloprovincialis
| Ткани | Значения соотношения активности СОД/каталаза | ||
|---|---|---|---|
| Сердцевидка | Анадара | Мидия | |
| гепатопанкреас | 310.2 | 71.1 | 224.2 |
| жабры | 243.7 | 70.4 | 64.3 |
| нога | 321.0 | 133.9 | 259.4 |
ОБСУЖДЕНИЕ
Состояние АО комплекса и содержание продуктов ПОЛ у исследованных моллюсков имело выраженную видовую и тканевую специфику. Как уже отмечалось, наиболее значительные отличия установлены в жабрах моллюсков. Интенсивность ПОЛ в жабрах исследованных видов снижалась в ряду мидия – анадара – сердцевидка. Наибольшая активность СОД и каталазы установлена в жабрах сердцевидки – как по сравнению с собственными тканями, так и с жабрами анадары и мидии. Выявленные различия, очевидно, обусловлены как экологическими и физиолого-биохимическими особенностями моллюсков, так и антропогенным влиянием.
Экологические и физиолого-биохимические особенности. Тканевая специфика активности АО ферментов у анадары и сердцевидки была близкой, несмотря на более низкие абсолютные значения у анадары: в жабрах активность СОД и каталазы – наибольшая по сравнению с остальными их тканями. Это свидетельствует об активном участии этих ключевых АО ферментов в защите жабр анадары и сердцевидки от окислительного стресса, так как жабры моллюсков-фильтраторов, как известно, наиболее уязвимы при действии окислительного стресса разного происхождения [30, 39]. Высокая активность СОД и каталазы отличает моллюсков этих двух видов от мидии, у которой, по нашим данным, активность исследованных ферментов в жабрах, напротив, – наименьшая. Установленные отличия могут быть связаны, в первую очередь, с условиями обитания и образом жизни моллюсков.
Выявленные особенности подчеркивает особую структуру АО системы анадары и сердцевидки, ведущих сходный образ жизни. Моллюски этих двух видов обитают на поверхности дна и способны периодически зарываться в верхний слой донных осадков [12, 26]. В отличие от них, мидия населяет как донные биотопы (иловая морфа), так и твердые субстраты на разных глубинах (скаловая морфа) [12]. Вероятно, жабры анадары и сердцевидки испытывают высокую окислительную нагрузку, что может быть обусловлено сочетанным действием накапливающихся поллютантов и дефицитом кислорода в донных осадках – факторов, способствующих усилению свободно-радикальных процессов [28, 30, 39]. Возможно, эти условия определили более высокую АО активность в жабрах анадары и сердцевидки, несмотря на более низкий уровень ПОЛ у них по сравнению с мидией.
Особенности организации АО системы и уровня ПОЛ у сердцевидки, установленные нами, возможно, связаны с особыми условиями обитания моллюска – на мелководном участке в непосредственной близости от берега. Показано [19], что даже в условиях обитания в приливно-отливной зоне C. glaucum, в отличие от близкородственного вида C. edule, предпочитает обитать на самом низком литоральном уровне – так, более 50% собранных моллюсков были найдены в первых 3 м от уреза воды на побережье Англии в весенний период. Очевидно, моллюск хорошо приспособлен к среде с частыми флуктуациями абиотических параметров, и в первую очередь, температуры и концентрации кислорода. Так, показана большая адаптированность литоральных моллюсков к обитанию в прибрежье с высокой вариабельностью параметров среды, чем у сублиторальных особей, что проявляется в высокой устойчивости к гипоксии и переходе к анаэробиозу [14]. Это дополнительно объясняет наличие высокоэффективного АО комплекса и низкого уровня ПОЛ у исследованной нами сердцевидки.
Анадара также может зарываться в слой донных осадков и испытывать повышенную окислительную нагрузку, как и сердцевидка, но этот моллюск имеет свои особенности АО защиты. Как известно, анадара содержит в гемолимфе гемоглобин [43], что способствует обеспечению моллюска кислородом, а следовательно, и большей выживаемости особей этого вида, чем других моллюсков, даже при очень низком содержании кислорода в воде [12, 34, 43]. Кроме того, анадара, в отличие от ряда черноморских моллюсков (мидии, устрицы), имеет высокоэффективный АО комплекс, в структуре которого высокую активность проявляют как низкомолекулярное, так и ферментное звено [21, 23, 24], а также систему каротиноидов, совместно с АО комплексом осуществляющую ряд АО функций [22].
В жабрах мидии наименьшая активность СОД, но более высокий уровень ТБК-активных продуктов, по сравнению с анадарой и сердцевидкой, отражает более напряженное состояние АО комплекса этого моллюска. Подобные отличия указанных параметров между мидией и анадарой были показаны и ранее [23, 24, 31]. Очевидно, в жабрах мидии процессы ПОЛ преобладают над АО активностью, и имеет место высокая окислительная нагрузка. Возможно, это связано с адаптацией мидии к обитанию не только на дне, но и на твердых субстратах на глубинах с более активным водообменом, чем на дне и в придонном слое воды [12]. Вероятно, в этих условиях более высокое содержание кислорода в воде могло обусловить и повышенную интенсивность свободно-радикальных процессов у мидии.
Моллюски рода Mytilus отличаются высоким содержанием гликогена, запасаемого не только в гепатопанкреасе, но и в периферических тканях – мышцах, жабрах, мантии [4]. В случае необходимости гликоген может превращаться в глюкозу. Как установлено нами ранее, содержание глюкозы в гепатопанкреасе и ноге мидии существенно выше, чем у анадары [24]. Роль глюкозы в метаболических процессах может быть двоякой – являясь основным энергетическим субстратом, в высоких концентрациях глюкоза может способствовать усилению ПОЛ в процессе липоксигеназного и полиольного пути ее окисления. Кроме того, в физиологических условиях глюкоза сама подвергается окислению под действием АФК с образованием ряда продуктов ПОЛ [1]. Возможно, эти процессы также оказали влияние на более высокий уровень ПОЛ во всех тканях мидии, чем у анадары и сердцевидки, а также привели на этом фоне и к более высокой активности СОД в гепатопанкреасе и ноге мидии, чем у анадары.
Как бентосные организмы, все исследованные моллюски периодически сталкиваются с влиянием гипоксии, ставшей широко распространенным явлением в Мировом океане [14], и в том числе, в Черном море [12]. Обитание моллюсков исследованных видов в одной бухте, но в разных биотопах, вероятно, также повлияло на состояние их АО комплекса и ПОЛ.
Как известно, на мелководных участках прибрежных акваторий гипоксические зоны являются более сложной средой обитания для гидробионтов, чем аналогичные зоны в более глубоководной части моря, так как адаптация в этих условиях происходит при более высокой температуре, нередко остром дефиците кислорода и постоянных колебаниях других абиотических параметров [14]. Это требует от организма высокой эффективности систем адаптации к стрессу, и в том числе АО системы. Как уже отмечалось, концентрация кислорода на мелководье, где обитает сердцевидка, составила, по нашим данным, 0.85–0.9 мл О2/л, а в более глубокой части бухты, где собирали особей мидии и анадары, – 2.9–3.1 мг О2/л при температуре воды 17.4 и 16.6°С соответственно. Столь низкое насыщение воды кислородом на мелководье, вероятно, обусловлено более высокой температурой и практически полным отсутствием перемешивания воды (“стоячая” вода) в сочетании с действием загрязняющих веществ [8, 9]. Более высокая активность СОД во всех исследованных тканях сердцевидки, а каталазы – в ее жабрах и ноге, чем в аналогичных тканях анадары и мидии, указывает на особое состояние АО комплекса C. glaucium. Эти отличия становятся еще более значимыми, если учесть существенно меньшее содержание ТБК-активных продуктов во всех тканях сердцевидки в сравнении с особями других двух видов. Такое соотношение параметров АО системы и ПОЛ у сердцевидки может иметь следующую трактовку:
– вероятно, высокая активность ферментов явилась ответной реакцией на интенсивную генерацию АФК в силу влияния условий обитания на мелководных участках, описанных выше. На этом фоне более низкий уровень ТБК-активных продуктов, чем у мидии и анадары, позволяет судить о том, что равновесие между АО активностью и ПОЛ сдвинуто в сторону АО защиты;
– можно рассматривать выявленное состояние и как видоспецифическую особенность C. glaucium, которая, вероятно, является результатом длительной адаптации моллюсков этого вида к обитанию на мелководье в приливной зоне с частыми флуктуациями параметров водной среды. Высокую конституциональную АО активность считают признаком эффективной адаптации гидробионтов к состоянию ОС [36].
Состояние системы АО защиты и интенсивность ПОЛ, очевидно, связаны и с поведенческими особенностями моллюсков. Одним из факторов, способных опосредованно влиять на адаптацию к окислительной нагрузке, является степень подвижности моллюсков [20]. В нашем исследовании моллюски имели разную подвижность и соответствующие поведенческие реакции. В отличие от мидии, ведущей прикрепленный образ жизни, способность к зарыванию у сердцевидки и анадары, очевидно, помогает этим моллюскам избегать влияния многих неблагоприятных факторов – хищничества, резких колебаний физико-химических параметров среды и других [12, 26]. Причем особи C. glaucum даже в отличие от близкого вида C. edule находятся всегда погруженными в слой донных отложений [19]. Вместе с тем такое поведение требует приспособленности к обитанию в донных осадках, отличающихся накоплением загрязняющих веществ, дефицитом кислорода [30]. Возможно, указанные условия способствовали более высокой активности СОД и каталазы у сердцевидки (все ткани) и анадары (жабры) на фоне меньшей интенсивности ПОЛ, чем у мидии, не способной к избеганию стресс-факторов. Вероятно, мидия использует другие пути адаптации. Известно, что в условиях гипоксии мидия Mytilus sp. снижает свой метаболизм в 18–20 раз [4]. Возможно, это обусловило более низкую активность СОД и каталазы в жабрах мидии, особенно, если моллюск снизил интенсивность своего дыхания. При этом в гепатопанкреасе и ноге мидии, напротив, активность СОД значительно выше, чем у анадары, а каталазы – близка к активности фермента в гепатопанкреасе двух других видов и в ноге анадары, что соответствует и более высокому уровню ПОЛ у мидии. Вероятно, в гепатопанкреасе и ноге мидии сохраняется более высокая интенсивность обмена, чем в жабрах, что и отразилось в частичном сходстве состояния АО системы и ПОЛ у мидии с двумя другими видами.
Другим важным фактором устойчивости моллюсков в неблагоприятных условиях среды является их энергетический статус, что связано в значительной мере с условиями среды, подвижностью животных, а также их разной толерантностью к дефициту кислорода [7, 14]. В условиях загрязнения в гемолимфе мидии M. edulis и анадары A. inaquivalvis установлено одновременное снижение уровня АТФ на 30–40% и энергетического заряда [7]. Интересно, что эти процессы наряду с АО активностью и интенсивностью ПОЛ имели тканевые особенности. Так, в жабрах мидии содержание АТФ после снижения при гипоксии быстро восстанавливалось до исходного уровня при возврате к нормоксии. В мышечной ткани моллюска, напротив, уменьшение уровня АТФ на 40–50% в первые часы гипоксии сохранялось и далее – при длительной аноксии [37]. Как известно, к росту генерации АФК может вести как избыток, так и недостаток кислорода в среде [14]. В связи с этим возможное падение уровня макроэргов у исследованной нами мидии в условиях дефицита кислорода могло способствовать усилению генерации супероксидного радикала и, как следствие, более высокой активности СОД в ноге мидии, в отличие от анадары, а также в отличие от жабр самой мидии, где ресурс АТФ может быстро нормализоваться [37].
Более высокая активность СОД и каталазы в тканях сердцевидки, чем у анадары и мидии, возможно, также отчасти связана с подвижностью и энергетикой моллюска. Для высокоподвижных моллюсков при дефиците кислорода показано быстрое снижение уровня АТФ и энергетического заряда в ноге, в то время как у малоподвижных моллюсков эти параметры сохранялись на высоком уровне [27]. Сердцевидку относят к малоподвижным моллюскам [26], что позволяет ожидать в ее ноге высокий энергетический потенциал и интенсивность обмена веществ. Это, в свою очередь, могло способствовать большей активности СОД и каталазы в ноге сердцевидки, чем у двух других видов. Подтверждением высокой эффективности исследованных АО ферментов в ноге служит также низкое содержание ТБК-активных продуктов в этом и других органах C. glaucum, выявленное нами.
Высокой активности АО ферментов у сердцевидки, возможно, способствуют и поведенческие реакции этого моллюска. Так, показано, что при острой аноксии на воздухе у C. edule наблюдали частые широкие открывания створок, в то время как особи C. glaucum, напротив, держали их плотно сомкнутыми длительное время – до 3 ч – с редкими открываниями [19]. Это означает, по-видимому, переход к анаэробному обмену, что может вести к усилению продукции АФК и продуктов ПОЛ [14]. Особенностью исследованной нами сердцевидки, обитавшей в условиях гипоксии на мелководье, явилась высокая тканевая активность СОД и каталазы, эффективно удаляющих продукты ПОЛ в больших концентрациях. Возможно, ткани сердцевидки имеют преадаптацию к окислительному стрессу в виде базально высокой активности АО ферментов, что необходимо моллюску для выживания в условиях гипоксии, а также частых колебаний концентрации кислорода на литорали, и что определяет низкий уровень ТБК-активных продуктов в ее тканях. Важную роль такой преадаптации АО системы отмечают у многих гидробионтов [36].
Влияние антропогенных факторов. Все исследованные моллюски – донные животные [12], в силу чего могут подвергаться комплексу неблагоприятных воздействий, и в том числе – антропогенному влиянию. Один из таких факторов, приводящих к развитию или усилению окислительного стресса, – накопление загрязняющих веществ в донных осадках [8, 28, 30]. В частности, для донных осадков б. Казачья установлена относительная чистота в отношении ряда поллютантов, но в отдельных участках выявлено локальное загрязнение тяжелыми металлами (ртутью), ПХБ, нефтяными продуктами [8], а также локальное ухудшение бактериологического состояния бухты [9]. Это позволяет рассматривать загрязнение как один из факторов, влияющих на АО систему и ПОЛ изученных моллюсков. Повреждающее действие поллютантов реализуется, как правило, через механизмы радикальных реакций с участием АФК [28, 31, 40]. В ответ на усиление генерации АФК активность АО ферментов в тканях гидробионтов может увеличиваться, чтобы скомпенсировать дисбаланс, вызванный окислительным повреждением [31, 36, 40]. СОД и каталаза – ключевые ферменты АО комплекса, инактивирующие супероксидный радикал и пероксид водорода в больших концентрациях [28]. Следовательно, высокую активность этих энзимов можно рассматривать как один из факторов адаптации к окислительному стрессу в условиях антропогенного загрязнения вод [28, 30, 31]. Наиболее выражены эти процессы у моллюсков-фильтраторов в жабрах, служащих основным барьером между организмом и водной средой [30], особенно у особей зарывающихся видов – сердцевидки и анадары. По нашим данным, именно в жабрах этих видов активность СОД и каталазы наиболее высока.
В качестве примера эффектов поллютантов на состояние АО системы и ПОЛ моллюсков можно выделить действие тяжелых металлов. Например, у сердцевидки C. edule установлена высокая степень биоаккумуляции ртути по сравнению с двумя другими видами – Crassostrea gigas и Ruditapes philippinarum [17]. Предполагают, что при накоплении поллютантов стресс, ослабляющий защиту организма, может приводить к снижению эффективности вентиляции и, следовательно, увеличению времени открытия створок с последующим интенсивным контактом мягких тканей сердцевидки с растворенными в воде металлами. Очевидно, это может вести к росту уровня АФК и, как следствие, активации СОД и каталазы в тканях моллюска.
В гепатопанкреасе и мантии мидии M. galloprovincialis при умеренном загрязнении вод тяжелыми металлами выявлен рост активности СОД и каталазы в 2–3 раза на фоне усиления ПОЛ [42]. В акваториях с разной степенью загрязнения в гепатопанкреасе мидии выявлено увеличение активности каталазы и СОД, а в жабрах – каталазы, что авторы объясняют адаптивной реакцией тканей моллюска, так как уровень ПОЛ был неизменным [18]. Между активностью каталазы и содержанием ТБК-активных продуктов в тканях мидии отмечали обратную зависимость, что указывает на важную роль фермента в АО защите моллюска. В сильно загрязненных водах существенный рост активности СОД отмечали только в жабрах мидии, но не в гепатопанкреасе, что объясняют прямым действием поллютантов на активацию АО защиты жабр [18]. Подчеркивается, что оба эти фермента, обезвреживающие АФК в высоких концентрациях, чрезвычайно важны в тканях моллюсков в условиях окислительного стресса при загрязнении [18, 42]. Однако в случае высокого уровня загрязнения отмечают и снижение активности СОД и каталазы вплоть до крайне низких величин [28], что отражает неспособность организма противостоять окислительному стрессу.
Существенно более высокое содержание ТБК-активных продуктов во всех изученных тканях мидии по сравнению с сердцевидкой и анадарой позволяет предположить и более высокий естественный уровень ПОЛ и окислительных процессов у мидии, чем у других исследованных видов. Особенно ярко это проявляется при загрязнении. Иллюстрацией проявления видовых особенностей сердцевидки и мидии в условиях загрязнения может служить реакция АО системы их жабр на действие тяжелых металлов. У сердцевидки активность СОД, каталазы и уровень ПОЛ были неизменны, что объясняют эффективной работой металлотионеинов, поддерживающих АО активность на высоком уровне [25]. Вероятно, это является адаптивной реакцией АО комплекса сердцевидки на загрязнение. По мнению F. Regoli и M. Giuliani [36], высокая активность АО ферментов является признаком эффективной защиты от внешнего ОС, а низкая, напротив, – снижения защитного потенциала организма. У мидии, напротив, выявлено увеличение этих показателей [33], что указывает, по мнению авторов, на развитие у мидии интенсивного окислительного стресса в ответ на действие тяжелых металлов.
Анализ величин рассчитанных коэффициентов СОД/КАТ выявил следующее. Обращает на себя внимание сходство значений коэффициента в гепатопанкреасе и ноге как у сердцевидки, так и у мидии, в то время как у анадары, напротив, практически одинаковые между собой коэффициенты получены в гепатопанкреасе и жабрах. Возможно, это связано с наличием у анадары гемоглобина, что отличает этого моллюска от сердцевидки и мидии. Вероятно, гемоглобин, во многом определяющий кислородный режим тканей анадары, способствует более сбалансированному соотношению активности СОД и каталазы в этих наиболее физиологически активных тканях моллюска, чем у других двух видов. Выявленные нами более высокие величины коэффициента СОД/КАТ на фоне существенно более низкого уровня ТБК-активных продуктов во всех тканях сердцевидки по сравнению с анадарой и мидией позволяют сделать вывод о более высокой эффективности тандема СОД-каталаза у сердцевидки. Наибольшие отличия коэффициента, полученные для жабр, подчеркивают особую значимость эффективной АО защиты для этого органа.
Таким образом, установлены видовые и тканевые особенности активности СОД и каталазы, а также уровня продуктов ПОЛ в тканях сердцевидки, анадары и мидии – моллюсков с высокой устойчивостью к окислительному стрессу. Наиболее эффективная организация АО комплекса выявлена у сердцевидки, имеющей повышенную устойчивость к окислительному стрессу. Это выражалось в более высокой активности СОД (все ткани) и каталазы (жабры, нога), а также существенно более низком содержании ТБК-активных продуктов (все ткани), чем у анадары и мидии.
Анадара отличалась меньшей активностью ферментов, чем у сердцевидки, за исключением каталазы в гепатопанкреасе, но превосходила мидию по активности обоих ферментов в жабрах. Уровень продуктов ПОЛ во всех тканях анадары выше, чем у сердцевидки, но меньше, чем у мидии. Состояние АО системы анадары отражает достаточно высокую устойчивость этого моллюска к окислительному стрессу.
Мидия уступала сердцевидке в активности СОД и каталазы (все ткани), а анадаре – только в жабрах. На этом фоне уровень ТБК-активных продуктов был существенно выше во всех тканях мидии, чем у моллюсков двух других видов. Это указывает на более высокую чувствительность мидии к окислительному стрессу, особенно жабр моллюска.
Выявленные особенности соотношения активности СОД и каталазы с уровнем продуктов ПОЛ в тканях исследованных моллюсков отражают адаптации их организма к окислительному стрессу, периодически возникающему в донных биотопах Черного моря.
Список литературы
Агарков А.А., Попова Т.Н., Матасова Л.В. Воздействие мелатонина на антиоксидантный статус при сахарном диабете 2 типа у крыс. Биомедицинская химия. 59(4): 434–442. 2013. [Agarkov A.A., Popova T.N., Matasova L.V. Effect of melatonin on antioxidant state under type ii diabetes at rat. Biomed chemistry. 59(4): 434–442. 2013 (in Russ)].
Алёмов С.В. Современное состояние макрозообентоса севастопольской бухты по данным бентосной съемки 1997 г. Экология моря. 48: 73–75. 1999 [Alyomov S.V. Macrozoobenthos of the Sevastopol Bay. Marine ecology. 48: 73–75. 1999].
Гирин С.В. Модификация метода определения активности каталазы в биологических субстратах. Лаб. диагностика. 4: 45–46. 1999. [Girin S.V. Modifikaciya metoda opredeleniya aktivnosti katalazy v biologiches-kikh substratax [Modification of the method for determining catalase activity in biological substrates]. Lab. diagnostika. 4: 45–46. 1999. (in Russ)]
Горомосова С.А., Шапиро А.З. Основные черты биохимии энергетического обмена мидий. М.: Лег. и пищ. промышленность. 1984. [Goromosova S.A., Shapiro A.Z. Osnovnye cherty biokhimii energeticheskogo obmena midij. [The main features of the biochemistry of the energy exchange of mussels]. M. Legk. i pishh. promyshlennost. 1984 (in Russ)].
Истомина А.А., Довженко Н.В., Бельчева Н.Н., Челомин В.П. Активность антиоксидантных ферментов у разных видов моллюсков в условиях гипоксии/аноксии. Известия Самарского научного центра РАН. 13(1–5): 1106–1108. 2011 [Istomina A.A., Dovzhenko N.V., Belcheva N.N., Chelomin V.P. Activity of antioxidant enzymes at different kinds of molluscums in the hypoxia/anoxia condition. Izvestiya Samarskogo nauchnogo centra RAN. 13(1–5): 1106–1108. 2011 (in Russ)].
Климова Я.С., Чуйко Г.М. Антиоксидантный статус двустворчатых моллюсков Dreissena polymorpha и D. bugensis (Dreissenidae, Bivalvia) из Волжского плеса Рыбинского водохранилища. Поволжский экол. журн. 1: 33–41. 2015 [Klimova Y.S., Chuiko G.M. Antioxidant status of freshwater bivalves Dreissena polymorpha and D. bugensis (Dreissenidae, Bivalvia) from the Volga reach of the Rybinsk reservoir. Povolzhskij ekologicheskij zhurnal. 1: 33–41. 2015 (in Russ)].
Колючкина Г.А., Исмаилов А.Д. Параметры экстрапаллиальной жидкости двустворчатых моллюсков – неспецифические биомаркеры кратковременного загрязнения водной среды. Океанология. 47(2): 233–240. 2007 [Kolyuchkina G.A., Ismailov A.D. Parameters of extrapallial fluid of bivalves as nonspecific biomarkers of short-term environmental pollution. Oceanology. 47(2): 213–220. 2007].
Малахова Л.В. Костова С.К., Плотицына О.В. Химическое загрязнение компонентов экосистемы Казачьей бухты (Черное море). Экологическая безопасность прибрежной и шельфовой зон и комплексное использование ресурсов шельфа. Сб. науч. тр. Севастополь. ЭКОСИ-Гидрофизика. 9: 112–116. 2003. [Malahova L.V., Kostova S.K., Ploticyna O.V. Himi-cheskoe zagryaznenie komponentov ekosistemy Kaza-chej buhty (Chernoe more). Ekologicheskaya bezopasnost pribrezhnoj i shelfovoj zon i kompleksnoe ispolzovanie resursov shelfa. [Chemical contamination of components of the Kazachva Bay ecosystem (Black Sea). Environmental safety of coastal and offshore zones and complex use of offshore resources.]. Sbornok nauch. tr. Sevastopol. EKOSI-Gidrofizika. 9: 112–116. 2003 (in Russ)].
Миронов О.Г., Кирюхина Л.Н., Алемов С.В. Экологическая характеристика бухты Казачьей (Черное море). Экология моря. 61: 85–89. 2002 [Mironov O.G., Kirukhina L.N., Alyomov S.V. Ecological characteristic of Kazachva Bay (the Black Sea). Marine ecology. 61: 85–89. 2002 (in Russ)].
Михайлова Т.В. Особенности размножения Cerastoderma glaucum (Mollusca, Bivalvia) В Черном море. Экология моря. 23: 64–68. 1986 [Mikhailova T.V. Specific features of Cerastoderma glaucum (Mollusca, Bivalvia) reproduction in the Black Sea. Marine ecology. 23: 64–68. 1986 (in Russ)].
Переслегина И.А. Активность антиоксидантных ферментов слюны здоровых детей. Лабораторное дело. 11: 20–23. 1989 [Pereslegina I.A. Aktivnost antioksidantnyh fermentov slyuny zdorovyh detej. [Activity of anti-oxidant enzymes saliva of healthy children.]. Laboratornoe delo. 11: 20–23. 1989 (in Russ)].
Ревков Н.К. Макрозообентос украинского шельфа Черного моря. Промысловые биоресурсы Черного и Азовского морей. ред.: В.Н. Еремеев, А.В. Гаевская, Г.Е. Шульман, Ю.А. Загородняя. Севастополь: ЭКОСИ-Гидрофизика. Гл. 5. 1: 140–162. 2011. [Revkov N.K. Makrozoobentos ukrainskogo shelfa Chyornogo morya. Promyslovye bioresursy Chyornogo i Azovskogo morej. [Macrozoobenthos of the Ukrainian Black Sea shelf. Fishing biological resources of the Black and Azov Seas]. Eds. V.N. Eremeyev, A.V. Gaevskaya, G.E. Shulman, Yu.A. Zagorodnyaya. Sevastopol: ECOSI-Hydrophysics. Chapter. 5. 1: 140–162. 2011 (in Russ)].
Солдатов А.А., Александрова О.Л., Головина И.В., Столбов А.Я. Ферментативная система антиоксидантной защиты у черноморского моллюска Mytilus galloprovincialis Lam. с пигментированными и депигментированными тканевыми структурами. Доклады НАН Украины. 5: 162–167. 2003 [Soldatov A.A., Aleksandrova O.L., Golovina I.V., Stolbov A.Y.A. Fermentativnaya sistema antioksidantnoj zashchity u chernomorskogo mollyuska Mytilus galloprovincialis Lam. s pigmentirovannymi i depigmentirovannymi tkanevymi strukturami. [Enzymatic system of antioxidant protection in Black Sea shellfish Mytilus galloprovincialis Lam. with pigmented and depigmented tissue structures]. Reports of the National Academy of Sciences of Ukraine. 5: 162–167. 2003 (in Russ)].
Фокина Н.Н., Нефедова З.А., Немова Н.Н. Биохимические адаптации морских двустворчатых моллюсков к аноксии (Обзор). Тр. Карельского НЦ РАН. 3: 121–130. 2011 [Fokina N.N., Netedova Z.A., Nemova N.N. Biochemical adaptations of marine bivalves to anoxic conditions (review) Trudy karelskogo nauchnogo centra RAN 3: 121–130. 2011 (in Russ)].
Холодов В.И., Пиркова А.В., Ладыгина Л.В. Выращивание мидий и устриц в Черном море. ред. В.Н. Еремеев. НАН Украины, Институт биологии южных морей им. А.О. Ковалевского. Севастополь. 2010 [Holodov V.I., Pirkova A.V., Ladygina L.V. Vyrashchivanie midij i ustric v Chernom more. [Growing mussels and oysters in the Black Sea] V.N. Eremeev (ed.). NAN Ukrainy, Institut biologii yuzhnyh morej im. A.O. Kovalevskogo. Sevastopol. 2010 (in Russ)].
Чикина М.В., Колючкина Г.А., Кучерук Н.В. Аспекты биологии размножения Scapharca inaequivalvis (Bruguiere) (Bivalvia, Arcidae) в Черном море. Экология моря. 64: 72–77. 2003 [Chikina M.V., Koluchkina G.A., Kucheruck N.V. Some features of reproduction biology of Scapharca inaequivalvis (Bruguière) (Bivalvia, Arcidae) in the Black Sea. Marine ecology. 64: 72–77. 2003 (in Russ)].
Baudrimont M., Schäfer J., Marie V., Maury-Brachet R., Bossy C., Boudou A., Blanc G. Geochemical survey and metal bioaccumulation of three bivalve species (Crassostrea gigas, Cerastoderma edule and Ruditapes philippinarum) in the Nord Medoc salt marshes (Gironde estuary, France). Sci. Tot. Environ. 337(1–3): 265–280. 2005.
Box A., Sureda A., Galgani F., Pons A., Deudero S. Assessment of environmental pollution at Balearic Islands applying oxidative stress biomarkers in the mussel Mytilus galloprovincialis. Comp. Biochem. Physiol. C: Pharmacol. Toxicol. 146(4): 531–539. 2007.
Boyden C.R. The Behaviour, Survival and Respiration of the Cockles Cerastoderma Edule and C. Glaucum in Air. Journal of the Marine Biological Association of the United Kingdom Cambridge Core. 52(3): 661–680. 1972.
Carroll J.L. Strategies of anaerobiosis in New Zealand infaunal bivalves: adaptations to environmental and functional hypoxia. N. Z. J. Mar. Freshwater Res. 29: 137–146. 1995.
Gostyukhina O.L. Comparative characteristics of the antioxidant glutathione complex in the Black Sea molluscs Mytilus galloprovincialis Lam. and Anadara inaequivalvis Br. J. Evol. Biochem. Physiol. 49(1): 59–65. 2013.
Gostiukhina O.L., Soldatov A.A., Golovina I.V., Borodina A.V. Content of carotenoids and the state of tissue antioxidant enzymatic complex in bivalve mollusc Anadara inaequivalvis Br. J. Evol. Biochem. Physiol. 49(3): 309–315. 2013.
Gostiukhina O.L., Golovina I.V. Comparative analysis of antioxidant complex of the Black Sea mollusks Mytilus galloprovincialis, Anadara inaequivalvis and Crassostrea gigas. Hydrobiological J. 49(3): 77–84. 2013.
Gostyukhina O.L., Andreenko T.I. Enzymatic and low-molecular weight units of antioxidant complex in two species of the Black Sea mollusks with different resistance to oxidative stress: Mytilus galloprovincialis Lam. and Anadara kagoshimensis (Tokunaga, 1906). Zhurnal Obshchei Biologii. 79(6): 483–493. 2018.
Freitas R., Costa E., Velez C., Santos J., Lima., Oliveira C., Rodrigues A., Quintino V., Figueira E. Looking for suitable biomarkers in benthic macroinvertebrates inhabiting coastal areas with low metal contamination: Comparison between the bivalve Cerastoderma edule and the Polychaete Diopatra neapolitana. Ecotoxicol. Environ. Saf. 75: 109–118. 2012.
Leontarakis P.K., Loukia I., Xatzianastasiou L.I., Theodorou J.A. Biological aspects of the lagoon cockle, Cerastoderma glaucum (Poiret, 1879), in a coastal lagoon in Keramoti, Greece in the Northeastern Mediterranean. Journal of shellfish research. 27(5): 1171–1175. 2008.
Livingstone D.R. Origins and evolution of pathways of anaerobic metabolism in the animal kingdom. Amer. Zoologist. 31: 522–534. 1991.
Livingstone D.R. Contaminant-stimulated reactive oxygen species production and oxidative damage in aquatic organisms. Mar. Pollut. Bull. 42(8): 656–666. 2001.
Lowry O.H., Rosebrough N.J., Farr A.L. Protein measurement with the Folin phenol reagent. J. Biol. Chem. 193(266): 75. 1951.
Maisano M., Cappello T., Natalotto A., Vitale V., Parrino V., Giannetto A., Oliva S., Mancini G., Cappello S., Mauceri A., Fasulo S. Effects of petrochemical contamination on caged marine mussels using a multi-biomarker approach: Histological changes, neurotoxicity and hypoxic stress. Mar. Environ. Res. 128: 114–123. 2017.
Manduzio H., Rocher B., Durand F., Galap C., Leboulenge F. The point about oxidative stress in mollusks (Review). ISJ. 91(2): 91–104. 2005.
Marques A., Pilo D., Araujo O., Pereira F., Guilherme S., Carvalho S., Santos A.M., Pacheco M., Pereira P. Propensity to metal accumulation and oxidative stress responses of two benthic species (Cerastoderma edule and Nephtys hombergii): are tolerance processes limiting their responsiveness?. Ecotoxicology. 25(4):[REMOVED HYPERLINK FIELD] 664–676. 2016.
Mejdoub Z., Fahde A., Loutfi M., Kabine M. Oxidative stress responses of the mussel Mytilus galloprovincialis exposed to emissary’s pollution in coastal areas of Casablanca. Ocean and Coastal Management. 136: 95–103. 2017.
Miyamoto Y., Iwanaga C. Effects of sulphide on anoxia-driven mortality and anaerobic metabolism in the ark shell Anadara kagoshimensis. Journal of the Marine Biological Association of the UK. 97(2): 329–336. 2017.
Ohkawa H., Ohishi N., Yagi K. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction. Analyt. Biochem. 95(1): 351–358. 1979.
Regoli F., Giuliani M. Oxidative pathways of toxicity and oxidative stress biomarkers in marine organisms. Mar. Environ. Res. 93: 106–117. 2014.
Shapiro A.Z. On the Content of Macroergic Compounds in Mussel Tissues under Normal and Hypoxic Conditions. J. Biol. Mor. 2: 69–75. 1981.
Soldatov A.A., Gostyukhina O.L., Golovina I.V. State of the antioxidant enzyme complex in tissues of the Black Sea mollusc Mytilus galloprovincialis under natural oxidative stress. J. Evol. Biochem. Physiol. 44(2): 175–182. 2008.
Trevisan R., Mello D., Delapedra G., Silva D., Arl M., Danielli N., Dafre A. Gills as a glutathione-dependent metabolic barrier in Pacific oysters Crassostrea gigas: Absorption, metabolism and excretion of a model electrophile. Aquat. Toxicol. 173: 105–119. 2016.
Valavanidis A., Vlahogianni T., Dassenakis M., Scoullos M. Molecular biomarkers of oxidative stress in aquatic organisms in relation to toxic environmental pollutants. Ecotoxicol. Environ. Safety. 64(2): 178–189. 2006.
Velez C., Pires A., Leandro S., Cardoso P., Moreira A., Figueira E., Soares A., Freitas R. The use of Cerastoderma glaucum as a sentinel and bioindicator species: take-home message. Ecological indicators. 62: 228–241. 2016.
Vlahogianni T., Dassenakis M., Scoullos M.J., Valavanidis A. Integrated use of biomarkers (superoxide dismutase, catalase and lipid peroxidation) in mussels Mytilus galloprovincialis for assessing heavy metals’ pollution in coastal areas from the Saronikos Gulf of Greece. Mar. Pollut. Bull. 54(9): 1361–1371. 2007.
Zwaan A., Cortesi P., ThiHart G., van den Roos J., Storey K.B. Differential sensitivities to hypoxia by two anoxia-tolerant marine molluscs: a biochemical analysis. Mar. Biol. 111: 343–351. 1991.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


