Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 2, стр. 127-137
ВЛИЯНИЕ СТРЕССА И АНТИДЕПРЕССАНТОВ В ПЕРИНАТАЛЬНЫЙ ПЕРИОД РАЗВИТИЯ НА РАЗНЫЕ ТИПЫ АДАПТИВНОГО ПОВЕДЕНИЯ И КОГНИТИВНЫЕ СПОСОБНОСТИ У САМОК КРЫС ПРЕПУБЕРТАТНОГО ВОЗРАСТА
И. П. Буткевич 1, 2, *, В. А. Михайленко 1, Е. А. Вершинина 1
1 Институт физиологии им. И.П. Павлова, РАН
Санкт-Петербург, Россия
2 Педиатрический медицинский университет
Санкт-Петербург, Россия
* E-mail: Irinabutkevich@yandex.ru
Поступила в редакцию 09.07.2019
После доработки 29.10.2019
Принята к публикации 20.11.2019
Аннотация
Исследовано влияние повторной периферической воспалительной боли у новорожденных самок крыс, рожденных матерями, подвергнутыми в период беременности хроническому действию стресса, а для коррекции адаптивного поведения у потомства еще и действию препаратов (ингибитор обратного захвата серотонина (5-HT) антидепрессант флуоксетин и агонист 5-HT1A рецепторов анксиолитик буспирон), на адаптивное поведение и когнитивные способности крысят при достижении ими препубертатного периода развития. Полученные новые данные о влиянии стресса в перинатальный критический период индивидуального развития на адаптивное поведение и способность к пространственному обучению поддерживают гипотезу о возможном благоприятном влиянии умеренных стрессовых событий в раннем возрасте на стрессоустойчивость в последующем онтогенезе. Охарактеризовано влияние примененных препаратов на исследованное адаптивное поведение и когнитивные способности пренатально стрессированного потомства, подвергнутого воспалительной боли в период новорожденности.
ВВЕДЕНИЕ
Пренатальный стресс (стресс во время беременности), как свидетельствуют многочисленные данные, нарушает развитие структур головного мозга, функциональную активность гипоталамо-гипофизарно-надпочечниковой системы (ГГНС), вызывает развитие тревожно-депрессивных состояний [1–3]. При исследовании механизмов пренатального стресса, наряду с самым современным эпигеномным механизмом [4], большое внимание продолжают уделять ГГНС и разным нейромедиаторным системам, среди которых серотонинергической системе отводится ключевая роль [5]. Уменьшение числа серотонин (5-HT)-иммунореактивных клеток в ядре шва, центральном представительстве серотонинергических нейронов, сочетающееся с усилением воспалительного болевого ответа в формалиновом тесте, нами было обнаружено ранее у пренатально стрессированных семидневных крысят [6]. Одной из самых важных мишеней пренатального стресса является 5-HT1A рецептор [7]. Мы также показали, что хроническое введение беременным самкам, стрессированным во время беременности, ингибитора обратного захвата 5-HT флуоксетина или агониста 5-HT1A рецепторов буспирона улучшает показатели адаптивного поведения у женского потомства в препубертатном возрасте [8]. Антидепрессант флуоксетин и анксиолитик буспирон осуществляют свое влияние на поведение через 5-HT1A рецептор [9, 10], который широко представлен в центральной нервной системе, особенно в структурах, вовлеченных в психоэмоциональное поведение и ноцицепцию. Буспирон является полным агонистом пресинаптических 5-HT1A рецепторов, ауторецепторов, локализованных на соме и дендритах серотонинергических нейронов в дорсальном ядре шва, и частичным агонистом постсинаптических 5-HT1A рецепторов, гетерорецепторов. Острая одноразовая инъекция буспирона вызывает активацию 5‑HT1A ауторецепторов, приводящую к торможению секреции 5-HT нейронами в ядре шва и торможению его синтеза. Хроническая долговременная стимуляция 5-HT1A рецепторов вызывает десенситизацию ауторецепторов, что в результате со временем приводит к растормаживанию секреции и синтеза 5-HT, к повышению его уровня в гиппокампе и префронтальной коре, где этот медиатор помогает снизить дисфункцию серотонинергической передачи у пациентов с депрессией. Наличие 5-HT1A рецепторов на нейронах паравентрикулярного ядра гипоталамуса определяет тесную функциональную взаимосвязь серотонинергической, ГГНС и ноцицептивной систем, особенно в ранние периоды индивидуального развития [11]. Однако механизм модулирующего влияния буспирона на ГГНС остается не ясным [12]. Флуоксетин, селективный блокатор обратного захвата 5-НТ транспортером в синапсах нейронов ЦНС [13], увеличивает уровень 5-HT в синаптической щели [14], усиливает его влияние на гетерорецепторы, что приводит к снижению депрессивного состояния. Флуоксетин широко используют для лечения тревожно-депрессивных состояний в период беременности [15].
Повторные инвазивные воздействия, которым при необходимости подвергаются новорожденные, и особенно недоношенные младенцы, часто сопровождаются процессом воспаления, что вызывает повторную активацию развивающейся ноцицептивной системы, проявляющуюся в дальнейшем в изменении болевой чувствительности [16]. Клинические наблюдения [17–19] и экспериментальные данные [20, 21] указывают на изменение в функциональной активности как ноцицептивной системы, так и реактивности ГГНС, и разных типов адаптивного поведения у особей, подвергнутых в новорожденном возрасте воспалительной боли. Хроническая инъекция агониста 5-HT1A рецептора буспирона таким крысам в критический препубертатный период их развития улучшала адаптивное поведение, что подтвердило включение этого типа серотонинергических рецепторов в долговременное влияние боли в неонатальном возрасте [22]. Заметим, что все предыдущие наши работы были посвящены негативным последствиям воспалительной неонатальной боли [23] или пренатального стресса [6]. Неблагоприятные изменения, вызванные стрессом в критические периоды развития, согласно традиционной «кумулятивной» концепции стресса, суммируются, что в дальнейшем коррелирует с ослаблением адаптивных возможностей организма. Данные клинических и лабораторных исследований, полученных за последнее десятилетие, позволили выдвинуть альтернативную упомянутой выше гипотезу, рассматривающую влияние накопительного стресса в ранний период развития, как адаптивное влияние, формирующее фенотип с повышенной стрессоустойчивостью [24, 25].
В настоящей работе в качестве перинатального стресса впервые применено сочетание пренатального стресса и стресса воспалительной боли у новорожденных крысят. Эти типы стрессоров выбраны нами в связи с тем, что они встречаются и в неонатальной клинике: стрессовые состояния, вызывающие депрессию у женщин в период беременности (пренатальный стресс), и стресс новорожденных в ответ на инвазивные болевые процедуры. Кроме того, мы исследуем влияние хронического введения флуоксетина и буспирона самкам крыс до стресса в период беременности, на адаптивное поведение и когнитивные способности потомства, подвергнутого воспалительной боли в новорожденном возрасте, как не изученную сторону проблемы. Одной из особенностей нашей работы является исследование последствий перинатальных стрессовых воздействий у крыс препубертатного периода развития, уникального “критического” периода, характеризующегося перестройкой важнейших регуляторных систем организма и высокой пластичностью. В этой работе, как и в предыдущих наших работах [8, 22], мы пользуемся классификацией [26], согласно которой возраст крысы с 21-го по 34-й день после рождения рассматривается как ранний адолесцентный период (в отечественной литературе препубертатный), а с 34-го по 46-й – как средне-адолесцентный. Подчеркнем, что в онтогенетических исследованиях используются и другие классификации препубертатного периода развития [27]. Последствия перинатального стресса преимущественно изучают на особях мужского пола. Принимая во внимание данные литературы о том, что депрессия, вызванная стрессом, как и повышенная болевая чувствительность, в большей степени свойственна женскому полу [28], настоящая работа выполнена на самках крыс.
Защита мозга от вредоносного влияния стресса важна не только для отдельного человека, но и общества в целом. В связи с этим к исследованию механизмов, с помощью которых сам стресс формирует стрессоустойчивость организма, исследователи проявляют повышенный интерес. Результаты поведенческих экспериментов на животных, полученные с использованием разнообразных моделей, предоставляют материал, сравнительный анализ которого указывает направление для изучения механизмов этого явления на молекулярном уровне и позволяет ответить на многие современные вопросы, касающиеся генетических, филогенетических и онтогенетических факторов этой актуальной проблемы.
Цель настоящей работы состояла в исследовании адаптивного поведения у крыс препубертатного периода развития, испытавших неонатальную боль, рожденных самками, которые во время беременности были подвергнуты стрессу, а для коррекции поведения у потомства еще и хронической инъекции флуоксетина и буспирона.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Работа выполнена на женском потомстве крыс линии Вистар из биоколлекции Института физиологии им. И.П. Павлова РАН (Санкт-Петербург) осенью 2018 г. Самки (n = 20) и самцы (n = 12) были рассажены в стандартные клетки (5 самок и 3 самца в каждой клетке) в виварии лаборатории. Условия содержания животных в виварии лаборатории были стандартные (22–23°С, режим свет/темнота по 12 ч, свободный доступ к пище). На следующее утро беременность определяли по мазку из влагалища. День обнаружения сперматозоидов в мазке, как и день рождения потомства, принимали за нулевой день.
Беременные самки в зависимости от типа препарата, внутрибрюшинную инъекцию которого осуществляли ежедневно с 9-го дня беременности до родов, были разделены на группы: 1) без введения веществ и растворителя и без стрессирования (без пренатальных воздействий для потомства), 2) физиологический раствор (1 мл), 3) флуоксетин (10 мг/кг, 1 мл, Sigma), 4) буспирон (3.5 мг/кг, 1 мл, Sigma) (табл. 1). Ранее нами было обнаружено, что хроническая инъекция физиологического раствора не стрессированным в период беременности крысам достоверно не изменяла у потомства поведенческие показатели в использованных тестах, поэтому в качестве контроля в настоящей работе было использовано потомство не стрессированных матерей без введения физиологического раствора. Выбор дозы флуоксетина соответствовал рекомендациям, имеющимся в литературе [29]. Буспирон применяли в апробированных нами ранее дозах [30]. Известно, что флуоксетин [31] и буспирон [32] проникают через плацентарный барьер.
Таблица 1.
Схема воздействий на беременных самок крыс и их новорожденное потомство
| Воздействия на беременных самок или на потомство | Группа 1 | Группа 2 | Группа 3 | Группа 4 | ||||
|---|---|---|---|---|---|---|---|---|
| С 9-го по 20-й день беременности введение препаратов | Без пренатальных воздействий | ↓ Физиологический раствор | ↓ Флуоксетин | ↓ Буспирон | ||||
| С 15-го по 20-й день беременности стресс | Иммобилизационный стресс | |||||||
| В первые два дня жизни потомства стресс (воспалительная боль) | ↓ Боль |
↓ Без боли | ↓ Боль |
↓ Без боли | ↓ Боль |
↓ Без боли | ↓ Боль |
↓ Без боли |
| n =10 | n = 8 | n = 9 | n = 10 | n = 10 | n = 9 | n = 10 | n = 9 | |
Для моделирования пренатального стресса (кроме крыс группы 1) беременных самок помещали в пеналы с 15-го по 21-й день беременности два раза в сутки (в разные утренние с 9 до 13, и вечерние с 14 до 19, часы для того, чтобы не было привыкания к стрессу) по 60 мин в условиях сильного освещения. В настоящей работе не были использованы не стрессированные самки крыс с введением флуоксетина и буспирона, так как данные, полученные на них, были опубликованы ранее [33]. Пенал, сделанный из органического стекла, имел небольшие отверстия для носа и хвоста крысы, и строго ограничивал движения животного. Наличие вдоль стенок внутри пенала пластин позволяло изменять его объем по мере увеличения срока беременности крысы.
На следующие сутки после рождения потомства помет сокращали до 8 особей (равное, по возможности, число самок и самцов). В настоящей работе использовали самок. Каждая из четырех исследуемых групп была разделена на две части, одна из которых была подвергнута воспалительной боли, а вторая боли не подвергалась. Воспалительный очаг создавали подкожным введением самочкам крыс формалина (2.5% раствор, 0.5 мкл в подошву левой задней конечности) в первый и, повторно, второй день жизни. Сразу после инъекции новорожденные крысята были возвращены матери. Схема воздействий на беременных самок крыс и их новорожденное потомство представлена в табл. 1.
Самки, достигшие 25 дней жизни, были исследованы в тесте «горячая пластина» для оценки базальной болевой чувствительности. Каждое животное помещали на горячую пластину, нагретую до 55°С, и регистрировали латентный период реакции отряхивания задней конечности (с) в ответ на термический раздражитель. Опыт повторяли трижды с перерывом в 10 мин, полученные данные усредняли. После опыта крыс помечали краской для идентификации.
На следующий день у этих животных оценивали интенсивность воспалительного болевого ответа в формалиновом тесте. После подкожной инъекции формалина (2.5%, 1.0 мкл в подошву левой задней конечности) каждую крысу по очереди помещали в прозрачную камеру (30 × 30 × 40 см) и регистрировали в течение 60 мин число сгибаний+встряхиваний (спинальный уровень) и продолжительность реакции вылизывания (супраспинальный уровень), характеризующие интенсивность болевого ответа на воспалительный агент [34]. Анализ данных производили с использованием специально разработанной программы. Следующие поведенческие тесты осуществляли с промежутком в три дня.
Для оценки уровня тревожности использовали приподнятый крестообразный лабиринт у крыс в возрасте 27 дней. Установка приподнятого крестообразного лабиринта состоит из центральной площадки (10 × 10 см) и четырех рукавов, два из которых снабжены боковыми стенками. Длина рукава составляет 45 см, ширина – 10 см, высота боковых стенок – 40 см. Вся установка приподнята на 70 см над уровнем пола. Крысу помещали на центральную площадку головой в сторону открытого рукава. Для оценки уровня тревожности регистрировали время пребывания в открытых рукавах (показатель, обратно пропорциональный уровню тревожности) за 5-минутное нахождение в установке.
В тесте принудительного плавания (модификация теста Порсолта) самок в возрасте 30 дней помещали по очереди на 5 мин в сосуд с водой (диаметр – 25 см, высота 60 см), нагретой до 25–27°С. Регистрировали время (с) нахождения крысы в неподвижном состоянии (время иммобильности), которое характеризует уровень депрессивно-подобного поведения.
В водном лабиринте Морриса (диаметр бассейна 1.2 м и глубина 0.5 м) у самок в возрасте 33 дней вырабатывали пространственную дифференцировку и оценивали способность крыс к пространственному обучению. Последовательно каждую самку помещали в бассейн с водой, окрашенной до опыта мелом, для предотвращения видимости платформы (диаметр 12 см), установленной на дне бассейна ниже уровня воды на 1 см. Регистрировали латентный период, в течение которого животное находило платформу. Если крыса не находила платформу в течение 60 с, животное помещали на 20 с на платформу (одна попытка), после чего отсаживали на 15 с в клетку для отдыха. Проводили четыре попытки, которые повторяли два раза (две пробы с перерывом 4 мин). Перед второй пробой платформу помещали в другой из четырех секторов бассейна. Анализировали время нахождения крысой платформы. Поведение животных в каждом тесте регистрировали с помощью видеокамеры. Все используемые нами поведенческие стандартизированные тесты подробно описаны в наших статьях [22, 23]. Все процедуры работы с животными выполнены с соблюдением “Правил и норм гуманного обращения с объектами исследования” [35]. Протоколы опытов утверждены комиссией по гуманному обращению с животными Института физиологии им. И.П. Павлова РАН.
Статистический анализ проводили с использованием одномерного двухфакторного дисперсионного анализа ANOVA. В качестве зависимых переменных были: латентный период в тесте горячая пластина, число сгибаний и встряхиваний, а также продолжительность вылизывания в формалиновом тесте, время пребывания в открытых рукавах в тесте приподнятого крестообразного лабиринта, время иммобильности в тесте вынужденного плавания и время нахождения платформы в водном тесте Морриса. Факторы: воздействия (контроль, физиологический раствор + пренатальный стресс, флуоксетин + пренатальный стресс, буспирон + + пренатальный стресс) и экспериментальные условия (пренатальный стресс, боль в новорожденном возрасте). Во множественных post-hoc сравнениях использовался тест Бонферрони. Статистические решения принимались на 5% уровне значимости при двусторонней альтернативе. Данные анализировались на основе программного комплекса SPSS Inc. Данные представлены средними значениями ±стандартные ошибки.
РЕЗУЛЬТАТЫ
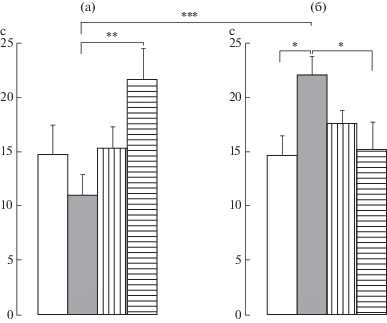
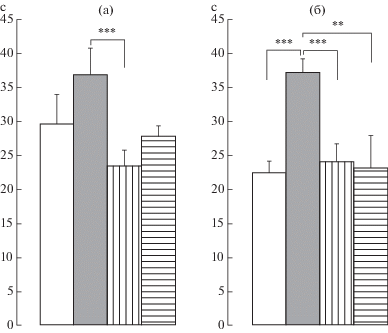
Влияние пренатальных воздействий и/или периферической воспалительной боли в новорожденном возрасте на показатель болевой чувствительности в тесте «горячая пластина» у самок крыс препубертатного периода развития. Обнаружено достоверное влияние взаимодействия экспериментальных условий и воздействий F(3,80) = 8.30, p < 0.001, η2 = = 0.237. Post-hoc анализ обнаружил достоверные различия в латентном периоде между пренатально стрессированными крысами с пренатальным введением физиологического раствора и крысами с введением буспирона (р < 0.01) (рис. 1а). Сочетание пренатального стресса и боли в новорожденном возрасте вызвало увеличение латентного периода по сравнению с этим показателем у крыс только с болью в новорожденном возрасте (р < 0.05) (рис. 1б) и у пренатально стрессированных крыс без болевого воздействия (р < 0.001) (рис. 1а, 1б). Введение буспирона уменьшило латентный период по сравнению с этим показателем у крыс с сочетанием пренатального стресса и боли в новорожденном возрасте (р < 0.05) (рис. 1б).
Рис. 1.
Влияние пренатальных воздействий (пренатальный стресс, пренатальное введение флуоксетина или буспирона) и/или боли в новорожденном возрасте на болевую чувствительность в тесте “горячая пластина” у самок крыс в препубертатный период развития. а, б – без боли и с болью в новорожденном возрасте соответственно. По вертикали – латентный период ответа на термический раздражитель (с). Светлые столбики – без пренатальных воздействий, темные столбики – пренатально стрессированные с введением физиологического раствора, столбики с вертикальной штриховкой – пренатальное введение флуоксетина пренатально стрессированным крысам, столбики с горизонтальной штриховкой – пренатальное введение буспирона пренатально стрессированным крысам. Уровень значимости: *p < 0.05, ** p < 0.01, *** p < 0.001. Данные представлены в виде среднего ± стандартная ошибка.
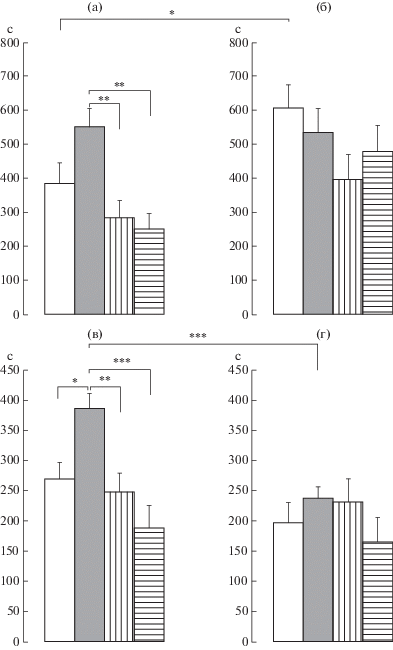
Влияние пренатальных воздействий и/или периферической воспалительной боли в новорожденном возрасте на показатели тонического болевого ответа в формалиновом тесте у самок крыс препубертатного периода развития. Обнаружено достоверное влияние на болевой ответ, организованный на спинальном уровне (число сгибаний + встряхиваний), экспериментальных условий F(1,80) = 10.3, p < < 0.01, η2 = 0.114 и воздействий F(3,80) = 6.2, p < 0.001, η2 = 0.185. Post-hoc анализ обнаружил достоверное различие в числе сгибаний+встряхиваний между влиянием боли в новорожденном возрасте и контролем (p < 0.05) (рис. 2а, 2б). У пренатально стрессированных крыс флуоксетин и буспирон уменьшили болевой ответ (p < 0.01 в обоих случаях) по сравнению с болевым ответом у пренатально стрессированных крыс (рис. 2а). В болевом ответе, организованном на супраспинальном уровне, обнаружено достоверное влияние экспериментальных условий F(1,80) = 6.7, p = 0.011, η2 = 0.078, воздействий F(3,80) = 8.2, p < 0.001, η2 = 0.234 и достоверное влияние взаимодействия экспериментальных условий и воздействий F(3,80) = 3.0, p < 0.05, η2 = 0.100 на продолжительность вылизывания. Post-hoc анализ обнаружил увеличение продолжительности вылизывания у пренатально стрессированных крыс по сравнению с контролем (p < 0.05), флуоксетин и буспирон нивелировали влияние пренатального стресса (p < 0.01, p < 0.001 соответственно) (рис. 2в). Сочетание пренатального стресса и боли в новорожденном возрасте достоверно уменьшило болевой ответ по сравнению с болевым ответом, вызванным пренатальным стрессом (p < 0.001). В этих условиях влияние флуоксетина и буспирона не проявилось (рис. 2в, 2г).
Рис. 2.
Влияние пренатальных воздействий и/или боли в новорожденном возрасте на интенсивность воспалительного болевого ответа в формалиновом тесте у самок крыс в препубертатный период развития. а, б – спинальный уровень ответа, в, г – супраспинальный уровень, а, в и б, г – без боли и с болью в новорожденном возрасте соответственно. По вертикали – число сгибаний+встряхиваний (а, б) и продолжительность реакции вылизывания (сек) (в, г). Светлые столбики – без пренатальных воздействий, темные столбики – пренатально стрессированные с введением физиологического раствора, столбики с вертикальной штриховкой – пренатальное введение флуоксетина пренатально стрессированным крысам, столбики с горизонтальной штриховкой – пренатальное введение буспирона пренатально стрессированным крысам. Уровень значимости: * p < 0.05, ** p < 0.01, *** p < 0.001. Данные представлены в виде среднего ± стандартная ошибка.
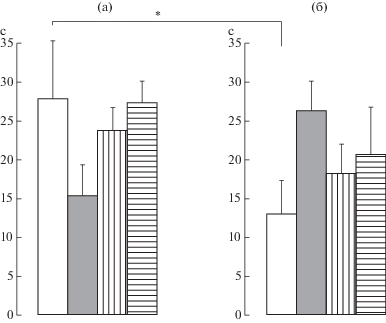
Влияние пренатальных воздействий и/или периферической воспалительной боли в новорожденном возрасте на показатель уровня тревожности в тесте приподнятого крестообразного лабиринта у самок крыс препубертатного периода развития. Обнаружено влияние на время пребывания в открытых рукавах взаимодействия экспериментальных условий и воздействий F(3,80) = 2.9, p < 0.05, η2 = 0.099. Тест Бонферрони показал различия между временем пребывания в открытых рукавах у самок, подвергнутых боли в новорожденном возрасте, и контролем (р < 0.05) (рис. 3а, 3б).
Рис. 3.
Влияние пренатальных воздействий и/или боли в новорожденном возрасте на уровень тревожности в тесте приподнятого крестообразного лабиринта у самок крыс в препубертатный период развития. а, б – без боли и с болью в новорожденном возрасте соответственно. По вертикали – время пребывания в открытых рукавах (сек). Светлые столбики – без пренатальных воздействий, темные столбики – пренатально стрессированные с введением физраствора, столбики с вертикальной штриховкой – пренатальное введение флуоксетина пренатально стрессированным крысам, столбики с горизонтальной штриховкой – пренатальное введение буспирона пренатально стрессированным крысам. Уровень значимости: * p < 0.05. Данные представлены в виде среднего ± стандартная ошибка.
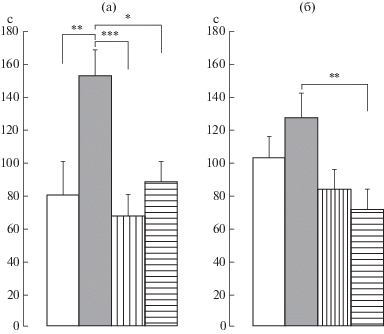
Влияние пренатальных воздействий и/или периферической воспалительной боли в новорожденном возрасте на показатель выраженности депрессивноподобного поведения в тесте принудительного плавания у самок крыс препубертатного периода развития. Обнаружено достоверное влияние воздействий F(3,80) = 9.4, p < 0.001, η2 = 0.260 на время иммобильности, но не выявлена зависимость от боли в новорожденном возрасте. Пренатальный стресс достоверно увеличил время иммобильности по сравнению с этим показателем у контрольных крыс (р < 0.01), флуоксетин и буспирон снизили этот показатель депрессивноподобного поведения (р < 0.001 и р < 0.05 соответственно) (рис. 4а). Не было выявлено различий во времени иммобильности у крыс, подвергнутых боли в новорожденном возрасте, и крыс с сочетанием пренатального стресса и боли в новорожденном возрасте. Только буспирон вызвал достоверное снижение времени иммобильности у крыс с сочетанием пренатального стресса и боли в новорожденном возрасте (р < 0.01).
Рис. 4.
Влияние пренатальных воздействий и/или боли в новорожденном возрасте на уровень выраженности депрессивноподобного поведения в тесте принудительного плавания у самок крыс в препубертатный период развития. а, б – без боли и с болью в новорожденном возрасте соответственно. По вертикали – время иммобильности (с). Светлые столбики – без пренатальных воздействий, темные столбики – пренатально стрессированные с введением физиологического раствора, столбики с вертикальной штриховкой – пренатальное введение флуоксетина пренатально стрессированным крысам, столбики с горизонтальной штриховкой – пренатальное введение буспирона пренатально стрессированным крысам. Уровень значимости: * p < 0.05, ** p < 0.01, *** p < 0.001. Данные представлены в виде среднего ± стандартная ошибка.
Влияние пренатальных воздействий и/или периферической воспалительной боли в новорожденном возрасте на показатель способности к обучению в водном лабиринте Морриса у самок крыс препубертатного периода развития. У самок обнаружено достоверное влияние воздействий F(3,80) = 12.5, p < 0.001, η2 = 0.319 на время нахождения платформы, но не выявлена зависимость от боли в новорожденном возрасте. Post-hoc анализ показал различие во времени нахождения платформы между пренатально стрессированными самками с введением физиологического раствора и пренатально стрессированными с введением флуоксетина самками (р < 0.001) (рис. 5а). Обнаружено достоверное различие во времени нахождения платформы у крыс с сочетанием пренатального стресса и боли в новорожденном возрасте и крыс, подвергнутых только боли в новорожденном возрасте (р < 0.001) (рис. 5б). В этих условиях флуоксетин (р < 0.001) и буспирон (р < 0.01) достоверно снизили время нахождения платформы (рис. 5а, 5б).
Рис. 5.
Влияние пренатальных воздействий и/или боли в новорожденном возрасте на способность крыс к пространственному обучению в тесте Морриса у самок крыс в препубертатный период развития. а, б – без боли и с болью в новорожденном возрасте соответственно. По вертикали – время нахождения платформы (с). Светлые столбики – без пренатальных воздействий, темные столбики – пренатально стрессированные с введением физиологического раствора, столбики с вертикальной штриховкой – пренатальное введение флуоксетина пренатально стрессированным крысам, столбики с горизонтальной штриховкой – пренатальное введение буспирона пренатально стрессированным крысам. Уровень значимости: ** p < 0.01, *** p < 0.001. Данные представлены в виде среднего ± стандартная ошибка.
ОБСУЖДЕНИЕ
Настоящая работа является первой, в которой исследовано долговременное влияние повторной периферической воспалительной боли у новорожденных самок крысят, рожденных матерями, подвергнутыми в период беременности хроническому действию стресса, на разные типы адаптивного поведения при достижении потомством препубертатного возраста. Ранее нами было показано протективное действие антидепрессанта флуоксетина и анксиолитика буспирона, введение которых беременным самкам крыс способствовало существенному снижению негативных последствий пренатального стресса в поведении потомства [8]. В настоящей работе мы исследовали влияние флуоксетина и буспирона, введенных беременным самкам, на адаптивное поведение потомства в условиях впервые примененного сочетания пренатального стресса и стресса воспалительной боли в период новорожденности. Полученные в настоящей работе данные показали, что пренатальный стресс усилил воспалительный болевой ответ, организованный на супраспинальном уровне (формалиновый тест) и повысил уровень депрессивно-подобного поведения (тест принудительного плавания). Хроническая инъекция стрессированным во время беременности самкам антидепрессанта флуоксетина или анксиолитика буспирона реверсировала влияние пренатального стресса у потомства, что указывает на антиноцицептивные и антидепрессивные свойства флуоксетина и буспирона [36, 37]. Многочисленные данные литературы свидетельствуют о нарушении, вызванном пренатальным стрессом, психоэмоционального поведения у грызунов [1–3]. Клинические наблюдения подтверждают результаты экспериментальных исследований на животных [38]. Наши исследования по влиянию пренатального стресса на болевой ответ существенно дополняют имеющиеся в литературе малочисленные данные, касающиеся ноцицептивной системы, полученные как на животных [39–41], так и на человеке [42].
Воздействие воспалительной болью на пренатально не стрессированных новорожденных проявилось неоднозначно в разных типах поведения при достижении животными препубертатного возраста. Болевое воздействие на новорожденных вызывало у животных препубертатного возраста усиление в формалиновом тесте болевого ответа, организованного на спинальном уровне, повышение уровня тревожности, но достоверно не изменило базальную болевую чувствительность, уровень выраженности депрессивноподобного поведения и способность к пространственному обучению. Данные литературы, полученные как в лабораторных условиях на животных [20, 21], так и в клинике [17–19], указывают на то, что болевые воздействия в раннем возрасте могут вызывать долговременные изменения не только в функциональной активности ноцицептивной системы, но и в ГГНС, и психоэмоциональном поведении. Важно подчеркнуть, что в нашей работе болевое воздействие на пренатально стрессированных новорожденных ни в одном из тестов не увеличило негативное влияние пренатального стресса.
Можно было бы предполагать, что воспалительная боль, которой подвергали сразу после рождения пренатально стрессированных крысят, усугубит нарушенное пренатальным стрессом исследованное у них поведение в препубертатном возрасте. Однако оказалось, что сочетание пренатального стресса и стресса воспалительной боли в период новорожденности ни в одном из использованных тестов (кроме теста Морриса) не нарушило поведение в большей степени, чем это сделал каждый из стрессовых воздействий в отдельности. Статистический анализ показал, что воспалительная боль у пренатально стрессированных новорожденных уменьшила проноцицептивное влияние пренатального стресса, понизив болевой ответ до контрольного значения в препубертатном возрасте. Это ярко было продемонстрировано как в сокращении времени продолжительности реакции вылизывания, организованной на супраспинальном уровне, так и в увеличении латентного периода болевой реакции на термический раздражитель. В этих условиях флуоксетин и буспирон не проявили свое действие. Данные, полученные в тестах для оценки болевой системы, являются особенно важным результатом нашей работы. Сразу после инъекции флуоксетина или буспирона у беременных самок наблюдается анксиолитический эффект, тогда как после введения физиологического раствора – повышение двигательной активности, как нами было показано ранее [43]. Флуоксетин [31], как и буспирон [32], проходят через плацентарный барьер и могут оказать влияние на 5-HT1A рецепторы, экспрессия которых в гиппокампе плода крысы обнаруживается с 12-го пренатального дня [44]. Наши данные свидетельствуют о том, что введение флуоксетина беременной самке, не подвергнутой стрессу, может вызвать отклонения в психоэмоциональном поведении потомства, тогда как в условиях пренатального стресса флуоксетин проявляет антидепрессивное влияние и возвращает поведение к норме [15, 33, 43], что поддерживает данные литературы [45].
Таким образом, результаты работы указывают на то, что сочетание пренатального стресса и стресса воспалительной боли в новорожденном возрасте ни в одном из использованных нами тестов не нарушило исследованные типы адаптивного поведения в большей степени, чем это сделал каждый из стрессоров в отдельности. Более того, сочетание стрессоров снизило болевую чувствительность и повысило стрессоустойчивость болевой системы к воспалительному агенту при достижении крысами препубертатного периода развития; в случае нормализации поведения действие флуоксетина и буспирона не проявилось. Данные, представленные в настоящем исследовании, поддерживают широко обсуждаемую гипотезу соответствия-несоответствия (match/mismatch hypothesis) [24, 25, 46], согласно которой поведение индивидуумов, испытавших умеренный стресс в перинатальный период развития, становится адаптивным к стрессовым воздействиям в дальнейшей жизни, если условия стресса в исследуемые периоды онтогенеза совпадают, в противном случае организм оказывается уязвимым к стрессовым нагрузкам, что приводит к развитию тревожно-депрессивных проявлений и различных заболеваний. Результаты настоящего исследования вносят вклад в концепцию повторного стресса, испытанного организмом в критические периоды развития, что важно для познания формирования адаптации индивидуума к последующим стрессам.
Список литературы
Entringer S., Buss C., Wadhwa P.D. Prenatal stress, development, health and disease risk: A psychobiological perspective-2015 Curt Richter Award Paper. Psychoneuroendocrinology. 62: 366–375. 2015.
Monk C., Lugo-Candelas C., Trumpff C. Prenatal developmental origins of future psychopathology: mechanisms and pathways. Annu. Rev. Clin. Psychol. 15: 317–344. 2019.
McGowan P.O., Matthews S.G. Prenatal Stress, Glucocorticoids, and Developmental Programming of the Stress Response. Endocrinology. 159 (1): 69–82. 2018.
Kundakovic M., Jaric I. The Epigenetic Link between Prenatal Adverse Environments and Neurodevelopmental Disorders. Genes (Basel). 8(3). pii: E104. 2017.
Kiryanova V., Smith V.M., Antie M.C., Dyck R.H. Behavior of adult 5-HT1A receptor knockout mice exposed to stress during prenatal development. Neuroscience. 371: 16–28. 2018.
Буткевич И.П., Барр Г.А., Михайленко В.А. Влияние пренатального стресса на серотонинергические нейроны в дорсальном ядре шва и на болевое поведение в неонатальный период развития. Рос. физиологич. журн. им. И.М. Сеченова. 101 (7): 758–768. 2015. [Butkevich I.P., Barr G.A., Mikhailenko V.A. Effects of Prenatal Stress on Serotoninergic Neurons in the Dorsal Raphe Nucleus and on Pain Behavior during the Neonatal Period of Development. Neuroscience and Behavioral Physiology 46 (9): 1005–1010. 2016 (in Russ.).
Van den Hove D.L., Lauder J.M., Scheepens A., Prickaerts J., Blanco C.E, Steinbusch H.W. Prenatal stress in the rat alters 5-HT1A receptor binding in the ventral hippocampus. Brain Res. 1090: 29–34. 2006.
Буткевич И.П., Михайленко В.А., Шимараева Т.Н., Кочубеев А.В. Коррекция болевого и аффективного поведения комбинацией флуоксетина и буспирона у пренатально стрессированных самок крыс. Педиатр. 9 (3): 57–63. 2018. [Butkevich I.P., Mikhailenko V.A., Shimaraeva T.N., Kochubeev A.V. Correction of pain-related and affective behavior by combination of fluoxetine and buspirone in prenatally stressed rats. Pediatrician. 9 (3): 57–63. 2018.
Vahid-Ansari F., Daigle M., Manzini M.C., Tanaka K.F., Hen R., Geddes S.D., Bйпque J.C., James J., Merali Z., Albert P.R. Abrogated Freud-1/Cc2d1a Repression of 5-HT1A Autoreceptors Induces Fluoxetine-Resistant Anxiety/Depression-Like Behavior. J. Neurosci. 37 (49): 11967–11978. 2017.
McAllister-Williams R.H., Alhaj H.A., Massey A., Pankiv J., Reckermann U. Somatodendritic 5-hydroxytryptamine1A (5-HT1A) autoreceptor function in major depression as assessed using the shift in electroencephalographic frequency spectrum with buspirone. Psychol. Med. 44 (4): 767–77. 2014.
Andrews M.H., Matthews S.G. Programming of the hypothalamo-pituitary-adrenal axis: serotonergic involvement. Stress. 7 (1): 15–27. 2004.
Gupta D., Radhakrishnan M., Bhatt S., Kurhe Y. Role of hypothalamic-pituitary-adrenal-axis in affective disorders: anti-depressant and anxiolytic activity of partial 5-HT1A agonist in adrenalectomized rats. Indian J. Psychol. Med. 35 (3): 290–298. 2013.
Hervas I., Artigas F. Effect of fluoxetine on extracellular 5-hydroxytryptamine in rat brain. Role of 5-HT autoreceptors. Eur. J. Pharmacol. 358: 9–18. 1998.
Kiryanova V., McAllister B.B., Dyck R.H. Long-term outcomes of developmental exposure to fluoxetine: a review of the animal literature. Dev. Neurosci. 35: 437–439. 2013.
Olivier J.D.A., Akerud H., Kaihola H. The effects of maternal depression and maternal selective serotonin reuptake inhibitor exposure on offspring. Front. Cell. Neurosci. 7 (73). 2013.
Walker S.M., Beggs S., Baccei M.L. Persistent changes in peripheral and spinal nociceptive processing after early tissue injury. Exp. Neurol. 275 (2): 253–60. 2016.
Valeri B.O., Holsti L., Linhares M.B. Neonatal pain and developmental outcomes in children born preterm: a systematic review. Clin. J. Pain. 31 (4): 355–362. 2015.
Walker S.M. Translational studies identify long-term impact of prior neonatal pain experience. Pain. 158 (1): 29–42. 2017.
Duerden E.G., Grunau R.E., Guo T., Foong J., Pearson A., Au-Young S., Lavoie R., Chakravarty M.M., Chau V., Synnes A., Miller S. Early procedural pain is associated with regionally-specific alterations in thalamic development in preterm neonates. J. Neurosci. 38 (4): 878–886. 2018.
Victoria N.C., Murphy A.Z. The long-term impact of early life pain on adult responses to anxiety and stress: Historical perspectives and empirical evidence. Exp. Neurol. 275 (2): 261–273. 2016.
Mooney-Leber S.M., Brummelte S. Neonatal pain and reduced maternal care: Early-life stressors interacting to impact brain and behavioral development. Neuroscience. 7 (342): 21–36. 2017.
Михайленко В.А., Буткевич И.П., Астапова М.К. Долговременные влияния стрессорных воздействий в неонатальный период развития на ноцицептивную систему и психоэмоциональное поведение. Рос. физиол. журн. им. И.М. Сеченова. 102 (5): 540–550. 2016. [Mikhailenko V.A., Butkevich I.P., Astapova M.K. Long-Term Effects of Stressors during the Neonatal Period of Development on the Nociceptive System and Psychoemotional Behavior. Neuroscience and Behavioral Physiology. 47 (8): 930–940. 2017.]
Butkevich I.P., Mikhailenko V.A., Vershinina E.A., Aloisi A.M., Barr G.A. Long-Term Effects of Chronic Buspirone during Adolescence Reduce the Adverse Influences of Neonatal Inflammatory Pain and Stress on Adaptive Behavior in Adult Male Rats. Front. Behav. Neurosci. 26: 11. 2017.
Nederhof E., Schmidt M.V. Mismatch or cumulative stress: Toward an integrated hypothesis of programming effects. Physiol. and Behav. 106: 691–700. 2012.
Daskalakis N.P., Bagot R.C., Parker K.J., Vinkers C.H., Kloet E.R. The three-hit concept of vulnerability and resilience: towards understanding adaptation to early-life adversity outcome. Psychoneuroendocrinology. 38 (9): 1858–1873. 2013.
Tirelli E., Laviola G., Adriani W. Ontogenesis of behavioral sensitization and conditioned place preference induced by psychostimulants in laboratory rodents. Neurosci. Biobehav. Rev. 27 (1–2): 163–178. 2003.
Калинина Д.С., Ленков Д.Н., Журавин И.А., Вольнова А.Б. Возрастная динамика ЭКоГ и судорожной активности крыс линии wistar в корковой модели фокальной эпилепсии. Журнал высшей нервной деятельности им. И.П. Павлова. 67 (3): 322–333. 2017. [Kalinina D.C., Lenkov D.N., Zhuravin I.A., Volnova A.B. Age Dynamics of ECoG and Epileptiform Activity in Wistar Rat Cortical Model of Focal Epilepsy. Neuroscience and Behavioral Physiology, 48 (8):1006–1013. 2018.
Aloisi A.M. Why we still need to speak about sex differences and sex hormones in pain. Pain Ther. 6: 111–114. 2017.
Glover M.E., Clinton S.M. Of rodents and humans: A comparative review of the neurobehavioral effects of early life SSRI exposure in preclinical and clinical research. Int. J. Dev. Neurosci. 51: 50–72. 2016.
Butkevich I.P., Mikhailenko V.A., Vershinina E.A., Otellin V.A., Aloisi A.M. Buspirone before prenatal stress protects against adverse effects of stress on emotional and inflammatory pain-related behaviors in infant rats: age and sex differences. Brain Research. 1419: 76–84. 2011.
Heikkinen T., Ekblad U., Palo P., Laine K. Pharmacokinetics of fluoxetine and norfluoxetine in pregnancy and lactation. Clin. Pharmacol. Ther. 73: 330–337. 2003.
Boyd. Psychiatric Nursing. Lippincott Williams & Wilkins. Philadelphia. Pa. USA. 2008.
Михайленко В.А., Буткевич И.П. Пренатальное влияние флуоксетина на реактивность болевой системы и психоэмоциональное поведение молодых самок и самцов крыс. Ж. эвол. биохим. и физиол. 2018. Т. 54. № 4. С. 283–291. [Mikhailenko V.A., Butkevich I.P. Prenatal effect of fluoxetine on nociceptive system reactivity and psychoemotional behavior of young female and male rats. Journal of Evolutionary Biochemistry and Physiology. 54 (4): 322–331. 2018. (in Russ.).
Coderre T.J., Katz J., Vaccarino A.L., Melzack R. Contribution of central neuroplasticity to pathological pain: review of clinical and experimental evidence. Pain. 52 (3): 259–285. 1993.
Zimmerman M. Committee for research and ethical issues of the IASP, Ethical standards for investigations of experimental pain in animals. Pain. 16: 109–110. 1983.
Barakat A., Hamdy M.N., Elbadr M.M. Uses of fluoxetine in nociceptive pain management: A literature overview. Eur. J. Pharmacol. 829: 12–25. 2018.
Dharmshaktu P., Tayal V., Kalra B.S. Efficacy of antidepressants as analgesics: a review. J. Clin. Pharmacol. 52: 6–17. 2012.
Palma-Gudiel H., Cirera F., Crispi F., Eixarch E., Facanas L. The impact of prenatal insults on the human placental epigenome: A systematic review. Neurotoxicol. Teratol. 66: 80–93. 2018.
Knaepen L., Pawluski J.L., Patijn J., Kleef M., Nibboel D., Joosten E.A. Perinatal maternal stress and serotonin signaling: effects on pain sensitivity in offspring. Dev. Psychobiol. 56: 885–896. 2014.
Said N., Lakehayli S., Battas O., Hakkou F., Tazi A. Effects of prenatal tress on anxiety-like behavior and nociceptive response in rats. J. Integr. Neurosci. 14 (2): 223–34. 2015.
Wang H.J., Xu X., Xie R.H., Rui Y.Y., Zhang P.A., Zhu X.J., Xu G.Y. Prenatal maternal stress induces visceral hypersensitivity of adult rat offspring through activation of cystathionine-β-synthase signaling in primary sensory neurons. Mol. Pain. 2018. 14: 1744806918777406.
Oberlander T.F., Grunau R.E., Fitzgerald C., Papsdorf M., Rurak D., Riggs K.W. Pain reactivity in 2-month-old infants after prenatal and postnatal serotonin reuptake inhibitor medication exposure. Pediatrics. 115: 411–425. 2005.
Буткевич И.П., Михайленко В.А. Различия в пренатальном влиянии флуоксетина и буспирона на адаптивное поведение молодых крыс. Физиол. ж. им. И.М. Сеченова 104 (4): 440–451. 2018. [Butkevich I.P., Mikhailenko V.A. Differences in the prenatal influence of fluoxetine and buspirone on reaction pain system and the behavior of young rats. Russ. J. Physiol. 104 (4): 440–451. 2018. (In Russ).
Patel T.D., Zhou F.C. Ontogeny of 5-HT1A receptor expression in the developing hippocampus. Developm. Brain Res. 157: 42–57. 2005.
Rayen I., van den Hove D.L., Prickaerts J., Steinbusch H.W., Pawluski J.L. Fluoxetine during development reverses the effects of prenatal stress on depressive-like behavior and hippocampal neurogenesis in adolescence. PloS. One. 2011. 6 (9): e24003.
Verstraeten B.S.E., McCreary J., Weyers S., Metz G.A.S., Olson D.M. Prenatal two-hit stress affects maternal and offspring pregnancy outcomes and uterine gene expression in rats: match or mismatch? Biol. Reprod. 100 (1): 195–207. 2019.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


