Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 2, стр. 87-97
МЕЛАТОНИН. МУЛЬТИФУНКЦИОНАЛЬНОСТЬ. РЫБЫ
В. В. Кузьмина *
Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 Ярославская обл., Борок, Некоузский р-н, дом 109, Россия
* E-mail: vkuzmina@ibiw.yaroslavl.ru
Поступила в редакцию 28.04.2019
После доработки 14.10.2019
Принята к публикации 05.11.2019
Аннотация
В обзоре приведены данные, касающиеся как общих закономерностей функционирования мелатонина (МТ) у позвоночных, так и особенности, характерные для рыб. Описана локализация секреции, механизмы синтеза и типы рецепторов МТ, его влияние на иммунную и антиоксидантную системы и водно-солевой баланс. Особое внимание уделено процессам размножения, роста и питания. Обсуждается влияние МТ на важнейшие аспекты нейроэндокринной регуляции питания рыб. Показано, что МТ, будучи главным эндогенным синхронизатором физиологических процессов, играет ключевую роль в центральной и периферической регуляции различных функций организма, адаптируя их к условиям окружающей среды.
ВВЕДЕНИЕ
Как известно, в синхронизации ежедневных и годичных ритмов животных наиболее важную роль играет чередование света и темноты. Реакция на этот цикл в большинстве случаев контролируется внутренними часами, которые в постоянных условиях работают без перерыва с периодом, близким к 24 ч (циркадианные ритмы) или одному году (цирканные ритмы). Центральная роль в реализации этих ритмов принадлежит МТ [1–7]. Выделенный в 1958 г. МТ – “гормон тьмы”, играет ключевую медиаторную роль в синхронизации целого ряда физиологических процессов у разных классов позвоночных [8]. Молекулярная структура МТ консервативна [9]. Это – липофильный индоламин (N-ацетил-5-метокситриптамин, C13H16N2O2), молярная масса 232.28 г/моль. Большинство работ выполнено на млекопитающих [1, 3, 10]. Вместе с тем изучение роли МТ в функционировании различных систем у рыб представляет значительный интерес, поскольку они являются наиболее древними позвоночными, имеющими практическое значение.
В последние десятилетия усилились исследования, направленные на понимание того, как МТ опосредует влияние фотопериода на важнейшие физиологические функции рыб, особенно костистых рыб. Установлено, что гормон контролирует процессы роста, приема пищи, пищеварения и размножения в результате специфических поведенческих ритмов [4–7, 11, 12]. МТ также является эффективным антиоксидантом, иммуностимулятором и антистрессовым индоламином [5, 13–15]. Охарактеризованы различные подтипы рецепторов МТ, их расположение и регуляция. Есть данные о влиянии МТ на важнейшие аспекты нейроэндокринной регуляции питания рыб, а также на возможность модификации цирканных ритмов рыб световыми сигналами [4, 7, 11].
ЛОКАЛИЗАЦИЯ СЕКРЕЦИИ И МЕХАНИЗМ СИНТЕЗА МЕЛАТОНИНА
Локализация секреции мелатонина. Секреция МТ осуществляется в эпифизе (шишковидной железе) в ночной период, что приводит к повышению его уровня в крови и спинномозговой жидкости по сравнению с дневным периодом (рис. 1). У большинства хрящевых и костистых рыб эпифиз и парапинеальный орган образуют шишковидный комплекс. В ходе эволюции структура шишковидного комплекса изменялась. Млекопитающие обладают только эпифизом. При этом фоторецепторные клетки шишковидного органа рыб стали пинеалоцитами шишковидной железы у млекопитающих, утратившими фотопигменты и способность непосредственно обнаруживать свет [11]. У млекопитающих свет воспринимается сетчаткой глаза, а далее сигнал передается в супрахиазматическое ядро гипоталамуса [1, 4, 7, 16, 17]. Затем мультисинаптическим путем, включающим паравентрикулярные ядра гипоталамуса, преганглионарные нейроны симпатической нервной системы и верхний шейный ганглий, информация поступает в эпифиз, синтезирующий мелатонин [18].
Рис. 1.
Схематическое изображение основных компонентов, вовлеченных в регуляцию циркадианного ритма мелатонина в пинеальном органе немлекопитающих (А) и шишковидной железе млекопитающих (В) [по: 11].
Обозначение. СХЯ – супрахиазматическое ядро.
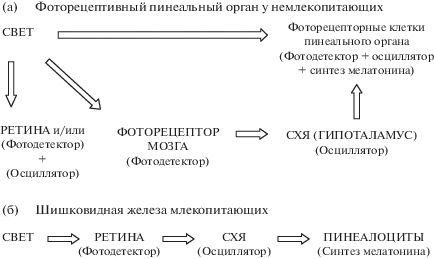
У рыб эпифиз и сетчатка глаза также занимают центральное место в организации циркадианных ритмов [19, 20]. При этом фото-нейроэндокринная система, по-видимому, организована как сеть независимых и взаимосвязанных светочувствительных единиц в сетчатке, эпифизе и, возможно, в мозге. Свет действует на фоторецепторные клетки эпифиза и сетчатки, обеспечивая синхронизацию их внутренних молекулярных часов с внешними условиями освещения. Кроме того, свет может действовать на другие светочувствительные и циркадианные структуры в вентральном промежуточном мозге, а также периферические органы. Информация от сетчатки и эпифиза достигает вентрального промежуточного мозга через ретиногипоталамический и пинеальный тракты и дает представление о продолжительности дня, а также о незначительных изменениях освещенности. Гормональная информация передается МТ, производство которого отражает продолжительность дня и время года [4, 20]. Важно отметить, что фоторецепторы эпифиза имеют структурное сходство с колбочками сетчатки, включая сходный состав липидов и белков фототрансдукционного каскада (опсин, трансдуцин, аррестин, циклический нуклеотид). Также аналогичен их электрический ответ на световые раздражители [2, 4, 7, 21].
Механизм синтеза мелатонина. МТ синтезируется из серотонина, который образуется из триптофана. Уровень серотонина выше днем, чем ночью, а уровень МТ, напротив, повышен ночью. Ночной подъем синтеза МТ в эпифизе обусловлен увеличением активности ариламин-N-ацетилтрансферазы (AANAT), катализирующей образование N-ацетилсеротонина, и гидроксииндол-O-метилтрансферазы, превращающей N-ацетилсеротонин в МТ. Считается, что костистые рыбы обладают двумя генами aanat [4, 22]; aanat 1 в большей степени экспрессируется в сетчатке и головном мозге, aanat 2 – в эпифизе [4]. Однако при исследовании трехиглой ко́люшки Gasterosteus aculeatus выявлено три гена (aanat 1a, aanat 1b и aanat 2), кодирующие синтез этих ферментов. Уровни их мРНК AANAT в мозге, глазах, коже, желудке, кишечнике, сердце и почках значительно различаются. Наиболее высокие уровни мРНК AANAT 1a и AANAT 1b выявлены в глазах. Крайне низкий уровень мРНК AANAT 2 во всех органах может свидетельствовать о том, что AANAT1a и/или AANAT1b являются главными изозимами у рыб этого вида [23].
Свет ингибирует активность AANAT2 и высвобождение МТ in vivo или in vitro. Ночью деполяризация фоторецептора обеспечивает поступление кальция (Ca2+) через кальциевые каналы и накопление цАМФ [21], которые благодаря фосфорилированию белка AANAT2 способствуют увеличению количества и активности фермента. Свет вызывает гиперполяризацию фоторецептора, дефосфорилирование и деградацию AANAT2 посредством протеасомного протеолиза, что приводит к снижению продукции МТ [4]. Светоиндуцированное снижение активности AANAT2 и секреция МТ являются дозозависимым процессом [24]. Также выявлена зависимость секреции МТ от спектрального состава света. Так, у рыб сем. лососевых Salmonidae торможение наблюдается при коротких волнах видимого спектра [25]. При этом непрерывный свет подавляет секрецию МТ, а постоянная темнота способствует высокому уровню его секреции [4].
У большинства видов костистых рыб секреция МТ связана с циркадианной системой часов, расположенных внутри самих фоторецепторных клеток [26]. Механизм циркадианных часов основан на обратной связи, состоящей из двух гетеродимеров, PER/CRY, действующих как репрессоры, и BMAL/CLOCK, действующие как активаторы, а также дополнительных петель блокировки. Гетеродимеры BMAL/CLOCK также управляют ритмом экспрессии ряда генов, включая ген аanat2, который связан с геном циркадианных часов. Транскрипция aanat 2 позволяет накапливать мРНК AANAT в течение дня и в начале ночи. Утренний свет восстанавливает часы и ингибирует активность AANAT и секрецию МТ [2, 4, 20]. Суточные ритмы МТ у рыб разных видов различны. У обыкновенного карпа Cyprinus carpio выявлены четкие суточные ритмы циркуляции МТ с пиком во время темновой фазы и наименьшим уровнем во время фотофазы [27], обусловленные ритмами AANAT эпифиза [7]. У обыкновенного лаврака Dicentrarchus labrax пик МТ в плазме крови наблюдается в дневное время [28].
Разнообразие ответов рыб разных видов на свет, в значительной мере обусловленное амплитудой сигнала МТ и активностью AANAT2, зависит от интенсивности и характеристик света [29], а также температуры. Существует корреляция между пиком ответа AANAT2 и оптимальной температурой рыб (форель Oncorhynchus mykiss – 12°C, обыкновенная щука Esox lucius – 20°C, данио-рерио Danio rerio – 30°C). Одновременное действие фотопериода, определяющего длительность сигнала МТ, и температуры, определяющей его амплитуду, в значительной мере определяет характер циркадианных и цирканных ритмов [4, 21]. Исследование влияния искусственного освещения различной интенсивности (0, 1, 10, 100 лк) и разного цвета (синий, зеленый, красный) на суточный ритм мелатонина у обыкновенной плотвы Rutilus rutilus показало, что концентрация МТ ночью значительно снижается при очень низкой интенсивности белого света (1 лк), а также при разных длинах волн [30]. Также на синтез МТ влияют внутренние факторы, в том числе сам МТ, высокая концентрация которого ингибирует его синтез, а также нейротрансмиттеры/нейромодуляторы, синтезирующиеся локально (аденозин, ГАМК) или вне эпифиза (норадреналин, глюкокортикоиды и половые стероиды) [4]. При исследовании in vivo и in vitro большого индийского карпа Catla catla в естественных фототермальных условиях была выявлена экспрессия генов ферментов, участвующих в синтезе МТ (tph1, aanat1, aanat2 и hiomt) в мозге и, особенно, в кишечнике. Ритм и акрофаза экспрессии этих генов в мозге и кишечнике независимы [31].
Внепинеальные источники мелатонина. Как указывалось выше, источником МТ, помимо эпифиза, является сетчатка [4, 19, 32]. У костистых рыб нет единообразия циркадианных ритмов выработки МТ в сетчатке. Так, у данио-рерио D. rerio и золотых рыбок Carassius auratus наблюдается ночной паттерн МТ сетчатки [33, 34]. У ряда видов, в частности у форели [35] и обыкновенного лаврака [36], ритм не обнаружен или пик МТ наблюдается в разное время цикла свет/темнота, включая день. При этом активность AANAT в сетчатке глаза форели высока в течение светлого периода суток и низка в темноте [35]. Различия ретинальных паттернов объясняются существованием нескольких типов клеток сетчатки (включая фоторецепторы, интернейроны и ганглиозные клетки), экспрессирующих ферменты биосинтеза мелатонина AANAT и HIOMT [4].
Также МТ в значительном количестве синтезируется энтерохромаффинными клетками желудочно-кишечного тракта [22, 37, 38] и в меньшей степени в других органах: печени, почках, клетках крови, гонадах и жабрах рыб [4, 7, 39]. Концентрация МТ в тканях желудочно-кишечного тракта может превышать таковую в крови в 10–100 раз, в эпифизе, по меньшей мере, в 400 раз [10]. При этом МТ внепинеального происхождения действует не только эндокринным, но и аутокринным и паракринным путем, причем механизм синтеза МТ в кишечнике и эпифизе различен даже у одного и того же вида животных [7]. Важно, что МТ может влиять на регенерацию и функцию эпителия кишечника, укреплять иммунную систему и снижать тонус мышц желудочно-кишечного тракта [10]. Исследование уровня МТ и активности AANAT у обыкновенного карпа показало, что, независимо от времени года и суточных колебаний освещенности, пик синтеза МТ в каждом сегменте кишечника наблюдается в середине дня [39]. Высвобождение МТ в желудочно-кишечном тракте, по-видимому, связано с периодичностью приема пищи. МТ желудочно-кишечного тракта циркулирует через печеночную портальную вену и разлагается в печени. Концентрация МТ в желчи превышает его концентрацию в желудочно-кишечном тракте в 10–40 раз [7].
Светочувствительность (внепинеальная и внеретинальная) центральной нервной системы. Известно, офтальмэктомизированные/пинеалэктомированные рыбы реагируют на фотопериодические стимулы, а компоненты каскада фототрансдукции, включая опсин и трансдуцин, обнаружены в отдельных областях мозга миног и рыб. Поскольку фоторецепторы эпифиза и сетчатки глаза являются клеточными циркадианными системами, предполагается, что все фоторецептивные клетки организма рыб обладают молекулярными часами [4, 7].
РЕЦЕПТОРЫ МЕЛАТОНИНА
Типы рецепторов мелатонина. Благодаря клонированию и фармако-кинетическим экспериментам с использованием 2-[125I-иодомелатонина (125IMel) у рыб было идентифицировано три подтипа рецепторов МТ, принадлежащих к семейству G-протеина: MT1, MT2 и Mel1c [20]. Клонирование полной длины рецепторов МТ было выполнено для форели (MT1), оранжевопятнистого сигана Siganus guttatus (MT1, Mel1c), обыкновенного лаврака (MT1, MT2, Mel1c), сенегальской солеи Solea senegalensis (MT1, MT2, Mel1c) и обыкновенной щуки (MT2) [40]. Позднее на примере сенегальской солеи были выявлены различные паттерны экспрессии разных рецепторов МТ и их разная роль в процессе развития и метаморфоза рыб. Транскрипты Mel1c были более многочисленными в неоплодотворенных овулированных ооцитах и их количество снижалось во время эмбрионального развития. Экспрессия mt1 и mt2 была максимальной через 2–6 дней после оплодотворения, снижаясь перед (mt2) или во время (mt1) метаморфоза. При этом изменения в цикле день–ночь с более высоким ночным уровнем мРНК были отмечены лишь для экспрессии mt1 и Mel1c [41]. Рецепторы MT1 и MT2 широко распространены в нервной (сетчатка, мозг) и периферических тканях, тогда как экспрессия Mel1c в основном обнаруживается в коже и сетчатке рыб [4, 20, 41]. Также известно, что у рыб существует эндоканабиноидная система, причем каннабиноидные рецепторы CB1 и CB2 экспрессируются в мозге, где CB1 локализуется совместно с нейропептидом Y (NPY) [42], а МТ, как будет показано ниже, значительно снижает экспрессию мРНК грелина, NPY и каннабиноидных рецепторов CB1.
Мозг и гипофиз. В мозге миног, хрящевых и костистых рыб экспрессия генов или связывание 125IMel ассоциируются с областями, которые получают или интегрируют информацию от сенсорных органов (обонятельные луковицы, конечный мозг, промежуточный мозг, оптический тектум и мозжечок), причем рецепторы в основном связаны с областями, получающими информацию из сетчатки и/или эпифиза. Функции МТ в центральной нервной системе рыб пока неизвестны. Предполагается, что МТ может быть проводником, который связывает все процессы в единую сеть. Поскольку МТ может быть синтезирован локально, он, как и в сетчатке, может быть аутокринным регулятором в этих областях. Кроме того, рецепторы МТ, связанные с ингибированием цАМФ, присутствуют в гипофизе обыкновенной щуки, форели и обыкновенного лаврака [4].
Сетчатка. МТ сетчатки участвует в контроле ряда функций, включая агрегацию меланосом в пигментном эпителии, сбрасывание наружных дисков палочек, ретиномоторные движения колбочек, модуляцию высвобождения нейротрансмиттеров и электроретинограмм [1, 4]. Исследование обыкновенного лаврака выявило экспрессию MT1 и MT2 в трех ядерных слоях нейрональной сетчатки рыб, а также в пигментном эпителии сетчатки [40]. Важно, что в нейрональной сетчатке экспрессируются рецепторы в тех же типах клеток, которые экспрессируют ферменты синтеза МТ. Это указывает на то, что МТ является истинным аутокринным регулятором в этом органе [4].
Периферические ткани. Экспрессия рецепторов МТ или связывание 125IMel обнаружены в различных периферических тканях, включая почку, кишечник, клетки крови, гонады и жабры [4, 7, 40, 43]. Однако функциональное значение этих рецепторов нуждается в дальнейшем исследовании.
Фото-нейроэндокринные связи у рыб. Информация об интенсивности света может достигать гипофиза непосредственно через гормональный мессенджер МТ и МТ рецепторы гипофиза. Ключевыми компонентами являются преоптическая область, супрахиазматическое ядро гипоталамуса, латеральное туберальное ядро и вентромедиальное ядро таламуса. Эти структуры получают информацию как эндокринной, так и в некоторых случаях нервной систем (либо из сетчатки, либо из эпифиза). В свою очередь, преоптическая область и гипоталамические нейроны посылают проекции в гипофиз, причем дофамин и пептиды, высвобождаемые из их терминалей, регулируют функцию гипофиза. К последним относятся пептид, активирующий аденилатциклазу гипофиза (PACAP), NPY, рилизинг-гормон роста (GHRH), кортикотропин-рилизинг-гормон (CRH) и гонадотропин-рилизинг-гормоны (GnRHs). Также показано, что преоптическая область и гипоталамические нейроны могут воздействовать на светочувствительные органы, включая нейроны GnRH, которые иннервируют как сетчатку, так и эпифиз, а также нейроны NPY и GHRH, которые иннервируют эпифиз [4].
ЭФФЕКТЫ МЕЛАТОНИНА
Как указывалось выше, МТ принимает участие в регуляции целого ряда биологических процессов у рыб. Кроме того, гормон участвует в работе иммунной системы и смолтификации у лососевых, а также влияет на гипофиз, щитовидную железу, в том числе на уровень T4 и T3, надпочечники и почки, оказывает антиоксидантное действие и седативный эффект [4, 5, 7, 11, 13, 14, 44].
Репродукция. Влияние фотопериода и МТ на процессы размножения у рыб изучено наиболее подробно, что вызвано главным образом требованиями аквакультуры [2, 32, 45]. При изучении влияния МТ на сезонный цикл размножения рыб использовали варьирование фотопериода, пинеалэктомию и/или введение МТ [4, 46]. Впервые влияние МТ на репродуктивную функцию рыб в условиях in vitro было доказано при исследовании обыкновенного крокера Micropogonias undulatus [47]. В этих опытах низкие концентрации МТ стимулировали высвобождение лютеинизи́рующего гормо́на в культуре из клеток гипофиза у рыб с полностью развитыми гонадами. В условиях in vivo МТ, введенный в промежуточный мозг, вызывал значительное повышение уровня лютеинизирующего гормона в плазме в конце фотофазы цикла день–ночь, что свидетельствовало о вовлечении гипофиза.
Позднее было показано, что пинеалэктомия ускоряет развитие гонад у канального сомика Ictalurus punctatus, сома мешкожаберного Heteroclitus fossilis и змееголова чана Channa punctatus, но не оказывает влияния на эти процессы у трехиглой колюшки, астинакса мексиканского Astyanax mexicanus, фундулюса Fundulus heteroclitus и золотой рыбки. Эффекты пинеалэктомии зависят от репродуктивной фазы, как это наблюдается у клариевого сома Clarias batrachus, сома мешкожаберного и змееголова чана [11]. Ежедневное введение МТ большому индийскому карпу в дозе 100 мкг/100 г массы тела в течение 20 сут вызывает ускоренный рост ооцитов в период подготовительной фазы и замедленный – в период преднерестовой и нерестовой фаз [15]. Эффекты МТ зависят не только от стадии развития гонад, но и от дозы [48]. У данио-рерио помимо участия в регуляции вителлогенеза, увеличении гонадо-соматического индекса, продукции икры и рецепторов эстрадиола в печени, МТ увеличивает транскрипцию генов кисспептинов (KISS1, KISS2), гонадотропин-рилизинг-гормона (GnRH3) в мозге и гипофизе [49]. Имплантаты МТ снижают экспрессию мРНК В-субъединицы лютеинизирующего и фолликулостимулирующего гормонов (LHb, FSHb) у европейского угря Anguilla anguilla [50].
Также доказана важная роль МТ в регуляции темпов созревания тестикул. У большого индийского карпа отмечено их преждевременное созревание как у рыб, получавших МТ, так и у рыб, подвергшихся воздействию постоянной темноты на подготовительной фазе, а также снижение темпов их созревания в период преднерестовой и нерестовой фаз [51]. Введение МТ (50 и 250 мг/кг рациона) самцам большеголового сома Clarias macrocephalus, находящихся на первой стадии полового созревания, значительно ускоряет темпы созревания тестикул и сперматозоидов [52]. Кроме того, МТ вызывает снижение экспрессии в плазме европейского угря 11-кетотестостерона [50] и вызывает изменения в уровнях мРНК генов кисспептина и гонадотропин-рилизинг-гормона, которые, по-видимому, отражают нарушения сперматогенеза [53].
МТ может ускорять созревание гонад через ось гипофиз-гипоталамус-гонады и тем самым влиять на сезонный цикл размножения рыб. Выявлены вариации в течение суток экспрессии гонадотропин-релизинг гормонов GnRH-1, GnRH-3 и нескольких их рецепторов (dlGnRHR-II-1c, -2a) в мозге самцов обыкновенного лаврака. Важно, что МТ влияет на экспрессию рецепторов GnRH-1, GnRH-3 и GnRH подтипов 1c, 2a и 2b лишь в ночной период [54]. Кроме того, введение МТ оказывает ингибирующее влияние на репродуктивную функцию, увеличивая экспрессию мРНК тирозин-гидроксилазы мозга, контролирующей у европейского угря секрецию лютеинизирующего гормона и фолликулостимулирующего гормона и ограничивающей в определенных областях мозга скорость синтеза дофамина [50]. Частичный контроль развития гонад взаимодействиями в системе МТ–дофамин подтвержден при исследовании самцов хризиптеры сапфирной Chrysiptera cyanea [55]. Однако введение МТ обыкновенному карпу приводит к увеличению концентрации дофамина в гипоталамусе только в летнем эксперименте [56].
Иммунная система. Сезонность влияет на иммунитет у рыб, включающий изменения в титре покоящихся антител и ответ на антигенную стимуляцию, лимфоидную систему, количество циркулирующих лимфоцитов, активность лизоцима и количество клеток красной и белой крови [7]. МТ влияет на развитие тимуса и селезенки, являющиеся основными органами иммунной системы, а наличие рецепторов МТ (MT1 и MT2) на лейкоцитах предполагает их функциональную роль в иммунитете [4]. У змееголова чана МТ модулирует активность фагоцитов селезенки через мембранный рецептор, связанный с путем цАМФ-ПКА, а именно протеинкиназу А [57]. Доказаны стимуляция МТ лейкоцитов, дозозависимое уменьшение их хемотаксиса к хемокиновым рецепторам (интегральным мембранным белкам, специфически связывающих и реагирующих на цитокины семейства CXC-хемокинов), ингибирование их апоптоза in vitro, а также уменьшение количества нейтрофилов при экспериментальном перитоните in vivo у обыкновенного карпа [58]. МТ влияет на экспрессию генов prl, gh и pomc. Два первых участвуют в контроле иммунитета у рыб, а третий кодирует белок-предшественник активных пептидов, включая α- и β-меланоцит-стимулирующий гормон, АКТГ и β-эндорфин, контролирующие не только стресс и питание, но и иммунитет [4]. Вместе с тем проблемы, касающиеся влияния МТ на иммунную систему рыб, нуждаются в детальном исследовании.
Антиоксидантная система. Известно, что инъекции МТ золотым рыбкам, подверженным тепловому стрессу (30°C), увеличивают уровень экспрессии и активность антиоксидантных ферментов – супероксиддисмутазы, каталазы и лизоцима, усиливая иммунную систему [14]. У большого индийского карпа МТ (100 мкг/100 г массы тела в день), вводимый в течение 2 нед в период роста фолликулов, действует как антиоксидант, снижая окислительный стресс. Наблюдается значительное повышение уровней супероксиддисмутазы, каталазы, глутатионпероксидазы, глутатион-S-трансферазы и глутатиона, а также снижение уровня малонового диальдегида [15].
Водно-солевой баланс. Локализация сайтов, связывающих МТ, в тканях осморегуляторных органов рыб, таких как жабры, кишечник и почки, позволяет предположить возможную взаимосвязь МТ и водно-солевого баланса [43]. Соленость воды по-разному влияет на содержание МТ в разных органах обыкновенного лаврака. Максимальный уровень МТ и связывающих его сайтов наблюдается в tectum opticum и нейрональной сетчатке при минимальной, а в жабрах и кишечнике – при максимальной солености [59]. Следовательно, не только эпифиз, но и другие ткани могут способствовать изменению уровня МТ в плазме в ответ на изменение солевого состава воды.
Рост. Рост у многих видов рыб в значительной мере зависит от продолжительности светового дня [4, 7]. Показано, что рост, потребление пищи и пищеварение связаны со специфическими поведенческими ритмами и размножением, а контролирует эти процессы эпифиз, продуцирующий МТ [4, 32, 60]. Однако результаты, касающиеся влияния МТ на массу тела и скорость роста, противоречивы. Так, внутрибрюшинное введение МТ золотым рыбкам при коротком фотопериоде в течение нескольких дней ускоряет увеличение массы тела и роста, а МТ имплантаты увеличивают массу тела у атлантического лосося Salmo salar, но снижают массу тела и скорость роста у форели [см.: 4]. МТ (25 мкг/л в течение 21 сут.) снижает удельную скорость роста на фоне увеличения концентрации белка и снижения уровня триглицеридов и холестерола в сыворотке крови нильской тилапии Oreochromis niloticus [61]. Содержание липидов в мышцах данио-рерио под влиянием хронического действия МТ также снижается. В печени МТ снижает экспрессию гена инсулиноподобного фактора роста I (IGF-I), участвующего в процессах роста и других сигналов, связанных с метаболизмом липидов, таких как рецепторы, активируемые пероксисомными пролифераторами (PPARα, β и γ), и стериновый регуляторный элемент, связывающий белок (SREBP) [62].
Поскольку хроническое введение МТ значительно уменьшает норадренергический обмен и повышает содержание дигидроксифенилуксусной кислоты в гипоталамусе золотых рыбок, без значимых изменений в уровне NPY в гипоталамусе и лептина в плазме, было высказано предположение, что он частично влияет на энергетический баланс посредством взаимодействия с гипоталамической катехоламинергической системой [63]. Действительно, хроническое (10 сут) внутрибрюшинное введение МТ рыбам этого вида уменьшает прирост массы тела и удельную скорость роста на 74 и 76% соответственно. При этом уменьшаются запасы мышечного гликогена и увеличивается мобилизация липидов. Было высказано предположение, что МТ может частично влиять на энергетический баланс у рыб посредством взаимодействия с гипоталамической катехоламинергической системой [64]. В условиях in vitro физиологические концентрации МТ дозозависимо повышают уровень гормона роста в гипофизе. При этом в ряде случаев стимуляция секреции гормона роста под влиянием МТ может сопровождаться индукцией ингибирования высвобождения его антагониста – пролактина [65]. В дополнение к прямому действию на гипофиз МТ может модулировать питание и рост рыб, контролируя выработку релизинг- и ингибирующих факторов нейронами из преоптической зоны и ядер гипоталамуса. Особенно важен синергетический эффект доступности еды и продолжительности светового времени суток [4]. Взаимодействие МТ с другими гормонами подтверждается данными о том, что в период смолтификации атлантического лосося при увеличении фотопериода уровень GH в плазме крови увеличивается [66].
Питание. В ряде работ установлено, что введение МТ, как правило, приводит к снижению потребления пищи. Было высказано предположение, что желудочно-кишечный тракт может вносить значительный вклад в уровень периферического МТ у рыб разных видов [4, 7]. Независимость уровня МТ желудочно-кишечного тракта от фотофазы (свет:темнота) позволяет предположить, что важным сигналом для синтеза МТ является доступность пищи [13]. Экспериментальные данные, подтверждающие гипотезу о прямой роли питания и его корреляции с системой МТ желудочно-кишечного тракта рыб, малочисленны. Так, при изучении влияния МТ и его аналога, 2-йодомелатонина, на потребление пищи золотыми рыбками была выявлена зависимость от фотопериода. Интрацеребровентрикулярное введение гормона и его аналога (2–200 и 0.2–200 нг/г массы тела соответственно) не влияет на потребление пищи рыбами, содержавшимися в условиях свет/темнота (12:12) ни в дневное, ни в ночное время. Однако внутрибрюшинные инъекции обоих индоламинов значительно снижают потребление пищи через 2, 5 и 8 ч после введения и в полдень, и в полночь. При этом не наблюдается седативный эффект. Ингибирующее действие МТ блокируется внутрибрюшинным введением его антагониста, лузиндола. По мнению авторов, ингибирующий эффект опосредуется через чувствительные к люзиндолу рецепторы МТ [67]. При исследовании в близких методических условиях (в дневное время) карпа показано, что через 5 и 48 ч после внутрибрюшинного введения МТ (100 нг/г массы тела) скорость пищевой реакции уменьшается в 1.6 и 1.8 раза соответственно. Количество потребляемой пищи наиболее значительно уменьшается через 5 ч после внутрибрюшинного введения гормона в дозах 100 и 200 нг/г массы тела: в 1.4 и 2.2 раза соответственно (собственные неопубликованные данные).
У данио-рерио МТ, растворенный в воде в дозе 100 нмоль/л и 1 мкмоль/л, также через 5 ч значительно снижает потребление пищи по сравнению с контролем, причем в случае большей дозы более, чем в 2 раза по сравнению с контролем. При этом уровень МТ в мозге дозозависимо увеличивается [49].
Кроме того, выявлены различия в эффектах МТ на потребление углеводов, белков и жиров обыкновенным лавраком в капсулах, каждая из которых содержала лишь один источник макроэлементов [63]. МТ (0.1, 0.5 и 2.5 мг/кг массы тела) вводили перорально в капсулах. Днем после потребления рыбами капсул уровень МТ в плазме крови достигал максимума через 45 мин. При максимальной дозе МТ уровень гормона в 26 раз превышал таковой у контрольных особей. Концентрация МТ сохранялась на более высоком уровне, чем ночью, в течение 6 ч, а общее потребление пищи дозозависимо снижалось. Значительно снижалось лишь потребление углеводов. Следовательно, орально вводимый МТ влияет не только на количество потребляемой пищи, но и на избираемость макронутриентов. Поскольку МТ образуется из серотонина, вызывающего у рыб анорексию, авторы подтвердили гипотезу Бубеника и Панга [27], предполагающую существование обратной связи (петли) между МТ и серотонином, которая регулирует аппетит и пищеварение через эндокринные и паракринные процессы в мозге и желудочно-кишечном тракте, с параллельным действием обеих молекул. При этом МТ может имитировать или усиливать насыщающее действие своего предшественника на уровне мозга и/или желудочно-кишечного тракта. Было высказано предположение, что верхний отдел желудочно-кишечного тракта, как и у млекопитающих, в ответ на прием пищи может выделять МТ, действующий в качестве сигнала, регулирующего аппетит, в то время как в нижних отделах он может действовать через рецепторы для синхронизации процессов питания и пищеварения [63].
Кроме того, оценивали влияние внутрибрюшинных инъекций МТ на потребление пищи и двигательную активность у рыб, различающихся по времени пищевой активности – у “дневной” золотой рыбки и “ночного” линя Tinca tinca [68]. Использовали различные условия: постоянный свет или свет/темнота (12:12), введение МТ в середине светлого периода или в середине темного периода, а также после 1-часового светового импульса в середине темного периода. Разовое введение МТ золотой рыбке значительно снижало потребление пищи и двигательную активность. У линя разовое введение МТ снижало потребление пищи и при светлой, и при темной фазе. При этом двигательная активность не изменялась при темной фазе и лишь незначительно увеличивалась при светлой фазе.
При ежедневном введении МТ золотой рыбке в течение 1 нед подавление потребления пищи сохранялось в течение 7 сут. Эти результаты показали, что мелатонин уменьшает потребление пищи у обоих видов, однако его влияние на двигательную активность зависит от времени введения (светлая или темная фаза) и паттерна активности этих видов. Авторы поддерживают идею о том, что эффекты МТ на питание и двигательную активность рыб могут быть независимыми. При этом действие МТ на пищевое поведение у золотой рыбки может быть опосредовано местным действием гормона в желудочно-кишечном тракте, как это предлагается для других животных [69]. Действие МТ на локомоторную активность может быть опосредовано через его действия на циркадианную систему, так как эффекты в большей степени зависят от условий освещения [68].
Помимо этого, МТ действует на активность пищеварительных ферментов. При добавлении в корм не подвергшейся стрессу форели МТ (0.04 г и 0.2 г/кг/день) в течение 10 дней уровень гормона в плазме значительно повышался лишь у рыб, получавших большую дозу гормона. При этом активность амилазы уменьшалась в случае меньшей и увеличивалась в случае большей дозы, активность протеаз также увеличивалась в случае большей дозы, активность липазы не изменялась. У стрессированных рыб характер изменения активности амилазы и протеаз был близок таковому контроля, активность липазы, напротив, увеличивалась во всех вариантах опыта, достоверно при большей дозе гормона [44]. При исследовании карпа было показано, что через 5 ч после внутрибрюшинного введения МТ (100 и 200 нг/г массы тела) активность пептидаз и амилолитическая активность уменьшалась (собственные неопубликованные данные).
Механизмы, опосредующие ингибирующее действие МТ на прием пищи, изучены слабо. Некоторые авторы предполагают, что этот эффект может быть связан с его седативным действием на локомоторное поведение, выявленное у нескольких видов рыб [60, 67, 70, 71]. Снижение потребления рыбами пищи под влиянием МТ связано с изменениями на генном уровне. При исследовании взрослых особей данио-рерио установлено значительное увеличение экспрессии генов, кодирующих молекулы, участвующие в подавлении питания, таких как лептин в печени и кишечнике, а также меланокортиновый рецептор MC4R в печени. Показано, что модуляция экспрессии гена лептина зависит от дозы МТ. Обе дозы МТ (100 нмоль/л и 1 мкмоль/л) вызывали значительное увеличение уровней мРНК лептина по сравнению с контролем, причем наиболее сильный эффект наблюдался при более высокой дозе. Повышение уровня мРНК рецептора MC4R также наблюдалось при более высокой дозе гормона, в то время как более низкая доза не оказывала какого-либо влияния по сравнению с контролем [62].
Кроме того, выявлено значительное снижение основных орексигенных сигналов в мозге. Так, МТ в описанных выше условиях вызывал значительное снижение экспрессии мРНК грелина (более, чем в 2 раза), NPY (примерно в 4 раза) и каннабиноидных рецепторов CB1 (примерно в 6 раз) по сравнению с контролем [49]. Введение в воду эндоканабиноида анандамина вызывало у золотистого спара Sparus aurata увеличение его уровня в мозге и печени почти в 1000 раз. При этом значительно увеличивалось потребление пищи, а также уровня мРНК NPY и каннабиноидных рецепторов CB1 в мозге, а в печени увеличивался не только уровень CB1, но и белка. Эти эффекты ослаблялись под действием AM251 – антагониста CB1. По мнению авторов, полученные результаты свидетельствуют о том, что МТ входит в сложную сеть сигналов, регулирующих потребление пищи и играющих ключевую роль в центральной и периферической регуляции аппетита [71].
МЕХАНИЗМЫ УЧАСТИЯ МТ В РЕГУЛЯЦИИ ЦИКЛА БОДРСТВОВАНИЕ–СОН
Твердо установлено, что регуляция цикла бодрствование–сон у млекопитающих находится под контролем циркадианных “биологических часов” организма, главная роль в которых принадлежит МТ. При этом большое значение придается системе гипокретин/орексин (HCRT). Орексиновые нейроны гипоталамуса млекопитающих тесно переплетаются и взаимодействуют с морфологически сходными клетками, содержащими меланинконцентрирующий гормон (MCH) и образующими взаимоперекрывающиеся проекции в кору больших полушарий, гиппокамп, миндалину, nucleus accumbens, сам гипоталамус, таламус, вентральную область покрышки, синее пятно и ядра шва. Распределение рецепторов MCH в мозге соответствует распределению рецепторов орексина, причем система MCH является тормозной, реципрокной по отношению к нейронам орексина (см. [72]).
При исследовании рыб также показано, что наиболее важную роль в регуляции сна играет МТ [6]. У личинок и взрослых особей данио-рерио МТ вызывает сон, снижая их двигательную активность и повышая порог возбуждения. Так, добавление МТ в воду подавляет двигательную активность личинок рыб на 50% [60], воздействуя на его рецепторы [70]. При этом выявлены взаимодействия между МТ и гипокретин/орексиновой системой [6]. На примере этого же вида показано, что перфузируемый HCRT вызывает выделение МТ в культивируемых эпифизах. Предполагается, что HCRT может модулировать выработку МТ у рыб ночью и консолидировать сон. Использование сверхэкспрессии HCRT и активации HCRT-экспрессирующих нейронов позволило обнаружить, что для HCRT-индуцированного возбуждения важен норэпинефрин [73]. У этого же вида рыб сверхэкспрессия NPY увеличивает сон, в то время как мутация NPY или абляция экспрессирующих NPY нейронов – снижают. Анализ архитектуры сна показал, что NPY регулирует сон, в первую очередь модулируя продолжительность периода бодрствования. При этом NPY способствует сну, ингибируя норадренергическую передачу сигналов [74]. Эти данные свидетельствуют о том, что в регуляции цикла бодрствование–сон у рыб важную роль играет взаимодействие МТ не только с нейротрансмиттерами, но и гормонами.
Анализ функций эпифиза у животных, относящихся к разным таксономическим группам, позволил предположить, что на ранних этапах эволюции пинеальный орган действовал как интерфейс между окружающей средой и центральной нервной системой для контроля и синхронизации циркадианных и цирканных ритмов различных функций организма в синергии с суточными и сезонными изменениями фотопериода, а также температуры. В ходе эволюции происходило постепенное снижение фоторецептивной функции и параллельное увеличение его нейроэндокринной функции. У млекопитающих эпифиз полностью потерял функцию фоторецептора и стал неотъемлемым компонентом сложной системы часов, ответственной за интеграцию и координацию широкого спектра физиологических процессов [11].
ЗАКЛЮЧЕНИЕ
Существуют как сходство, так и различия механизмов восприятия света рыбами и млекопитающими. Системы восприятия света у тех и других включают сетчатку и эпифиз, а также фоторецепторы в глубине мозга. Кроме того, близки молекулярные механизмы синтеза МТ, типов рецепторов, а также функций МТ. МТ, будучи главным эндогенным синхронизатором физиологических процессов, адаптирующих их к условиям окружающей среды, играет ключевую роль в регуляции различных функций не только у млекопитающих, но и у рыб. Вместе с тем организация циркадианной системы у рыб отличается от таковой млекопитающих. У рыб эпифиз и парапинеальный орган образуют шишковидный комплекс. Млекопитающие обладают только эпифизом. Фоторецепторные клетки шишковидного органа рыб у млекопитающих представлены пинеалоцитами шишковидной железы, утратившими фотопигменты и способность непосредственно обнаруживать свет. У рыб функции эпифиза шире, чем у млекопитающих, поскольку включают систему контроля между окружающей средой и центральной нервной системой, обеспечивающей синхронизацию функций организма с суточными и сезонными изменениями фотопериода. У млекопитающих эпифиз функционирует как эндокринная железа и является компонентом часов, ответственных за интеграцию и координацию физиологических процессов.
Список литературы
Чернышева М.П. Гормоны животных. Введение в физиологическую эндокринологию. СПб: Глаголь. 1995 [Chernysheva M.P. Gormony zhivotnyh. Vvedenie v fiziologicheskuyu endokrinologiyu [Animal hormones. Introduction to physiological endocrinology]. SPb: Glagol. 1995 (in Russ)].
Maitra S.K., Seth M., Chattoraj A. Photoperiod, pineal photoreceptors and melatonin as the signal of photoperiod in the regulation of reproduction in fish. J. Endocrinol. Reprod. 10 (2): 73–87. 2006.
Беспятых А.Ю., Бродский В.Я., Бурлакова О.В., Голиченков В.А., Вознесенская Л.А., Колесников Д.Б., Молчанов А.Ю., Рапопорт С.И. Мелатонин: теория и практика (Ред. С.И. Рапопорт, В.А. Голиченков). М.: ИД “МЕДПРАКТИКА – М. 2009 [Bespyatyh A.Yu., Brodskij V.YA., Burlakova O.V., Golichenkov V.A., Voznesenskaya L.A., Kolesnikov D.B., Molchanov A.Yu., Rapo-port S.I. Melatonin: teoriya i praktika. Red. S.I. Rapoport, V.A. Golichenkov [Melatonin: Theory and Practice. Eds. S.I. Rapoport, V.A. Golichnikov]. M.: “MEDPRAKTIKA – M”. 2009 (in Russ)].
Falcón J., Migaud H., Muñoz-Cueto J.A., Carrillo M. Current knowledge on the melatonin system in teleost fish. Gener. Comp. Endocrinol. 165 (3): 469–482. 2009.
Acuña-Castroviejo D., Escames G., Venegas C., Díaz-Casado M.E., Lima-Cabello E., López L.C., Rosales-Corral S., Tan D.X., Reiter R.J. Extrapineal melatonin: sources, regulation, and potential functions. Cell. Mol. Life Sci. 71: 2997–3025. 2014.
Zhdanova I.V. Sleep and its regulation in zebrafish. Rev. Neurosci. 22: 27–36. 2011.
Ngasainao M.R., Lukram I.M. A Review on Melatonin and its Prospects in Fish. Aquacult. Res. Rev.: J. Zool. Sci. 4 (3): 34–41. 2016.
Lerner A.B., Case J.D. Takahashi Y., Lee T.H., Mori W. Isolation of melatonin, the pineal gland factor that lightens melanocytes. J. Am. Chem. Soc. 80 (10): 2587–2587. 1958.
Tan D.X., Manchester L.C. Terron M.P., Flores L.J., Reiter R.J. One molecule, many derivatives: a never-ending interaction of melatonin with reactive oxygen and nitrogen species? J. Pineal Res. 42 (1): 28–42. 2007.
Bubenik A.G. Gastrointestinal melatonin: localization, function, and clinical relevance. Digest. Disease Sci. 47: 2336–2348. 2002.
Gupta B.B.P. Comparative endocrinology of the pineal organ: Structural evolution, regulation and function. Updates on Integrative Physiology and Comparative Endocrinology (Eds.Ch. Haldar, S. Gupta, S. Goswami). Varanasi: Publication Cell, Press and Publication Division Banaras Hindu University. 297–328. 2016.
Porter M.J.R., Duncan N.J., Mitchell D., Bromage N.R. The use of cage lighting to reduce plasma melatonin in Atlantic salmon (Salmo salar) and its effects on the inhibition of grilsing. Aquacult. 176: 237–244. 1999.
Herrero M.J., Martínez F.J., Míguez J.M., Madrid J.A. Response of plasma and gastrointestinal melatonin, plasma cortisol and activity rhythms of European sea bass (Dicentrarchus labrax) to dietary supplementation with tryptophan and melatonin. J. Comp. Physiol. 177B: 319–326. 2007.
Jung S.J., Choi Y.J., Kim N.N., Choi J.Y., Kim B.S., Choi C.Y. Effects of melatonin injection or green-wavelength LED light on the antioxidant system in goldfish (Carassius auratus) during thermal stress. Fish Shellfish Immunol. 52: 157–166. 2016.
Mondal P., Hasan K.N., Pal P.K., Maitra S.K. Influences of exogenous melatonin on the oocyte growth and oxidative status of ovary during different reproductive phases of an annual cycle in carp Catla catla. Triogenol. 1–16. 2016.
Moore R.Y., Speh J.C., Leak R.K. Suprachiasmatic nucleus organization. Cell Tissue Res. 309: 89–98. 2002.
Арушанян Э.Б., Батурин В.А., Попов А.В. Супрахиазматическое ядро гипоталамуса как регулятор циркадианной системы млекопитающих. Усп. физиол. наук. 19 (2): 67–87. 1988. [Arushanian E.B., Baturin V.A., Popov A.V. The suprachiasmatic nucleus of the hypothalamus as a regulator of the circadian system of mammals. Usp Fiziol Nauk. 19 (2): 67–87. 1988 (in Russ)].
Simonneaux V., Ribelayga C. Generation of the melatonin endocrine message in mammals: A review of the complex regulation of melatonin synthesis by norepinephrine, peptides, and other pineal transmitters. Pharmacol. Rev. 55: 325–395. 2003.
Cahill G.M., Besharse J.C. Ciradian rhythmicity in vertebrate retinas: Regulation by a photoreceptor Oscillator. Prog. Ret. Eye Res. 14: 267–291. 1995.
Falcón J., Besseau L., Sauzet S., Bœuf G. Melatonin effects on the hypothalamo- pituitary axis in fish. Trends Endocrinol. Metab. 18: 81–88. 2007.
Falcón J. Cellular circadian clocks in the pineal. Prog. Neurobiol. 8: 121– 162. 1999.
Fernández-Durán B., Ruibal C., Polakof S., Ceinos R.M., Soengas J.L., Míguez J.M. Evidence for arylalkylamine N-acetyltransferase (AANAT2) expression in rainbow trout peripheral tissues with emphasis in the gastrointestinal tract. Gen. Comp. Endocrinol. 152 (2–3): 289–294. 2007.
Kulczykowska E., Kleszczyńska A., Gozdowska M., Sokołowska E. The time enzyme in melatonin biosynthesis in fish: Day/night expressions of three aralkylamine N-acetyltransferase genes in three-spined stickleback. Comp. Biochem. Physiol. 208A: 46–53. 2017.
Migaud H., Taylor J.F., Taranger G.L., Davie A., Cerda Hansen T., Bromage N.R. A Comparative Ex Vivo and in Vivo Study of Day and Night Perception in Teleosts Species Using the Melatonin Rhythm. J. Pineal Res. 41: 42–52. 2006.
Max M., Menaker M. Regulation of melatonin production by light, darkness, and temperature in the trout pineal. J. Comp. Physiol. 170 (A): 479–489. 1992.
Bolliet V., Ali M.A., Lapointe F.J., Falcón J. Rhythmic Melatonin Secretion in Different Teleost Species: an in vitro Study. J. Comp. Physiol. 165 (B): 677–683. 1996.
Bubenik G.A., Pang S.F. The role of serotonin and melatonin in gastrointestinal physiology: ontogeny, regulation and food intake, and mutual serotonin-melatonin feedback. J. Pineal Res. 16: 91–99. 1994.
García-Allegue R., Madrid J.A., Sánchez-Vázquez F.J. Melatonin rhythms in European sea bass plasma and eye: influence of seasonal photoperiod and water temperature. J. Pineal. Res. 31 (1): 68–75. 2001.
Boeuf G., Le Bail P-Y. Does light have an influence on fish growth? Aquacult. 177: 129–152. 1999.
Brüning A., Hölker F., Franke S., Kleiner W., Kloas W. Influence of light intensity and spectral composition of artificial light at night on melatonin rhythm and mRNA expression of gonadotropins in roach Rutilus rutilus. Fish Physiol. Biochem. 44 (1): 1–12. 2018.
Sanjita Devi H., Rajiv C., Mondal G., Khan Z.A. Dharmajyoti Devi S., Yumnamcha T., Bharali R., Chattoraj A. Melatonin bio-synthesizing enzyme genes (Tph1, Aanat1, Aanat2, and Hiomt) and their temporal pattern of expression in brain and gut of a tropical carp in natural environmental conditions. Cogent Biol. 2: 123–337. 2016.
Maitra S.K., Mukherjee S., Hasan K.N. Melatonin: Endogenous sources and role in the regulation of fish reproduction. In: Indoleamines (Ed. Á.Catalá). Ch. 2. Hauppauge, New York: Nova Science Publishers, Inc. 43–77. 2015. https://www.researchgate.net/publication/282097816
Cahill G.M. Circadian Regulation of Melatonin Production in Cultured Zebrafish Pineal and Retina. Brain Res. 708: 177–181. 1996.
Iigo M., Furukawa K., Hattori A., Ohtani-Kaneko R., Hara M., Suzuki T., Tabata M., Aida K. Ocular Melatonin Rhythms in the Goldfish, Carassius auratus. J. Biol. Rhythms. 12: 182–192. 1997.
Besseau L., Benyassi A., Moller M., Coon S.L., Weller J.L., Boeuf G., Klein D.C., Falcón J. Melatonin pathway: breaking the ‘high-at-night’ rule in trout retina. Exp. Eye Res. 82: 620–627. 2006.
Iigo M., Sanchez-Vasquez F. J., Madrid J.A., Zamora S., Tabata M. Unusual Responses to Light and Darkness of Ocular Melatonin in European Sea Bass. Neuroreport. 8: 1631–1635. 1997.
Lepage O., Larson E.T., Mayer I., Winberg S. Tryptophan affects both gastrointestinal melatonin production and interrenal activity in stressed and nonstressed rainbow trout. J. Pineal Res. 38: 264–271. 2005.
Mukherjee S., Moniruzzaman M., Maitra S.K. Daily and seasonal profiles of gut melatonin and their temporal relationship with pineal and serum melatonin in carp Catla catla under natural photo-thermal conditions. Biol. Rhythm Res. 45: 301–315. 2014.
Bubenik G.A., Pang S.F. Melatonin levels in the gastrointestinal tissues of fish, Amphibians, and a Reptile. Gen. Comp. Endocrinol. 106: 415–419. 1997.
Sauzet S., Besseau L., Herrera Perez P., Covès D., Chatain B., Peyric E., Boeuf G., Muñoz-Cueto J.A., Falcón J. Cloning and retinal expression of melatonin receptors in the European sea bass, Dicentrarchus labrax. Gen. Comp. Endocrinol. 157: 186–195. 2008.
Lan-Chow-Wing O., Confente F., Herrera-Pérez P., Isorna E., Chereguini O., Rendón Mdel C., Falcón J., Muñoz-Cueto J.A. Distinct expression profiles of three melatonin receptors during early development and metamorphosis in the flatfish Solea senegalensis. Int. J. Mol. Sci. 15 (11): 20789–20799. 2014.
Volkoff H. The Neuroendocrine Regulation of Food Intake in Fish: A Review of Current Knowledge. Front. Neurosci. 10: 540–571. 2016.
Kulczykowska E., Kalamarz H.,Warne J.M., Balment R.J. Day–night specific binding of 2-[125I] iodomelatonin and melatonin content in gill, small intestine and kidney of three fish species. J. Comp. Physiol. 176 (B): 277–285. 2006.
Conde-Sieira M., Muñoz J.L., López-Patiño M.A., Gesto M., Soengas J.L., Míguez J.M. Oral administration of melatonin counteracts several of the effects of chronic stress in rainbow trout. Dom. Anim. Endocrinol. 46: 26–36. 2014.
Mylonas C.C., Fostier A., Zanuy S. Broodstock management and hormonal manipulations of fish reproduction Gen. Comp. Endocrinol. 5 (3): 516–534. 2010.
Mayer I., Bornestaf C., Borg D. Melatonin in non-mammalian vertebrates: physiological role in reproduction? Comp. Biochem. Physiol. 118 (A): 515–531. 1997.
Khan I.A., Thomas P. Melatonin influences gonadotropin II secretion in the Atlantic croaker (Micropogonias undulatus). Gen. Comp. Endocrinol. 104: 231–242. 1996.
Singh T.P., Lal P. Endocrine physiology of reproduction in Indian catfish. In: Advances in Fish Biology (Ed Singh H.R.). Delhi, India: Hindustan Publishing Corporation. 147–154. 1994.
Piccinetti C.C., Migliarini B., Olivotto I., Coletti G., Amici A., Carnevali O. Appetite regulation: The central role of melatonin in Danio rerio. Hormon. Behav. 58: 780–785. 2010.
Sébert M.E., Legros C., Weltzien F.A., Malpaux B., Chemineau P., Dufour S. Melatonin activates brain dopaminergic systems in the eel with an inhibitory impact on reproductive function. J. Neuroendocrinol. 20: 917–929. 2008.
Bhattacharya S., Chattoraj A., Maitra S.K. Melatonin in the regulation of annual testicular events in carp Catla catla: evidence from the studies on the effects of exogenous melatonin, continuous light and continuous darkness. Chronobiol. Int. 24: 629–650. 2007.
Aripin S.A., Jintasataporn O., Yoonpundh R. Effects of exogenous melatonin in Clarias Macrocephalus male broodstock first puberty stage. J. Aquac. Res. Develop. 6: 307–313. 2015.
Alvarado M.V., Carrillo M., Felip A. Melatonin-induced changes in kiss/gnrh gene expression patterns in the brain of male sea bass during spermatogenesis. Comp. Biochem. Physiol. 185 (A): 69–79. 2015.
Servili A., Herrera-Pérez P., del Carmen Rendón M., Muñoz-Cueto J.A. Melatonin Inhibits GnRH-1, GnRH-3 and GnRH Receptor Expression in the Brain of the European Sea Bass, Dicentrarchus labrax. Int. J. Mol. Sci. 14 (4): 7603–7616. 2013.
Badruzzaman M., Bapary M.A., Takemura A. Possible roles of photoperiod and melatonin in reproductive activity via changes in dopaminergic activity in the brain of a tropical damselfish, Chrysiptera cyanea. Gen. Comp. Endocrinol. 194: 240–247. 2013.
Popek W., Luszczek-Trojnar E., Drog-Kozak E., Rzsa J., Epler P. Effect of melatonin on dopamine secretion in the hypothalamus of mature female common carp, Cyprinus carpio L. Acta Ichthyol. Piscat. 36: 134–141. 2006.
Roy B., Singh R., Kumar S., Rai U. Diurnal variation in phagocytic activity of splenic Phagocytes in freshwater teleost Channa punctatus: melatonin and its signaling mechanism. J. Endocrinol. 199 (3): 471–480. 2008.
Kepka M., Szwejser E., Pijanowski L., Verburg-van Kemenade B.M., Chadzinska M. A role for melatonin in maintaining the pro- and anti-inflammatory balance by influencing leukocyte migration and apoptosis in carp. Dev. Comp. Immunol. 53 (1): 179–190. 2015.
López-Olmeda J.F., Oliveira C., Kalamarz H., Kulczykowska E., Delgado M.J., Sánchez- Vázquez F.J. Effects of water salinity on melatonin levels in plasma and peripheral tissues and on melatonin binding sites in European sea bass (Dicentrarchus labrax). Comp. Biochem. Physiol. 152 (A): 486–490. 2009.
Zhdanova I.V., Wang S.Y., Leclair O.U., Danilova N.P. Melatonin promotes sleep-like state in zebrafish. Brain Res. 903: 263–268. 2001.
Singh R., Singh A.K., Tripathi M. Melatonin induced changes in specific growth rate, gonadal maturity, lipid and protein production in Nile tilapia Oreochromis niloticus (Linnaeus 1758). Asian-Australas J. Anim. Sci. 25: 37–43. 2012.
Piccinetti C.C., Migliarini B., Olivotto I., Simoniello M.P., Giorgini E., Carnevali O. Melatonin and Peripheral Circuitries: Insights on Appetite and Metabolism in Danio rerio. Zebrafish. 10 (3): 275–282. 2013.
Rubio V.C., Sánchez-Vázquez F.J., Madrid J.A. Oral administration of melatonin reduces food intake and modifies macronutrient selection in European sea bass (Dicentrarchus labrax, L.). J. Pineal Res. 37 (1): 42–47. 2004.
De Pedro N., Martinez-Alvarez R.M., Delgado M.J. Melatonin reduces body weight in goldfish (Carassius auratus): effects on metabolic resources and some feeding regulators. J. Pineal Res. 45: 32–39. 2008.
Falcón J., Besseau L., Fazzari D., Attia J., Gaildrat P., Beauchaud M., Boeuf G. Melatonin modulates secretion of growth hormone and prolactin by trout pituitary glands and cells in culture. Endocrinol. 144: 4648–4658. 2003.
Volkoff H., Unniappan S., Kelly S.P. The endocrine regulation of food intake. Fish Physiology. Eds N.J. Bernier, G. Van Der Kraak, A.P. Farrell, C.J. Brauner. Cambridge. 28. 421–465. 2009.
Pinillos M.L., De Pedro N., Alonso-Gomez A.L., Alonso-Bedate M., Delgado M.J. Food intake inhibition by melatonin in goldfish (Carassius auratus). Physiol. Behav. 72: 629–634. 2001.
Lopez-Olmeda J.F., Madrid J.A., Sanchez Vazquez F.J. Melatonin effects on food intake and activity rhythms in two fish species with different activity patterns: Diurnal (goldfish) and nocturnal (tench). Comp. Biochem. Physiol. 144 A (2): 180–187. 2006.
Bubenik G.A., Pang S.F., Cockshut J.R., Smith P.S., Grovum L.W., Friendship R.M., Hacker R.R. Circadian variation of portal, arterial and venous blood levels of melatonin in pigs and its relationship to food intake and sleep. J. Pineal Res. 28: 9–15. 2000.
Zhdanova I.V., Geiger D.A., Schwagerl A.L., Leclair O.U., Killiany R., Taylor J.A., Rosene D.L., Moss M.B., Madras B.K. Melatonin promotes sleep in three species of diurnal nonhuman primates. Physiol. Behav. 75: 523–529. 2002.
Piccinetti C.C., Migliarini B., Petrosino S., Di Marzo V., Carnevali O. Anandamide and AM251, via water, modulate food intake at central and peripheral level in fish. Gen. Comp. Endocrinol. 166 (2): 259–267. 2010.
Ковальзон В.М. Центральные механизмы регуляции цикла бодрствование–сон. Физиол. Чел. 2011. Т. 37. № 4. С. 124–134. [Koval’zon V.M. Central mechanisms of sleep-wakefulness cycle. Fiziol. Cheloveka. 37 (4):124–134. 2011 (in Russ)].
Appelbaum L., Wang G.X., Maro G.S., Mori R., Tovin A., Marin W., Yokogawa T., Kawakami K., Smith S.J., Gothilf Y., Mignot E., Mourrain P. Sleep-wake regulation and hypocretin-melatonin interaction in zebrafish. Proc. Nat. Acad. Sci. USA. 106 (51): 21942–21947. 2009.
Singh C., Rihel J., Prober D.A. Neuropeptide Y regulates sleep by modulating noradrenergic signaling. Curr. Biol. 27 (24): 3796–3811. 2017.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


