Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 2, стр. 146-152
ЛОКАЛИЗАЦИЯ 5-HT2C- И 5-HT1B-СЕРОТОНИНОВЫХ РЕЦЕПТОРОВ В ОРЕКСИНЕРГИЧЕСКИХ НЕЙРОНАХ ПЕРИФОРНИКАЛЬНОЙ ОБЛАСТИ ГИПОТАЛАМУСА ГРЫЗУНОВ
И. В. Романова 1, *, И. Ю. Морина 1, А. О. Шпаков 1
1 Федеральное государственное бюджетное учреждение науки
Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: irinaromanova@mail.ru
Поступила в редакцию 01.08.2019
После доработки 25.08.2019
Принята к публикации 26.09.2019
Аннотация
Как орексиновые пептиды, генерируемые из препро-орексина в орексинергических нейронах латерального гипоталамуса и гипоталамической перифорникальной области (PFA), так и серотонин, который поступает в эти области гипоталамуса из окончаний серотонинергических нейронов ядер шва, играют важную роль в регуляции пищевого поведения и циркадных ритмов. Это указывает на тесные взаимосвязи между серотониновой и орексиновой системами в латеральном гипоталамусе/PFA, которые, однако, остаются малоизученными. Цель нашего исследования состояла в иммуногистохимической идентификации и количественной оценке серотониновых рецепторов 2С-подтипа (5-HT2C-СР) и 1B-подтипа (5-HT1B-СР) в орексинергических нейронах PFA гипоталамуса мыши и крысы. Для идентификации орексинергических нейронов использовали иммуногистохимическую реакцию к орексину-А, а для оценки колокализации серотониновых рецепторов и орексина-А было проведено двойное флуоресцентное иммуномечение. С помощью двойного иммуномечения была продемонстрирована колокализация орексина-А и рецепторов 5-HT2C-СР и 5-HT1B-СР в PFA гипоталамуса различных видов грызунов – мышей С57Bl/6J и крыс Wistar. Показано, что все орексинергические нейроны экспрессировали оба типа исследуемых серотониновых рецептора. В то же время только 32–35% рецепторов 5‑HT2C-СР и 5-HT1B-СР были локализованы в орексинергических нейронах, а оставшаяся их часть экспрессировалась в других типах PFA-нейронов. Таким образом, получены иммуногистохимические доказательства регуляции серотонином функциональной активности орексинергических нейронов в PFA гипоталамуса грызунов, и установлено, что эти эффекты серотонина могут реализовываться через 5-HT2C-СР и 5-HT1B-СР.
ВВЕДЕНИЕ
Серотонин (5-гидрокситриптамин, 5-НТ) в латеральном гипоталамусе и перифорникальной области (perifornical area, PFA) гипоталамуса играет важную роль в регуляции аппетита и циркадных ритмов. Ослабление серотонинергической передачи сигнала в латеральном гипоталамусе и PFA вследствие ожирения, развивающегося в период полового созревания, в дальнейшем приводит к изменениям пищевого поведения и нарушениям регуляции сна и бодрствования [1]. Среди факторов, которые экспрессируются в нейронах латерального гипоталамуса и PFA, и подобно серотонину участвуют в регуляции аппетита и циркадных ритмов, ключевая роль принадлежит пептидам орексинового семейства, образующихся вследствие сайт-специфичного протеолиза из молекулы препро-орексина [2, 3]. Доминирующей и наиболее функционально важной формой среди орексиновых пептидов является орексин-А, который специфично связывается с обоими типами орексиновых рецепторов OX1R и OX2R, вызывает их активацию и тем самым осуществляет контроль систем подкрепления и вознаграждения и регулирует периферический глюкозный и энергетический обмен [4, 5].
Имеются основания считать, что между серотониновой и орексиновой системами в латеральном гипоталамусе и PFA имеются тесные взаимосвязи, которые включают регуляторное влияние серотонина на функциональную активность орексинергических нейронов и на продукцию ими орексиновых пептидов [6, 7]. Сравнительно недавно с помощью иммуногистохимического подхода были выявлены контакты между проекциями серотонинергических нейронов ядра шва и орексинергическими нейронами латерального гипоталамуса и показано, что серотонин влияет на функциональную активность орексинергических нейронов [8]. Результаты электрофизиологических экспериментов демонстрируют способность серотонина подавлять активность орексинергических нейронов через активацию метаботропных серотониновых рецепторов 1А-подтипа (5-HT1A-СР), функционально сопряженных с Gi/o-белками, в латеральном гипоталамусе [9, 10]. С помощью иммуногистохимических методов на поверхности орексинергических нейронов в латеральном гипоталамусе мыши были выявлены и охарактеризованы 5‑HT1A-СР и ионотропные 5-HT3A-СР, а также идентифицированы 5-HT1B-СР и 5-HT2C-СР [11]. Однако локализация серотониновых рецепторов, в том числе 5-HT1B-СР и 5-HT2C-СР, в орексинергических нейронах в PFA гипоталамуса до настоящего времени не была изучена.
Цель нашего исследования состояла в иммуногистохимической идентификации и количественной оценке нейронов PFA гипоталамуса мыши и крысы, которые экспрессируют 5-HT2C-СР и 5‑HT1B-СР. Выбор этих рецепторов обусловлен тем, что, согласно данным литературы и нашим результатам, Gq/11-сопряженный 5-HT2C-СР и Gi/o-сопряженный 5-HT1B-СР играют ключевую роль в реализации регуляторных эффектов серотонина на пищевое поведение и цикл сон–бодрствование. Нарушение функций этих рецепторов может приводить к гиперфагии, ожирению и метаболическому синдрому [12–14]. Орексинергические нейроны идентифицировали по положительной иммуногистохимической реакции к орексину-А, основному пептиду орексинового семейства, образуемому из препро-орексина, экспрессируемого в этих нейронах.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В экспериментах использовали половозрелых самцов мышей линии С57Bl/6J (масса 20–22 г, n = 4) и самцов крыс линии Wistar (масса 200–220 г, n = 4). После наркоза хлоралгидратом (400 мг/кг) животные были перфузированы транскардиально сначала 0.1 М Na+-фосфатным буфером (pH 7.4) и затем 4%-ным раствором пара-формальдегида в 0.2 М Na+-фосфатном буфере. Мозг фиксировали в течение ночи (4°С) в том же растворе пара-формальдегида, промывали буфером и после криопротекции в 30%-ном растворе сахарозы замораживали в изопентане при –42°С. С помощью криостата (“Leika Microsystems”, Германия) из области гипоталамуса получали чередующиеся серии фронтальных срезов (16 мкм), каждый десятый срез монтировали на стеклах Superfrost/Plus, высушивали при комнатной температуре и хранили при –20°С. Для исследования отбирали стекла со срезами, включающими PFA гипоталамуса, согласно атласу мозга крысы и мыши [15, 16].
Двойное иммуномечение проводили в соответствии с ранее описанным протоколом [14]. После демаскировки антигена кипячением в Na+-цитратном буфере (рН 6.0) срезы тщательно промывали в 0.02 М Na+-фосфатном буфере (рН 7.4) и блокировали в смеси сывороток козы (3%) и быка (2%), растворенных в том же буфере, но содержащем 0.01% Triton X-100. Затем срезы инкубировали в течение 48 ч (4°C) с первичными антителами. Для иммуногистохимической реакции использовали смесь первичных антител мыши против орексина-А (“R&D Systems”, США) в разведении 1:1000 с антителами кролика против 5-HT2C-СР (“Elabscience Biotechnology Ltd.”, США) или против 5-HT1B-СР (“USBiological”, США) в разведении 1:200. После тщательной промывки срезы инкубировали в течение 1 ч в коктейле вторичных антител, конъюгированных с различными флуоресцентными метками – осла против мыши с Alexa-568 и козы против кролика с Alexa-488 (“Invitrogen”, США) в разведении 1:1000. После промывки в Na+-фосфатном буфере на срезы на 2 мин наносили ядерный краситель DAPI (“Sigma”, США) в разведении 1:2000, после чего срезы тщательно промывали и заключали под покровное стекло с помощью среды мовиол (“Sigma”, США) и хранили при 4°C до ее полимеризации. Специфичность реакции проверяли с помощью негативного контроля (реакции без первичных и без вторичных антител). Анализ срезов проводили с помощью микроскопа DMI6000 и лазерной сканирующей конфокальной установки TCS SP5-II (“Leiсa Microsystems”, Германия). Последовательное сканирование проводили с помощью иммерсионного объектива × 63, лазеров с длиной волны возбуждения 488 и 568 нм, также был использован режим проходящего света, позволяющий оценить локализацию рецепторов в клетке. Изображения анализировали с помощью пакета программ “Leica LAS AF”. Срезы с DAPI анализировали с помощью микроскопа Carl Zeiss Axio Imager A1 с флуоресцентной установкой (HB-100). Серии снимков стандартной площадью 137 × 102 мкм.получали с помощью иммерсионного объектива × 100. В PFA гипоталамуса у каждого животного определяли общее число 5-HT2C-СР- или 5-HT1B-СР-иммунопозитивных нейронов, а также число орексин-А-иммунопозитивных клеток, колокализованых с 5-HT2C-СР- или 5-HT1B-СР. Подсчитывали среднее значение (в %) орексин-А-иммунопозитивных и орексин-А-иммунонегативных клеток, колокализованных с 5-HT2C-СР- или 5-HT1B-СР, от общего числа клеток, экспрессирующих 5-HT2C-СР- (100%) или 5-HT1B-СР (100%).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
С использованием иммуногистохимических методов в PFA гипоталамуса самцов мышей линии С57Bl/6J были выявлены тела и отростки нейронов, иммунопозитивных по отношению к пептидному нейрогормону орексину-А, основному маркеру орексинергических нейронов, и к серотониновым рецепторам 5-HT2C-СР и 5-HT1B-СР, которые широко представлены и в других гипоталамических структурах. С помощью техники двойного иммуномечения было показано, что оба типа исследуемых серотониновых рецепторов локализованы в телах орексин-А-иммунопозитивных иммунопозитивных нейронов (рис. 1). Это указывает на то, что 5-HT2C-СР и 5‑HT1B-СР способны экспрессироваться в орексинер-орексинергических нейронах PFA гипоталамуса мыши и тем самым могут опосредовать регуляторные эффекты серотонина на их функциональную активность, в том числе на синтез и секрецию ими препро-орексина, предшественника пептидов орексинового семейства. Нами также установлено, что оба типа исследуемых серотониновых рецепторов (анализ флуоресцентных снимков с DAPI) локализованы не только в телах орексин-А-иммунопозитивных, но и в телах нейронов другой эргичности в PFA, в которых орексин-А не экспрессируется (рис. 1, 2).
Рис. 1.
Иммуногистохимическая реакция к орексину-А и серотониновым рецепторам 2С-подтипа и 1B-подтипа в перифорникальной области гипоталамуса мыши.
Микрофотографии демонстрируют иммуногистохимические реакции к 5-HT2C-СР (а), орексину-А (б, д), 5-HT1B-СР (г), наложение орексина-А и 5-HT2C-СР (в) или 5-HT1B-СР (е). Сплошные стрелки указывают на 5-HT2C-СР и 5-HT1B-СР, локализованные в орексин-А-иммунопозитивных нейронах; прерывистые стрелки указывают на локализацию серотониновых рецепторов в нейронах другой эргичности. Масштаб 20 мкм.
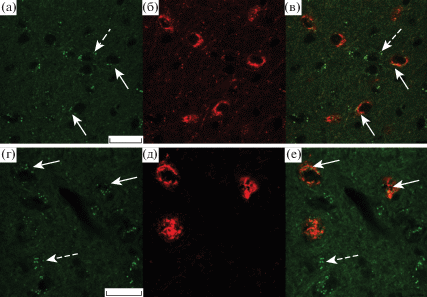
Рис. 2.
Двойное иммуномечение орексина-А и серотониновых рецепторов 5-HT2C-подтипа (а) и 5-HT1B-подтипа (б) в перифорникальной области гипоталамуса мыши.
Сплошные стрелки указывают на серотониновые рецепторы, локализованные в орексин-А-иммунопозитивных нейронах, прерывистые стрелки указывают на серотониновые рецепторы, расположенные в нейронах другой эргичности. Масштаб 10 мкм.
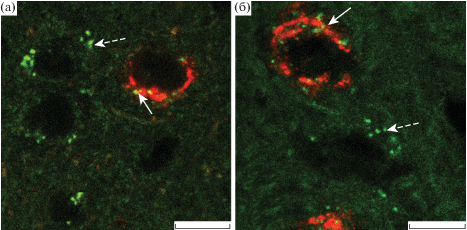
Проведенный нами количественный анализ показал, что орексин-А-иммунопозитивные нейроны составляют около 34% от общего числа 5-HT2C-СР-иммунопозитивных нейронов и около 32% от общего числа 5-HT1B-СР-иммунопозитивных нейронов в PFA гипоталамуса мыши. Это указывает на то, что только около одной трети 5-HT2C-СР и 5-HT1B-СР колокализованы с орексином-А и, следовательно, вовлечены в регуляцию активности орексинергических нейронов. При этом оба типа исследуемых серотониновых рецепторов экспрессируются во всех нейронах, иммунопозитивных к орексину-А (рис. 2). Это позволяет сделать следующие заключения. Во-первых, в PFA гипоталамуса мыши серотонин контролирует активность множества популяций нейронов, продуцирующих различные нейромедиаторы и нейрогормоны, что хорошо согласуется с важной ролью серотонина в обеспечении взаимодействия и интеграции нейрональных сетей в латеральном гипоталамусе и PFA [11, 17, 18]. Во-вторых, серотонин в PFA гипоталамуса мыши является важнейшим регулятором активности орексинергических нейронов, и эта его функция обеспечивается присутствием его рецепторов, в том числе 5-HT2C-СР и 5-HT1B-СР, во всех идентифицированных нами с помощью иммуногистохимических методов орексинергических нейронах.
Присутствие 5-HT2C-СР и 5-HT1B-СР указывает на способность серотонина запускать в орексинергических нейронах сразу несколько сигнальных каскадов, которые могут влиять на экспрессию генов, ответственных за синтез и секрецию препро-орексина, а также модулировать секреторную активность орексинергических нейронов. Так, связывание серотонина с 5-HT2C-СР приводит к активации αq/11-субъединиц Gq/11-белков, вызывая стимуляцию внутриклеточных кальциевых путей и чувствительных к диацилглицерину изоформ протеинкиназы С [19, 20]. В свою очередь при связывании серотонина с 5-HT1B-СР через посредство αi/o-субъединиц Gi/o-белков ингибируется активность фермента аденилатциклазы, что ведет к снижению внутриклеточного уровня цАМФ, а через посредство βγ-димеров, генерируемых при активации Gi/o-белков, стимуляцируются различные типы потенциал-зависимых кальциевых каналов [21, 22]. Наряду с G-белок-зависимыми путями, связывание серотонина с 5-HT2C-СР и 5-HT1B-СР вызывает активацию β-аррестиновых путей, ответственных за стимуляцию митогенактивируемых протеинкиназ и других внутриклеточных эффекторов [23, 24]. Следует отметить, что до настоящего времени молекулярные механизмы, лежащие в основе регуляции продукции и секреции орексиновых пептидов в латеральном гипоталамусе и PFA, а также факторы, ответственные за такую регуляцию, несмотря на исследования в этом направлении, остаются плохо изученными [2, 25–29].
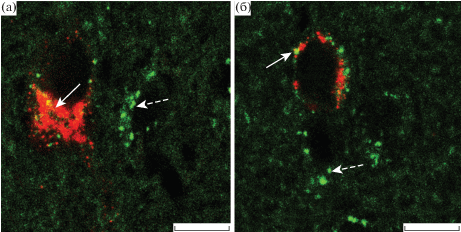
На следующем этапе исследований с помощью двойного иммуномечения было изучено распределение серотониновых рецепторов 5-HT2C-СР и 5-HT1B-СР на орексин-А-иммунопозитивных нейронах в PFA гипоталамуса самцов крыс линии Wistar. Как и в случае мышей, было продемонстрировано, что все орексин-А-иммунопозитивные нейроны PFA проявляют положительную иммуногистохимическую реакцию к серотониновым рецепторам 5-HT2C-СР и 5-HT1B-СР (рис. 3, 4). При этом показано, что орексин-А-иммунопозитивные нейроны составляют около 32% от общего числа 5-HT2C-СР-иммунопозитивных нейронов и около 35% от общего числа 5-HT1B-СР-иммунопозитивных нейронов (рис. 3). Таким образом, как и у мышей, орексинергические нейроны PFA гипоталамуса крысы экспрессируют 5-HT2C-СР и 5-HT1B-СР, которые являются мишенями для серотонина, секретируемого окончаниями серотонинергических нейронов. Проекции серотонинергических нейронов приходят из областей среднего мозга, граничащих с латеральным гипоталамусом и PFA. Полученные данные свидетельствуют об универсальном характере колокализации 5-HT2C-СР и 5-HT1B-СР в орексинергических нейронах PFA у различных видов грызунов. Необходимо подчеркнуть, что в отношении крысы данные по иммуногистохимической колокализации орексина-А и серотониновых рецепторов отсутствуют не только для PFA, но и для латерального гипоталамуса.
Рис. 3.
Иммуногистохимическая реакция к орексину-А и серотониновым рецепторам 2С-подтипа и 1B-подтипа в перифорникальной области гипоталамуса крысы.
Микрофотографии демонстрируют иммуногистохимические реакции к 5-HT2C-СР (а), орексину-А (б, д), 5-HT1B-СР (г), наложение орексина-А и 5-HT2C-СР (в) или 5-HT1B-СР (е). Сплошные стрелки указывают на 5-HT2C-СР и 5-HT1B-СР, локализованные в орексин-А-иммунопозитивных нейронах; прерывистые стрелки указывают на локализацию серотониновых рецепторов в нейронах другой эргичности. Масштаб 20 мкм.
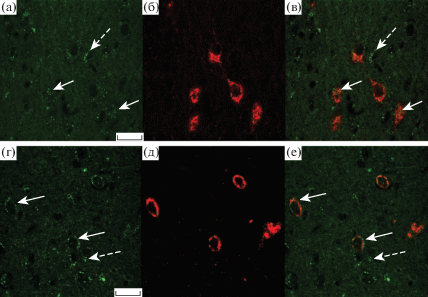
Рис. 4.
Двойное иммуномечение орексина-А и серотониновых рецепторов 5-HT2C-подтипа (а) и 5-HT1B-подтипа (б) в перифорникальной области гипоталамуса крысы.
Сплошные стрелки указывают на серотониновые рецепторы, локализованные в орексин-А-иммунопозитивных нейронах, прерывистые стрелки указывают на серотониновые рецепторы, расположенные в нейронах другой эргичности. Масштаб 10 мкм.
Таким образом, нами впервые с помощью двойного иммуномечения показана колокализация орексина-А и серотониновых рецепторов 5-HT2C-СР и 5-HT1B-СР в PFA гипоталамуса различных видов грызунов – мышей и крыс, что указывает на тесную функциональную взаимосвязь между функциональной активностью орексинергических нейронов и серотониновой сигнальной системой в этой области гипоталамуса и на возможные молекулярные механизмы регуляторного влияния серотонина на физиологические процессы, контролируемые через посредство орексинергических нейронов.
Список литературы
Gazea M., Patchev A.V., Anderzhanova E., Leidmaa E., Pissioti A., Flachskamm C., Almeida O.F.X., Kimura M. Restoring Serotonergic Homeostasis in the Lateral Hypothalamus Rescues Sleep Disturbances Induced by Early-Life Obesity. J Neurosci. 38 (2): 441–451. 2018.
Burt J., Alberto C.O., Parsons M.P., Hirasawa M. Local network regulation of orexin neurons in the lateral hypothalamus. Am. J. Physiol. 301 (3): R572-80. 2011.
Sieminski M., Szypenbejl J., Partinen E. Orexins, Sleep, and Blood Pressure. Curr. Hypertens. Rep. 20 (9): 79. 2018.
Aston-Jones G., Smith R.J., Sartor G.C., Moorman D.E., Massi L., Tahsili-Fahadan P., Richardson K.A. Lateral hypothalamic orexin/hypocretin neurons: a role in reward-seeking and addiction. Brain Res. 1314: 74–90. 2010.
Tsuneki H., Wada T., Sasaoka T. Role of orexin in the central regulation of glucose and energy homeostasis. Endocr. J. 59 (5): 365–374. 2012.
Joshi A., Youssofzadeh V., Vemana V., McGinnity T.M., Prasad G., Wong-Lin K. An integrated modelling framework for neural circuits with multiple neuromodulators. J. R. Soc. Interface. 14 (126). pii: 20160902. 2017.
Saito Y.C., Tsujino N., Abe M., Yamazaki M., Sakimura K., Sakurai T. Serotonergic Input to Orexin Neurons Plays a Role in Maintaining Wakefulness and REM Sleep Architecture. Front Neurosci. 12: 892. 2018.
Chowdhury S., Yamanaka A. Optogenetic activation of serotonergic terminals facilitates GABAergic inhibitory input to orexin/hypocretin neurons. Sci. Rep. 6: 36039. 2016.
Li Y., Gao X.-B., Sakurai T., van den Pol1 A.N. Hypocretin/orexin excites hypocretin neurons via a local glutamate neuron – a potential mechanism for orchestrating the hypothalamic arousal system neuron. Neuron. 36 (6): 1169–1181. 2002.
Muraki Y., Yamanaka A., Tsujino N., Kilduff T.S., Goto K., Sakurai T. Serotonergic Regulation of the Orexin/Hypocretin Neurons through the 5-HT1A Receptor. J. Neuroscience. 24 (32): 7159–7166. 2004.
Jalewa J., Joshi A., McGinnity T.M., Prasad G., Wong-Lin K., Hölscher C. Neural circuit interactions between the dorsal raphe nucleus and the lateral hypothalamus: an experimental and computational study. PLoS One. 9 (2): e88003. 2014.
Doslikova B., Garfield A.S., Shaw J., Evans M.L., Burdakov D., Billups B., Heisler L.K. 5-HT2C receptor agonist anorectic efficacy potentiated by 5-HT1B receptor agonist coapplication: an effect mediated via increased proportion of pro-opiomelanocortin neurons activated. J. Neurosci. 33 (23): 9800-4. 2013.
Derkach K.V., Bondareva V.M., Chistyakova O.V., Berstein L.M., Shpakov A.O. The effect of long-term intranasal serotonin treatment on metabolic parameters and hormonal signaling in rats with high-fat diet/low-dose streptozotocin-induced type 2 diabetes. Int. J. Endocrinol. 2015: 245459. 2015.
Romanova I.V., Derkach K.V., Mikhrina A.L., Sukhov I.B., Mikhailova E.V., Shpakov A.O. The leptin, dopamine and serotonin receptors in hypothalamic POMC-neurons in normal and obese rodents. Neurochemical Research. 43 (4): 821–837. 2018.
Paxinos G.T., Watson C. The Rat Brain in Stereotaxic Coordinates, 4th Edition, Academic Press, San Diego, CA, USA, 1998.
Franklin K.B.J., Paxinos G.T. The Mouse Brain in Stereotaxic Coordinates, 3rd Edition, Academic Press, San Diego, CA, USA, 2008.
Fetissov S.O., Meguid M.M., Chen C., Miyata G. Synchronized release of dopamine and serotonin in the medial and lateral hypothalamus of rats. Neuroscience. 101 (3): 657–663. 2000.
Otlivanchik O., Le Foll C., Levin B.E. Perifornical hypothalamic orexin and serotonin modulate the counterregulatory response to hypoglycemic and glucoprivic stimuli. Diabetes. 64 (1):226–235. 2015.
Graves S.M., Clark M.J., Traynor J.R., Hu X.T., Napier T.C. Nucleus accumbens shell excitability is decreased by methamphetamine self-administration and increased by 5-HT2C receptor inverse agonism and agonism. Neuropharmacology. 89: 113–121. 2015.
Lauffer L., Glas E., Gudermann T., Breit A. Endogenous 5-HT2C Receptors Phosphorylate the cAMP Response Element Binding Protein via Protein Kinase C-Promoted Activation of Extracellular-Regulated Kinases-1/2 in Hypothalamic mHypoA-2/10 Cells. J. Pharmacol. Exp. Ther. 358 (1): 39–49. 2016.
Nishijo T., Momiyama T. Serotonin 5-HT1B receptor-mediated calcium influx-independent presynaptic inhibition of GABA release onto rat basal forebrain cholinergic neurons. Eur. J. Neurosci. 44 (1): 1747–1760. 2016.
Lu C.W., Lin T.Y., Huang S.K., Wang S.J. 5-HT1B receptor agonist CGS12066 presynaptically inhibits glutamate release in rat hippocampus. Prog. Neuropsychopharmacol. Biol. Psychiatry. 86: 122–130. 2018.
Kleene R., Chaudhary H., Karl N., Katic J., Kotarska A., Guitart K., Loers G., Schachner M. Interaction between CHL1 and serotonin receptor 2c regulates signal transduction and behavior in mice. J Cell Sci. 128 (24): 4642–4652. 2015.
Liu Y., Gibson A.W., Levinstein M.R., Lesiak A.J., Ong S.E., Neumaier J.F. 5-HT1B Receptor-Mediated Activation of ERK1/2 Requires Both Gαi/o and β-Arrestin Proteins. ACS Chem. Neurosci. 10 (7): 3143–3153. 2019.
Moriguchi T., Sakurai T., Takahashi S., Goto K., Yamamoto M. The human prepro-orexin gene regulatory region that activates gene expression in the lateral region and represses it in the medial regions of the hypothalamus. J. Biol Chem. 277(19):16985–16992. 2002.
Ford G.K., Al-Barazanji K.A., Wilson S., Jones D.N., Harbuz M.S., Jessop D.S. Orexin expression and function: glucocorticoid manipulation, stress, and feeding studies. Endocrinology. 146 (9): 3724–3731. 2005.
Ferrari L.L., Park D., Zhu L., Palmer M.R., Broadhurst R.Y., Arrigoni E. Regulation of Lateral Hypothalamic Orexin Activity by Local GABAergic Neurons. J. Neurosci. 38 (6): 1588–1599. 2018.
Hirano A., Hsu P.K., Zhang L., Xing L., McMahon T., Yamazaki M., Ptáček L.J., Fu Y.H. DEC2 modulates orexin expression and regulates sleep. Proc Natl Acad Sci USA. 115 (13): 3434–3439. 2018.
Tanaka S., Honda Y., Takaku S., Koike T., Oe S., Hirahara Y., Yoshida T., Takizawa N., Takamori Y., Kurokawa K., Kodama T., Yamada H. Involvement of PLAGL1/ZAC1 in hypocretin/orexin transcription. Int. J. Mol. Med. 43 (5): 2164–2176. 2019.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


