Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 2, стр. 153-157
ИЗМЕНЕНИЕ ПАРАМЕТРОВ СЕРДЕЧНОГО РИТМА У ПЛОДОВ КРЫС (RATTUS NORVEGICUS F. DOMESTICA) ПРИ АКТИВАЦИИ ХОЛИНОРЕАКТИВНЫХ СТРУКТУР
Н. Д. Вдовиченко 1, *, П. А. Гайдукова 1
1 Федеральное государственное бюджетное учреждение науки
Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: vdona@mail.ru
Поступила в редакцию 01.07.2019
После доработки 18.10.2019
Принята к публикации 25.10.2019
Холинергическая система является одной из основных систем, обеспечивающих нормальное развитие организма. Известно, что в ходе раннего онтогенеза происходит ее морфологическое и функциональное становление [1]. Стадия закладки внутрисердечных ганглиев вегетативной нервной системы у зародышей крысы происходит до 14-го дня эмбриогенеза, а образование простых контактов преганглионарных волокон с нейробластами в ганглиях сердца происходит у крысы уже на 14–16-й день эмбриогенеза [2]. Установлено, что гуморальные влияния на функциональные показатели сердца крыс отмечаются уже в середине эмбрионального развития [3]. Однако, несмотря на обширные морфологические исследования развития холинергической системы, ее функциональное созревание и развитие холинергических влияний на сердечную деятельность, а также последствия нарушения нормального функционирования холинергической системы в пренатальный период остаются до сих пор недостаточно изученными. Большинство имеющихся экспериментальных работ посвящено изучению отдаленных последствий применения различных холинергических средств у беременных. В представленной работе мы рассматриваем изменение вагосимпатического баланса, но, учитывая, что парасимпатическая и симпатическая нервные системы в исследуемые сроки пренатального онтогенеза морфологически еще не полностью сформированы, под этим термином мы понимаем баланс между холинергическими и адренергическими влияниями.
Целью данной работы стало исследование параметров сердечного ритма у плодов крыс на 18–20-й день гестации (Е18–Е20) в условиях изменения уровня активности холинергических структур, вызванного увеличением количества ацетилхолина (АХ) вследствие ингибирования ацетилхолинэстеразы (АХЭ) эзерином.
Исследования проводили в острых опытах на крысах линии Вистар в соответствии с положениями Российского национального комитета по биологической этике РАН. Результаты получены на 20 плодах от 8 самок; 11 плодов на Е18 и 9 на Е20. У самки, находящейся под слабым уретановым наркозом (ICN Biomedicals, Inc.) (1 г/кг) в сочетании с эпидуральной анестезией лидокаином (ОАО “Борисовский завод медицинских препаратов”) (10 мг/кг), через разрез в брюшной стенке извлекали матку и помещали ее в кювету с термостатированным (37 ± 0.2°С) физиологическим раствором. У двух плодов, извлеченных из матки с сохранением плацентарного кровообращения, одновременно регистрировали электрокардиограмму (ЭКГ). Параллельно регистрировали ЭКГ и внешнее дыхание у самки для контроля функционального состояния и его возможного влияния на активность плода. Активацию холинореактивных структур вызывали введением плодам ингибитора АХЭ эзерина (05211751 MP Biomedicals, США) в дозе 3 мг/кг внутрибрюшинно. Выбранная доза эзерина является летальной для 100% новорожденных крысят (по данным, полученным в нашей лаборатории В.А. Си-зоновым и Л.Е. Дмитриевой [4]) и среднесмертельной – для взрослой крысы. При выборе дозы исходили из соображения о необходимости наличия выраженной реакции сердечно-сосудистой системы плода на действие эзерина при минимальных изменениях состояния самки. Общее время наблюдения составляло 70–80 мин (30 мин – фоновая запись и 40–50 мин – после введения препарата, регистрацию физиологических показателей начинали сразу после инъекции). Ввод сигналов в компьютер осуществляли посредством АЦП E14-440 (фирма L-card, Россия) программа “Power Graph” (ООО “ДИСофт”, Россия). Период дискретизации АЦП составлял 0.5 мс, в дальнейшем прореживалось до 1 мс, эпоха анализа 10 мин. Общее время исследования для каждого плода составляло от 40 до 120 мин. Преобразование ЭКГ в периодограмму и другую цифровую обработку регистрируемых сигналов проводили в программах “PowerGraph 3.3.8” и “Origin 7.5” (OriginLab Corporation, США) с помощью разработанных в нашей лаборатории оригинальных алгоритмов с использованием пакета анализа данных этих программ. Для анализа фона выбирали 10-ти минутные фрагменты, наиболее близкие к моменту введения эзерина и не содержащие экстрасистол, а также значительных колебаний ЧСС, связанных с изменениями в сердечной или дыхательной деятельности самки. После введения эзерина анализу подвергались 10-ти минутные фрагменты, выбранные из участка записи с 6‑й по 20-ю минуту (период максимального эффекта эзерина). Спектральный анализ периодограмм ритма сердца (32 768 точек) осуществляли по алгоритму быстрого преобразования Фурье (БПФ) с использованием окна Уолша (Welch), с последующей нормализацией и усреднением спектров. Сердечную деятельность оценивали по частоте сердечных сокращений (ЧСС) и по показателям вариабельности сердечного ритма (ВСР). Анализ показателей ВСР применяется для выявления и оценки периодических составляющих колебаний сердечного ритма. Анализ выполняли по трем частотным диапазонам, выбранным на основании литературных и собственных экспериментальных данных [5]: HF 0.8–2.5 Гц, LF 0.3–0.8 Гц, VLF 0.03–0.3 Гц. Колебания HF принято считать высокочастотной составляющей, физиологически связанной с парасимпатическим влиянием на сердце. LF – низкочастотные колебания, преимущественно связанные с симпатическим фактором. Колебания VLF позволяют судить о присутствии гуморально-метаболического влияния на сердечно-сосудистую систему. Статистическая обработка данных осуществлялась стандартными методами в программе “Origin7.5”. Использовали парный тест Стьюдента с поправками Холма. Статистически обработанные данные представлены как среднее ± стандартная ошибка. Все изменения рассматривали по отношению к фоновым показателям тех же плодов до введения препарата. Различия считали статистически значимыми при p < 0.05.
В сердечной деятельности интактных плодов крыс между 18 и 20 днями гестации происходят изменения, отражающие процесс развития сердечной системы и установления ее связей с другими функциональными системами [6]. В этот период на 34% увеличивается ЧСС, у плодов на Е20 происходит снижение выраженности медленноволновых колебаний сердечного ритма, характерных для плодов на Е18. Децелерации, являющиеся характерной реакцией сердца на движение у плодов на Е18, сменяются акселерациями на Е20. Различия в сердечной деятельности плодов на Е18 и Е20 выявил и анализ ВСР. В фоне на Е18 в спектре преобладает VLF диапазон. На Е20 отмечен рост всех показателей ВСР (табл. 1). Общая мощность спектра (To) увеличивается на 83%, мощность LF увеличивается в 2 раза, HF в 5 раз. Меньше всего меняется мощность VLF, она возрастает всего на 5.3%. Плоды на Е20 были разделены на 2 подгруппы, так как между ними наблюдались достоверные различия (рис. 1 (а, 3, 4)). Распределение животных осуществляли, опираясь на анализ ВСР. У первой группы (22% плодов) спектр смещен в сторону HF диапазона и To в несколько раз превышает этот же показатель второй группы (78% плодов), в которой преобладает диапазон VLF. Таким образом, у плодов исследованных возрастов доминирующими являются гуморально-метаболические влияния. По мере увеличения гестационного срока влияние холинергической системы увеличивается.
Таблица 1.
Показатели вариабельности сердечного ритма и ЧСС плодов разного срока гестации после инъекции эзерина (3 мг/кг)
| Показатели | Срок гестации | |||||||
|---|---|---|---|---|---|---|---|---|
| Е18 | Е20 | Е20 (Подгруппа 1) | Е20 (Подгруппа 2) | |||||
| фон | опыт | фон | опыт | фон | опыт | фон | опыт | |
| VLF (у.е.) | 7.491 ± 0.52 | 8.95 ± 1.462** | 7.902 ± 1.071 | 6.687 ± 0.636 | 10.438 ± 3.356 | 7.591 ± 0.049 | 7.177 ± 1.019 | 6.428 ± 0.802*** |
| LF (у.е.) | 0.912 ± 0.408 | 2.508 ± 0.972 | 1.895 ± 0.944 | 0.344 ± 0.106 | 6.507 ± 2.078 | 0.774 ± 0.329* | 0.577 ± 0.139 | 0.221 ± 0.054* |
| HF (у.е.) | 1.758 ± 0.845 | 2.815 ± 1.422 | 8.857 ± 5.002 | 0.348 ± 0.117 | 33.484 ± 10.508 | 0.916 ± 0.168* | 1.821 ± 0.705 | 0.186 ± 0.047* |
| To (у.е.) | 10.161 ± 1.635 | 14.272 ± 3.125* | 18.654 ± 6.707 | 7.379 ± 0.75 | 50.429 ± 15.941 | 9.281 ± 0.209* | 9.575 ± 1.79 | 6.835 ± 0.86** |
| VLF (% к То) | 74 | 63 | 42 | 90 | 21 | 82 | 75 | 94 |
| LF (% к То) | 9 | 17 | 10 | 5 | 13 | 8 | 6 | 3 |
| HF (% к То) | 17 | 20 | 48 | 5 | 66 | 10 | 19 | 3 |
| LF/HF (y.e.) | 0.518 | 0.891 | 0.214 | 0.986** | 0.194 | 0.845 | 0.317 | 1.184** |
| HF/To (y.e.) | 0.173 ± 0.037 | 0.197 ± 0.045*** | 0.475 ± 0.079 | 0.047 ± 0.012*** | 0.664 ± 0.002 | 0.099 ± 0.02*** | 0.19 ± 0.036 | 0.027 ± 0.005*** |
| ЧСС (уд/мин) | 227.8 ± 5.9 | 158.9 ± 10.4*** | 305.3 ± 4.5 | 231 ± 12.4*** | 292.6 ± 1.4 | 226.6 ± 20.8*** | 308.9 ± 5.0 | 232.2 ± 15.6*** |
Примечание. Значения показателей VLF, LF, HF, To даны в нормированном виде (максимумы мощности индивидуальных спектров приняты за 1). Дополнительно диапазоны VLF, LF, HF представлены в процентах к общей мощности спектра. Коэффициенты HF/To, LF/HF рассчитаны исходя из нормализованных показателей LF, HF и То.
Звездочками отмечена достоверность различий между фоном и опытом: * – p < 0.05; ** – p < 0.01; *** – p < 0.001. Достоверность различий для показателя LF/HF рассчитывалась по усредненным индивидуальным значениям для каждого животного.
Рис. 1.
Усредненные спектры периодограмм сердечного ритма в фоне (а) и после введения эзерина (б) у плодов разного срока гестации: 1 – на Е18, 2 – на Е20, 3 – у 1-й подгруппы плодов на Е20, 4 – у 2-й подгруппы плодов на Е20.
По оси абсцисс – частота колебаний (Гц), под шкалой показано деление спектра на частотные диапазоны для анализа ВСР. По оси ординат – мощность спектра, нормализованная до 1 (у.е.). Ось абсцисс представлена логарифмической шкалой от 0.03 до 2.5.
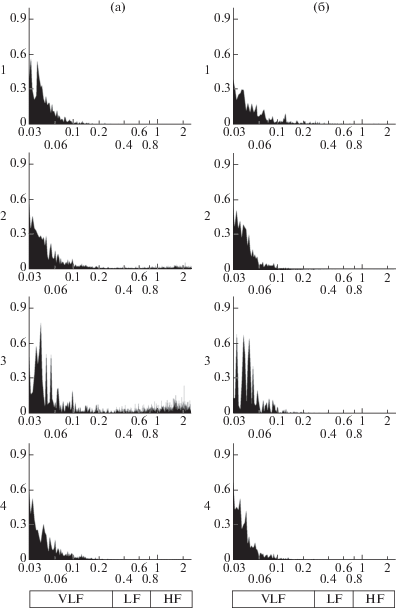
Введение эзерина вызывает уменьшение ЧСС на Е18 – на 30%, а на Е20 – на 24%. Визуальный анализ периодограмм свидетельствует о появлении периодических децелераций у 18-ти и 20-ти суточных плодов в течение всего времени наблюдения, максимальная амплитуда отмечена в первые несколько минут после инъекции. Существенные изменения наблюдали в спектре ВСР. У плодов на Е18 происходит рост как To, так и всех ее составляющих. Доля HF после введения эзерина увеличивается на 60%, VLF – на 20%. Самое значительное увеличение претерпевает LF – на 175%, что приводит к увеличению почти в 2 раза коэффициента LF/HF. Несмотря на перераспределение регуляторных влияний, преобладающим все равно остается гуморально-метаболическое (рис. 1а, 1б). На Е20 реакция плодов на введение эзерина полностью меняется. Общая мощность спектра уменьшается более чем в 5 раз у плодов первой подгруппы и в полтора – у второй. Больше всего снижается вклад холинергических и симпатических воздействий. Мощность HF уменьшается на 97% у первой подгруппы и на 90% у второй, LF – на 88 и 62% соответственно. Сильно сокращается их доля в общем спектре, особенно HF – в среднем в 7 раз, что приводит к росту коэффициента LF/HF. Снижение HF также приводит к значительному уменьшению коэффициента HF/To. Мощность VLF уменьшаются на 27% у животных первой подгруппы и на 10% – у второй. Вместе с тем следует учитывать, что доля VLF-диапазона в общей мощности спектра возрастает после инъекции эзерина на 290 и 25% соответственно. Таким образом, введение эзерина плодам на 18–20-й плодный день вызывает разнонаправленные изменения в работе холинореактивных структур. У плодов на Е18 происходит рост общей мощности спектра и всех его составляющих, а на Е20, наоборот, снижение всех показателей. При этом у плодов обеих возрастных групп преобладающим остается гуморально-метаболическое влияние. Ранее было показано, что у однодневных новорожденных крысят реакция сердечно-сосудистой системы на введение эзерина сходна с наблюдаемой нами на Е20 [7].
Функциональное созревание периферического нервного аппарата миокарда заканчивается в эмбриональном периоде до возникновения центральных симпатических и парасимпатических влияний. Парасимпатическая иннервация в сердце крыс выявляется еще в эмбриональный период и полностью формируется ко второму месяцу постнатального онтогенеза, тогда как признаки функциональной зрелости симпатической иннервации выявляются к 3–4-й неделе после рождения [1, 2, 8, 9]. Из анализа полученных нами данных видно, что уже на Е18 активация холинергической системы вызывает отрицательный хронотропный эффект, что может свидетельствовать о достаточном созревании холинорецепторов и их включении в регуляцию ритма сердца плодов крыс. Увеличение мощности высокочастотных (HF) колебаний, а также их доли в общем спектре на 20-й день гестации могут быть первыми признаками начала работы парасимпатической системы. Вместе с тем значительную роль в регуляции сердечного ритма продолжают играть гуморально-метаболические факторы. В пользу этого свидетельствует усиление мощности VLF-диапазона после инъекции животным эзерина, связанное с избытком АХ, который может оказывать несинаптическое действие на холинореактивные структуры сердца [10].
Таким образом, установлено, что в последние дни пренатального развития у плодов крыс наблюдаются первые признаки созревания парасимпатической регуляции сердечного ритма, сосуществующей на Е20 с доминирующими более ранними гуморальными влияниями.
Список литературы
Hasan W. Autonomic cardiac innervations. Organogenesis. 9 (3): 176–193. 2013.
Швалев В.Н., Сосунов А.А., Гуски Г. Морфологические основы иннервации сердца. М. Наука. 1992. [Shvalev V.N., Sosunov A.A., Guski G. Morfologicheskie osnovy innervatsii serdtsa [Morphological bases of cardiac innervation]. Moscow. Nauka. 1992.]
Чиглинцев В.М. Влияние стимуляции блуждающих нервов на показатели сердечной деятельности и содержание оксида азота у растущих гипокинезированных и десимпатизированных крыс. Нижневартовск. Изд-во Нижневарт. гос. ун-та. 2013. [Chiglintsev V.M. Vliyanie stimulyatsii bluzhdayushchikh nervov na pokazateli serdechnoy deyatelnosti i soderzhanie oksida azota u rastushchikh gipokinezirovannykh i desimpatizirovannykh krys [Effect of vagus stimulation on indicators of cardiac activity and content of nitrogen oxide in growing rats of hypokinesis and desympatized]. Nizhnevartovsk. Izdatelstvo Nizhnevartovskogo gosudarstvennogo universiteta. 2013. (in Russ.)]
Сизонов В.А., Дмитриева Л.Е. Нарушения ритма сердца, вызванные инъекцией ингибитора холинэстеразы эзерина в раннем онтогенезе крыс. Бюл. экспер. биол. и мед. 165 (1): 52–56. 2018. [Sizonov V.А., Dmitrieva L.E. Heart rhythm disturbances caused by injection of cholinesterase inhibitor physostigmine to rats during the early ontogeny. Bull. Exp. Biol. Med. 165 (1): 44–47. 2018. (in Russ.)]
Кузнецов С.В., Гончаров Н.В., Глашкина Л.М. Изменение параметров функционирования сердечно-сосудистой и дыхательной систем у крыс разного возраста под воздействием малых доз ингибитора холинэстераз фосфакола. Ж. эвол. биохим. и физиол. 41 (2): 160–167. 2005. [Kuznetsov S.V., Goncharov N.V., Glashkina L.M. Changes of parameters of functions of respiratory and cardiovascular systems of different age rats under influence of small doses of cholinesterase inhibitor Phosphacol. J. Evol. Biochem. Physiol. 41 (2): 201–210. 2005. (in Russ.)]
Тимофеева О.П., Вдовиченко Н.Д., Кузнецов С.В. Динамика становления ритмической активности сердца у плодов и новорожденных крыс. Бюл. экспер. биол. и мед. 152 (10): 373–378. 2011. [Timopheeva O.P., Vdovichenko N.D., Kuznetsov S.V. Dynamics of the formation of rhythmic activity of the heart in fetuses and newborn rats. Bull. Exp. Biol. Med. 152 (4): 397–401. 2012. (in Russ.)]
Сизонов В.А., Дмитриева Л.Е., Кузнецов С.В. Влияние блокады М-холинорецепторов на функциональную активность моторной, сердечной и дыхательной систем новорожденных крысят при активации холинореактивных структур. Ж. эвол. биохим. физиол. 55 (3): 179–187. 2019. [Sizonov V.A., Dmitrieva L.E., Kuznetsov S.V. The Effect of M-Cholinoreceptor Blockade on Functional Activity of Somatomotor, Cardiovascular and Respiratory Systems in Newborn Rats upon Activation of Cholinoreactive Structures. J. Evol. Biochem. Physiol. 55 (3): 198–207. 2019. (in Russ.)]
Чумасов Е.И., Евлахов В.И., Коржевский Д.Э. Современные представления об иннервации сердца и ее участии в регуляции системной гемодинамики. Регионарное кровообращение и микроциркуляция. 11 (1): 9–14. 2012. [Chumasov Ye.I., Yevlakhov V.I., Korzhevskiy D.E. Sovremennyye predstavleniya ob innervatsii serdtsa i yego uchastii v regulyatsii sistemnoy gemodinamiki. Regionarnoye krovoobrashcheniye i mikrotsirkulyatsiya. 11 (1): 9–14. 2012. (in Russ.)]
Olshansky B., Sabbah H.N., Hauptman P.J., Colucci W.S. Parasympathetic nervous system and heart failure: pathophysiology and potential implications for therapy. Circulation. 118 (8): 863–871. 2008.
Abramochkin D.V., Borodinova A.A., Rosenshtraukh L.V., Nikolsky E.E. Both neuronal and non-neuronal acetylcholine take part in non-quantal acetylcholine release in the rat atrium. Life Sci. 91 (21–22): 1023–1026. 2012.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


